白刺花染色体压片技术优化及核型分析
, , , ,
(贵州大学动物科学学院草业科学系, 贵阳 550025)
白刺花染色体压片技术优化及核型分析
雷文英,赵丽丽,简忠领,陈超,宋高翔
(贵州大学动物科学学院草业科学系, 贵阳 550025)
以贵州白刺花(Sophoradavidii)根尖为试材,从取材时间、预处理方法、解离时间3个方面改进白刺花染色体常规压片技术,并对白刺花染色体进行核型分析。结果表明,白刺花染色体压片最佳取材时间为09:00-10:00时,根尖用冰水混合物在4 ℃冰箱里预处理24 h为宜,卡诺固定液(无水酒精∶冰醋酸=3∶1)固定24 h,解离用1 mol/L盐酸在60 ℃水浴下解离8 min最好。核型分析结果表明,白刺花染色体基数为x=9,染色体数目2 n=18,染色体核型公式为2 n=2 x=2 M+16 m,染色体相对长度为2 n=2 x=18=2 S+10 M 1+6 M 2。白刺花的染色体属于1 A型。
白刺花; 染色体压片; 染色体数目; 核型分析
白刺花为我国原产植物,主要分布于华北、西北、西南,是豆科槐属落叶灌木,也叫苦刺花、马蹄针、狼牙刺等[1-2]。白刺花具有清热、解毒凉血、消肿利湿等药用价值,主要用于治疗咽喉肿痛、肝炎、水肿、热毒疮疡等常见症状[3-4]。白刺花同时是主要蜜源植物之一。其蜂蜜又叫狼牙刺蜜,属于一等蜜,是平喘、祛痰、利气的理想辅助食品[5-7]。白刺花幼嫩枝叶适口性较好,可刈割青饲和调制青贮饲料[8];其适应性较强、耐踩踏、耐刈割、再生性好,可直接放牧山羊[9]。白刺花根系发达(当茎的测量高度为40 cm时,白刺花的主根地下深处可高达100 cm,其侧根主要集中在30 cm土层处分布)[10],防风固沙能力强[11-12]。白刺花具有较强的干旱胁迫适应能力[13],在恶劣条件下仍能生长。总之,白刺花在石漠化的生态环境中具有较好的资源优势,特别是在生态畜牧业建设中起到较重要的作用。但在利用的过程中,白刺花育成品种缺乏,种源难以保证,严重限制了该优良种质的利用。因此,了解白刺花种质材料的遗传背景,加快新品种培育至关重要。
植物染色体是基因的主要载体,基因控制植物性状。染色体的观察是探索生物系统发生、遗传规律和育种的基础,是选择、识别和繁殖亲本材料的重要技术环节[14]。直接鉴定法是目前染色体倍性鉴定常用的方法,也被称为染色体计数法,这是确定倍性最基本和最精确的方法[15]。根尖压片技术在甘蔗、姜科植物、蔬菜、粮食作物等的染色体研究中得到广泛应用,过程中发现,不同取材时间、不同预处理方法、不同解离时间对制片效果的影响较大。但目前关于白刺花染色体倍性研究的报道较少,本研究拟利用常规压片技术,研究白刺花压片技术的取材时间、预处理试剂、解离时间等,优化白刺花染色体常规压片技术,并对白刺花染色体数目和核型进行鉴定研究,了解白刺花的遗传背景,为利用白刺花种质资源开展育种工作,培育出适于推广,具有我国自主知识产权的白刺花品种提供理论依据。
1 材料和方法
1.1 材 料
试验材料为白刺花根尖。白刺花种子采自贵州省水城县(104°44′13″E,26°17′08″N,海拔1 140 m)。选择饱满且大小一致的白刺花种子用砂纸打磨,自来水冲洗干净后,放置于装有蒸馏水的烧杯中浸泡24 h,将浸泡后的种子放入铺有2层滤纸的培养皿中并加入蒸馏水润湿。然后将培养皿置于20~25 ℃的条件下进行种子萌发并观察萌发情况。待种子萌发后胚根生长至0.8~1 cm时取出根尖,截取根尖进行试验操作。
1.2 方 法
1.2.1 染色体压片技术
本试验参照李国珍[26]、刘祖洞[16]等的研究方法,从取材时间、预处理方法和解离时间3个方面进行条件优化,具体处理如下:
1) 取材:设置08:00时以前、08:00—09:00时、09:00—10:00时这3个时间段取材,取萌发好的白刺花根尖为材料。
2) 预处理:分别将材料放在①冰水混合物置于4 ℃冰箱中处理24 h;②0.002 mol/L的秋水仙素在4 ℃冰箱中处理3.5 h,通过对比分析,选择最优处理方式。
3) 解离:把保存在70%乙醇里的材料取出并用蒸馏水漂洗2次,移置于在60 ℃恒温水浴锅里预热的放有1 mol/L盐酸的试管中解离[17],解离时间为3 min和8 min。
1.2.2 染色体镜检和核型分析
利用光学电子显微镜进行观察。选择20个染色体形状良好,均匀分散,并且条数清晰的细胞,以确定材料染色体的数量。取3个处于有丝分裂中期并且染色体分散良好的细胞进行观察,核型平均数按照李懋学等[18]的方法计算,根据Levan[19]的方法求出核型公式,确定染色体类型,根据Arano[20]和Stebbins[21]的方法计算核型不对称系数,并进行分类。
1.3 数据及图像处理
利用SPSS、EOS Utility、Photoshop_CS 5_CHS&ENG、WPS Microsoft Excel 97-2003对数据及图像进行处理。相关公式如下:
染色体臂比=长臂(L)/短臂(S);
染色体相对长度系数(%)=染色体长度/全组染色体平均数×100%;
染色体相对长度(%)=染色体长度/染色体组总长度×100%;
核型不对称系数(%)=长臂总长/全组染色体总长×100%。
2 结果与分析
2.1 染色体制片方法
2.1.1 取材时间对白刺花染色体制片的影响
对于白刺花的染色体制片,取材时间关系到能否大量观察到分裂中期相,试验分别在08:00时以前、08:00—09:00时、09:00—10:00时3个时段取材,由图2 A观察发现,08:00时以前取材,可观察到染色体,少数细胞处于分裂中期相,中期分裂相细胞比例为13.2%(图1)。由图2 B观察发现,08:00—09:00时取材,可观察到染色体,少数细胞处于分裂中期相,中期分裂相细胞比例为38.9%(图1)。由图2 C观察发现,09:00—10:00时可观察到染色体,多数细胞处于分裂中期相,中期分裂相细胞比例为62.4%(图1),3个取材时间获得的中期分裂相细胞比例存在显著差异。因此,09:00—10:00时是白刺花染色体制片较好的取材时段。
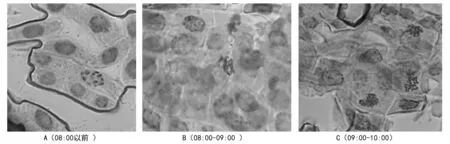
图2 不同取材时间下染色体的形态

注:A为秋水仙素处理时间超过3.5 h,解离3 min;B为秋水仙素处理时间超过3.5 h,解离8 min; C为冰水混合物预处理24 h,解离3 min;D为冰水混合物处理24 h,解离8 min。图3 预处理试剂及不同解离时间对白刺花染色体制片的影响
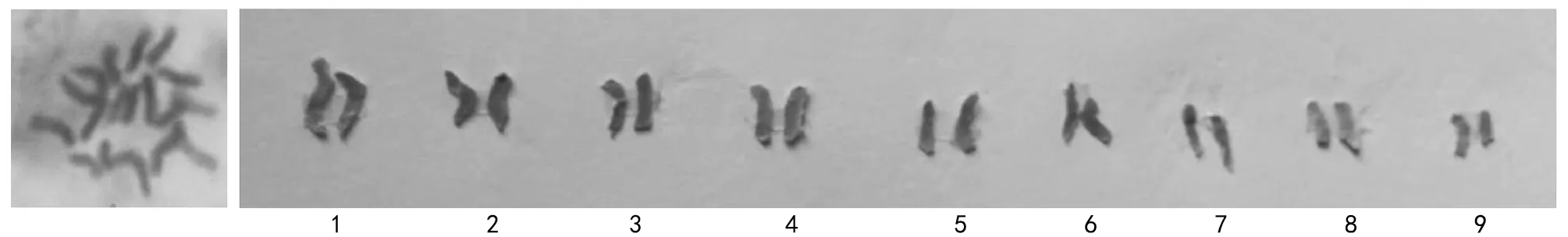
图4 白刺花染色体核型图

图1 不同取材时间对中期分裂相细胞比例的影响
2.1.2 不同预处理试剂及不同解离时间对白刺花染色体制片的影响
将材料用秋水仙素处理3.5 h,染色体开始粘连,解离3 min,染色2 h,染色体形态模糊,染色较浅,如图3 A;解离8 min,染色2 h,染色体形态模糊,染色较深,如图3 B。用冰水混合物处理24 h,染色同样都是2 h,但分别解离3 min和8 min。解离3 min,染色体条形清晰但染色较浅,如图3 C;解离8 min染色较深,条形清晰,如图3 D。
2.2 白刺花染色体核型分析
选择20个染色体形态分散良好的细胞,计数的染色体条数均为18条,记为2 n=18条(见图4)。白刺花染色体的参数与核型分析见表1,白刺花染色体核型模式图见图5。
表1 白刺花染色体核型参数
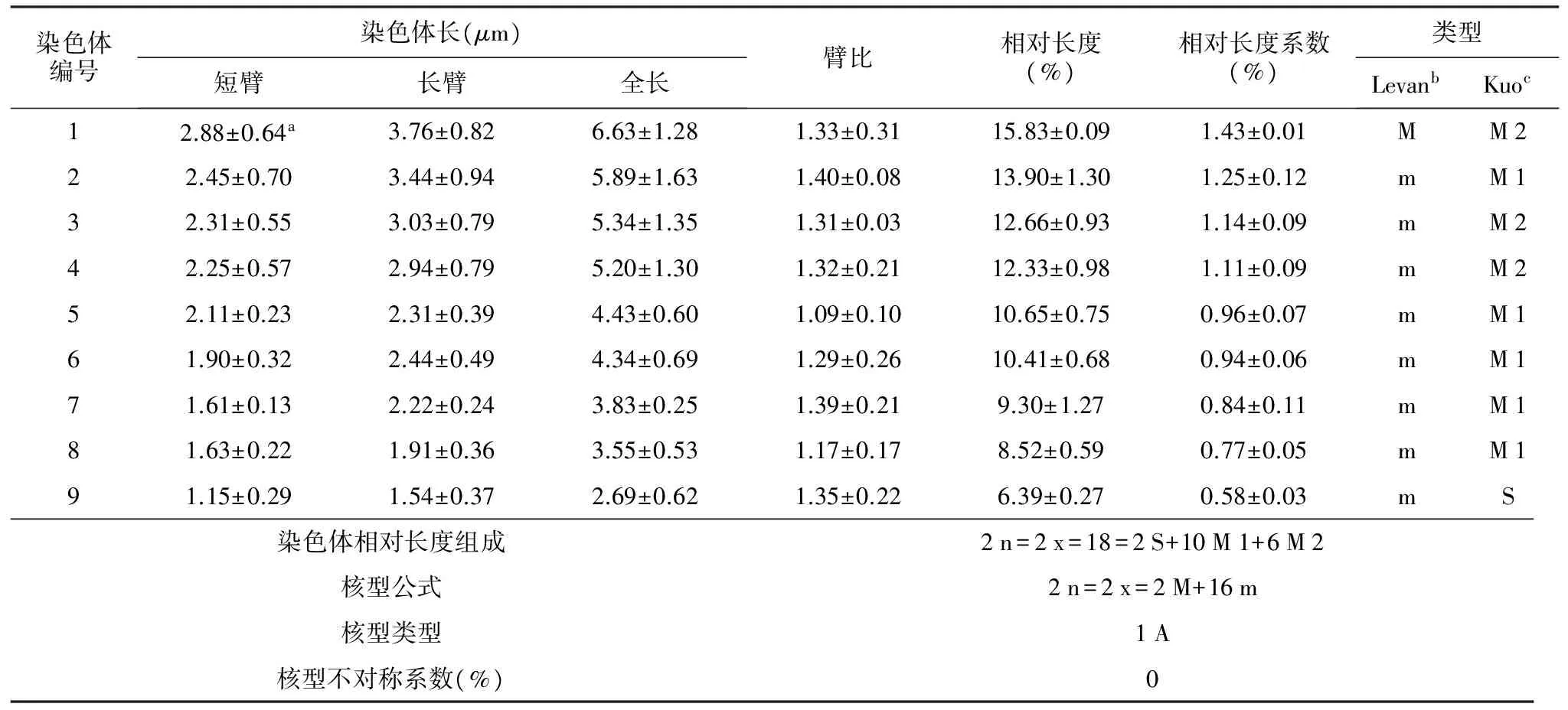
染色体编号染色体长(μm)短臂长臂全长臂比相对长度(%)相对长度系数(%)类型LevanbKuoc12.88±0.64a3.76±0.826.63±1.281.33±0.3115.83±0.091.43±0.01MM222.45±0.703.44±0.945.89±1.631.40±0.0813.90±1.301.25±0.12mM132.31±0.553.03±0.795.34±1.351.31±0.0312.66±0.931.14±0.09mM242.25±0.572.94±0.795.20±1.301.32±0.2112.33±0.981.11±0.09mM252.11±0.232.31±0.394.43±0.601.09±0.1010.65±0.750.96±0.07mM161.90±0.322.44±0.494.34±0.691.29±0.2610.41±0.680.94±0.06mM171.61±0.132.22±0.243.83±0.251.39±0.219.30±1.270.84±0.11mM181.63±0.221.91±0.363.55±0.531.17±0.178.52±0.590.77±0.05mM191.15±0.291.54±0.372.69±0.621.35±0.226.39±0.270.58±0.03mS染色体相对长度组成2n=2x=18=2S+10M1+6M2核型公式2n=2x=2M+16m核型类型1A核型不对称系数(%)0
注:“a”为平均值±标准误;“b、c”为染色体类型分别按照Levan等[19]和Kuo等[22]的方法划分。

图5 白刺花染色体核型模式图
由表1和图5可知,白刺花的染色体臂比范围为1.09~1.40,长短臂相差较小;相对长度范围为6.39%~15.83%,相对长度组成为2 n=2 x=18=2 S+10 M 1+6 M 2。综合分析其核型公式为2 n=2 x=2 M+16 m。
各染色体的臂比值均小于2∶1,比例达到100%,无核型不对称染色体,因此白刺花的染色体属于1 A型。
白刺花的9对染色体中,主要分为两类:中部着丝点的染色体(m)和正中部着丝粒染色体(M);其中,中部着丝点的染色体为8对,占总染色体数的88.9%;正中部着丝粒染色体为1对,占细胞里总染色体数的11.1%。由此可看出,白刺花染色体的核型种类为中等的对称核型。
3 讨论与结论
3.1 高质量染色体制片技术的探讨
在白刺花染色体制片的过程中,正确的取材时间是保证看到大量中期分裂相的关键。试验结果显示,在09:00—10:00时均可以找到较多细胞分裂旺盛的中期相,这与汪祥等[23]对中华蚊母树染色体制片最佳取材时间的研究结果相一致。取材之后的预处理亦是染色体制片最重要的步骤,冰水混合物和秋水仙素均能抑制纺锤丝形成,促使染色体缩短变粗,便于观察到形态清晰的染色体。试验结果表明,秋水仙素处理的时间控制较为重要,处理时间过长会导致染色体粘连,形态难以辨别。当处理时间适宜时,染色体形态比较好,但因药品价格昂贵且有剧毒,对于白刺花染色体制片不建议使用。本试验中,冰水混合物处理白刺花根尖24 h后,获得的染色体形态良好,污染少、无毒、制作方便、经济,建议使用。
材料在预处理后要进行固定,固定步骤的质量会直接影响到制片的效果,卡诺固定液能使染色体收缩程度相对适中,便于染色体数目的计数和染色体长度测量与核型分析[23]。另外,固定好的材料如果不能及时进行试验,要把根尖放于70%酒精中置于4 ℃的冰箱中保存。
解离主要是软化细胞,破坏细胞的细胞壁。解离的时间过短,会造成细胞壁未完全消化,染色体重叠,出现染色体难以着色,不利于观察等问题;但解离时间过长,会出现染色体受损等问题。本试验研究表明,1 mol/L盐酸解离8 min,染色体着色较好,解离3 min和5 min,着色较浅并且不易着色,这与涂红艳等[24]、孙勃等[25]、汪祥等[23]对其他植物染色体制片最佳解离时间的研究结果相一致。根尖染色的时间在0.5~2 h最佳。时间过短,染色体着色过浅不便观察,时间过长根尖容易软以及变烂[26]。
综上,白刺花染色体制片最佳的实验优化方案为:取材时间为09:00—10:00时,预处理方法为冰水混合物处理24 h,之后在60 ℃水浴下用1 mol/L盐酸解离8 min,卡诺固定液固定,改良石碳酸品红染色液染色0.5~2 h,敲片后镜检。
3.2 白刺花核型分析
本试验结果表明,白刺花的体细胞染色体数目为2 n=2 x=18,染色体基数x=9,其染色体的核型公式为2 n=2 x=2 M+16 m,白刺花的染色体中有16条中部着丝粒染色体,2条为正中部着丝粒染色体。白刺花染色体相对长度组成为2 n=2 x=18=2 S+10 M 1+6 M 2,无核型不对称染色体,染色体类型为1 A型。根据Stebbins[21]和Levitzky[27]的观点,白刺花核型对称程度很高,在进化的过程中处于比较原始的类型。本试验主要针对贵州地区白刺花染色体核型进行分析,探索了其最佳制片技术,同时为贵州石漠化山区白刺花基因组特征、染色体核型研究、遗传育种、品种分类鉴定、新品种的培育提供了科学依据。
[1]李兴美,何胜江,何勇,等.浅谈白刺花的饲用价值及种苗繁殖技术[J].贵州畜牧兽医,2009,33(4):44-45.
[2]赵丽丽,王普昶,龙忠福,等.白刺花硬实种子破除方法研究[J].山地农业生物学报,2011,30(4):319-322.
[3]郭学民,肖啸,梁丽松,等.白刺花种子硬实与萌发特性研究[J].种子,2010,29(12):38-42.
[4]毛晓健,温敏,蒋孝悝.白刺花水煎剂的部分药效学研究[J].云南中医中药杂志,2009,30(2):44-46.
[5]王达明.白刺花——具有重要经济潜力的灌木[J].云南林业,1991(3):20.
[6]毛秀红,荀守华,孙居文,等.我国槐属植物育种资源开发利用进展[J].植物生理学报,2015(4):399-406.
[7]任再金.关于蜜源植物的分类问题[J].蜜蜂杂志,1997(6):26-28.
[8]徐本美,冯桂强,张金政,等.白刺花硬实种子特性的研究[J].植物学通报,1997,14(2):45-48.
[9]陈玲,刘苇洁,徐信,等.不同处理方法对白刺花种子萌发的影响[J].种子,2011,30(7):110-113.
[10]王会儒,郭星.白刺花育苗技术[J].林业实用技术,2004(5):26.
[11]李安定,李苇洁,唐金刚.贵州喀斯特石漠化区白刺花群落主要种群生态位分析[J].湖北农业科学,2013,52(14):3 286-3 289.
[12]梁应林,李仲佰,唐继高.适宜贵州石漠化地区栽培养羊的饲用木本植物鉴选[J].草业与畜牧,2013(3):14-17.
[13]李芳兰,包维楷,吴宁.白刺花幼苗对不同强度干旱胁迫的形态与生理响应[J].生态学报,2009,29(10):5 413-5 414.
[14]何平华.苹果染色体速效观察的研究[J].贵州农业科学,1982(5):60-61.
[15]魏爱民,杜胜利,韩毅科,等.植物细胞染色体倍性鉴定方法[J].天津农业科学,2001,7(2):41-43.
[16]刘祖洞,江绍慧.遗传学实验[M].北京:高等教育出版社,1979:10.
[17]刘永安,冯海生,陈志国,等.植物染色体核型分析常用方法概述[J].贵州农业科学,2006,34(1):98-102.
[18]李懋学,陈瑞阳.关于植物核型分析的标准化问题[J].武汉植物学研究,1985,3(4):297-302.
[19]Levan A,Fredga K,Sandberg A.Nomenclature for centromeric position on chromosomes[J].Hereditas,1964,52(2):201-220.
[20]Arano H.Cytological studies in subfamily Carduoideae (Compositae) of Japan:IX,The karyotype analysis and phylogenic considerations on Pertya and Ainsliaea[J].Botanical Magazine(Tokyo),1963,76(895):32-39.
[21]Stebbins G L.Chromosome and evolution in higher plants[M].London:Edward Aronld,1971:87-89.
[22]Kuo S R,Wang T T,Huang T C.Karyotype analysis of some Formosan gymnosperms[J].Taiwania,1972,17(1):66-80.
[23]汪祥,李晓玲,杨进,等.中华蚊母树染色体制片及核型分析[J].西北植物学报,2011,31(9):1 747-1 748.
[24]涂红艳,张爱玲,肖望,等.姜科植物染色体制片方法的优化[J].热带作物学报,2016,37(5):1 017-1 021.
[25]孙勃,辜金花,童袁桃,等.木耳菜染色体制片优化及核型分析[J].华南农业大学学报,2016,37(6):106-108.
[26]李国珍.染色体及其研究方法[M].北京:科学出版社,1985:109-130.
[27]Levitzky G A.The karyotype in systematics[J].Bull Appl Bot Genet Breed,1931,27:220-240.
Optimization of Chromosome Preparation and Karyotype Analysis ofSophoradavidii
LEIWenying,ZHAOLili,JIANZhongling,CHENChao,SONGGaoxiang
(Department of Grassland Science,College of Animal Science,Guizhou University,Guiyang 550025,China)
To optimize the chromosome preparation procedure and investigate the karyotype ofSophoradavidii.The root ofSophoradavidiigrowing in Guizhou was used as plant material.Factor affected chromosome preparation including sampling time,pretreatment and dissociation durations were investigated.Results showed that,The best compression technique forSophoradavidiichromosome was as follows:sampling time for 09:00-10:00 in the morning,24 hour pretreatment using mixture of ice and water in the refrigerator at 4 ℃,8 minute dissociation at 60 ℃ using hydrochloric acid 1 mol/L.The basic chromosome number was x=9,Sophoradavidiiwas diploid and the chromosome number was 2 n=18,the chromosome karyotype formula was 2 n=2 x=2 M+16 m,the relative length of the chromosome was 2 n=2 x=18=2 S+10 M 1+6 M 2.The chromosome ofSophoradavidiibelongs to 1 A type.
Sophoradavidii; chromosome preparation; chromosome number; karyotype analysis
2017-02-26
贵州大学大学生创新创业训练计划项目(创新020);国家科技支撑计划(2014 BAD 23 B 03);国家自然科学基金项目(31560664);贵州省科技计划项目(黔科合支撑[2016]2516号、黔科合NY字[2014]3048号);黔南州社会发展科技项目(喀斯特石漠化林草牧综合治理技术研究与示范)。
雷文英(1992—),女,学士,研究方向:草业科学;E-mail:1531497269@qq.com。
赵丽丽(1981—),女,博士,副教授,主要从事草种质资源及育种;E-mail:zhaolili0508@163.com。
10.16590/j.cnki.1001-4705.2017.08.005
S 793.2
A
1001-4705(2017)08-0005-05

