猪源沙门菌流行病学调查与耐药性分析
焦连国 , 杨贵燕 , 苏金辉 , 朱要宏 , 赵亚荣 , 王安如 , 王九峰
(1.中国农业大学动物医学院 , 北京 海淀 100193 ; 2.北京大北农科技集团股份有限公司动物医学研究中心 ,北京 海淀 100195 ; 3.饲用微生物工程国家重点实验室 , 北京 海淀 100192)
猪源沙门菌流行病学调查与耐药性分析
焦连国1, 杨贵燕1, 苏金辉1, 朱要宏1, 赵亚荣2, 王安如3, 王九峰1
(1.中国农业大学动物医学院 , 北京 海淀 100193 ; 2.北京大北农科技集团股份有限公司动物医学研究中心 ,北京 海淀 100195 ; 3.饲用微生物工程国家重点实验室 , 北京 海淀 100192)
沙门菌作为常见的食源性病原菌之一,同时是引起断奶仔猪腹泻的重要病原菌之一,我国每年因沙门菌感染所引起的经济损失严重。沙门菌感染通常会导致猪副伤寒,主要特征是严重的系统性疾病,并且可能会导致肠炎或腹泻性疾病。本研究通过收集全国范围内仔猪腹泻样品,对沙门菌进行分离鉴定,了解规模化猪场沙门菌流行情况,同时对沙门菌抗生素敏感性进行分析。从我国16个省份,84个猪场,571份样品中分离得到的128株沙门菌中,发现最常见的血清型是鼠伤寒沙门菌,其次是德尔卑沙门菌、伦敦沙门菌、婴儿沙门菌、韦太夫雷登沙门菌和阿贡纳沙门菌。这些沙门菌的耐药情况严重,尤其是复方新诺明,其耐药率高达100%。
沙门菌 ; 分离鉴定 ; 流行率 ; 耐药性 ; 猪
沙门菌是人和动物常见的重要病原菌之一,目前呈全球性的分布。该菌寄居在人和动物肠道内,是我国常见的细菌性人兽共患病。沙门菌可分为两个种:肠道沙门菌和邦戈沙门菌;肠道沙门菌又可分为6个亚种:肠道亚种、萨拉姆亚种、双亚利桑那亚种、亚利桑那亚种、豪顿亚种和英迪加亚种。亚种可以进一步分血清型,它是基于体细胞(O)和鞭毛(H)抗原的存在而彼此分化。
沙门菌病是猪最严重的肠道疾病之一,肠道沙门菌感染在育肥猪和断奶仔猪的流行率比较高,鼠伤寒沙门菌是最常见的血清型之一[1]。各个年龄段的猪都可感染肠道沙门菌,但由于仔猪未成熟的肠道功能,并发其他病原菌以及周围环境的改变,比较容易感染沙门菌,尤其是1~4月龄断奶仔猪。沙门菌病是猪场提高仔猪存活率而重点防范的疫病之一。近几年,我国规模化猪场发展迅猛,养殖呈现集约化与规模化,这对猪场沙门菌病的防控提出了更高要求,为更好防控我国猪场沙门菌病,迫切需要掌握沙门菌在猪场的流行状况及药物的耐药信息,为此我们进行了下面的研究工作。
1 材料与方法
1.1 沙门菌分离及初步鉴定 称取样品10 g稀释于100 mL缓冲蛋白胨水(BPW)培养基中,在摇床中增菌18 h(37 ℃,80 r/min)。吸取300 μL前增菌液分3个位置滴加于改良MSRV半固体选择性培养基中,42 ℃± 1℃培养18~24 h进行选择性增菌。用接种环从改良MSRV半固体培养基中灰白色区域周围挑出一环,三区划线于XLT4培养基,36 ℃± 1 ℃培养18~24 h。XLT4平板上沙门菌菌落中间为黑色,周围有透明晕环。
1.2 沙门菌疑似菌落DNA提取 挑取疑似菌落于XLT4琼脂平板上三区划线纯化3-4代后,挑取单菌落混匀于胰蛋白胨大豆肉汤培养基(TSB)中,37 ℃摇床中培养12 h。采用TIANGEN公司的细菌基因组DNA提取试剂盒(TIANamp Bacteria DNA Kit) 进行沙门菌DNA提取,按照试剂盒说明书进行操作。
1.3 PCR根据参考文献设计沙门菌的stn基因核苷酸序列为引物,见表1;本研究所使用PCR反应体系及循环设置见表2、表3。
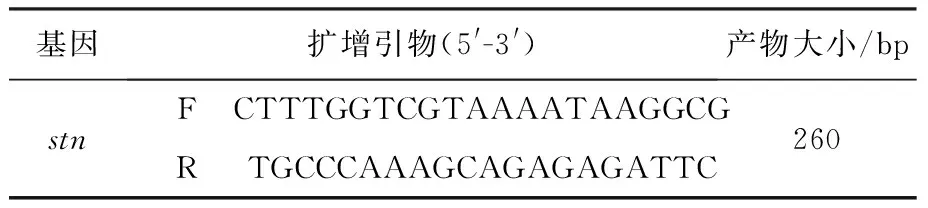
表1 stn基因引物合成序列

表2 PCR反应体系

表3 PCR反应循环设置
1.4 PCR产物琼脂糖凝胶电泳 配置1%琼脂凝胶,用微波炉高火加热煮沸让琼脂溶解,取出待其温度降至55 ℃左右时,加入核酸染料EB(5 μL/100 mL),混匀后倒板待其凝固后使用。每孔加入6 μL PCR产物。连接电源后,进行琼脂凝胶电泳 30 min。使用Alpha Imager 2000紫外凝胶成像仪进行显影。
1.5 生化鉴定 采用法国梅里埃公司的肠杆菌和其他革兰阴性杆菌鉴定试剂盒(API-20E) 进行沙门菌生化鉴定,按照试剂盒说明书进行操作。
1.6 血清型鉴定 本次试验使用的是购自宁波天润生物药业有限公司沙门菌属诊断血清试剂盒,参考GB 4789.4—2010《食品微生物学检验—沙门菌检验》标准,采用玻片凝集法进行鉴定。
1.7 耐药性分析 采用美国临床实验室标准委员会(Clinical and Laboratory Standards Institute,CLSI)推荐的肉汤法对得到的沙门菌分离株进行耐药性检测,共选用18种抗菌药物,药物选取原则为文献中报道较多,在我国应用也较普遍且CLSI所推荐的药物。
2 结果
2.1 沙门菌分离结果 本次研究针对全国范围内16个省份84家猪场肠内容物、粪便进行采集,共采集571份样品,经过分离鉴定,共有66份阳性样本,分离沙门菌128株,沙门菌分离阳性率为11.56%。
2.2 选择性培养基鉴定结果 XLT4培养基可以抑制非沙门菌的生长,提供肉眼可见的疑似沙门菌纯菌落的识别。在XLT4琼脂平板上菌落为中间黑色,周围为透明晕环。见图1。

图1 沙门菌在XLT4琼脂平板的生长情况
2.3 PCR产物电泳结果 将疑似沙门菌DNA样品通过PCR技术进行扩增,随后将PCR产物进行琼脂凝胶电泳,通过紫外凝胶成像仪显示结果。结果如图2。
图2 沙门菌琼脂凝胶电泳图
2.4 沙门菌生化鉴定结果 参照API-20生化试剂条操作说明书和判定标准对沙门菌分离株进行生化鉴定。经鉴定,128株疑似沙门菌均为沙门菌属。整体来说生化谱可以分为3种:6 7 0 4 7 5 2、6 7 0 4 5 5 2和7 5 0 4 5 1 2。将所得的生化谱结果用APIWEB软件进行比对,3种生化谱结果并不能直接得出对应的沙门菌菌种名称,需配合血清型鉴定。结果如中插彩版图3。
2.5 血清型鉴定结果 本试验所分离的128株沙门菌经血清型鉴定后有6种不同的血清型。数量最多的为鼠伤寒沙门菌,其次是德尔卑沙门菌、伦敦沙门菌、婴儿沙门菌、韦太夫雷登沙门菌和阿贡纳沙门菌。鼠伤寒沙门菌广泛分布于各个省份,并且本次分离的鼠伤寒沙门菌有两种血清型:1,4,[5],12∶i∶1,2和1,4,[5],12∶i∶-,而且鼠伤寒1,4,[5],12∶i∶-占绝大多数。结果如表4、表5。
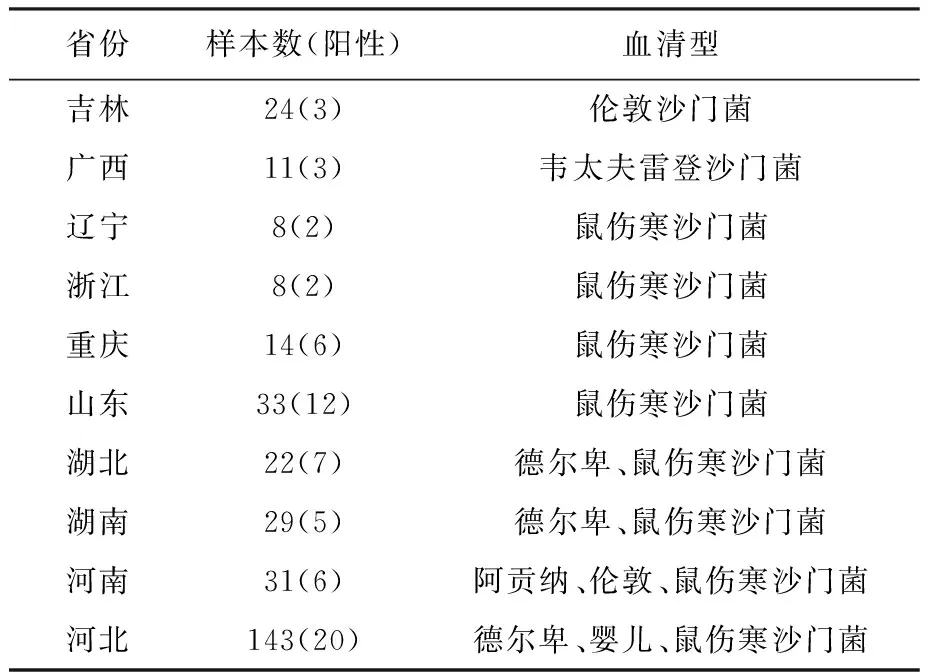
表4 各省份沙门菌血清型鉴定结果
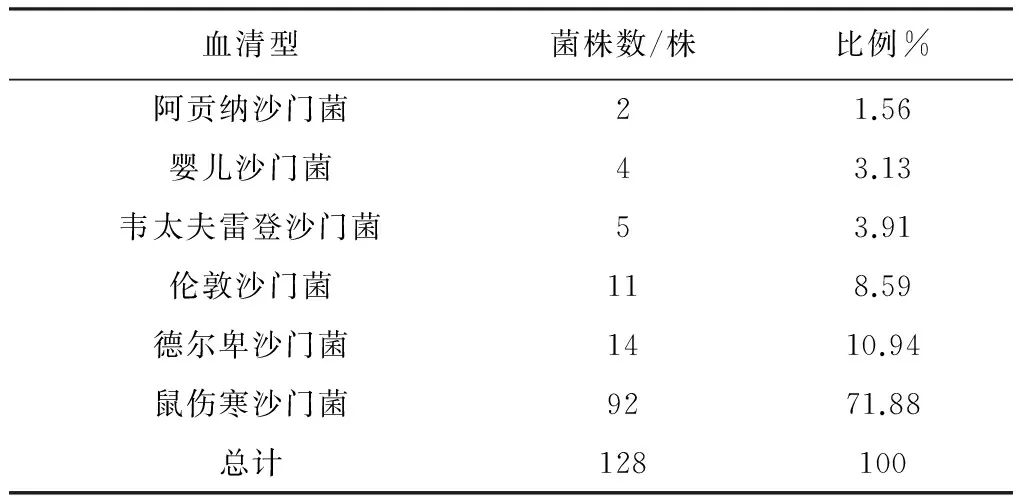
表5 沙门菌各血清型统计结果
2.6 耐药性分析结果 本试验中所用质量控制菌株-大肠杆菌ATCC 25922对所选18种药物的最小抑菌浓度均处于质量控制允许范围之内,结果真实可信。沙门菌的耐药性结果具体见表6。总体来说,沙门菌的耐药情况还是比较严重的,尤其是复方新诺明,其耐药率高达100%。另外,氨苄西林、四环素、氯霉素和氟苯尼考的耐药率也都在60%以上。幸运的是,沙门菌分离株对阿米卡星都是敏感的。

表6 沙门菌耐药性检测结果
3 讨论
本试验共采集到全国16个省份,84家养殖场的571份样本,其中阳性样本66份,阳性率为11.56%,主要分布在河北、山东、湖南、湖北等省份。猪源沙门菌的流行率与其他研究结果相一致,山东省2009年猪源沙门菌分离率是10%[2],欧盟猪源沙门菌分离率是6.3%[3],美国猪源沙门菌分离率为10.34%[4]。但是本试验的猪源沙门菌分离率明显低于四川省的16.4%分离率[5]。这表明区域不同、样本类型、采集季节、培养方式、分离方式以及环境条件都有可能影响到分离率。所以我国建立一个规范的沙门菌长期监测体系是非常必要的。本试验分离得到的128株沙门菌来自10个省份,分为6种血清型,数量最多的为鼠伤寒沙门菌,其次是德尔卑沙门菌、伦敦沙门菌、婴儿沙门菌、韦太夫雷登沙门菌和阿贡纳沙门菌。鼠伤寒沙门菌广泛分布于我国猪场,而且鼠伤寒1,4,[5],12∶i∶-占绝大多数。根据世界卫生组织下属的全球食源性感染网络提供的数据表明,我国最常见的血清型是德尔卑沙门菌,而美国和日本流行率最高的血清型则分别是鼠伤寒沙门菌和婴儿沙门菌。本试验的血清型结果与其他研究结果还是比较一致的。所有沙门菌分离株进行18种抗生素耐药性监测发现,分离株对复方新诺明高度耐药,耐药率达到100%,而对阿米卡星却是敏感的。另外,沙门菌对氨苄西林、四环素、环丙沙星、氯霉素以及氟苯尼考的耐药率都比较高。这个结果与我国其他地方的研究结果相一致[2,5-7]。耐药结果与地域结合在一起分析,可以得出辽宁、吉林等地的抗生素耐药比较乐观,但山东、河南、湖南等省份,耐药形势比较严峻。造成各地区耐药情况不一致的原因可能是各省份在使用抗生素方面有区别。另外,山东、河南、湖北、湖南等地作为我国生猪养殖大省,在疾病治疗与预防方面更多的使用抗生素也是造成抗生素耐药的重要因素。
[1] Kumar T, Rajora V R, Arora N. Prevalence ofSalmonellain pigs and broilers in the Tarai region of Uttarakhand, India [J]. Indian J Med Microbiol, 2014, 32(1):99.
[2] Lai J, Wu C, Wu C,etal. Serotype distribution and antibiotic resistance ofSalmonellain food-producing animals in Shandong province of China, 2009 and 2012[J]. Int J Food Microbiol, 2014, 180(3):30-38.
[3] European Food Safety Authority. The European Union summary report on antimicrobial resistance in zoonotic and indicator bacteria from humans, animals and food in 2012[J]. 2014, 19(12):20748.
[4] National Antimicrobial Resistance Monitoring System. Animal Arm Annual Report. Available Online:https://search.usa.gov/search?utf8=%E2%9C%93amp;affiliate=agriculturalresearchser vicearsamp;query=Animal+Arm+Annual+Reportamp;btnG[J].x=16amp;btnG.y=9.
[5] Li R, Lai J, Wang Y,etal. Prevalence and characterization ofSalmonellaspecies isolated from pigs, ducks and chickens in Sichuan Province, China[J]. Int J Food Microbiol, 2013, 163(1):14-18.
[6] Kuang X, Hao H, Dai M,etal. Serotypes and antimicrobial susceptibility ofSalmonellaspp. isolated from farm animals in China [ J]. Front Microbiol, 2014, 6:602.
[7] Yang B, Qiao L, Zhang X,etal. Serotyping, antimicrobial susceptibility, pulse field gel electrophoresis analysis ofSalmonella, isolates from retail foods in Henan Province China [J]. Food Control, 2013, 32(1):228-235.
PrevalenceandantimicrobialsusceptibilityofSalmonellaisolatesfrompigsinChina
JIAO Lian-guo1, YANG Gui-yan1, SU Jin-hui1,ZHU Yao-hong1, ZHAO Ya-rong2, WANG An-ru3, WANG Jiu-feng1
(1.College of Veterinary Medicine, China Agricultural University, Beijing 100193, China;2.Animal Medicine Research Center of DaBeiNong Group, Beijing 100195, China;3.State Key Laboratory of Direct-Fed Microbial Engineering, Beijing 100192, China)
Salmonellaas one of the common foodborne pathogens is also one of the pathogens in causing diarrhea in weaned piglets. China is a great country in pig industry, and the economic loss due to salmonellosis in pigs is severe. The symptoms ofSalmonellainfection in pigs are usually typhoid, characterized by severe systemic disease, and intestinal inflammation and diarrheal disease. This study collected samples from pigs with diarrhea in different farms of China to investigate the prevalence and drug resistance ofSalmonella. From the 128Salmonellastrains isolated from 571 samples from 84 farms in 16 provinces of China, we found that the most prevalent serotype wasS. Typhimurium, thenS. Derby,S. London,S. Infantis,S. Weltevreden andS. Agona. The antibiotics resistance ofSalmonellaisolates was severe, and all of the isolates were resistant to trimethoprim/sulfamethoxazole.
Salmonella; isolation and identification ; prevalence ; antimicrobial susceptibility ; pig
WANG Jiu-feng
S852.61
A
0529-6005(2017)10-0017-04
2017-05-10
国家重点研发计划项目(2017YFD0502200);公益性行业(农业)科研专项(201403054);国家自然科学基金(21026089)
焦连国(1978-),男,博士生,研究方向为临床兽医学,E-mail:26682488@qq.com
王九峰,E-mail:jiufeng_wang@hotmail.com
——和田盘羊

