以鸡蛋壳内膜为模板制备碳酸钙及吸附性能
周绿山,庞明杨,熊文宇,周艳
以鸡蛋壳内膜为模板制备碳酸钙及吸附性能
周绿山,庞明杨,熊文宇,周艳
(四川文理学院化学化工学院,四川达州 635000)
利用鸡蛋壳内膜为生物模板剂,氯化钙为钙源制备碳酸钙。通过单因素实验考察反应物初始浓度、生物模板用量及反应时间等因素对碳酸钙制备的影响。结果显示其较佳制备条件是:反应物初始浓度为1.5mol/L,生物模板用量为0.02g,反应时间为30min。利用较佳条件下制备的碳酸钙处理10mg/L的铁离子溶液时,在碳酸钙用量为0.2g时,吸附反应10min后的铁离子去除率为91.39%。
生物模板法;碳酸钙;鸡蛋壳内膜;铁离子
碳酸钙是地球上广泛存在的一种矿物质,俗称石灰石,是一种传统的无机化工产品。我国是碳酸钙资源大国,有着丰富的碳酸钙矿物资源地区,但研制产量低、品种少、生产工艺及设备落后,使我国资源未得到充分利用[1]。碳酸钙在日常生活中得以广泛应用,市场前景广阔,具有很大的发展空间。在造纸方面,改变传统纸张在酸性环境下进行的格局,提出了碱性、中性造纸理念,优化纸张性能[2]。在塑料方面,添加碳酸钙可提高塑料制品的稳定性、硬度和刚性、耐热性、散光性等,还可以降低其制作成本,达到节能环保的目的[3]。在橡胶方面,使用碳酸钙填充剂不但可以降低成本,而且还可以调节产品硬度,优化加工工序[4]。在医药方面,因碳酸钙具有良好的生物相容性、大的比表面积、环保安全无毒等特性,常用被用于药物负载,制备缓释药品[5-8]。尽管碳酸钙的应用在许多行业都有所应用,但随着工业与科技的不断发展,各个行业对碳酸钙产品质量的要求也在不断提高,除了要求安全、环保、低成本外,还要求碳酸钙结构功能多样化、颗粒超细化、应用多元化等[9]。因此,碳酸钙绿色、环保、经济、合理的制备方法及其应用已成为相关领域竞相研究的热点。
在碳酸钙的制备方法中,模板法可以提供分子水平上与初始生物体内环境相仿的体系,可以直接有效地控制碳酸钙的成核、聚集、生长和晶体形状,有效地控制碳酸钙晶体表面上成核的位置、成核区域的密度以及晶体的生长趋势,因此其制备出的碳酸钙具有结构有序、特殊形貌的特点,并渐渐成为碳酸钙制备研究的热点之一。纵观现有研究成果,常用的模板剂主要有表面活性剂、高分子聚合物、生物组织等等[10-12]。
鸡蛋是日常食品,其蛋壳常作废物弃之,没能利用好其潜在价值。鸡蛋壳内膜是由限制膜、内层膜、及外层膜组成,厚度约为70 µm,其天然蛋白纤维是由外表面的可溶性糖蛋白和居于内部的胶原质组成,有特殊的官能团残基及蛋白质排布模式,能交错成复杂的半透性孔道结构,在材料的制备及合成中能发挥复杂的物理和化学作用[13,14]。
本实验主要以鸡蛋壳内膜为生物模板制备碳酸钙,并应用于模拟吸附水环境中的金属离子,以达到环境保护的目的。同时也希望能为绿色合成碳酸钙及蛋壳资源的开发应用提供良好的发展思路。
1 实验部分
1.1 主要试剂与仪器
实验过程中使用的主要试剂有碳酸钠、氯化钙、盐酸、氢氧化钠、氯化铁等等,其均为分析纯(AR),由成都市科龙化工试剂厂生产。而主要使用到的仪器如表1所示。

表1 主要仪器设备
1.2 实验方法
1.2.1 生物模板剂(鸡蛋壳内膜)的处理
将从市场收集到的鸡蛋壳用蒸馏水清洗干净后,小心剥离蛋膜,并用蒸馏水进行清洗,然后用1 mol/L NaOH溶液快速漂洗,接着再用蒸馏水洗涤至中性,于恒温干燥箱中保持40 ℃干燥24 h,最后研磨过筛(200目),并储于广口试剂瓶中备用。
1.2.2 碳酸钙的制备
分别称取一定量的无水氯化钙和无水碳酸钠于250 mL烧杯中,并用50 mL蒸馏水溶解得到氯化钙溶液和碳酸钠溶液。将盛有氯化钙溶液的烧杯置于磁力搅拌器中,在不断搅拌的条件下(25 ℃,100 r/min)加入氯化钙溶液和生物模板剂(鸡蛋壳内膜),待反应结束后,静置陈化10 min进行减压抽滤,用蒸馏水洗涤至中性,最后将湿滤饼放入恒温干燥箱中保持110 ℃(±2 ℃)干燥1~1.5 h即可制得碳酸钙产品。
1.2.3 碳酸钙纯度分析
准确称取0.1 g碳酸钙样品三份,分别置于250 mL锥形瓶中,分别用移液管准确加入20 mL 0.500 mol/L盐酸标准溶液溶解,并将其加热沸腾2 min,然后加入4滴10 g/L酚酞指示剂溶液,用0.25 mol/L 氢氧化钠标准溶液滴定至淡红色为止,若30 s内不变色,即为滴定终点,记录相关数据,计算碳酸钙纯度。计算公式如下:

式中:-碳酸钙样品质量,g;
-碳酸钙相对分子质量,g/mol;
1-盐酸标准溶液浓度,mol/L;
2-氢氧化钠标准溶液浓度,mol/L;
1-加入标准盐酸溶液的体积,mL;
2-滴定样品溶液所用氢氧化钠溶液的体积,mL。
1.2.4 铁离子吸附实验
配制浓度为10 mg/L Fe3+溶液(精确称取0.01 g氯化铁溶于1 000 mL蒸馏水中),移取20 mL10 mg/L Fe3+溶液于50 mL烧杯中,加入一定量的碳酸钙粉末,在磁力搅拌作用下进行反应,待反应结束后离心分离,将上层清液移置50 mL烧杯中并标记为待测溶液。
1.2.5 铁离子的测定
移取10 mL已知浓度的铁离子标准溶液于25 mL容量瓶中,依次加入2 mL10%磺基水杨酸和10 mL NH3·H2O-NH4Cl缓冲溶液,用蒸馏水进行定容,摇匀[15]。以蒸馏水做参比,利用可见分光光度计在410~530 nm波长范围内每间隔10 nm测一次吸光度,结果表明磺基水杨酸合铁(Ⅲ)在460 nm处有最大吸收,故实验过程中以460 nm作为特征吸收波长对待测液中的铁离子进行检测。
1.2.6 标准曲线的建立
准确称取氯化铁0.01 g溶于1 000 mL蒸馏水,配成浓度为10 mg/L的氯化铁储备液。将标准储备液进行梯度稀释,配成2.0、4.0、6.0、8.0 mg/L的铁离子溶液。按照铁离子测定方法在460 nm处测定其吸光度,以浓度为横坐标,以吸光度为纵坐标,绘制标准曲线,结果如图1所示,标准曲线方程为=0.0526+0.0228,2=0.9991。
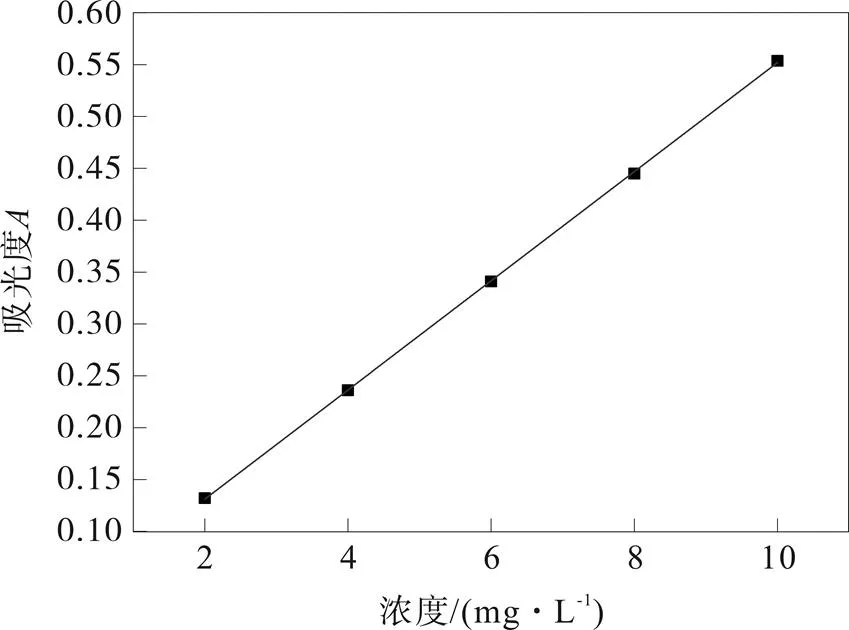
图1 磺基水杨酸法测铁的标准曲线
1.2.7 去除率
将在不同条件下处理后的铁离子溶液制备成待测液,利用可见分光光度计测定其在460 nm处的吸光度。根据吸光度进行去除率分析,计算式如下:
= (0–i) /0× 100%
式中:0-铁离子溶液原始吸光度;
i-碳酸钙处理铁离子溶液后的吸光度。
2 结果与讨论
2.1 碳酸钙制备的影响因素
2.1.1 反应物浓度的影响
利用蒸馏水配制0.5、1.0、1.5、2.0、2.5 mol/L氯化钙溶液和碳酸钠溶液备用。移取50 mL氯化钙溶液于250 mL烧杯中,在25 ℃条件下通过滴液漏斗向其加入含有0.02 g生物模板的碳酸钠溶液50 mL(约10 min),并将烧杯置于磁力搅拌器中不断搅拌,当碳酸钠滴加结束后继续反应30 min。然后将反应溶液进行静置陈化10 min,接着进行减压抽滤,并用蒸馏水洗涤至中性,最后将湿滤饼放入恒温干燥箱中保持110 ℃(±2 ℃)干燥1~1.5 h后得到产品。通过分析可得产品的平均纯度为98.18%。分别称取不同浓度下制备的碳酸钙样品0.1 g置于20 mL10 mg/L Fe3+溶液中,搅拌反应5 min后进行离心分离(8 000 r/min,5 min),取澄清液进行460 nm处吸光度分析,其结果如图2所示。

图2 反应物初始浓度对实验的影响
由图2可知,当其他条件一定时,反应物初始浓度对碳酸钙的制备有较为显著的影响。结果表明,随着反应物初始浓度的增加,碳酸钙处理Fe3+溶液的能力先增大后减小,当原料初始浓度为1.5 mol/L时,处理效果最为明显,去除率为72.31%。
2.1.2 生物模板剂用量的影响
在50 Ml 1.5 mol/L的碳酸钠溶液中分别加入0.01、0.02、0.03、0.04、0.05 g生物模板剂,充分混匀后于25 ℃、不断搅拌的条件下缓慢滴加入盛有50 mL1.5 mol/L氯化钙溶液的250 mL烧杯中(约10 min)。待滴加结束后继续搅拌反应30 min,所得溶液经10 min静置陈化后进行减压抽滤,用蒸馏水洗涤至中性,最后将湿滤饼放入恒温干燥箱中保持110 ℃(±2 ℃)干燥1~1.5 h制得碳酸钙产品。通过分析可得其平均纯度为98.67%。分别称取改变生物模板剂用量制备得到的碳酸钙产品0.1 g用于处理20 mL10 mg/L Fe3+溶液,搅拌反应5 min后进行离心分离(8 000 r/min,5 min),取澄清液进行460 nm处吸光度分析,其结果如图3所示。
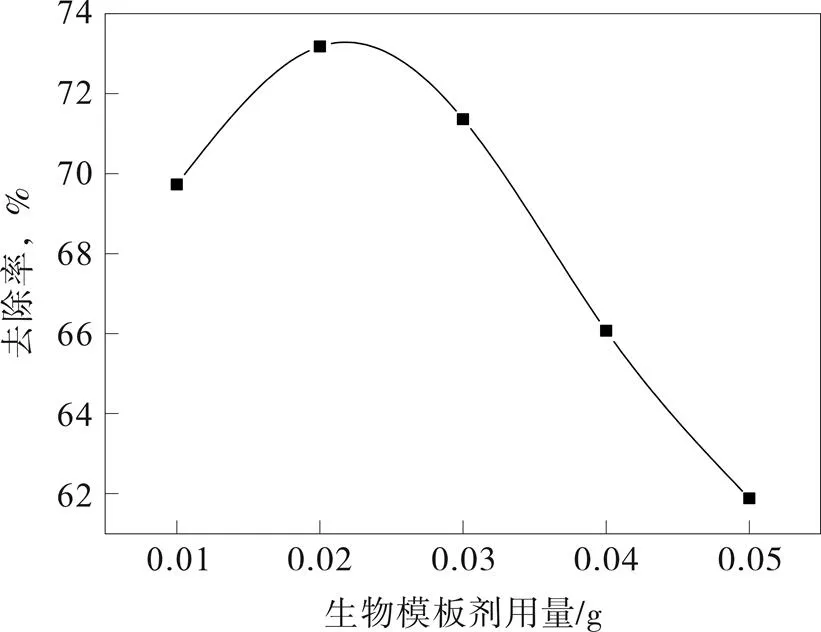
图3 生物模板剂用量对实验的影响
模板剂的加入主要是影响碳酸钙的结构,改善比表面积,利用不同的模板剂可获得不同形貌的产品,但用量的多少也影响着产品的性能[16,17]。由图3可知,生物模板剂用量对实验的影响很强烈,低用量时能增大碳酸钙对铁离子的处理能力,但用量过高时制备出来的碳酸钙吸附能力明显减弱,原因在于鸡蛋壳膜过多时后期不能完全被清除,会阻碍碳酸对铁离子的吸附。结果表明,当生物模板用量为0.02 g时,所制备的碳酸钙对铁离子溶液的处理能力最佳,去除率为73.18%。
2.1.3 反应时间的影响
取1.5 mol/L氯化钙溶液与含有0.02 g生物模板剂的碳酸钠溶液各50 mL,于25 ℃条件下搅拌反应,待碳酸钠溶液滴完毕之后继续反应,控制时间为10、20、30、40、50 min。反应达要求后需进行10 min静置陈放,接着进行减压抽滤,用蒸馏水洗涤滤饼至中性,然后将滤饼移入110℃(±2℃)的恒温干燥箱中干燥1~1.5 h得产品,最后对产品进行纯度分析,结果显示其平均纯度为98.43%。称取不同反应时间下所制得的碳酸钙产品0.1 g加入到20 mL10 mg/L Fe3+溶液中,搅拌反应5 min后进行离心分离(8 000 r/min,5 min),取澄清液进行460 nm处吸光度分析,其结果如图4所示。
在图4中,显示出反应时间对碳酸钙的吸附能力影响结果,随着反应时间的增加先急剧上升而后趋于平稳。充足的反应时间是产品结晶充分的保证,只有结晶良好的产品才会显示出优良的性能。在结果中,当反应时间为30 min时,所制备的碳酸钙处理铁离子溶液效果最佳,去除率为73.17%。

图4 反应时间对实验的影响
碳酸钙的制备受反应物浓度、生物模板剂用量和反应反应时间的影响,通过实验发现,当控制反应物浓度为1.5 mol/L时,加入0.02 g生物模板剂、充分反应30 min后能制得性能较佳的碳酸钙产品。经重复实验验证,在此条件下制备得到的碳酸钙产品纯度可高达98.87%。然而纯度只是影响碳酸钙处理铁离子溶液的一方面因素,要有良好的去除效果,还需探讨出碳酸钙用量、吸附时间等对其影响。
2.2 碳酸钙吸附性能
2.2.1 碳酸钙用量的影响
移取5份20 mL 10 mg/L Fe3+溶液于50 mL烧杯中,分别加入0.1、0.2、0.3、0.4、0.5 g最佳条件下制备的碳酸钙产品,在不断搅拌下反应5 min,待反应结束后离心分离(8 000 r/min,5 min),取澄清液进行460 nm处吸光度分析,其结果如图5所示。

图5 碳酸钙的用量对实验的影响
由图5可知,随着碳酸钙用量的增加,对铁离子的吸附能力先急剧增加,而后略有下降,原因可能是碳酸钙用量过多时,自身所携带的有机物或金属离子对其吸附能力产生阻碍。结果表明:当碳酸钙用量为0.2 g时,铁离子去除率最好,为72.78%。
2.2.2 吸附时间的影响
选用0.2 g碳酸钙产品进行实验,改变吸附时间为5、10、15、20、25、30、60 min,待反应结束后离心分离取清液进行吸光度分析,结果如图6所示。
吸附时间对碳酸钙产品的吸附能力有着至关重要的影响。时间短,吸附不完全,造成产品性能差;当随着吸附时间的延长,吸附会逐渐趋于最大值,但由于吸附时同时也发生着脱附反应,所以当吸附达到极值时脱险速率也随之增大,造成一段时间内吸附能力有所下降,而长时间接触后会趋于平衡。由图6可知,当吸附时间为10 min 时,碳酸钙的吸附能力最好,对铁离子的去除率最高可达91.37%。

图6 吸附时间对实验的影响
2.3 验证性实验
分别称取0.2 g在反应物浓度1.5 mol/L,生物模板用量0.02 g,反应时间30 min 条件下制备的碳酸钙3份,加入到20 mL 10 mg/L Fe3+溶液进行吸附10 min。处理后的Fe3+溶液经过离心分离后取清液在460 nm处测其吸光度,计算得到的去除率见表2。

表2 验证实验结果
由表2可知,在最佳条件下制备的碳酸钙(原料初始浓度1.5 mol/L,生物模板用量0.02 g,反应时间30 min)并在最佳条件处理铁离子溶液(碳酸钙用量0.2 g、反应时间10 min),通过分析可得其平均去除率达到91.39%,其相对标准偏差为0.14%。
3 结论
(1)利用鸡蛋壳内膜为生物模板制备碳酸钙,通过单因素实验可知其较佳工艺条件为:反应物初始浓度1.5 mol/L,生物模板用量0.02 g,反应时间30 min,产品的纯度可达98.87%。
(2)通过单因素实验可知,利用较佳条件下制备的碳酸钙处理10 mg/L的铁离子溶液时,当碳酸钙用量为0.2 g时,吸附反应10 min后的铁离子去除率为91.39%。
[1]钱海燕,万永敏,石防震,等.化学法制备超细碳酸钙[J].中国粉体技术,2000,6(2):11-14.
[2]姬广斌,柴晓利,陈伟忠. 超细重质碳酸钙的应用及制备工艺[J].上海化工,2000(11):19-20.
[3]刘英俊. 碳酸钙在塑料中应用进展[J]. 无机盐工业, 2008(3): 11-13.
[4]闻新春. 纳米碳酸钙的表面改性及其在橡胶中的运用[J]. 化工管理, 2016 (29):168.
[5]Chaoyang Wang, Hongxia Liu, Quanxing Gao, et al. Alginate–calcium carbonate porous microparticle hybrid hydrogels with versatile drug loading capabilities and variable mechanical strengths[J]. Carbohydrate Polymers, 2008, 71: 476-480.
[6]Rajendra Kurapati, Ashok M. Raichur. Composite cyclodextrin– calcium carbonate porous microparticles and modified multilayer capsules: novel carriers for encapsulation of hydrophobic drugs[J]. J. Mater. Chem. B, 2013, 1:3175-3184.
[7]Yaran Zhang , Ping Ma, Yao Wang , et al. Biocompatibility of Porous Spherical Calcium Carbonate Microparticles on Hela Cells[J]. World Journal of Nano Science and Engineering, 2012, 2: 25-31.
[8]Daniel Preisig, David Haid , Felipe J.O. Varum, et al. Drug loading into porous calcium carbonate microparticles by solvent evaporation[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2014, 87:548-558.
[9]杨小红,陈建兵,刘金库.简易模板法仿生合成碳酸钙纳米球[J].池州学院学报,2007,21(3):39-40.
[10]陈彰旭,辛梅华,李明春,等. 模板法合成碳酸钙研究进展[J]. 化工进展, 2014, 33(10):2687-2692.
[11]Ping H, Wu S. Preparation of cage-like nano-CaCO3hollow spheres for enhanced CO2sorption[J]. RSC Advances, 2015, 80(5):65052-65057.
[12]Zhao J, Li Y J, Cheng G X. Synthesis of CaCO3crystals using hydroxypropylmethyl cellulose hydrogel as template[J]. Science Bulletin, 2007, 52(13):1796-1801.
[13]余晓,陈中银,牛新书,等. 蛋膜结构氧化锌微纤维的合成与表征[J]. 河南师范大学学报(自然版), 2007, 35(4):103-105.
[14]吴义平. 碳酸钙的植物模板法制备与表征[D].安徽大学,2009.
[15]包桂兰,刘青山.磺基水杨酸差示分光光度法测定不同含量铁的研究及应用[J]. 内蒙古师大学报(自然汉文版),2001,30(2):139-141.
[16]Wei Q R, Lu J, Ai H, et al. Novel method for the fabrication of multiscale structure collagen/hydroxyapatite-microsphere composites based on CaCO3microparticle templates[J]. Materials Letters, 2012, 80: 9l-94.
[17]张腾龙, 庞艺川, 冯杰. 多孔碳酸钙微粒的简易制备及其形貌控制[J]. 高校化学工程学报, 2015, 29(2): 377-381.
[18]Chaoyang Wang, Chengyi He, Zhen Tong. Combination of adsorption by porous CaCO3microparticles and encapsulation by polyelectrolyte multilayer films for sustained drug delivery[J]. International Journal of Pharmaceutics, 2006, 308: 160-167.
Synthesis of Calcium Carbonate Based on Eggshell Membrane and Its Adsorption Property
,,,
(School of Chemistry and Chemical Engineering, Sichuan University of Arts and science, Sichuan Dazhou 635000, China)
Eggshell membrane was selected as the bio-template, CaCO3was synthesized from calcium chloride. Effect of initial concentration of reactant, bio-template dosage and reaction time on the synthesis of calcium carbonate was investigated by single factor experiments. The results show that the optimum synthesis conditions of CaCO3are as follows: the reactant initial concentration 1.5 mol/L, bio-template dosage 0.02 g, reaction time 30 min. When the iron ion solution(10mg/L)was treated by 0.2 g calcium carbonate which was synthesized under the optimum conditions, the iron removal rate was 91.39% after 10 min adsorption treatment.
Bio-template;Calcium carbonate;Eggshell membrane;Iron ion
TQ127.1+3;TB321
A
1671-0460(2017)10-2026-05
四川省教育厅项目,项目号:16ZB0361;大学生创新创业训练计划项目,项目号:201610644016、201710644008。
2017-08-17
周绿山(1987-),男,四川省德阳市人,讲师,硕士,2014年毕业于昆明理工大学化学工程专业,研究方向:环境化工相关领域研究。E-mail:zhoulvshan@126.com。

