依托泊苷联合顺铂对完全切除性肺低分化神经内分泌癌术后的疗效观察
贺外信 辛田田 杜玲玲
依托泊苷联合顺铂对完全切除性肺低分化神经内分泌癌术后的疗效观察
贺外信1辛田田1杜玲玲2
目的探究依托泊苷联合顺铂对完全切除性肺低分化神经内分泌癌术后的近期疗效、远期生存及毒副反应。方法前瞻性分析收集肺低分化神经内分泌癌SCLC和LCNEC受试者共44例,给予依托泊苷(VP-16)100 mg/m2,第1-3天;顺铂 25 mg/m2,第1-3天,21天为一个周期。至少完成3个周期的化疗以后评估疗效和毒副反应。结果有效率RR 61%,疾病控制率DCR为 89%,其中LCNEC达92%,SCLC有83%(Pgt;0.05)。3年生存率达到82%,3年内无进展生存期(RFS)75%。主要的毒副反应为骨髓抑制,其中LCNEC血小板减少率,恶心呕吐及肝肾功能损害的发生率略高于SCLC。结论依托泊苷联合顺铂的化疗辅助方案对完全切除性肺低分化神经内分泌癌的治疗在可接受的毒性范围内,且具有可行性。
依托泊苷;顺铂;小细胞肺癌;大细胞神经内分泌癌;辅助化疗
临床上,肺神经内分泌癌可分为低级别的典型类癌(typical carcinoid,TC)、中等级别的不典型类癌(atypical carcinoid,AC),以及两种高级别(低分化)肿瘤:大细胞神经内分泌癌(large cell neuroendocrine carcinoma,LCNEC)和小细胞肺癌(small-cell lung cancer,SCLC),其中SCLC最为常见,约占20%,其次为LCNEC,约占3%。SCLC和LCNEC在男性吸烟者中高发,细胞有丝分裂率高,可表达多种神经内分泌细胞标记物,存在基因突变,恶性度高,预后差[1]。临床上SCLC和LCNEC具有类似的生物侵袭性,从大数据分析发现,两者的生存曲线随时间的进展而逐步重叠,生存率远低于其他类型的非小细胞肺癌[2],此中 LCNEC的5年生存率有40.3%,SCLC有35.7%[3]。
越来越多的后期临床试验证明,以“铂类+依托泊苷”为基础的联合辅助化疗对疾病的治疗及预后起到了至关重要的效果。基于此,考虑到肺神经内分泌癌中的重要两大癌种类型的治疗现状,依据临床中依托泊苷联合顺铂这一经典化疗方案,我们前瞻性的分析评估了完全切除性肺低分化神经内分泌癌的术后疗效。
资料与方法
一、临床资料
我院收集的44例经临床表现,胸部CT检查,皮肺穿刺,细胞学或者组织病理学检查确诊的SCLC和LCNEC受试者,且接受了完全切除性手术,入选标准:年龄在18-75岁之间;术后4-10周内可接受化疗;所有受试者全身体质状态评分(WHO ECOG PS)在0-1;初治,没有接受过其他放疗和化疗;无主要器官功能受损(总胆红素≤1.5 mg/dL,AST、ALTlt;100 IU/L,血红蛋白≥9.5 g/dL,血小板≥100,000/mm3,血清肌酐≤1.5 mg/dL,白细胞≥4000/mm3,室内空气PaO2≥70 torr);受试者对接受的治疗和随访具有良好的依从性,并签署了知情同意书。
二、治疗方案
用药方案:依托泊苷(VP-16)溶解至250 mL生理盐水中,浓度100 mg/m2,第1-3天,中静脉滴注;顺铂亦溶解至250 mL生理盐水中,浓度25 mg/m2,第1-3天,中静脉滴注。21天为一个周期,滴注时辅以常规的止吐、护胃、水化以及利尿治疗手段。每个周期都进行血常规、心电图、肝功能及肾功能的检查和记录,并详细观察化疗前后受试者有无骨髓抑制、恶心或呕吐等不良副作用;治疗周期内若出现不良反应过重(≥Ⅳ度)或受试者不能耐受者减20%剂量,若出现过多剂量调整,则剔除统计。
三、评价标准
治疗开始前1周之内完成基线评估(包括受试者疾病史采集,胸部CT扫描,腹部CT扫描或B超,头部CT或MRI,骨扫描,肝肾功能等)。根据实体瘤疗效评价标准RECIST 1.1 版分为:完全缓解(complete response,CR):目标病灶消失;部分缓解(partial response,PR):病灶基线长径总和缩小gt;30%;稳定(stable disease,SD):基线病灶长径总和有缩小但未达 PR 或者有增加但未达 PD;进展(progress disease,PD):基线病灶长径总和增加 gt; 20%或者出现新病灶。评价为CR、PR及SD的受试者需在4周后以CT进行复查确认;近期疗效评价通过客观有效率(response rate,RR)评价,RR=(CR+PR)/(CR+PR+SD+PD)%,疾病控制率(disease control rate,DCR),DCR=(CR+PR+SD)/(CR+PR+SD+PD)%,不良反应按照NCI分度标准3.0版进行分析,分为0-Ⅳ度。
四、统计学方法
若受试者可接受至少3到4个依托泊苷联合顺铂的治疗周期,即可作为首要化疗完成率判定指标;3年无复发生存率,3年存活率和毒性反应。获得的数据通过 SPSS 20.0 统计软件统计,定性资料采用百分数(%)表示,以Pgt;0.05为差异具有统计学意义标准。
结 果
一、受试者信息
本研究的44个受试者的基础信息,平均年龄在65岁,82%为男性;其中LCNEC受试者占59%,SCLC受试者占41%。(见表1)。
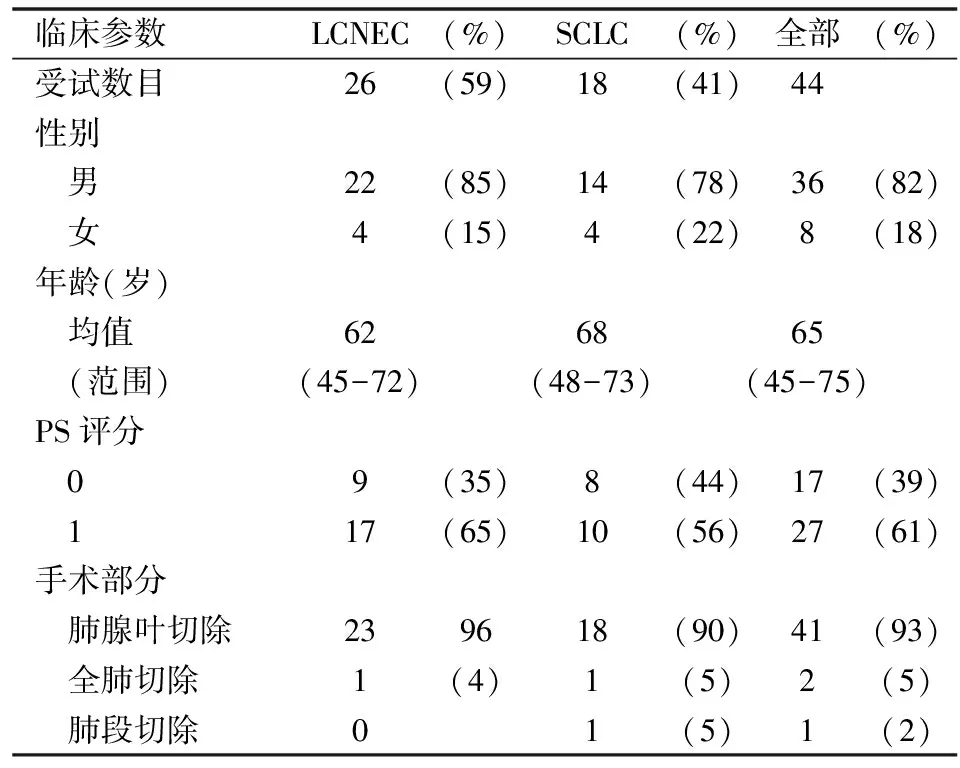
表1 受试者临床基线特征
SCLC: Small cell lung carcinoma, LCNEC: Large cell neuroendocrine carcinoma. (overall,n=44)
二、治疗依从性评价
治疗依从性情况,其中接受4个EP的化疗循环的受试者38人,占比达到82%,试验化疗完成率达87%(90% confidence interval(CI); 71-90%)。有8例受试者不良反应过重减少了剂量,只进行了1-2个治疗周期。(见表2)。

表2 受试者辅助化疗依从性
三、疗效及生存状况
44例患者均可评价疗效,其中CR 6例,PR 21例,SD 12例,PD 5例,有效率RR 61%,疾病控制率DCR为 89%,其中LCNEC达92%,SCLC达83%。RR 和DCR差异无显著性(Pgt;0.05)。3年生存率达到82%,3年内无进展生存期(RFS)75%,(见表3、图1、图2)。
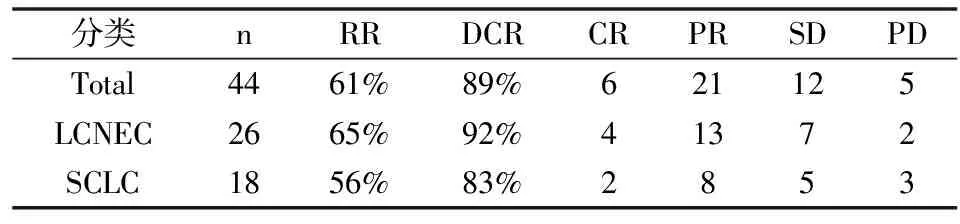
表3 受试者临床疗效情况

图1 总生存率

图2 无进展生存(RFS)率
四、不良反应
受试者均未出现治疗相关性死亡,主要毒副反应为骨髓抑制,表现为白细胞、血小板和血红蛋白减少,其中LCNEC血小板减少率,恶心呕吐及肝肾功能损害的发生率略高于SCLC,(见表4)。
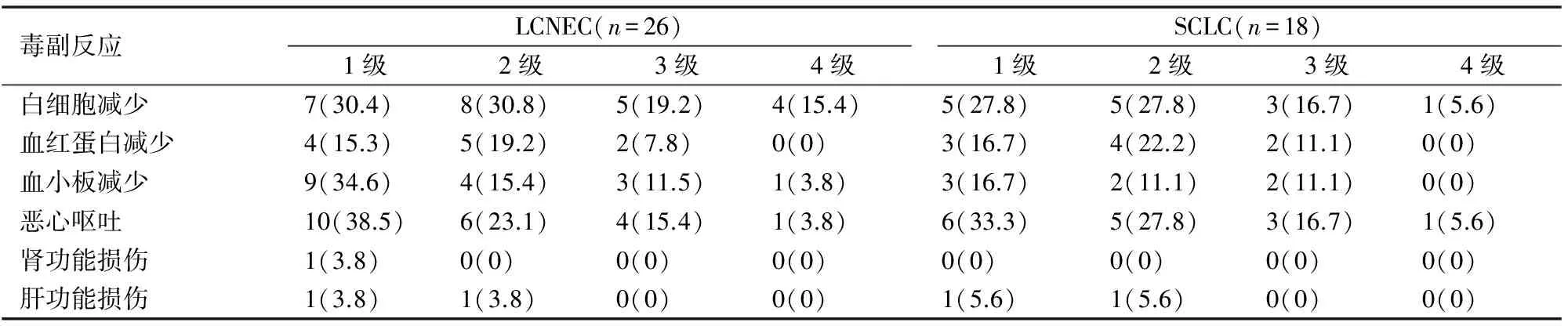
表4 治疗毒副作用情况
讨 论
本研究疗效观察结果显示,依托泊苷联合顺铂的化疗辅助方案对完全切除性肺低分化神经内分泌癌的治疗在可接受的毒性范围内且具有可行性。本研究是第一个前瞻性试验来评价术后的辅助化疗,44例受试者均可评价疗效,有效率RR 61%,疾病控制率DCR为 89%,3年内无进展生存期(RFS)75%,3年生存率达到82%。虽然针对完全切除性肺低分化神经内分泌癌的辅助化疗方案尚无定论和报道,但与单纯的外科手术相比,进行化疗辅助更有助于生存率的提高。
最新的临床大数据显示,在所有化疗方案中,依托泊苷联合顺铂仍是被公认的一线标准化疗方案。顺铂是第一代铂类,是在临床上最普及使用的抗癌药物之一。它是一种铂类金属化合物,可与DNA结合成DDP-DNA复合物,进而干扰肿瘤细胞DNA复制、转录等功能来抑制细胞的分裂,从而具有超强的广谱抗癌的作用[4-5]。第三代铂类洛铂也被广泛用于肺小细胞癌[6-7],李等人发现洛铂联合依托泊苷治疗广泛期小细胞肺癌与顺铂联合依托泊苷疗效相当[8];曹等人[9]也发现在安全性方面洛铂可能优于顺铂。另外,在2002年,日本临床肿瘤协作组(JCOG-9511)的临床试验结果发现,在初治广泛期小细胞肺癌人群中,以伊立替康为主的联合化疗方案疗效超过了EP方案,这也是近几年首次发现比EP方案效果更好的联合化疗方案,此后伊立替康逐渐用于广泛期小细胞肺癌治疗[10-11]。2014年,Hirotsugu等人[12]针对完全切除性肺低分化神经内分泌癌做了以伊立替康和顺铂为化疗联合方案的前瞻性研究, 3年生存率达到81%,与我们的观察结果相近,治疗效果相当。
临床上对SCLC的辅助化疗方案探究比较深入,但随着组织学诊断技术的进步,特别是免疫组化技术对神经内分泌标志物标记的发展,越来越多的肺部神经内分泌肿瘤得以诊断并分型,也成为近年来肺部神经内分泌癌发病率不断增高的原因之一[13]。但LCNEC发病率较低,很难进行随机临床试验,导致现阶段尚未形成其辅助化疗的治疗标准[14]。临床回顾性分析发现,SCLC的化疗标准方案也适用于LCNEC的辅助化疗方案[15]。在完全切除性SCLC的患者中,首先会考虑用铂类进行辅助化疗。
综上所述,虽然已有众多报道指出众多辅助化疗组合疗效不同,甚至用洛铂或者伊立替康有更好的耐受性,但作为经典辅助化疗方案,依托泊苷联合顺铂辅助化疗对SCLC的治疗具有更好的效果,其中Iyoda等人依据SCLC患者的化疗方案,对LCNEC患者也进行了铂类+依托泊苷的化疗方案治疗的前瞻性研究:与对照组的47.4%相比,实验组5年生存率达到88.9%[16]。综合两类肺癌的综合临床疗效,依托泊苷联合顺铂仍是最经典的选择,且对完全切除的低分化肺神经内分泌癌有良好的治疗效果,具有可行性,但目前大多为回顾性研究,针对的病例数目有限,一些不良反应结果仍需更多的前瞻性研究验证。
[1] Gridelli C,Rossi A,Airoma G,et al.Treatment of pulmonary neuroendocrine tumours: state of the art and future developments[J].Cancer Treat Rev,2013,39(5):466-472.
[2] Lee HW,Ha SY,Roh MS.Altered Expression of PTEN and Its Major Regulator MicroRNA-21 in Pulmonary Neuroendocrine Tumors[J].Korean J Pathol,2014,48(1):17-23.
[3] Asamura H,Kameya T,Matsuno Y,et al.Neuroendocrine neoplasms of the lung: a prognostic spectrum[J].J Clin Oncol,2006,24(1):70-76.
[4] Califano R,Abidin AZ,Peck R,et al.Management of small cell lung cancer: recent developments for optimal care[J].Drugs,2012,72(4):471-490.
[5] 郗照勇,刘扬中.顺铂耐药的分子机制[J].中国科学(化学),2014,44(4):410-422.
[6] 梁宇峰,隋东虎,程颖.一类抗肿瘤新药洛铂治疗小细胞肺癌临床研究进展[J].中国新药杂志,2014,23(2):184-188,209.
[7] 王俊,王建中,张长春,等.洛铂或顺铂联合依托泊苷治疗广泛期小细胞肺癌的临床观察[J].临床肿瘤学杂志, 2015,20(2):168-170.
[8] 李芸,高珅,张学林,等.依托泊苷联合洛铂与依托泊苷联合顺铂一线治疗广泛期小细胞肺癌的对比研究[J].中国临床医生杂志,2016,44(6):61-63.
[9] 曹齐生.洛铂/顺铂联合依托泊苷治疗初治小细胞肺癌的疗效和安全性比较[J].中国药房,2016,27(3):306-308.
[10] 郭爱萍,余宗阳,欧阳学农.伊立替康联合顺铂与依托泊苷联合顺铂方案一线治疗广泛期小细胞肺癌的临床疗效观察[J].现代肿瘤医学,2014,22(12):2889-2891.
[11] 伍志新,陈立军,宋文军,等.伊立替康联合洛铂治疗复发性广泛期小细胞肺癌(SCLC)的临床研究[J].现代肿瘤医学,2014,22(6):1344-1346.
[12] Kenmotsu H,Niho S,Ito T,et al.A pilot study of adjuvant chemotherapy with irinotecan and cisplatin for completely resected high-grade pulmonary neuroendocrine carcinoma (large cell neuroendocrine carcinoma and small cell lung cancer)[J].Lung Cancer,2014,84(3):254-258.
[13] Sun JM,Ahn MJ,Ahn JS,et al.Chemotherapy for pulmonary large cell neuroendocrine carcinoma: similar to that for small cell lung cancer or non-small cell lung cancer[J].Lung Cancer,2012,77(2):365-370.
[14] Peng G,Yin Z,Li X,et al.Meta-analysis of human lung cancer microRNA expression profiling studies comparing cancer tissues with normal tissues[J].J Exp Clin Cancer Res,2012,31:54.
[15] Rossi G,Cavazza A,Marchioni A,et al.Role of chemotherapy and the receptor tyrosine kinases KIT, PDGFRalpha, PDGFRbeta, and Met in large-cell neuroendocrine carcinoma of the lung[J].J Clin Oncol,2005,23(34):8774-8785.
[16] Iyoda A,Makino T,Koezuka S,et al.Treatment options for patients with large cell neuroendocrine carcinoma of the lung[J].Gen Thorac Cardiovasc Surg,2014,62(6):351-356.
Clinicalobservationofetoposidecombinedwithcisplatinintreatmentofcompletelyresectedpoorlydifferentiatedneuroendocrinecarcinomas
HEWai-xing,XINTian-tian,DULing-ling
DepartmentofRespiratoryMedicine,Yan’anPeople’sHospital,Yan’an,Shaanxi716000,China
ObjectiveTo investigate the therapeutic effect, long term survival and side effects of etoposide and cisplatin on completely resected poorly differentiated neuroendocrine carcinomas.Methods44 patients with SCLC or LCNEC were prospectively analyzed, who were treated by etoposide 100 mg/m2(d1-d3) and cisplatin 25 mg/m2(d1-d3), and 21 days as a cycle. Efficacy and toxicities were evaluated after 3 or more cycles.ResultsThe overall response rate were 61%, and the disease control rate were 75%, each LCNEC were 92% and SCLC were 83% (Pgt;0.05). The rate of overall survival at 3 years was estimated at 82% and the rate of RFS at 3 years was 75%. The main side effects were bone marrow suppression, and there were higher incidences of thrombocytopenia, nausea and vomiting, and liver and kidney impairment in LCNEC versus SCLC.ConclusionThe combination of etoposide and cisplatin as postoperative adjuvant chemotherapy is feasible and possibly efficacious for completely resected poorly differentiated (high grade) neuroendocrine carcinomas.
etoposide; cisplatin; SCLC; LCNEC; adjuvant chemotherapy
10.3969/j.issn.1009-6663.2017.12.038
716000 陕西 延安,延安市人民医院 1. 呼吸内科 2. 急诊医学科
辛田田,E-mail:yananznfe@126.com
2017-05-11]

