电活化玻碳电极的制备及其对抗坏血酸、多巴胺、尿酸与亚硝酸盐的同时测定
王 鑫,杨梦静,张 雷
(上海师范大学 生命与环境科学学院 化学系,上海 200234)
电活化玻碳电极的制备及其对抗坏血酸、多巴胺、尿酸与亚硝酸盐的同时测定
王 鑫,杨梦静,张 雷*
(上海师范大学 生命与环境科学学院 化学系,上海 200234)

电活化玻碳电极;抗坏血酸;多巴胺;尿酸;亚硝酸盐

1 实验部分
1.1 试剂与仪器
AA(分析纯,上海曹杨二中化工厂),DA(98%,Aladdin公司),UA(99%,Alfa Aesar公司),NaNO2(分析纯,上海振兴试剂厂),磷酸盐缓冲溶液(pH 4.0~9.0)由0.1 mol·L-1的NaH2PO4和0.1 mol·L-1的Na2HPO4溶液配制,其他试剂均为分析纯,实验用水为二次蒸馏水(18.2 MΩ·cm)。
PGSTAT128N型AUTOLAB电化学工作站(瑞士万通中国有限公司);雷磁pHS-25型精密pH计(上海精密科学仪器有限公司);SJ-1200型超声波清洗器(上海洁净超声波设备厂);三电极系统:工作电极为直径3 mm的GCE和A-GCE,参比电极为饱和甘汞电极(SCE),辅助电极为铂丝电极。
电化学阻抗(EIS)测量均在1 mmol·L-1K3Fe(CN)6、1 mmol·L-1K4Fe(CN)6及0.1 mol·L-1KNO3的混合溶液中进行。开路电位为0.21 V,频率范围为0.01~100 kHz。
1.2 实验方法
1.2.1活化电极的制备将GCE依次用0.3、0.05 μm的Al2O3粉末在麂皮上抛光至镜面,用水冲洗后,再依次在无水乙醇和水中各超声清洗1 min,晾干,得到洁净的GCE。
将洁净GCE置于1 mol·L-1的H2SO4溶液中浸泡5 min,用循环伏安法以0.05 V·s-1的扫速在-0.2~2.0 V范围内扫描至稳定,取出电极,在乙醇和水中分别超声清洗1 min,即得“活化”的玻碳电极(A-GCE),将其存放于0.1 mol·L-1PBS中(pH 7.0),置于冰箱(约4 ℃)保存备用。
2 结果与讨论
2.1 A-GCE的电化学活性
由于裸GCE较低的电子转移速率,使得大部分电活性物质在其表面呈现出较差的电化学行为,包括高的氧化过电位和弱的电流响应,从而使其实用性受到限制。基于碳基电极的特性,为进一步开发GCE的应用价值,简单的电化学氧化法被广泛用于GCE的表面“修饰”,使其电子传递能力得到了极大的改善[20-23]。在H2SO4、HClO4等强酸溶液中进行电化学氧化后,GCE表面的C—C键断裂并被进一步氧化产生各种酸性、中性和碱性的含氧基团,如:羰基、羧基、羟基等,这些含氧基团对某些电化学活性物质的氧化还原具有一定的电催化作用[24-27]。
为了探究电化学处理GCE过程中可能的变化机制,Kiema课题组[22]研究了GCE在1.0 mol·L-1H2SO4及0.1 mol·L-1NaOH溶液中于1.80 V电解10~120 s后电极表面的结构和成分变化。结果显示,在酸性介质中进行高电位氧化后,电极表面呈现出多孔的氧化石墨层结构,并富含羰基、羧基、羟基等含氧基团,使得电极表面荷负电。Gu等[23]认为预处理GCE对电活性分析物响应的促进作用主要由电极表面羰基和羟基功能团之间的转换造成;而McCreery等[28]认为尽管碳表面的氧化物种能改善电极表面的性能,但表面预处理后增多的棱面密度对GCE表面的电荷传递过程起主要的促进作用。
由此可见,经过电化学处理后,不仅在GCE表面生成大量的具有催化活性的含氧基团,相邻的不同基团之间也可相互转换[23],而且在电极表面生成大量的微小颗粒,颗粒与颗粒之间存在孔隙,形成多孔的氧化物多层膜[29-30],增加了电极的表面积和棱面密度,使GCE表面的电化学活性得到改善。
2.2 A-GCE的电化学阻抗表征
电化学阻抗(EIS)是用于测试电极界面动力学屏障的工具,常用以研究在改性过程中电极表面的阻抗变化。为了进一步研究GCE活化前后的导电性,以[Fe(CN)6]3-/4-为探针,考察了GCE活化前后的阻抗值变化。
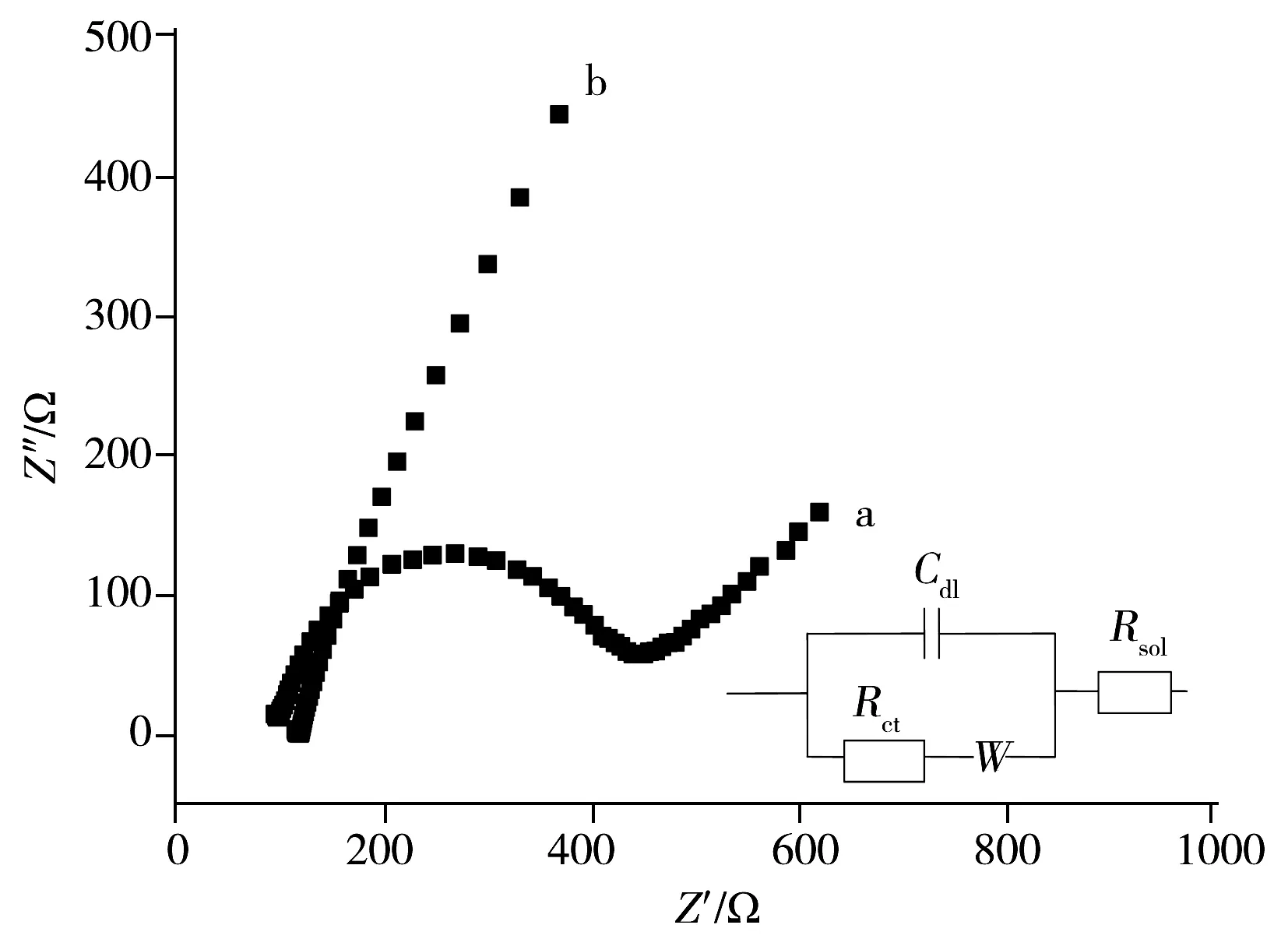
图1 GCE(a)和A-GCE(b)的电化学阻抗图Fig.1 EIS plots of GCE(a)and A-GCE(b) in 1 mmol·L-1 K3Fe(CN)6+1 mmol·L-1 K4Fe(CN)6 with 0.1 mol·L-1 KNO3 as electrolyteinsert:Randle's equivalent circuit
图1为GCE(曲线a)和A-GCE(曲线b)在1 mmol·L-1[Fe(CN)6]3-/4-中的电化学阻抗图。电化学阻抗谱包括位于高频区的半圆部分和位于低频区的直线部分;高频区的半圆部分对应电子传递受限过程,低频区的直线部分对应电子传递扩散过程。为了说明溶液/界面之间的电学性质,图1内插图给出了理想的Randle等效电路图[31]。在Randle电路图中,电子转移阻抗(Rct)和扩散电阻(W)与界面电容(Cdl)是并联的。Rct和Cdl的共同作用形成了电化学阻抗谱中的半圆,其直径的大小表示电荷交换电阻的大小。由图1可知,Fe[(CN)6]3-/4-在GCE上的阻抗谱(曲线a)呈明显的半圆形,Rct为350 Ω,说明电子在GCE上的转移阻抗相对较大;而在A-GCE上,[Fe(CN)6]3-/4-的阻抗谱(曲线b)在所有频率范围内近似呈一条直线,在高频区未出现半圆部分,表明电极反应是受扩散控制的过程,[Fe(CN)6]3-/4-容易在电极表面发生反应,说明电活化后的A-GCE加速了界面电子转移速度,使电极的导电性能增加[32-33]。
由图2A可知,在GCE上,AA在0.15 V呈现出1个宽的弱氧化峰;而在A-GCE上,AA在0.04 V处出现1个窄而强的氧化峰。与裸GCE相比,AA在A-GCE上不仅具有较低的氧化过电位,且其氧化峰电流大幅增加,为其在GCE上峰电流的2.8倍,表明A-GCE对AA的电化学氧化具有较好的催化作用。
由图2B可见,DA在GCE上呈现1对很弱的氧化还原峰,峰电位分别位于0.21 V和0.13 V处,峰电流分别为4.71 μA和1.65 μA;而在A-GCE上,DA在0.18 V和0.17 V处出现1对灵敏的氧化还原峰,峰电流分别增加至29.54 μA和12.50 μA,分别为其在GCE上的6.3倍和7.6倍,表明A-GCE对DA的电化学氧化具有催化作用,并改善了DA的氧化还原可逆性。
由图2C可知,在GCE上,UA在0.39 V处呈现1个宽的弱氧化峰,峰电流为6.12 μA;而在A-GCE上,UA呈现1个窄而灵敏的氧化峰(Ipa=35.19 μA)和1个较弱的还原峰,峰电位分别位于0.35 V和0.30 V,表明A-GCE不仅对UA的电化学氧化具有催化作用,而且能改善UA的氧化还原可逆性。
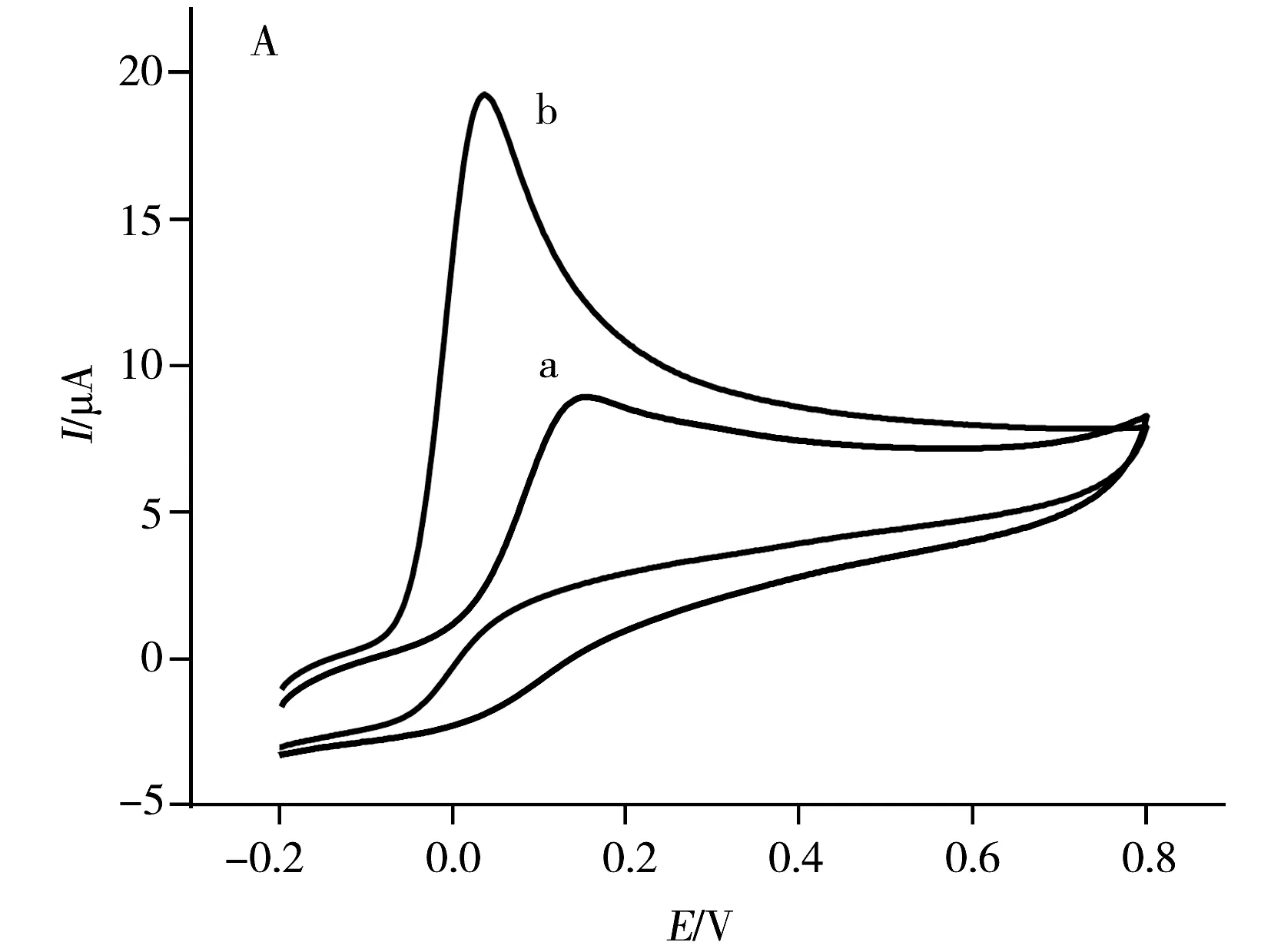
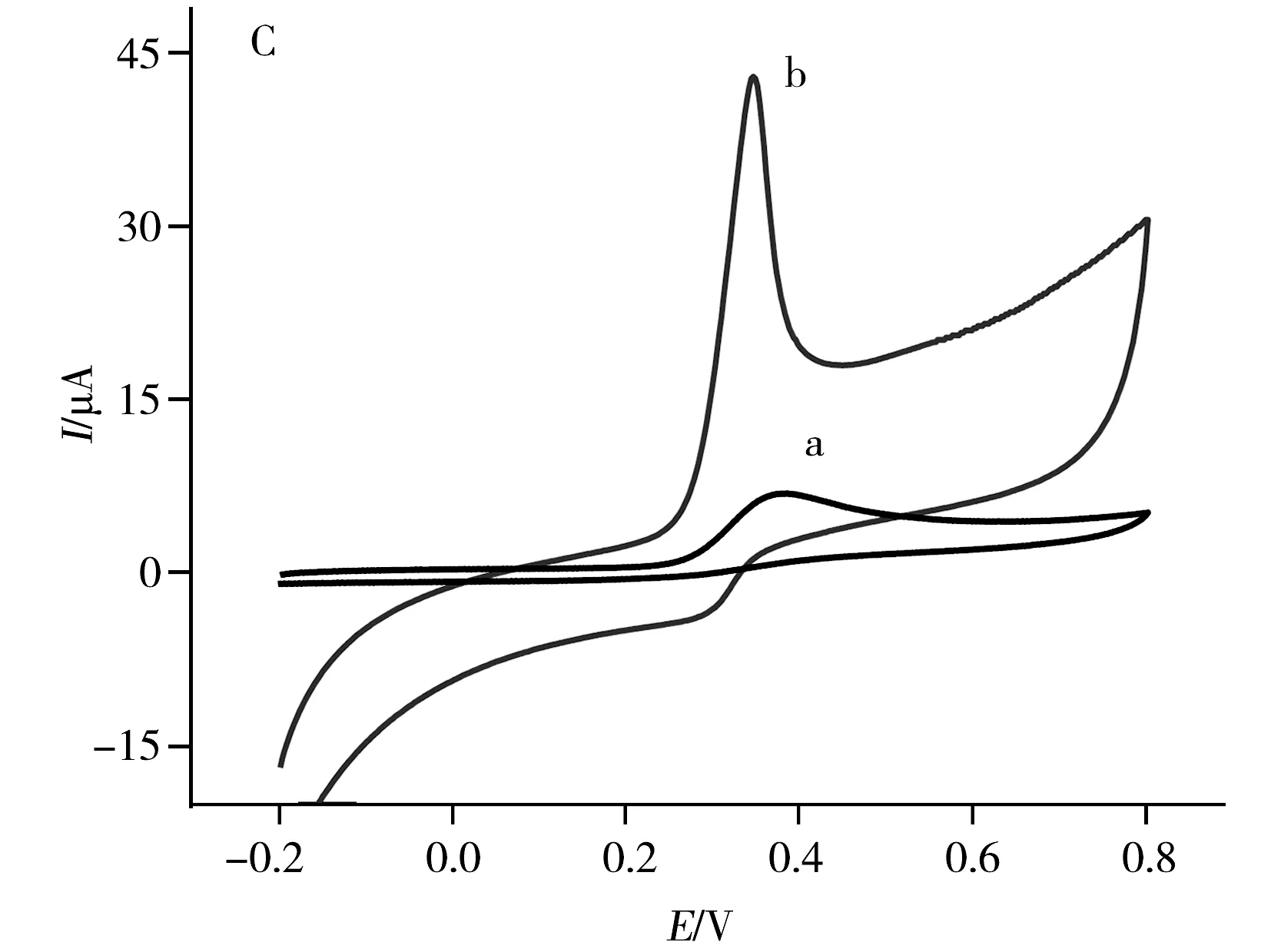
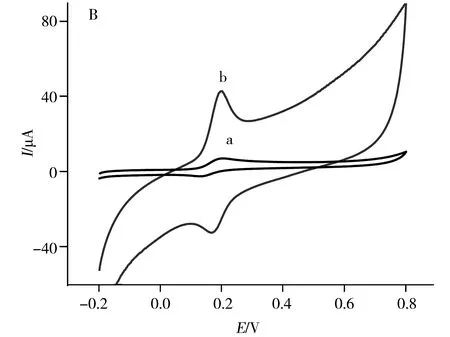
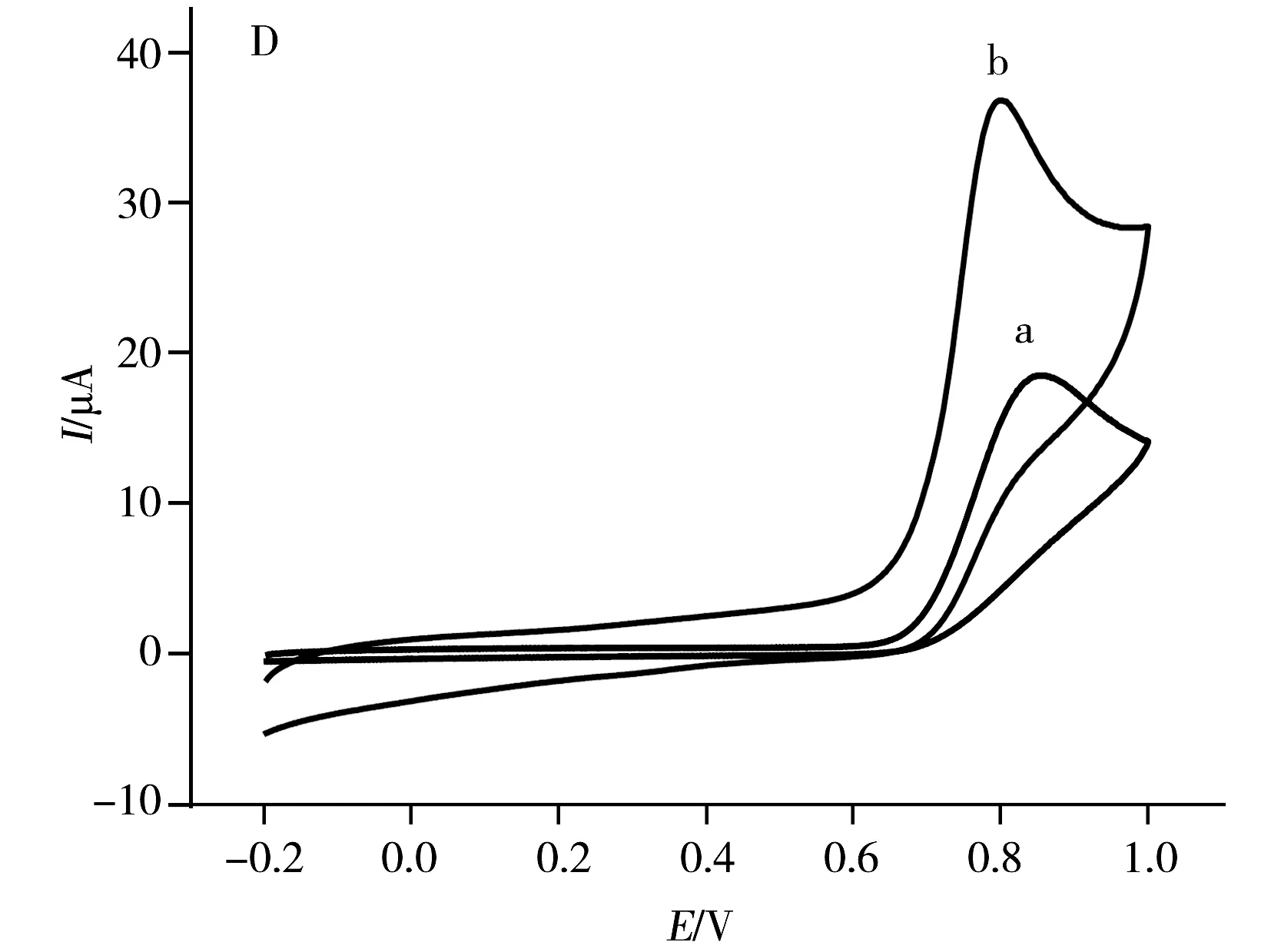
图2 1 mmol·L-1 AA(A)、0.1 mmol·L-1 DA(B)、0.6 mmol·L-1 UA(C)和在GCE(曲线a)和A-GCE(曲线b)上的CV图Fig.2 CVs of 1 mmol·L-1 AA(A),0.1 mmol·L-1 DA(B),0.6 mmol·L-1 UA(C) and 0.9 mmol·L-1 N(D) at GCE(curve a) and A-GCE(curve b) in 0.1 mol·L-1 PBS(pH 7.0)



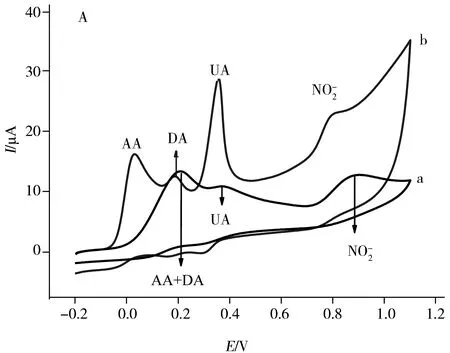
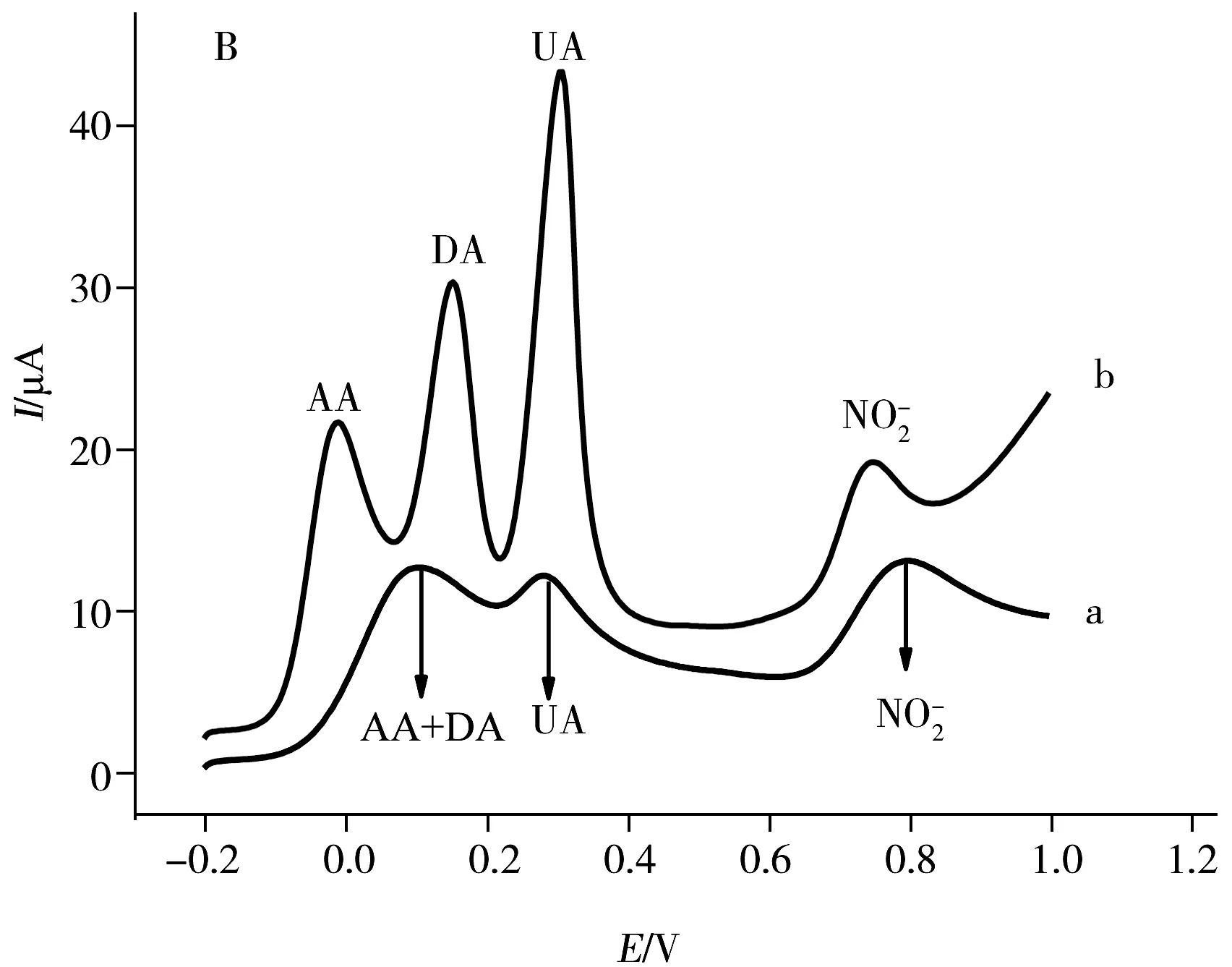
图3 AA、DA、UA和混合液在GCE(曲线a)和A-GCE(曲线b)上的CV(A)和DPV(B)图Fig.3 CVs(A) and DPVs(B) responses of GCE(curve a)and A-GCE(curve b)in 0.1 mol L-1 PBS(pH 7.0) containing 600 μmol·L-1 AA,50 μmol·L-1 DA,650 μmol·L-1 UA and 30 μmol·L-1 Nscan rate:0.05 V·s-1
2.5 溶液酸度的选择
2.6 H2SO4浓度的影响

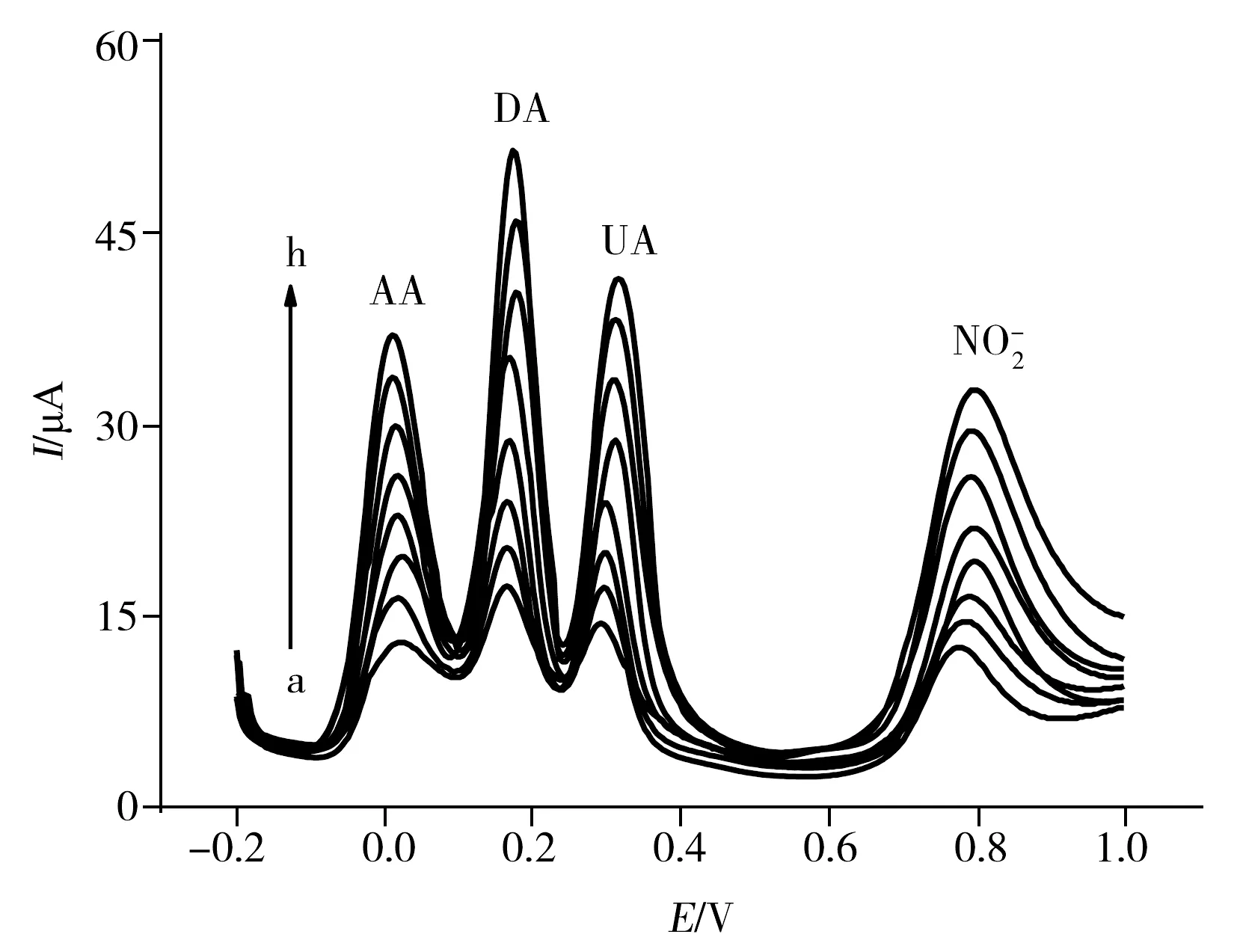
图4 在0.1 mol·L-1 pH 7.0的PBS中,不同浓度的AA、DA、UA和混合液在A-GCE上的DPV图Fig.4 DPVs of AA,DA,UA and N mixture at A-GCE in 0.1 mol·L-1 PBS(pH 7.0)cAA(a→h):5,300,600,900,1 200,1 500,1 800,2 100 μmol·L-1;cDA(a→h):2,20,40,60,80,100,120,140 μmol·L-1;cUA(a→h):1,100,200,300,400,500,600,700 μmol·L-1;cNO-2(a→h):10,150,300,450,600,750,900 and 1 050 μmol·L-1


2.9 干扰实验

2.10 电极的重现性与稳定性
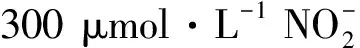
2.11 实际样品分析


表1 血清样品中AA、DA、UA和的同时测定Table 1 Simultaneous determination of AA,DA,UA and N in serum samples
*mean value(n=5);-:not detection
3 结 论

[1] Yang J,Liu Z M,Zhan H J,Wang Z L.J.Instrum.Anal.(杨君,刘志敏,展海军,王珍玲.分析测试学报),2014,33(4):403-408.
[2] Choukairi M,Bouchta D,Bounab L,Benatyah M,Elkhamlichi R,Chaouket F,Raissouni I,Rodriguez I N.J.Electroanal.Chem.,2015,758:117-124.
[3] Bikker A,Wielders J,Van Loo R,Loubert M.Int.J.Surg.,2016,2:15-18.
[4] Park S J,Lee S H,Yang H,Park C S,Lee C,Kwon O S,Park T H,Jang J.ACSAppl.Mater.Interfaces,2016,8(42):28897-28903.
[5] Guan W,Duan X,Reed M A.Biosen.Bioelectron.,2014,51:225-231.
[6] Kuralay F,Dumangöz M,Tunç S.Talanta,2015,144:1133-1138.
[7] Jiang J J,Fan W J,Du X Z.Biosen.Bioelectron.,2014,51:343-348.
[8] Chen J,Wang Y C,Cui R,Zhang B X.Chin.J.HealthLab.Technol.(陈娟,王一超,崔蓉,张宝旭.中国卫生检验杂志),2014,14:1996-1999.
[9] Li L J,Wang J.J.BinzhouUniv.(李玲君,王军.滨州学院学报),2012,6:96-100.
[10] Chen Z L,Hayashi K,Iwasaki Y,Kurita R,Niwa O,Sunaawa K.Electroanalysis,2005,17(3):231-238.
[11] Tang N L,Meng H Y,Li X,Qin W L.J.Instrum.Anal.(唐宁莉,蒙华毅,李欣,覃温露.分析测试学报),2013,32(7):867-871.
[12] Huang D Q,Cheng Y,Xu H Y,Zhang H,Sheng L Q,Xu H J,Liu Z D,Wu H,Fan S H.J.SolidStateElectrochem.,2015,19(2):435-443.
[13] Karuppiah C,Devasenathipathy R,Chen S,Arulraj D,Palanisamy S,Mani V,Vasantha V S.Electroanalysis,2015,27(2):485-493.
[14] Rahman M M,Lopa N S,Kim K,Lee J J.J.Electroanal.Chem.,2015,754:87-93.
[15] Xu Y Z,Sun X P,Zhao X,Dai Z,Zou X Y.J.Instrum.Anal.(许宇智,孙星鹏,赵欣,戴宗,邹小勇.分析测试学报),2011,30(11):1235-1240.
[16] Shahrokhian S,Salimian R,Rastgar S.Mater.Sci.Eng.C,2014,34:318-325.
[17] Tang L,Tong Y,Zheng R F,Liu W L,Gu Y,Li C,Chen R X,Zhang Z Q.Sens.ActuatorsB,2014,203:95-101.
[18] Akkapol S,Poomrat R,Kanet W,Orawon C,Monpichar S.Talanta,2016,158:134-141.
[19] Lei Y,Du D X,Tang L N,Tan C K,Chen K L,Zhang G J.Anal.Lett.,2015,48(6):894-906.
[20] Wang S M,Su W Y,Cheng S H.Int.J.Electrochem.Sci.,2010,5:1649-1664.
[21] Thiagarajan S,Tsai T H,Chen S M.Biosen.Bioelectron.,2009,24:2712-2715.
[22] Kiema G K,Fitzpatrick G,McDermott M T.Anal.Chem.,1999,71:4306-4312.
[23] Gu H Y,Yu A M,Chen H Y.Anal.Lett.,2011,34:2361-2374.
[24] Cai X H,Kalcher K,Neuhold C,Ogorevc B.Talanta,1994,41(3):407-413.
[25] Nagaoka T,Yoshino T.Anal.Chem.,1986,58(6):1037-1042.
[26] Evans J F,Kuwana T,Henne M T,Royer C P.J.Electroanal.Chem.,1977,80(2):409-416.
[27] Kamau G N,Willis W S,Rusling J F.Anal.Chem.,1985,57(2):545-551.
[28] Rice R J,Pontikos N M,McCreery R L.J.Am.Chem.Soc.,1990,112(12):4617-4622.
[29] Kepley L J,Bard A J.Anal.Chem.,1988,60:1459.
[30] Wang J,Martinez T,Yaniv D R,McCormick L.J.Electroanal.Chem.,1990,286:265-272.
[31] Qiu D F,Bao X Y,Feng Y Q,Liu K C,Wang H W,Shi H Z,Guo Y C,Huang Q Z,Zeng J L,Zhou J,Xing Z C.Electrochim.Acta,2012,6:339-346.
[32] Gooding J J,Wibowo R,Liu J Q,Yang W R,Losic D,Orbons S,Mearns F J,Shapter J G,Hibbert D B.J.Am.Chem.Soc.,2003,125(30):9006-9007.
[33] Goder C,Boujtita M,Murr N E.NewJ.Chem.,1999,23:795.
Fabrication of an Electro-activated Glassy Carbon Electrode and Its Application in Simultaneous Determination of Ascorbic Acid,Dopamine,Uric Acid and Nitrite
WANG Xin,YANG Meng-jing,ZHANG Lei*
(Department of Chemistry,College of Life and Environmental Sciences,Shanghai Normal University,Shanghai 200234,China)
electro-activated glassy carbon electrode;ascorbic acid;dopamine;uric acid;nitrite
2017-06-19;
2017-09-03
上海市教育科学研究项目(B-13034)
*
张 雷,博士,副教授,研究方向:电分析化学,E-mail:chemzl@shnu.edu.cn
10.3969/j.issn.1004-4957.2017.11.006
O657.1
A
1004-4957(2017)11-1325-08

