蜜蜂蜂毒涂膜剂对SD大鼠动静脉旁路血栓形成的影响
黄 茜 胡 园 张成桂 赵海荣 程 涛 巫秀美 李云飞
1.大理大学云南省昆虫生物医药研发重点实验室,云南 大理 671000;2.上海华汇拓医药科技有限公司,上海 浦东 201203;3.大理大学药用特种昆虫开发国家地方联合工程研究中心,云南 大理 671000
蜜蜂蜂毒涂膜剂对SD大鼠动静脉旁路血栓形成的影响
黄 茜1,3胡 园1,3张成桂1,3赵海荣1,2,3程 涛2巫秀美1,3*李云飞2*
1.大理大学云南省昆虫生物医药研发重点实验室,云南 大理 671000;2.上海华汇拓医药科技有限公司,上海 浦东 201203;3.大理大学药用特种昆虫开发国家地方联合工程研究中心,云南 大理 671000
目的:初步评价蜜蜂蜂毒涂膜剂对SD大鼠动静脉旁路血栓模型的有效性。方法:雄性SD大鼠,随机分为空白涂膜剂组、氯吡格雷组(8.0mg/kg)、蜜蜂蜂毒涂膜剂组(2.0、4.0、8.0mg/kg),通过大鼠动静脉旁路血栓形成模型,测定血栓干湿重量、血浆凝血四项和凝血因子II、V、X活性、血小板聚集性等指标来评价蜜蜂蜂毒涂膜剂的抗血栓作用。结果:与空白涂膜剂组比较,蜜蜂蜂毒涂膜剂各组均能减轻大鼠动静脉旁路血栓形成后血栓的干、湿重,中剂量组较好,抑制率分别为21.15%(湿重)和20.49%(干重)。蜜蜂蜂毒涂膜剂各剂量组凝血酶原时间和凝血酶时间未见明显变化,活化部分凝血活酶时间有延长的趋势;纤维蛋白原含量呈升高的趋势,均无统计学差异。蜜蜂蜂毒涂膜剂高剂量组有降低凝血因子II和X活性的趋势;各组凝血因子V活性呈现升高的趋势。结论:蜜蜂蜂毒涂膜剂具有一定抑制SD大鼠动静脉旁路血栓形成的倾向,且呈一定的剂量依赖性。其对于凝血系统和血小板聚集的影响不明显,其抑制血栓形成的作用机制仍待进一步的研究。
蜜蜂蜂毒;涂膜剂;血栓;SD大鼠
血栓形成是指在一定条件下,血液有形成分在血管内形成栓子,造成血管部分或全部堵塞、相应部位血液供应障碍而形成的一系列综合病征,是多种心脑血管疾病共同的病理过程[1]。目前,防治血栓性疾病的方法主要是降低血液粘度,然而使用此类药物会导致消化系统溃疡,造成诸如消化道出血、无症状性溃疡病等疾病的发生[2]。相对西药来说,中药尤其是中药复方具有多靶点作用和整体调节的特点[3],因此运用中药来治疗血栓性疾病相对具有一定的优势。蜜蜂蜂毒为蜜蜂科动物中华蜜蜂Apis cerana Fabricius.等的工蜂尾部螫刺腺体中排出的毒液[4],具有祛风除湿,止痛的功效[5]。文献报道,其在较大剂量时,在体内外都能使血液凝固时间明显延长[3],具有改善微循环和溶栓的作用。但对其是否有抗血栓形成作用尚未深入探索。研究通过复制大鼠动静脉旁路血栓形成模型,探讨蜜蜂蜂毒涂膜剂的抗血栓作用,及其对血小板聚集和凝血系统的影响。
1 仪器与材料
1.1 动物 SPF级成年健康雄性SD大鼠,体重260~300 g,购于湖南莱斯克景达实验动物有限公司,动物合格证号:SCXK(湘)K2013-0004。实验动物购置后在大理大学实验动物中心实验室适应性饲养1~2周后用于正式实验。实验条件:清洁级,动物房室温18~25℃,湿度40%~70%,光照12h明暗交替,自由进食、饮水。所有实验研究符合中国伦理委员会有关动物研究指导原则。
1.2 药物与试剂 硫酸氢氯吡格雷(批号:2A62,赛诺菲(杭州)制药有限公司);二磷酸腺苷(Adenosine diphospate,ADP,批号:7-16-5366,Helena Laboratories);蜜蜂蜂毒涂膜剂(批号:20160628,国家地方联合工程研究中心);水合氯醛(批号:20120827,天津市光复精细化工研究所);硫酸阿托品注射液(批号:03141205,上海禾丰制药有限公司);枸橼酸钠(批号:20080828,天津市大茂化学试剂厂);氨苄西林(批号:104D036,Solarbio);氯化钠(批号:C150120L,昆明南疆制药有限公司);肝素钠(批号:425C023,Solarbio)。
1.3 仪器 METTLERAE240型精密电子分析天平(梅特勒-托利多仪器(上海)有限公司);TC-30K型电子天平(江苏常熟仪器厂);ES-1450型高压灭菌锅(日本TOMY KOGYO公司);TL-16R型台式高速冷冻离心机(上海市离心机械所);VOR72-X-5型涡旋器(海门市其林贝尔);CA-620型凝血分析仪(希森美康医用电子(上海)有限公司);AggRAM型血小板聚集仪( Helena Laboratories);肝素钠采血管(山东省成武县华博医疗器械有限公司);聚乙烯软管(内径0.7 mm,外径1.2 mm以及内径1.1 mm,外径2.0 mm)。
2 方法
2.1 实验分组及给药 检疫合格的SD大鼠,取血测定凝血4项,剔除异常者,剩余大鼠按体重筛选50只随机分为5组,每组10只:空白涂膜剂组、阳性药氯吡格雷组8 mg/kg、蜜蜂蜂毒涂膜剂2.0、4.0和8.0 mg/kg组。动物给药前1天局部(眶静脉上方至顶骨)脱毛,给药时将蜜蜂蜂毒涂膜剂涡旋后均匀涂敷于该区域,待水分挥发后形成薄膜,保持10 min左右后放回笼盒。重复给药前应用蘸生理盐水的棉签轻轻擦去残留的薄膜。
给药频率:基质模型组涂抹空白基质60 μL,蜜蜂蜂毒涂膜剂组按相应给药剂量每只大鼠涂抹药物60 μL,氯吡格雷组(8.0mg/kg)灌胃给药。连续预防给药5d,末次给药后2 h,复制大鼠动静脉旁路血栓模型,进行各项指标的检测。
2.2 造模方法 参考文献[6-9],大鼠以10%水合氯醛溶液腹腔麻醉,肌肉注射阿托品1 mL/kg.BW用于抑制呼吸道分泌物。完全麻醉后颈部剃毛,并用75%酒精消毒,分离右颈总动脉和左颈外静脉并分别用微动脉夹夹闭。用三段聚乙烯管组成套管,两端聚乙烯管(内径:1 mm)均长10 cm,中间一段(内径:2 mm)长8 cm,中间聚乙烯管中提前放入5 cm长的4号手术线(已称重)。将套管一端插入左颈外静脉并固定,另一端插入右颈总动脉并固定,打开动脉夹,开放血流15 min后中断。
2.3 指标检测
2.3.1 血栓干湿重及抑制率 血流开放15 min后中断,取出丝线,迅速用滤纸吸滤称重,总重量减去丝线干重即为血栓湿重;血栓置于60℃烘箱中24 h,烘干称重,总重量减去丝线干重即为血栓干重。计算出血栓抑制率。
血栓抑制率=[(对照组平均血栓湿重-给药组平均血栓湿重)/对照组平均血栓湿重]×100%
2.3.2 凝血功能检测 各组大鼠取完血栓后,腹主动脉取血2 mL,用3.2%枸橼酸钠溶液1∶9抗凝后,3000 rpm离心10 min分离血浆,用自动凝血仪检测活化部分凝血活酶时间(Activated partial thromboplastin time,APTT),凝血酶原时间(Prothrombin time,PT)、凝血酶时间(Thrombin time,TT)和纤维蛋白原(Fibrinogen,FIB)。
2.3.3 凝血因子II、V、X活性 各组大鼠取完血栓后,腹主动脉取血1 mL,用3.2%枸橼酸钠溶液1∶9抗凝后,3000 rpm离心10 min分离血浆,用自动凝血仪检测凝血因子II(Prothrombin,凝血酶原),V(labile/proaccelerin,易变因子),X (stuart power 因子)。
2.3.4 血小板聚集率的测定 采用比浊法,腹主动脉快速采血3 mL,参考实验方法[7]将血液加入含有3.2%枸橼酸钠的离心管中,使3.2%枸橼酸钠和血液的容积之比为1∶9,混匀后25℃下以1000 rpm离心10 min,取上层血浆即为富血小板血浆(Platelet rich plasma,PRP)。剩余的血浆,25℃下以4500 rpm离心15 min,取上层血浆即为贫血小板血浆(Platelet poor plasma,PPP)。取PPP 250μL和PRP 225μL于比浊杯中,37℃预热孔中温育5 min,测定时先将PPP杯插到测试孔中调零,取出PPP杯后插入PRP杯,加入磁力搅拌子后,以600 rpm的速度进行搅拌,加入25μL的诱导剂ADP(终浓度0.02 mol/L),测定5 min内的血小板最大聚集率。
2.4 统计分析 数据采用SPSS 21.0统计软件进行数据分析,以均数加减标准差表示,数据符合正态性且方差齐的,采用参数检验中的单因素方差分析(one-way ANOVA)比较,组间两两比较采用LSD(最小显著差检验),数据不符合正态性或方差不齐的采用非参数检验中的Mann-Whitney检验分析比较,以Plt;0.05表示差异有统计学意义。
3 结果
3.1 对大鼠动静脉旁路血栓形成后血栓干湿重的影响 空白涂膜剂组的血栓湿重为(15.1±5.2)mg,与空白涂膜剂组比较,氯吡格雷组血栓湿重明显降低,差异具有统计学意义(Plt;0.05),血栓形成抑制率为57.92%。蜜蜂蜂毒涂膜剂2.0、4.0、8.0 mg/kg剂量组均具有降低的趋势,抑制率分别为3.50%、21.15%、14.98%。
空白涂膜剂组的血栓干重为(3.14±1.22)mg,与其比较,氯吡格雷组血栓干重明显降低(Plt;0.05),血栓形成抑制率为57.39%。蜜蜂蜂毒涂膜剂2.0、4.0、8.0 mg/kg剂量组均具有降低的趋势,抑制率分别为1.73%、20.49%、11.27%,4 mg/kg剂量组的效果比较明显。见表1。
3.2 对大鼠动静脉旁路血栓形成后血浆凝血四项的影响 与空白涂膜剂组比较,蜜蜂蜂毒涂膜剂各剂量组(2.0、4.0、8.0 mg/kg)PT和TT未见明显变化;APTT有延长的趋势;FIB含量呈升高的趋势,均无统计学差异(Pgt;0.05)。见表2。
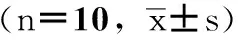
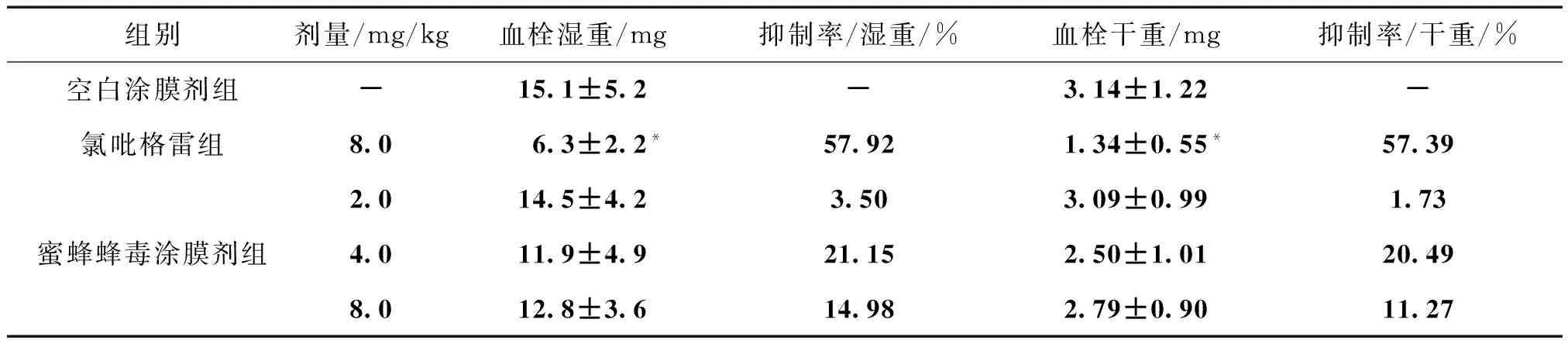
组别剂量/mg/kg血栓湿重/mg抑制率/湿重/%血栓干重/mg抑制率/干重/%空白涂膜剂组-15.1±5.2-3.14±1.22-氯吡格雷组8.06.3±2.2*57.921.34±0.55*57.39蜜蜂蜂毒涂膜剂组2.014.5±4.23.503.09±0.991.734.011.9±4.921.152.50±1.0120.498.012.8±3.614.982.79±0.9011.27
注:与空白涂膜剂组比较,*Plt;0.05。
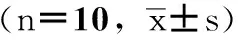

组别剂量/mg/kgPT/sAPTT/sTT/sFIB/g/L空白涂膜剂组-13.71±0.5819.98±4.2847.26±11.331.99±0.11氯吡格雷组8.013.28±0.3919.34±0.8745.77±5.16 2.02±0.14蜜蜂蜂毒涂膜剂组2.013.19±0.3423.25±5.4044.37±10.422.03±0.224.013.42±0.5620.45±1.7341.80±12.032.15±0.188.013.34±0.4720.42±2.0047.16±6.551.91±0.17
3.3 对大鼠动静脉旁路血栓形成后血浆凝血因子II、V和X活性的影响 蜜蜂蜂毒涂膜剂各剂量组中凝血因子II、V、X活性与空白涂膜剂组比较,差异均无统计学意义(Pgt;0.05)。与空白基质组比较,氯吡格雷组和蜜蜂蜂毒涂膜剂(8.0 mg/kg)组有降低凝血因子II活性的趋势;蜜蜂蜂毒涂膜剂各组凝血因子V活性呈现升高的趋势;氯吡格雷组和蜜蜂蜂毒涂膜剂(2.0和4.0 mg/kg)组凝血因子X均呈现升高趋势。见表3。
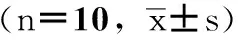

组别剂量/mg/kgII/%V/%X/%空白涂膜剂组-46.00±10.10257.54±68.2922.43±3.26氯吡格雷组8.042.64±3.78 223.55±80.2623.41±2.03蜜蜂蜂毒涂膜剂组2.055.65±26.06 298.97±154.0026.31±4.094.049.83±4.69 265.74±107.5824.80±2.978.042.42±5.42 263.06±58.9121.77±2.85
3.4 对动静脉旁路血栓形成后ADP诱导血小板聚集的影响 与空白涂膜剂组比较,氯吡格雷组血小板聚集率明显降低(Plt;0.05);蜜蜂蜂毒涂膜剂2.0、4.0、8.0 mg/kg剂量组均有降低血小板聚集率的趋势,但无统计学差异(Pgt;0.05)。见表4。
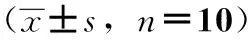
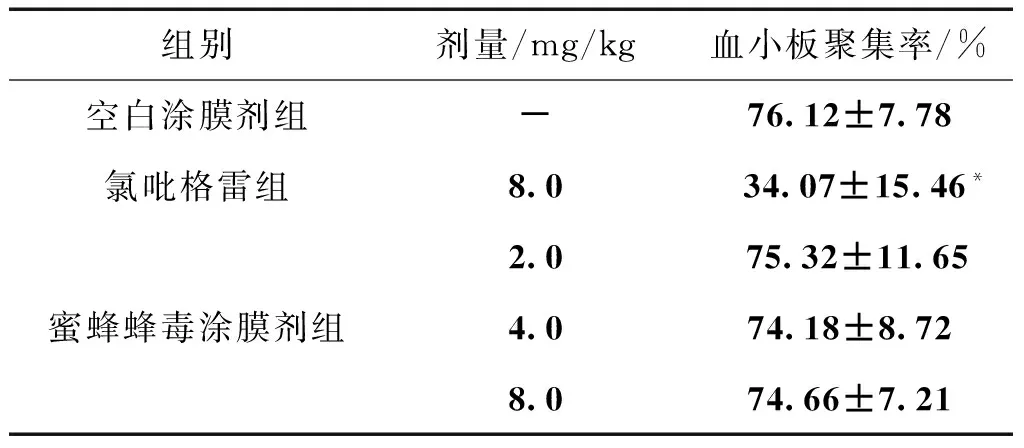
组别剂量/mg/kg血小板聚集率/%空白涂膜剂组-76.12±7.78氯吡格雷组8.0 34.07±15.46*蜜蜂蜂毒涂膜剂组2.0 75.32±11.654.074.18±8.728.074.66±7.21
注:与空白涂膜剂组比较,*Plt;0.05。
4 讨论
4.1 选择蜜蜂蜂毒经皮给药的原因 实验采用经皮给药的依据来自于蜜蜂蜂毒药物口服生物利用度低,静脉注射容易产生溶血反应和过敏性休克[10],而经皮给药能有效避免这些缺点,避免口服给药可能有毒副反应、不容易产生耐药性、使用便利等优点。近年来,虫药治疗血栓性疾病的报道越来越多,其成为攻克疑难杂症的新靶点[11]。蜜蜂蜂毒民间用于治疗中风偏瘫患者[12],大量文献表明其有抗凝作用[13-16],其机制可能与蜜蜂蜂毒成分的抗凝及其蜂毒明肽透过血脑屏障有关,但还未证实。
4.2 对动静脉旁路丝线上血栓形成的抑制作用 血栓形成有3个因素[17]:a血管内皮损伤;b血小板粘附,聚集和释放反应;c凝血活性增高。而血小板聚集是血栓形成过程中至关重要的一步,抑制剂可以通过阻断血小板活化或抑制与其它配体结合而影响血小板聚集。在大鼠动静脉旁路血栓模型中,血栓主要是由于血小板粘附到丝线上,产生聚集,形成的是血小板血栓,主要用于验证氯吡格雷的药效。血栓形成抑制率=(对照组血栓湿重-给药组血栓湿重)/对照组血栓湿重×100%,其中对照组为实验中的空白基质模型组。实验大鼠的血栓湿重越大,对应的血栓形成抑制率就越低,即表明相应组别的药物对动静脉旁路血栓形成的抑制作用越小。相反,血栓湿重越小,对应的血栓形成抑制率就越高,即表明相应组别的药物对动静脉旁路血栓形成的抑制作用越大。实验结果表明,Ento-Ⅰ涂膜剂各组均有减轻大鼠动静脉旁路血栓形成后血栓的干湿重,且中剂量组抑制效果较好。从实验结果可以看出,阳性药及蜜蜂蜂毒涂膜剂各组均能减轻大鼠动静脉旁路血栓形成后血栓的干、湿重,且中剂量组抑制效果较好。
4.3 蜜蜂蜂毒的抗栓机制探索 实验选用APTT、TT、PT、FIB这4个综合反应凝血功能的指标[18]及凝血因子II、V、X考察蜜蜂蜂毒对大鼠动静脉旁路血栓形成后凝血功能影响。实验结果表明,阳性药及蜜蜂蜂毒涂膜剂对模型大鼠APTT、TT、PT、FIB及凝血因子II、V、X等均无显著影响。原因是目前发现的血小板激活途径有二磷酸腺苷(Adenosine Diphosphate,ADP)、花生四烯酸(Arachidonic Acid,AA)及血小板活化因子(Platelet Activating Factor,PAF)[19]。而氯吡格雷预防血栓形成的机制为ADP途径,实验结果显示其有显著的抗血栓形成作用,但蜜蜂蜂毒涂膜剂对ADP诱导的血小板聚集不明显,可能蜜蜂蜂毒不能抑制ADP诱导的血栓形成,与传统中药的抗血栓形成机制不一样,动物药物主要针对的靶点是增强纤溶活性和抗凝血,故其可APTT,升高FIB含量,并对凝血因子II、V、X活性有一定的影响。凝血因子II、V、X
在本实验条件下,阳性药硫酸氯吡格雷在8 mg/kg的剂量下,能明显地抑制SD大鼠动静脉旁路血栓的形成以及ADP诱导的血小板聚集。蜜蜂蜂毒涂膜剂在2~8 mg/kg的剂量范围内,具有一定抑制SD大鼠动静脉旁路血栓形成的倾向,并呈一定剂量依赖性,但对凝血系统、凝血因子活性、血小板聚集等的影响不明显,其抑制血栓形成的作用机制仍待进一步的研究。
综上,研究表明蜜蜂蜂有一定的抗血栓形成作用,但作用机理可能主要是针对凝血因子,还需要根据凝血瀑布进一步研究其究竟参与抗凝血系统的哪一个环节,故接下来的工作是选取其他抗栓模型进一步研究蜜蜂蜂毒的抗血栓形成作用及机理,同时展开对其他毒素治疗血栓性疾病的研究,以期发掘昆虫的药用潜能和价值[20]。
致谢 感谢药用昆虫及蛛形类资源开发利用工程实验室药理药效学研究平台提供条件完成此实验。
[1]Badimon L, Vilahur G. Coronary Atherothrombotic Disease Progress in Antiplatelet Therapy[J]. Rev Esp Cardiol, 2008, 61(5):501-513.
[2]李芳君,谢少玲. 醒脑静注射液对大鼠脑缺血-再灌注损伤的保护作用[J]. 中药材,2011,34(7):1111-1113.
[3]吴水生, 施红, 张小如. 中药复方药效学研究中应重视多靶点作用的现实意义[J]. 中国中西医结合杂志, 2001, 21(7):545-546.
[4]Moreno M, Giralt E. Three Valuable Peptides from Bee and Wasp Venoms for Therapeutic and Biotechnological Use: Melittin, Apamin and Mastoparan[J]. Toxins, 2015, 7(4):1126.
[5]钱锐. 蜜蜂毒的成分、药理及医用[J]. 蜜蜂杂志, 1998(5):7-9.
[6]林江,周瑾,邓学鹏,等. 结缔组织生长因子肽对大鼠动静脉旁路血栓形成的影响[J]. 现代医学,2012,40(5):511-513.
[7]胡路云,包芷君,刘涵,等. 丹红化瘀口服液抗血栓形成作用[J]. 中国实验方剂学杂志,2015,21(10):104-108.
[8]陈奇. 中药药理实验方法学[M].北京:人民卫生出版社出版,1993:619-623.
[9]王辉,刘刚,罗顺德. 莲心碱对血小板聚集_凝血功能和血栓形成的影响[J]. 中国药理学通报,2010,26(6):768-772.
[10]刘新生. 蜂毒注射液的不良反应分析[J]. 世界最新医学信息文摘:连续型电子期刊,2014(29):86-286.
[11]杨土坚. 蜂针疗法治疗脑梗塞后遗症病例分析[J]. 中国蜂业,2014,34(3):39.
[12]吴围屏,刘自元,孟令玗,等. 蜂毒抗凝血作用的探讨[C].山东省药学会2006年生化与生物技术药物学术研讨会论文集,2006.
[13]冯锐,王音,朱凤,等. 蜜蜂蜂毒涂膜剂的镇痛及其抗凝抗血栓形成作用[J]. 国际药学研究杂志,2016,43(3):509-513.
[14]王音,张艳,李成功,等. 蜜蜂蜂毒涂膜剂经皮给药对小鼠耐缺氧和抗心肌缺血作用初探[J]. 国际药学研究杂志,2017,43(3):251-256.
[15]金凡茂,张枝雪,王音,等. Ento-Ⅰ涂膜剂对大鼠脑缺血再灌注损伤的保护作用[J]. 国际药学研究杂志,2016,43(3):504-508.
[16]朱凤,胡园,刘衡,等. Ento-Ia涂膜剂经皮给药对小鼠急性不完全性脑缺血的保护作用[J]. 中国民族民间医药,2017,26(2):47-51.
[17]刘丽娜,兰燕宇,郑林,等. 灯盏细辛、赤芍配伍对血栓形成和凝血时间的交互作用[J]. 中国实验方剂学杂志,2012,18(21):157-160.
[18]王建富, 张金平, 吴茅, 等. 3种抗病毒药对家兔凝血功能影响的初步研究[J]. 海峡药学,2005,17(5):36-38.
[19]Saeed SA, Rasheed H. Calcium-dependent synergistic interaction of platelet activating factor and epinephrine in human platelet aggregation[J]. Acta Pharmacol Sin. 2003, 24(1):31-36.
[20]Zhao HR, Chen JY, Jin FM, et al. Animal drugs in treatment of cerebral ischemia and their mechanisms[J]. International Journal of Pharma Sciences and Research (IJPSR) 2015,6(1):15-22.
Effect of Bee Venom Plastic on The thrombosis of Arteriovenous Bypass in SD Rats
HUANG Xi1,3HU Yuan1,3ZHANG Chenggui1,3ZHAO Hairong1,3CHENG Tao2WU Xiumei1,3*LI Yunfei2*
1.Yunnan Provincial Key Laborator of Entomological Biopharmaceutical Ramp;D,Dali University,Dali 671000,China;2. Shanghai Synergy Pharmaceutical Sciences Co.,LTD, Shanghai 201203,China;3.National-Local Joint Engineering Research Center for Entomoceutics,Dali 671000,China
Objective To evaluate the effectiveness of bee venom plastic on arteriovenous shunt thrombosis model in SD rats. Methods SD rats were randomly divided into matrix model group, clopidogrel group (8.0mg/kg), bee venom plastic groups (2.0, 4.0, 8.0mg/kg). To evaluate the antithrombotic effect of Bee venom plastic by measurement of the thrombus wet weight, the activity of four indexes of blood coagulation and blood coagulation factor II, V, X through the establishment of arteriovenous shunt thrombosis model in rat. Results compared with matrix model group, Bee venom plastic groups reduced the dry and wet weight of thrombus after vein bypass thrombus, and the middle dose group was better, the inhibition rates were 21.15% (wet weight) and 20.49% (dry weight). There were no obvious changes in prothrombin time(PT)and Thrombin time(TT) in each dose group of Bee venom plastic, and activated partial thromboplastin time (APTT) had an extended trend, the content of fibrinogen (FIB)showed an upward trend, and there was no statistical difference between them.The high dose group of Bee venom plastic had the trend of decreasing the activity of coagulation factors II and X, and the activity of coagulation factor V showed an upward trend in each group. Conclusion the Bee venom plastic has the tendency of inhibiting the thrombosis of arteriovenous shunt in SD rat with the dose range of 2~8mg/kg, and it has a dose-dependent manner. The influence on blood coagulation and platelet aggregation are not obvious, further study on the antithrombotic mechanism need to be conducted.
Bee Yenom;Plastic;Thrombosis;SD Rats
R285.5
A
1007-8517(2017)20-0045-05
国家自然科学基金(81360679);云南省应用基础研究重点项目(P0120160023)。
黄茜(1993-),女,汉族,硕士研究生在读,研究方向为药剂学。E-mail:18760951099@163.com
巫秀美(1968-),女,汉族,博士研究生,讲师,研究方面为流行病学与统计分析。E-mail:wxm6865@163.com;李云飞(1977-),男,汉族,博士研究生,副研究员,研究方向为天然药物开发与研究。E-mail:liyunfei@huahaipharm.com
2017-09-06 编辑:梁志庆)

