椰子壳挥发油对心肌损伤大鼠生物化学标志物的影响及分析※
高秀娟 张广增 姚荣妹 高 筠 包巨太
(华北理工大学中医学院实验中心,河北 唐山 063210)
椰子壳挥发油对心肌损伤大鼠生物化学标志物的影响及分析※
高秀娟 张广增1姚荣妹△高 筠 包巨太2
(华北理工大学中医学院实验中心,河北 唐山 063210)
目的观察椰子壳挥发油对急性心肌损伤大鼠生物化学标志物的影响。方法将肢体Ⅱ导联心电图正常的40只雄性Wistar大鼠,随机分为4组,即正常组、模型组、椰子壳挥发油组、复方丹参滴丸组,每组10只,连续给药7 d,在实验的第6、7 d,除正常组外,各组大鼠颈部皮下注射盐酸异丙肾上腺素,建立急性心肌损伤模型。实验第8 d检测各组大鼠血清和心肌组织中以下心肌损伤标志物的含量:天冬氨酸氨基转移酶(AST)、α-羟丁酸脱氢酶(α-HBDH)、血清肌酸激酶(CK)、肌酸激酶MB同工酶(CK-MB)、乳酸脱氢酶(LDH)、乳酸脱氢酶同工酶1(LDH1)、心肌肌钙蛋白T(cTnT)、心肌肌钙蛋白I(cTnI)、肌红蛋白(Mb)。结果与正常组比较,模型组大鼠血清中AST、CK、CK-MB、LDH、LDH1、α-HBDH、cTnT、cTnI、Mb升高(Plt;0.01),复方丹参滴丸组大鼠血清中CK-MB、LDH、LDH1、α-HBDH、cTnI升高(Plt;0.01,Plt;0.05),椰子壳挥发油组大鼠血清中AST、CK-MB、LDH、LDH1、α-HBDH、cTnI升高(Plt;0.01,Plt;0.05)。与模型组比较,复方丹参滴丸组大鼠血清中AST、CK、CK-MB、LDH、LDH1、α-HBDH、cTnT、cTnI、Mb降低(Plt;0.01),椰子壳挥发油组大鼠血清中CK、CK-MB、LDH、LDH1、α-HBDH、cTnT、cTnI、Mb降低(Plt;0.01)。与复方丹参滴丸组比较,椰子壳挥发油组大鼠血清中AST、LDH升高(Plt;0.01)。与正常组比较,模型组心肌组织中AST、CK、CK-MB、LDH、α-HBDH、cTnT、cTnI、Mb升高(Plt;0.01),复方丹参滴丸组心肌组织中AST、CK-MB、α-HBDH升高(Plt;0.01),椰子壳挥发油组心肌组织中AST、CK、CK-MB、α-HBDH升高(Plt;0.01,Plt;0.05)。与模型组比较,复方丹参滴丸组、椰子壳挥发油组心肌组织中AST、CK、CK-MB、LDH、α-HBDH、cTnT、cTnI、Mb均降低(Plt;0.01)。与复方丹参滴丸组比较,椰子壳挥发油组心肌组织中Mb降低(Plt;0.01)。结论椰子壳挥发油可以降低心肌损伤时多种酶类、蛋白质类标志物的释放,在一定程度上抑制心肌损伤的发生。
椰子;心肌疾病;Wistar大鼠;生物学标记;中药药理学
椰子为棕榈科椰子属,在我国种植广泛,现主要集中分布于海南各地、台湾南部、广东雷州半岛和云南西双版纳,是一种药食同源的植物。椰子壳含有挥发油,具有很高的药用价值,可用来治疗治疗筋骨疼痛、咳喘、皮肤病、心脏病等多种疾病[1]。我们在前期临床实践中发现,从椰子壳中提取的挥发油具有较好的改善心肌损伤的作用,但其作用机制尚不明确,因此我们从能够特异和敏感地反映心肌损伤的生物化学标志物入手,初步探讨其抗心肌损伤的作用机制,为椰子壳挥发油进一步临床应用和中药新药开发提供实验室依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性Wistar大鼠40只,体质量180~220 g,购自北京华阜康生物科技股份有限公司,许可证号:SLXK(京)2009-0004,饲养于华北理工大学屏障环境动物实验室。
1.1.2 药品 椰子,购买于河北省唐山市果品批发市场,经华北理工大学药学院吕立勋副教授鉴定为棕榈科植物椰子的果实,椰子壳挥发油由华北理工大学药学院制备(制备方法:水蒸气蒸馏法。将椰子壳阴干,粉碎,称取粗粉,加8倍量蒸馏水,水蒸汽蒸馏5 h,蒸馏结束后将烧瓶及导管装置自然冷却至室温,收集挥发油,无水硫酸钠除水,4 ℃避光保存。采用挥发油测定法进行检测,得油率约为0.45%。盐酸异丙肾上腺素注射液(上海禾丰制药有限公司,国药准字H31021344);复方丹参滴丸(天士力制药股份有限公司,国药准字Z10950111)。
1.1.3 试剂 天冬氨酸氨基转移酶(AST)试剂盒(中生北控生物科技股份有限公司,生产批号110861);α-羟丁酸脱氢酶(α-HBDH)试剂盒(中生北控生物科技股份有限公司,生产批号110241);血清肌酸激酶(CK)试剂盒(南京建成生物工程研究所,生产批号20110503);肌酸激酶MB同工酶(CK-MB)试剂盒(南京建成生物工程研究所,生产批号20110402);乳酸脱氢酶(LDH)试剂盒(南京建成生物工程研究所,生产批号20110609);乳酸脱氢酶同工酶1(LDH1)试剂盒(南京建成生物工程研究所,生产批号20110502);心肌肌钙蛋白T(cTnT)试剂盒(上海百沃科贸有限公司,生产批号BV-E12121503);心肌肌钙蛋白I(cTnI)试剂盒(上海百沃科贸有限公司,生产批号BV-E12121501);肌红蛋白(Mb)试剂盒(上海百沃科贸有限公司,生产批号BV-E12121502)。
1.1.4 仪器 电子调温电热套(天津市泰斯特仪器有限公司,型号:98-1-B);旋转蒸发仪(上海亚荣生化仪器厂,型号:RE-5205);台式低温离心机(德国赛默飞世尔科技有限公司,型号:ST40);电热鼓风干燥箱(上海博迅实业有限公司医疗设备厂,型号:GZX-9070 MBE);多导生理记录仪(美国BIOPAC公司,型号:MP150);数显恒温水浴锅(国华电器有限公司,型号:HH-6);自动酶联免疫测定仪(美国Bio-Rad公司,型号:Bio-Rad3550);全自动生化分析仪(意大利AMS公司,SABA18型);雾化器(德国百瑞公司,型号:085G1005);电子天平(上海第二天平仪器厂,MP200A型)。
1.2 方法
1.2.1 分组及给药 Wistar大鼠先适应性喂养7 d,用生理记录仪测大鼠Ⅱ导联心电图,ST段接近等电位线,T波无低平者即可入选。选出40只,随机分为4组,每组10只。正常组及模型组予0.9%氯化钠注射液灌胃;椰子壳挥发油组予椰子壳挥发油雾化给药,生药给药量为5 g/(kg·d);复方丹参滴丸组予80 mg/(kg·d)灌胃。各组均每日给药1次,连续7 d,容积均为20 mL/kg。
1.2.2 急性心肌损伤模型的建立 从实验第6 d开始,正常组颈部皮下注射0.9%氯化钠注射液,0.15 mL/只,其它各组大鼠颈部皮下注射盐酸异丙肾上腺素注射液20 mg/(kg·d),连续2 d,建立急性心肌损伤模型[2-3]。
1.2.3 取材 ①血清:给药结束后,大鼠禁食水24 h,于实验的第8 d全部大鼠以10%水合氯醛350 mg/kg麻醉后腹主动脉取血,于4 ℃,1 000 r/min,离心10 min,分离出血清,-20 ℃冷冻保存备用。②心脏:采血后迅速开胸取出心脏,除去大血管和结缔组织,用滤纸吸干表面血液,迅速剪成10小块并称质量、标记,放入-20 ℃冰箱保存备用。③心肌匀浆制备:称取心肌组织200 mg,在4 ℃预冷的0.9%氯化钠注射液中漂洗3次,滤纸吸干,用眼科剪迅速剪碎组织块,按质量体积比1∶9加入0.86%冷氯化钠注射液1.8 mL,充分研磨,制备成10%心肌组织匀浆,按3 500 r/min,离心10 min,取上清液迅速冷冻保存待测,全程在冰上进行。
1.3 观察指标 分别检测血清和心肌组织中下列心肌损伤标志物的含量:AST(比色法)、α-HBDH(比色法)、CK(微板法)、CK-MB(比色法)、LDH(微板法)、LDH1(抑制法)、cTnT(血清:胶乳增强免疫比浊法;组织:放射免疫法)、cTnI(血清:胶乳增强免疫比浊法;组织:放射免疫法)、Mb(血清:胶乳增强免疫比浊法;组织:分光光度法),严格按试剂盒说明书操作。

2 结 果
2.1 各组大鼠血清中各心肌损伤生物化学标志物比较 见表1、2。
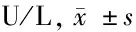

组 别nASTCKCK-MBLDHLDH1正常组101562.1±117.6262.6±44.2362.3±97.6163.4±34.4993.9±89.5模型组101931.2±246.9∗∗636.5±99.4∗∗631.2±83.3∗∗356.9±28.0∗∗1732.9±127.5∗∗复方丹参滴丸组101660.2±200.7△272.7±53.0△472.6±42.1∗∗△275.9±44.4∗∗△1178.0±104.8∗△椰子壳挥发油组101897.6±167.3∗∗#263.9±23.1△458.8±71.1∗∗△298.4±52.4∗∗△#1145.7±130.6∗△
与正常组比较,*Plt;0.05,**Plt;0.01;与模型组比较,△Plt;0.01;与复方丹参滴丸组比较,#Plt;0.01
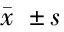

组 别nα-HBDH(U/L)cTnT(ng/L)cTnI(ng/L)Mb(ng/mL)正常组10162.1±27.6138.6±47.298.7±17.6108.4±24.4模型组10291.2±46.9∗∗381.5±69.3∗∗431.2±53.3∗∗181.9±38.9∗∗复方丹参滴丸组10180.2±20.7∗△172.7±53.1△272.7±42.1∗∗△122.7±34.4△椰子壳挥发油组10175.6±27.3∗△168.9±38.3△298.9±30.5∗∗△118.9±26.1△
与正常组比较,*Plt;0.05,**Plt;0.01;与模型组比较,△Plt;0.01
由表1、2可见,与正常组比较,模型组AST、CK、CK-MB、LDH、LDH1、α-HBDH、cTnT、cTnI、Mb升高(Plt;0.01),复方丹参滴丸组CK-MB、LDH、LDH1、α-HBDH、cTnI升高(Plt;0.01,Plt;0.05),椰子壳挥发油组AST、CK-MB、LDH、LDH1、α-HBDH、cTnI升高(Plt;0.01,Plt;0.05)。与模型组比较,复方丹参滴丸组AST、CK、CK-MB、LDH、LDH1、α-HBDH、cTnT、cTnI、Mb降低(Plt;0.01),椰子壳挥发油组CK、CK-MB、LDH、LDH1、α-HBDH、cTnT、cTnI、Mb降低(Plt;0.01)。与复方丹参滴丸组比较,椰子壳挥发油组AST、LDH升高(Plt;0.01)。
2.2 各组大鼠心肌组织中各心肌损伤生物化学标志物比较 见表3、4。
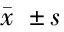

组 别nAST(U/gprot)CK(U/mgprot)CK-MB(U/mgprot)LDH(U/gprot)正常组10258.2±37.61728.7±184.21952.1±297.6260.1±25.2模型组10363.6±46.5∗∗2006.2±325.4∗∗2681.2±383.9∗∗358.7±48.9∗∗复方丹参滴丸组10295.9±60.1∗∗△1782.7±203.0△2122.5±342.4∗∗△272.7±54.7△椰子壳挥发油组10287.4±37.8∗∗△1833.4±279.3∗△2058.4±471.1∗∗△268.9±48.4△
与正常组比较,*Plt;0.05,**Plt;0.01;与模型组比较,△Plt;0.01
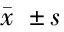

组 别nα-HBDH(U/gprot)cTnT(pg/mL)cTnI(pg/mL)Mb(nmol/g)正常组10155.4±29.6248.6±27.2195.6±46.6502.7±64.2模型组10282.2±46.3∗∗483.5±50.8∗∗328.2±65.9∗∗771.5±78.4∗∗复方丹参滴丸组10180.2±40.4∗∗△272.7±43.6△203.7±49.2△562.3±59.7△椰子壳挥发油组10186.6±37.8∗∗△263.1±38.5△208.3±37.5△506.1±70.9△#
与正常组比较,**Plt;0.01;与模型组比较,△Plt;0.01;与复方丹参滴丸组比较,#Plt;0.01
由表3、4可见,与正常组比较,模型组AST、CK、CK-MB、LDH、α-HBDH、cTnT、cTnI、Mb升高(Plt;0.01),复方丹参滴丸组AST、CK-MB、α-HBDH升高(Plt;0.01),椰子壳挥发油组AST、CK、CK-MB、α-HBDH升高(Plt;0.01,Plt;0.05)。与模型组比较,复方丹参滴丸组、椰子壳挥发油组AST、CK、CK-MB、LDH、α-HBDH、cTnT、cTnI、Mb均降低(Plt;0.01)。与复方丹参滴丸组比较,椰子壳挥发油组Mb降低(Plt;0.01)。
3 讨 论
心肌损伤主要是由病毒、细菌、肺炎支原体等引发的各种感染、缺氧、缺血、免疫反应、药物心脏毒性、中毒、心脏手术等所致。异丙肾上腺素造成的心肌损伤有着多种病理生理机制的共同参与[4],主要是通过对β1和β2受体的调制[5],收缩心脏及外周血管,使冠状动脉充盈不足,增加心肌耗氧量,致使心肌供血不足,造成心肌损伤[6]。
心肌损伤后,心肌细胞内的各种成分包括多种酶类、蛋白质及其他大分子被释放入血[7],其中某些成分能较为特异和敏感地反映心肌损伤,称为心肌损伤生物化学标志物。心肌损伤标志物大致分2类,一类为酶类标志物(主要包括LDH及同工酶、CK及同工酶、AST等);一类为蛋白类标志物(主要包括心肌肌钙蛋白、Mb)[8]。随着心肌标志物研究和临床应用的深入,普遍认为心肌损伤标志物的检测结果与病情进展具有一致性。2004年美国临床生化科学院起草的新的相关实验室医学实践指南(草案)中,建议所有由急性心肌缺血引起的临床症状的患者都应进行心肌坏死标志物测定[9]。因此,在临床上判断患者是否存在心肌损伤,除结合心电图改变、临床表现外,检测心肌损伤标志物是一种常用的重要诊断依据[10]。
我们通过注射大剂量盐酸异丙肾上腺素制备大鼠急性心肌损伤模型,分别对大鼠血清和心肌组织中心肌损伤标记物进行检测,结果显示:造模后,模型组大鼠血清和心肌组织中心肌损伤标志物均明显升高;椰子壳挥发油组大鼠血清中CK、CK-MB、LDH、LDH1、α-HBDH、cTnT、cTnI、Mb较模型组降低(Plt;0.01);椰子壳挥发油组大鼠心肌组织中各生化标志物较模型组均降低(Plt;0.01);椰子壳挥发油组与复方丹参滴丸组比较,血清中AST、LDH和心肌组织中Mb差异有统计学意义(Plt;0.01)。根据以上实验结果,我们认为利用水蒸汽蒸馏法从椰子壳中提取的挥发油,可以降低急性心肌损伤大鼠血清和心肌组织中生化标志物的活性,具有较好的改善心肌损伤的作用,其作用的机制为保护心肌细胞膜的完整性,减少心肌细胞内酶类、蛋白质及其他大分子释放入血,减轻心肌细胞的损伤。
有研究表明,从艾叶[11]、薄荷[12]等中药提取的挥发油具有通经达络、行气散瘀、芳香开窍等作用[13],那么椰子壳提取的挥发油是否同样具有辛散通络、行气的功效,通过扩张血管,增加供氧,减轻因缺血缺氧造成的心肌过氧化损伤,我们在后续的研究中将继续探讨。
[1] 中国药材公司.中国中药资源志要[M].北京:科学出版社,1994:1462.
[2] Lim KH,Cho JY,Kim B,et al.Red ginseng (Panax ginseng) decreases isoproterenol-induced cardiac injury via antioxidant properties in porcine[J].J Med Food,2014,17(1):111-118.
[3] 徐叔云,卞如濂,陈修.药理学实验方法学[M].3版.北京:人民卫生出版社,2002:1052.
[4] Ostádal B,Rychterová V,Poupa O.Isoproterenol-induced acute experimental cardiac necrosis in the turtle (Testudo Horsfieldi)[J].Am Heart J,1968,76(5):645-649.
[5] 高海成,孙波,苗春生.大剂量盐酸异丙肾上腺素诱发大鼠心肌缺血性坏死模型的建立[J].中国生物制品学杂志,2009,22(3):288-290,296.
[6] 张乾忠.心肌损伤生化标志物应用进展及检测结果解析[J].中国实用儿科杂志,2013,28(7):481-487.
[7] Scirica BM,Sabatine MS,Jarolim P,et al.Assessment of multiple cardiac biomarkers in non-ST-segment elevation acute coronary syndromes:observations from the MERLIN-TIMI 36 trial[J].Eur Heart J,2011,32(6):697-705.
[8] Lang K,Brner A,Figulla HR.Comparison of biochemical markers for the detection of minimal myocardial injury:superior sensitivity of cardiac troponin--T ELISA[J].J Intern Med,2000,247(1):119-123.
[9] 周新,涂植光.临床生物化学和生物化学检验[M].3版.北京:人民卫生出版社,2005:284-297.
[10] 郑铁生,樊绮诗,姜旭淦.临床生物化学实验诊断与病例解析[M].北京:中国医药科技出版社,2010:159-165.
[11] 蒋勇.艾蒿主要药用成分的研究进展[J].安徽农业科学,2011,39(14):8367-8368.
[12] 梁呈元.中国薄荷属(Mentha L.)植物种质资源多样性研究[D].南京:南京农业大学,2009.
[13] 谷晓慧,蔡芳华,吴文惠,等.艾草和薄荷挥发油提取方法及其构成成分的初步研究[J].价值工程,2014,(20):282-284.
2017-06-24)
(本文编辑:李珊珊)
Effectsandanalysisofcoconutshellvolatileoilonbiochemicalmarkersinmyocardialinjuryrats
GAOXiujuan*,ZHANGGuangzeng,YAORongmei,etal.
*ExperimentCenterinCollegeofTraditionalChineseMedicine,NorthChinaUniversityofScienceandTechnology,Hebei,Tangshan063210
ObjectiveTo observe the effects of coconut shell volatile oil on the biochemical markers of acute myocardial injury rats.Methods40 Wistar rats with limb Ⅱ lead electrocardiogram normal were randomly divided into 4 groups, namely, normal group, model group, coconut shell volatile oil group and compound Danshen dropping pill group, 10 rats in each group and continuous drug administration for 7 d. From the 6thd to the 7thd of the experiment, except for the normal group, the other rats were injected subcutaneously with isoprenaline hydrochloride into the neck to establish acute myocardial injury model. The contents of aspartate aminotransferase(AST),alpha-hydroxybutyrate dehydrogenase (α-HBDH), serum creatine kinase (CK), creative kinase isoenzyme (CK-MB), lactate dehydrogenase(LDH), lactate dehydrogenase isoenzyme(LDH1), cardiac troponin T (cTnT), cardiac troponin I (cTnI) and myoglobin (Mb) were detected in the serum and myocardial tissue of the rats at the 8th day.ResultsCompared with the normal group, the AST, CK, CK-MB, LDH, LDH1, α-HBDH, cTnT, cTnI and Mb in the serum were increased in the model group (Plt;0.01), the CK-MB, LDH, LDH1, α-HBDH, and cTnI in the serum were increased in the Danshen dropping pill group (Plt;0.01,Plt;0.05), the AST, CK-MB, LDH, LDH1, α-HBDH and cTnI in the serum were increased in the coconut shell volatile oil group (Plt;0.01,Plt;0.05). Compared with model group, the AST, CK, CK-MB, LDH, LDH1, α-HBDH, cTnT, cTnI and Mb in the serum were reduced in the Danshen dropping pill group (Plt;0.01), the CK, CK-MB, LDH, LDH1, α-HBDH, cTnT, cTnI and Mb in the serum were reduced in the coconut shell volatile oil group (Plt;0.01). Compared with Danshen dropping pill group, the AST and LDH were increased in the coconut shell volatile oil group (Plt;0.01). Compared with the normal group, the AST, CK, CK-MB, LDH, α-HBDH, cTnT, cTnI and Mb in the myocardial tissue were increased in the model group (Plt;0.01), the AST, CK-MB, and α-HBDH in the myocardial tissue were increased in the Danshen dropping pill group (Plt;0.01), the AST, CK, CK-MB, and α-HBDH in the myocardial tissue were increased in the coconut shell volatile oil group (Plt;0.01,Plt;0.05). Compared with model group, the AST, CK, CK-MB, LDH, α-HBDH, cTnT, cTnI and Mb in the myocardial tissue were reduced in the Danshen dropping pill group and the coconut shell volatile oil group (Plt;0.01). Compared with Danshen dropping pill group, the Mb in the in the myocardial tissue were reduced in the coconut shell volatile oil group (Plt;0.01).ConclusionThe coconut shell volatile oil can reduce the release of a variety of enzymes, protein markers when myocardial injury, and to a certain extent inhibit the occurrence of myocardial injury.
Coconut; Myocardial disease; Wistar rats; Biochemical markers; Pharmacology of traditional Chinese medicine
10.3969/j.issn.1002-2619.2017.10.028
※ 项目来源:“重大新药创制”科技重大专项“十一五”计划第二批课题(编号:2009ZX09103-442);河北省科技计划项目(编号:13272509)
△ 通讯作者:华北理工大学中医学院实验中心,河北 唐山 063210
1 河北省唐山市协和医院心内科,河北 唐山 063004
2 华北理工大学中医学院中医基础教研室,河北 唐山 063210
高秀娟(1978—),女,副教授,硕士。从事中医学的教学与临床工作。研究方向:心血管病的中医药防治。
R542.2;R285
A
1002-2619(2017)10-1550-05

