微泡破坏促进骨髓间充质干细胞归巢治疗犬心肌梗死
常学锋 于 淼 初贵富 马大实
(北华大学附属医院急诊科,吉林 吉林 132000)
微泡破坏促进骨髓间充质干细胞归巢治疗犬心肌梗死
常学锋 于 淼1初贵富 马大实2
(北华大学附属医院急诊科,吉林 吉林 132000)
目的通过诊断超声介导微泡破坏联合冠状动脉内移植促进骨髓间充质干细胞(BMSCs)归巢梗死心肌,为临床治疗心肌梗死探索新的方法。方法急性心肌梗死(AMI)造模成功犬随机分为4组,每组6只,造模7 d后,分别给予磷酸盐缓冲液(PBS)、超声+微泡+PBS、BMSCs、超声+微泡+BMSCs。28 d后,评估心功能和灌注缺损区域占左心室灌注区的百分比(DA%),评估心肌梗死面积占左心室心肌横断面面积的百分比,BMSCs分化的心肌细胞数量及是否出现α-肌动蛋白。结果超声+微泡+冠状动脉移植BMSCs和单纯冠状动脉移植BMSCs均可缩小心肌梗死面积和灌注缺损面积、改善心功能和室壁运动异常指数(WMSI)、促进BMSCs在心肌内存活,但前者效果更显著;两者均可表达α-肌动蛋白,但前者α-肌动蛋白染色阳性的细胞数多于后者。结论诊断超声介导微泡破坏联合冠状动脉内移植可以促进BMSCs归巢梗死心肌,使更多的BMSCs抵达梗死区域分化为有功能的心肌细胞,从而降低心肌梗死面积并改善心脏功能。
心肌梗死;诊断超声介导微泡破坏;骨髓间充质干细胞;冠状动脉内移植
急性心肌梗死(AMI)是临床常见的危重类型。最常用的AMI治疗包括药物治疗和介入治疗,但都不能增加心肌梗死后的心肌细胞数量〔1〕。研究表明,骨髓间充质干细胞(BMSCs)能够分化为心肌组织和血管,减少组织纤维化和释放旁分泌因子,最终逆转左心室重塑〔2〕。最近的临床试验表明,移植的异体BMSCs与自体BMSCs同样可以安全有效地用于心脏组织重建〔3〕。将足够的BMSCs安全、准确地归巢到梗死区对于其治疗AMI的功效十分关键。通过同轴整体交换型球囊扩张(OTW)经梗死相关冠状动脉移植的BMSCs不仅定位准确,而且风险较低,易于操作;诊断超声介导的微泡破坏可以增加血管通透性,促进BMSCs归巢到心肌梗死区〔4~6〕。
1 材料和方法
1.1试剂 二氨基联苯胺(DAB)显色酶底物试剂盒购自Boster(中国武汉)。 小鼠单克隆抗BrdU抗体购自美国的SANTA。 L-DMEM培养基购自Invitrogen(Carlsbad,CA,USA),Percoll溶液购自Sigma(St.Louis,MO,USA)。 CD34和CD44兔单克隆抗体购自Dingguo Biotechnology(中国北京)。 2.5 mm×15 mm OTW球囊购自Medtronic(Minneapolis,MN,USA)。
1.2BMSCs 准备 穿刺取骨髓:将犬以5%戊巴比妥钠1 ml/kg腹腔麻醉后,用注射器穿刺犬肱骨,抽取10 ml骨髓并与等体积肝素混合。通过Percoll密度梯度离心纯化BMSCs,将获得的单核细胞接种在100 mm的培养皿中,培养液包含有20%磷酸盐缓冲液(PBS)、100 U/ml青霉素、0.1 mg/ml链霉素的L-DMEM,在5%CO2, 37.0℃下培养。 24 h后更换培养基以除去非黏附细胞(如红细胞和巨噬细胞)。细胞生长至70%以上时进行传代。细胞以1∶3的比例传代,每2 d更换培养基。 所有测定用第3代细胞进行,随后用MTT比色测定分析培养细胞的生长规律。通过CD34和CD44阳性细胞的免疫组织化学染色鉴定BMSCs。在移植前24 h加入10 μl BrdU标记液以标记BMSCs。
1.3AMI模型的制作 造模组禁食8 h后用3%戊巴比妥钠40 mg/kg腹腔麻醉实验动物。以Sedinger技术穿刺右侧股动脉,置入6F鞘管。选6F造影导管自右股动脉插至主动脉根部,注入少量造影剂优维显370显示冠状动脉前降支(LAD)。选用BMW导丝送至前降支远端,推送6FOTW球囊导管,使之抵达第一间隔支和第二间隔支之间,离LAD和左回旋支(LCX)分叉处0.5~1.0 cm,注入适量造影剂,以4~6 amt充盈球囊堵塞冠状动脉前降支4 h后撤除气囊,造模完毕。
1.4方法 从吉林省中医药科学院实验动物中心获得12只雄性和12只雌性健康比格犬(体重15.0~18.0 kg)。造模7 d后将犬随机分为4组,每组6只,雌雄各半,(1)PBS组:确定目标冠状动脉即前降支开口后用5 ml生理盐水进行冲洗,采用带有中心腔的OTW球囊将冠状动脉近端边缘完全堵塞后由远及近于2 min内注射PBS。(2)超声+微泡+PBS组:冠状动脉造影确定目标冠状动脉即前降支开口,给予超声辐射:经股静脉应用微量泵以1.5 ml/min的速度匀速缓慢静脉注射2.0 ml声诺维,注入声诺维时启动超声:采用VIVID 7D 3S探头,频率为1 MHz,强度为1.0 W/cm2,时间触发模式,触发脉冲持续时间23 ms,帧频(FPS)为0.5,触发时间间隔为2 s,机械指数(MI)1.3,作用时间10 min,深度8~10 cm,超声探头固定于犬心脏左室乳头肌水平,观看短轴切面图。随后操作同PBS组。(3)BMSCs组:以BMSCs取代PBS,余操作同PBS组。(4)超声+微泡+BMSCs组:以BMSCs取代PBS,余操作同超声+微泡+PBS组。
1.5评价 (1)造模时注入适量造影剂于指引导管内,观看录像,造影剂是否被阻于气囊近端,以证明血流有无阻断。(2)M型超声、二维超声心动图及MCE测量心功能、DA%:M型超声测量心功能,包括舒张末期容积(EDV)、收缩末期容积(ESV)、左室射血分数(LVEF)、短轴缩短率(FS)、室壁增厚率(D%)、室壁运动异常指数(WMSI)。MCE测量DA%。分别于造模前及造模后4 h、梗死相关冠状动脉再通后分别进行心肌造影。选择每次造影心肌显影达平台时灌注缺损面积最小的图像,应用自编的Matlab软件计算DA%。(3)病理和免疫组化分析:给予PBS或BMSCs 28 d后,将犬用心内注射氯化钾处死,取出心脏,找到冠脉LAD阻断点,将阻断水平以下心肌做连续横断面切片,做病理学分析和免疫组化。病理分析采用NBT染色。计算各实验组心肌梗死面积占左心室心肌横断面面积的百分比。免疫组化分析α-肌动蛋白和BrdU染色细胞。
1.6统计学方法 采用SPSS18.0软件进行t检验、方差分析。
2 结 果
2.1心功能和DA%的测量 各组AMI造模成功:各组造模后4 h较造模前心脏功能显著降低,DA%显著增加(均Plt;0.05)。见表1。MCE同步心电图导联V1表现出特征性AMI变化,包括弓背向上抬高的ST段与直立的T波连接以形成单个曲线和病理Q波(图1)。超声+ BMSCs组和BMSCs组在BMSCs移植后心脏功能和DA%较其余两组均有显著改善,且前者较后者改善更为显著(均Plt;0.05);其余两组心脏功能和DA%较造模4 h没有改善(Pgt;0.05)。见表2。

表1 心肌梗死造模前后各组心功能、WMSI及DA%比较
与同组造模前比较:1)Plt;0.05
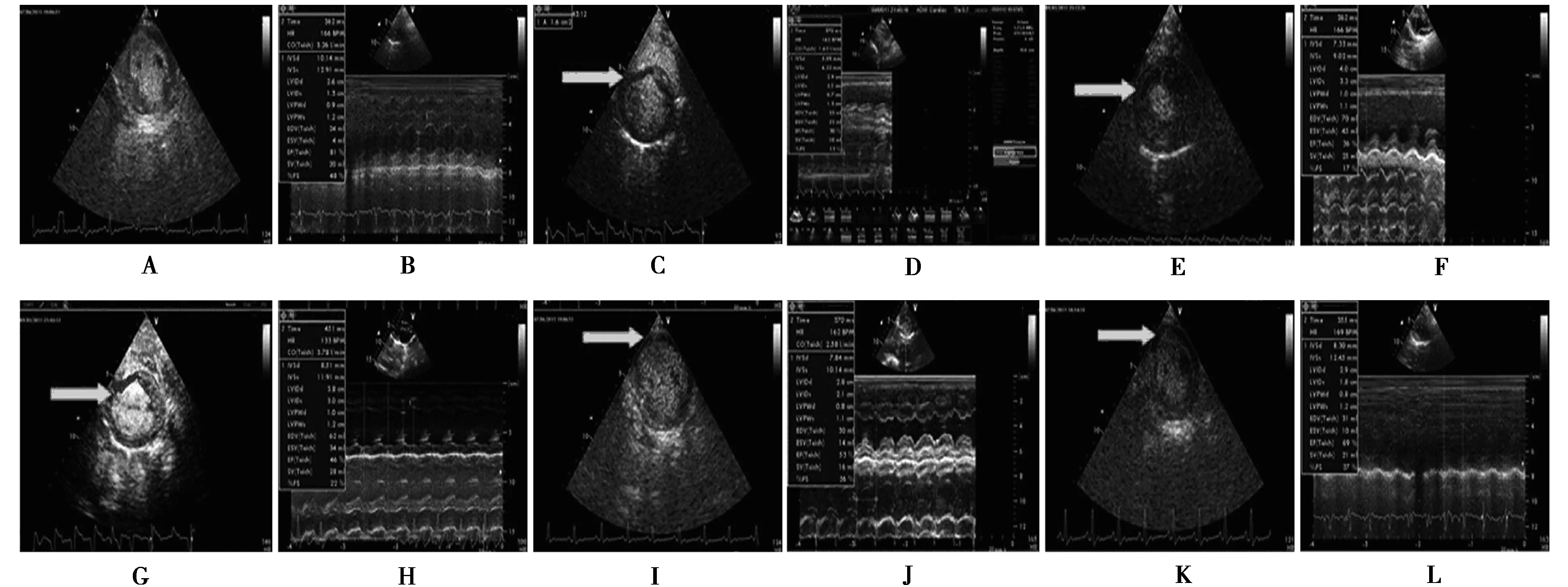
A、C、E、G、I、K为DA%,B、D、F、H、J、L为心功能;A、B为造模;C、D为造模后4 h;E~L为给予PBS或BMSCs 28 d后其中E、F为PBS组,G、H为超声+微泡+PBS组,I、J为BMSCs组,K、L为超声+微泡+BMSCs组图1 不同实验阶段各组DA%和心功能

组别EDV(ml)LVEF(%)FS(%)DA%D%WMSIPBS组67.00±4.381)2)36.50±5.051)2)18.50±4.811)2)11.19±1.431)2)9.83±5.081)2)3.17±1.171)2)超声+微泡+PBS组71.83±4.491)2)37.17±5.041)2)17.67±4.801)2)11.25±1.881)2)12.17±6.371)2)3.17±0.981)2)BMSCs组37.33±4.371)53.17±5.041)28.50±4.761)7.11±1.631)21.67±5.471)2.00±0.001)超声+微泡+BMSCs组30.50±4.2365.83±5.1937.17±4.714.56±1.1330.50±6.191.50±0.55
超声+微泡+BMSCs组分别与其余各组比较:1)Plt;0.05;BMSCs组分别与超声+微泡+BMSCs以外各组比较:2)Plt;0.05
2.2病理检查结果 NBT染色结果显示,与BMSCs,超声+ PBS和PBS组相比,超声+ BMSCs组梗死面积分别减少了35.9%、59.5%和59.2%(Plt;0.05)。 与超声+ PBS和PBS组相比,BMSCs组分别减少了36.7%和36.4%(Plt;0.05)。见图2。

A.PBS组;B.超声+微泡+PBS组;C.BMSCs组;D.超声+微泡+BMSCs组图2 各组NBT染色
给予PBS或BMSCs28 d后各组与MCE相同切面水平的横断面心肌梗死面积占左心室心肌横断面面积的百分比分别为:PBS组(11.18±1.43)%,超声+微泡+PBS组(11.24±1.87)%,BMSCs组(7.11±1.60)%,超声+微泡+BMSCs组(4.56±1.09)%。
BrdU染色显示,在BMSCs移植后第28天,超声+微泡+ BMSCs组和BMSCs组BrdU阳性细胞数分别为270.83±18.41和168.50±19.41,超声+微泡+ BMSCs组明显高于BMSCs组(Plt;0.05)。见图3。

图3 不同组BrdU阳性细胞
2.3各组α-肌动蛋白染色阳性的心肌细胞数 α-肌动蛋白染色阳性的证据为细胞质被染为棕黄色。各组α-肌动蛋白染色阳性的心肌细胞数由多到少依次为超声+微泡+BMSCs组、BMSCs组、超声+微泡+PBS组、PBS组,其中后2组在心肌梗死区域几乎没有α-肌动蛋白染色阳性的细胞(图4)。
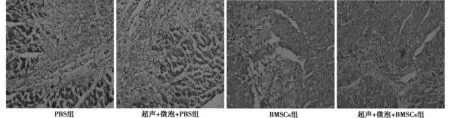
图4 各组α-肌动蛋白染色阳性的心肌细胞
3 讨 论
本研究结果表明,BMSCs的移植增加了能够有效收缩的心肌细胞数量,减少了心肌梗死面积和灌注缺陷面积,改善了心脏功能。心肌梗死发生后病变局部的微环境是细胞存活的最关键因素,它将影响移植细胞的黏附、迁移和定殖能力及长期存活〔7〕。Kuethe等〔8〕发现在心肌梗死后第7天,血管内皮生长因子VEGF的分泌达到高峰;而且在心肌梗死7~15 d之后,炎症反应较前减弱,纤维组织开始形成但又没有完全形成,此时移植细胞容易存活。本研究结果也证实了BMSCs移植后能够存活和分化。本研究结果提示超声+微泡+冠状动脉移植BMSCs和单纯冠状动脉移植BMSCs均可缩小心肌梗死面积和灌注缺损面积、改善心功能,促进BMSCs在心肌内存活,表达α-肌动蛋白且前者效果更显著。
1Sanz-Rosa D,García-Prieto J, Ibanez B.The future:therapy of myocardial protection〔J〕.Ann N Y Acad Sci,2012;1254:90-8.
2Williams AR,Hare JM.Mesenchymal stem cells:biology,pathophysiology,translational findings,and therapeutic implications for cardiac disease〔J〕.Circ Res,2011;109:923-40.
3Hare JM,Fishman JE,Gerstenblith G,etal.Comparison of allogeneic vs.autologous bone marrow-derived mesenchymal stem cells delivered by transendocardial injection in patients with ischemic cardiomyopathy〔J〕.JAMA,2012;308:2369-79.
4Vulliet PR,Greeley M,Halloran SM,etal.Intra-coronary arterial injection of mesenchymal stromal cells and microinfarction in dogs〔J〕.Lancet,2004;363:783-4.
5Yoshida J,Ohmori K,Takeuchi H,etal.Treatment of ischemic limbs based on local recruitment of vascular endothelial growth factor-producing inflammatory cells with ultrasonic microbubble destruction〔J〕.Coll Cardiol,2005;46:899-905.
6Imada T,Tatsumi T,Mori Y,etal.Targeted delivery of bone marrow mononuclear cells by ultrasound destruction of microbubbles induces both angiogenesis and arteriogenesis response〔J〕.Arterioscler Thromb Vasc Biol,2005;25:2128-34.
7Wollert KC,Drexler H.Clinical application of stem cells for the heart〔J〕.Circ Res,2005;96:151-63.
8Kuethe F,Figulla HR,Herzau M,etal.Treatment with granulocyte colony-stimulating factor for mobilization of bone marrow cells in patients with acute myocardial infarction〔J〕.Heart,2005;150-5.
〔2017-04-11修回〕
(编辑 郭 菁)
R542
A
1005-9202(2017)21-5228-04;
10.3969/j.issn.1005-9202.2017.21.005
吉林省卫生计生科研计划(20152057);吉林市医疗卫生指导性计划项目(201737056)
1 吉林大学第一医院放射线科 2 吉林大学第一医院心脏外科
马大实(1972-),男,副教授,硕士,主要从事心脏疾病研究。
常学锋(1973-),男,副主任医师,主要从事急诊内科及心内科研究。

