清胰Ⅱ号对重症急性胰腺炎大鼠胰腺及肠组织中MCP-1表达的影响
尚献会 李建国 范振海 兑丹华
(遵义医学院附属医院小儿普胸泌外科,贵州 遵义 563003)
清胰Ⅱ号对重症急性胰腺炎大鼠胰腺及肠组织中MCP-1表达的影响
尚献会 李建国1范振海2兑丹华3
(遵义医学院附属医院小儿普胸泌外科,贵州 遵义 563003)
目的探究清胰Ⅱ号对重症急性胰腺炎(SAP)大鼠胰腺及肠组织中单核细胞趋化蛋白(MCP)-1表达及细胞凋亡的影响。方法将36只大鼠随机分为对照组、模型组、模型+清胰Ⅱ号组,每组12只,对照组正常饲养,其余各组采用胆胰管逆行注射牛磺胆酸钠0.1 ml/100 g的方法建立SAP模型,模型+清胰Ⅱ号组造模后给予清胰Ⅱ号10 ml/kg。造模后12、24 h随机选取7只大鼠采样,比较各组腹水量、胰腺和回肠病理学变化,判断造模是否成功。酶联免疫吸附测定法(ELISA)检测血清MCP-1、白细胞介素(IL)-10、二胺氧化酶(DAO)、血清淀粉酶(AMY)活力。实时定量PCR(qRT-PCR)检测胰腺及肠组织中MCP-1 mRNA表达情况。流式细胞术检测胰腺细胞的凋亡率。结果模型组大鼠腹内血性腹水及胰腺坏死显著高于对照组,表明造模成功。造模后12、24 h,模型+清胰Ⅱ号组大鼠血性腹水、血清MCP-1、IL-10、DAO、AMY活力及胰腺、回肠组织中MCP-1 mRNA的表达显著低于模型组(Plt;0.05);与对照组相比,模型组及模型+清胰Ⅱ号组胰腺细胞的凋亡率显著增加,且模型+清胰Ⅱ号组SAP显著高于模型组(Plt;0.05)。结论清胰Ⅱ号可下调炎症因子MCP-1、IL-10表达,降低DAO、AMY活力,促进胰腺细胞凋亡,对重症急性胰腺炎大鼠胰腺及肠组织具有良好的修复和保护作用。
清胰Ⅱ号;重症急性胰腺炎;二胺氧化酶;单核细胞趋化蛋白-1
重症急性胰腺炎(SAP)是一种临床常见的急性炎症性疾病,主要发生在胰腺组织,可由多种原因引起〔1〕。SAP患者常伴发急性肺损伤、急性呼吸窘迫综合征、全身炎症反应综合征等,易导致肠黏膜损伤及功能障碍,与多种炎症介质如白细胞介素(IL)-10、单核细胞趋化蛋白(MCP)-1瀑布样级联反应密切相关〔2〕。目前,临床诊断和治疗水平取得了较大的进步,但SAP患者的死亡率仍达30%~50%〔3〕。清胰Ⅱ号是一种由栀子、木香、赤芍、大黄、芒硝等制成的中药复方制剂,具有疏肝清热,杀虫驱蛔的功效。研究表明清胰Ⅱ号颗粒剂能够减轻SAP早期的损伤反应,保护胰脏、肾脏、肠道功能〔4~7〕。研究发现,清胰Ⅱ颗粒剂能够抑制胰脏出血、坏死和并发多器官功能障碍综合征的发生,对组织细胞起保护功能〔8〕。本文利用SAP模型大鼠,探究清胰Ⅱ号对其胰腺及肠组织中IL-10、MCP-1、细胞凋亡等的影响及其作用机制。
1 材料与方法
1.1实验主要试剂和器材 牛磺胆酸钠购自美国Sigma公司;10%水合氯醛、清胰Ⅱ号颗粒剂购自遵义医学院附属医院;乌拉坦购自武汉胜天宇生物科技有限公司;MCP-1、IL-10、二胺氧化酶(DAO) 酶联免疫吸附(ELISA)检测试剂盒购自南京建成科技有限公司;血清淀粉酶(AMY)试剂盒购自上海沪震实业有限公司;Trizol试剂、反转录试剂盒购自大连TaKaRa公司,细胞凋亡检测试剂盒购自美国Sigma公司。BX51-P偏光显微镜购自上海巴玖实业有限公司,定量PCR仪购自瑞士Roche公司,流式细胞仪购自美国Beckman Coulter公司。
1.2实验动物与SAP大鼠模型的建立 36只SPF级SD大鼠购自重庆第三军医大学实验动物中心,8~12周龄,体质量(200.39±40.39)g,雌雄各半。动物饲养在温度22℃~25℃、湿度55%~60%的环境中,自由饮食和饮水。实验随机分为对照组、模型组、模型+清胰Ⅱ号组。实验干预前禁食12 h。参考康新等〔9〕的建模方法,模型组、模型+清胰Ⅱ号组大鼠采取胆胰管逆行给予牛磺胆酸钠0.1 ml/100 g建立SAP模型,对照组给予等量的生理盐水。造模后24 h注射10%水合氯醛0.3 ml/100 g处死,苏木素-伊红(HE)染色并记录大鼠腹水量,光镜下观察胰腺、回肠病理形态学变化判断造模是否成功。
1.3药物干预 模型+清胰Ⅱ号组大鼠造模后给予清胰Ⅱ号颗粒剂10 ml/kg,6 h重复灌胃1次,共3次。对照组与模型组在相同时间给予等量生理盐水灌胃。
1.4检测血清中MCP-1、IL-10、DAO、AMY水平的变化 造模后12、24 h,各组随机选取6只大鼠,采用0.5 ml/100 g 20%乌拉坦麻醉,原切口入腹,下腔静脉取血5 ml,室温静置30 min,待出现淡黄色液体时,2 000 r/min离心15 min,取上清液置于EP管,根据ELISA检测试剂盒说明书检测各组大鼠血清MCP-1、IL-10、DAO、AMY水平。
1.5检测胰腺和回肠组织MCP-1 mRNA表达量 采用实时定量PCR(qRT-PCR)检测胰腺和回肠组织MCP-1 mRNA表达情况。MCP-1基因的引物由上海生工生物有限公司合成,上游序列为5′-CACGTCGTAGCAAACCACCAA-3′,下游序列为5′-GTTGGTTGTCTTTGAGATCCA-3′。造模后12、24 h后取部分胰腺、回肠组织置于液氮中。加入1 ml Trizol提取胰腺和回肠组织中的总RNA并以根据逆转录试剂盒说明书将所提取RNA反转录为cDNA,GAPDH为参照,采用20 μl体系进行扩增。扩增条件为预变性94℃ 60 s,94℃ 10 s,54℃ 10 s,72℃ 10 s,50个循环。实验重复3次,采用2-ΔΔCt定量分析方法计算MCP-1 mRNA相对表达量。
1.6检测大鼠胰腺细胞凋亡率 将所取部分胰腺组织置于平
皿中,加入磷酸盐缓冲液(PBS)清洗干净,将胰腺组织剪成小块后匀浆,使用200目尼龙网过滤,125 r/min离心5 min,PBS清洗3次,300目尼龙网过滤后,500 r/min离心5 min,收集细胞。加入100 μl 1×膜联蛋白-V(Annexin V)缓冲液悬浮细胞,加入5 μl Annexin V-FITC和10 μl碘化丙啶(PI),轻轻振荡混匀,室温避光反应10~15 min,加入400 μl 1×Annexin V缓冲液,混匀后置于流式细胞仪中1 h内检测细胞的早期凋亡率。
1.7统计学方法 采用SPSS21.0软件进行t检验、单因素方差分析。
2 结 果
2.1观察小鼠基本外观和胰腺、回肠病理形态学变化 造模后12、24 h,与对照组相比,模型组、模型+清胰Ⅱ号组大鼠血性腹水体积显著增加;模型+清胰Ⅱ号组〔(4.85±0.58)ml,(3.02±0.31)ml〕显著低于模型组〔(8.20±1.03)ml、(9.11±1.13)ml〕(Plt;0.05)。
对照组胰腺、回肠组织基本正常,模型组大鼠回肠出现明显水肿、间质血管充血、出血及中性粒细胞浸润,胰腺小叶结构紊乱,细胞肿胀、坏死、出血;模型+清胰Ⅱ号组大鼠回肠、胰腺组织结构较为完整,坏死病灶、间质血管充血现象较轻,周围有少量中性粒细胞浸润,提示造模成功。见图1。
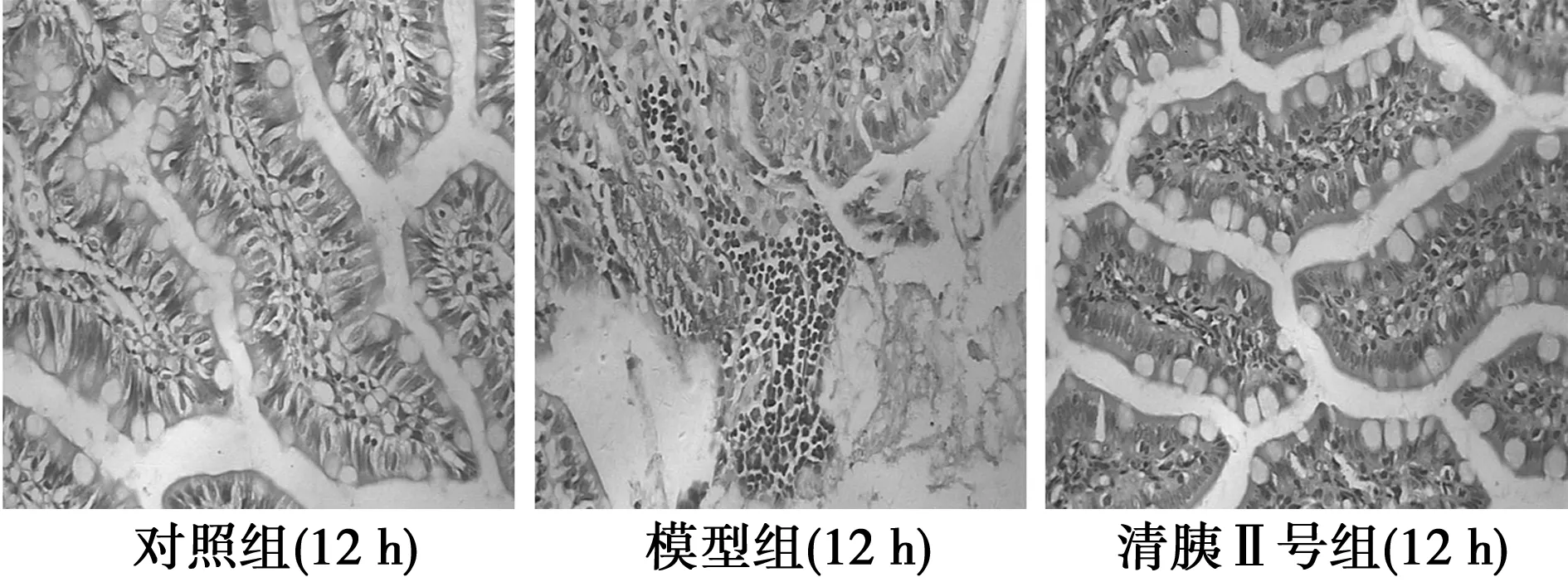
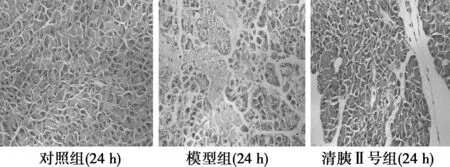
图1 造模后12、24 h三组大鼠胰腺光镜HE染色(×400)
2.2检测血清中IL-10、DAO、AMY水平 与对照组相比,模型组、模型+清胰Ⅱ号组大鼠在12、24 h时间点血清IL-10、DAO、AMY活力水平显著增高(Plt;0.05);与模型组相比,模型+清胰Ⅱ号组均显著降低(Plt;0.05)。随着时间的延长,模型组均逐渐升高,但模型+清胰Ⅱ号组均逐渐降低。见表1。

表1 检测大鼠血清中IL-10、DAO、AMY水平
与对照组比较:1)Plt;0.05;与模型组比较:2)Plt;0.05;下表同
2.3大鼠血清、胰腺及肠组织中MCP-1表达量的变化 与对照组相比,模型组、模型+清胰Ⅱ号组大鼠血清MCP-1蛋白和胰腺及回肠组织MCP-1 mRNA的表达量均显著增加(Plt;0.05);模型+清胰Ⅱ号组均显著低于模型组(Plt;0.05)。随着时间的延长,模型组均逐渐升高,但模型+清胰Ⅱ号组均逐渐降低。见表2。

表2 大鼠血清、胰腺及肠组织中MCP-1表达量的变化
2.4大鼠胰腺细胞凋亡率的检测 造模后12、24 h,模型组、模型+清胰Ⅱ号组大鼠胰腺细胞凋亡率显著高于对照组(Plt;0.05);与模型组相比,模型+清胰Ⅱ号组显著增加(Plt;0.05)。见表3。
表3 大鼠胰腺细胞凋亡率的检测
3 讨 论
SAP患者体内胰腺自身防御机制障碍,导致胰管阻塞,大量胰酶分泌,诱发胰酶消化自身周围组织,引起局部或全身的炎症反应,甚至使全身多器官发生损伤。多种炎性因子参与SAP的发生、发展,发生瀑布样级联反应。IL-10是一种内源性免疫抑制因子,由Th细胞分泌产生,能够抑制多种细胞合成其他细胞因子,抑制SAP患者胰腺组织中的IL-10的表达量可减轻炎症反应,对胰脏具有保护作用。SAP患者随着病情的减轻,致炎-抗炎因子出现平衡,炎症反应减轻,IL-10水平降低〔10〕。MCP-1是主要的单核/巨噬细胞趋化因子,能够调节单核/巨噬细胞分泌量,诱发炎症反应,参与疾病的演进过程。研究表明,MCP-1水平与细胞的损伤程度、局部并发症、病理损害评分、疾病的严重程度等呈正相关〔11〕。本实验表明炎症反应和炎症因子在SAP的发生、发展中起着重要作用。清胰Ⅱ号可以降低炎症因子的水平,从而降低炎症反应,延缓SAP进程。
肠道是全身的炎症反应的原动力,能够合成诸多炎症介质,SAP发生时患者出现胰腺坏死和胰外器官衰竭,阻碍肠道屏障功能,加剧炎症反应〔12,13〕。外周血中DAO活性能反映肠上皮细胞成熟度及完整性,可作为肠黏膜屏障功能监控的主要指标〔14,15〕。AMY是临床诊断中用于检测SAP的常用指标,AMY含量的高低与胰腺炎的发生有密切关系〔16〕。临床上通过检测血清中AMY的活性能够评价SAP的病情变化〔17,18〕。本研究结果表明,清胰Ⅱ号可以减轻肠黏膜损伤,进而缓解SAP大鼠的严重程度。
细胞凋亡是一种程序性死亡方式,可减轻炎症反应,被认为具有保护SAP的作用,对SAP病程的进展具有重要作用。研究表明,增加胰腺细胞的凋亡率,减少细胞的坏死率可阻碍胰腺损伤〔19〕。本实验结果表明清胰Ⅱ号可增加胰腺细胞的凋亡率,保护胰腺损伤,缓解SAP进程。
1包红梅.急性重症胰腺炎肠内营养护理研究进展〔J〕.蛇志,2015;27(2):211-2.
2Shen X,Li WQ.High-mobility group box 1 protein and its role in severe acute pancreatitis〔J〕.World J Gastroenterol,2015;21(5):1424-35.
3鱼毛毛,刘金姣,王雨楠,等.葡萄多酚对雨蛙肽诱导的急性胰腺炎胰腺组织的保护作用〔J〕.中国病理生理杂志,2014;30(10):1820-6.
4周 淼,代静静,兑丹华,等.清胰Ⅱ号对重症急性胰腺炎大鼠肠道免疫损伤的影响〔J〕.中国普通外科杂志,2017;26(3):317-24.
5李 敏,林思思,沈 利,等.清胰汤Ⅱ号冲剂对急性胰腺炎小鼠的保护作用及机制〔J〕.中国病理生理杂志,2015;31(7):1282-7.
6蔡治方,兑丹华,陈正修,等.清胰Ⅱ号颗粒剂对大鼠重症急性胰腺炎合并肾损伤时的保护作用〔J〕.山东医药,2012;52(28):10-2.
7张华甫,兑丹华,王 霞.清胰Ⅱ号颗粒剂对大鼠重症急性胰腺炎肝损伤的保护作用〔J〕.临床医学,2010;30(5):112-3.
8黎筱青,陈幼祥.早期肠内营养对重症急性胰腺炎肠道屏障功能的影响〔J〕.江西医药,2006;41(9):705-7.
9康 新,梁正凯,路晓光,等.大黄附子汤对重症急性胰腺炎肠黏膜上皮细胞线粒体超微结构和离子泵的影响〔J〕.中华实验外科杂志,2015;32(1):41-4.
10Sternby H,Hartman H,Johansen D,etal.IL-1β,IL-6,IL-8 and IL-10 changes significantly within and between severity grades early in the course of acute pancreatitis〔J〕.Pancreatology,2017;17(3):S67-8.
11Yang YZ,Xiang Y,Chen M,etal.Clinical significance of dynamic detection for serum levels of MCP-1,TNF-α and IL-8 in patients with acute pancreatitis〔J〕.Asian Pac J Trop Med,2016;9(11):1088-91.
12Merza M,Hartman H,Rahman M,etal.Neutrophil extracellular traps induce trypsin activation,inflammation,and tissue damage in mice with severe acute pancreatitis〔J〕.Gastroenterology,2015;149(7):1920-31.
13侯 斐,刘瑞霞,阴赪宏.炎症介质在急性胰腺炎微循环障碍中的作用〔J〕.临床和实验医学杂志,2015;14(16):1399-400.
14Meng Y,Zhang Y,Liu M,etal.Evaluating intestinal permeability by measuring plasma endotoxin and diamine oxidase in children with acute lymphoblastic leukemia treated with high-dose methotrexate〔J〕.Anti-cancer Agents Med Chem,2016;16(3):387-92.
15Shamji MH,Layhadi JA,Scadding GW,etal.Basophil expression of diamine oxidase:a novel biomarker of allergen immunotherapy response〔J〕.J Allerg Clin Immunol,2015;135(4):913-21.
16Usher CL,Handsaker RE,Esko T,etal.Structural forms of the human amylase locus and their relationships to SNPs,haplotypes and obesity〔J〕.Nature Genetics,2015;47(8):921-5.
17Frossard JL,Robert J,Soravia C,etal.Early prediction in acute pancreatitis:the contribution of amylase and lipase levels in peritoneal fluid〔J〕.J Pancreas,2016;1(2):36-45.
18Sharif MM,Rahman MT,Ferdousi MA,etal.Relation of pancreatic enzymes and serum transaminases levels with modified CT severity index in acute pancreatitis〔J〕.Birdem Med J,2016;5(3):18-24.
19Jung KH,Yi TG,Son MK,etal.Therapeutic effect of human clonal bone marrow-derived mesenchymal stem cells in severe acute pancreatitis〔J〕.Arch Pharm Res,2015;38(5):742-51.
〔2017-09-25修回〕
(编辑 郭 菁/滕欣航)
R69
A
1005-9202(2017)21-5233-04;
10.3969/j.issn.1005-9202.2017.21.007
贵州省科技厅联合基金项目(黔科合LH字〔2016〕7480号LH120170211);贵州省科技厅中医药现代化攻关项目(黔科合中药专字〔2003〕13 号)
1 遵义医学院附属医院胃肠外科
2 遵义医学院附属医院贵州省细胞工程重点实验室
3 遵义医学院附属医院肝胆外科
兑丹华(1957-),女,教授,主任医师,主要从事胰腺疾病基础与临床应用研究。
尚献会(1980-),男,硕士,主治医师,主要从事胰腺疾病基础研究。

