不同磷酸钙陶瓷对兔骨髓基质干细胞增殖及成骨分化相关基因表达的影响
王 哲,敖 俊,赵彦禹,张志敏,吴明松,3,李学英
(1.遵义医学院 医学遗传学教研室,贵州 遵义 563099;2.遵义医学院附属医院 脊柱外科,贵州 遵义 563099;3.遵义医学院 贵州省高等学校口腔疾病研究特色重点实验室/医学与生物学研究中心,贵州 遵义 563099)
不同磷酸钙陶瓷对兔骨髓基质干细胞增殖及成骨分化相关基因表达的影响
王 哲1,敖 俊2,赵彦禹1,张志敏1,吴明松1,3,李学英1
(1.遵义医学院 医学遗传学教研室,贵州 遵义 563099;2.遵义医学院附属医院 脊柱外科,贵州 遵义 563099;3.遵义医学院 贵州省高等学校口腔疾病研究特色重点实验室/医学与生物学研究中心,贵州 遵义 563099)
目的比较不同成分磷酸钙陶瓷材料对兔骨髓基质干细胞(BMSCs)增殖及成骨分化基因表达的影响。方法将不同相成分的磷酸钙陶瓷材料分为两组,分离并培养兔BMSCs分别与之共培养,于第1、3、7天用MTT法检测细胞增殖情况,并用FDA/PI染色后观察细胞形态。于第3、7、14天采用实时荧光定量PCR检测BMSCs的碱性磷酸酶(ALP)、骨形态发生蛋白(BMP-2)、骨唾液酸蛋白(BSP)和转录因子Osterix的mRNA表达变化。结果共培养7d后,两种材料上BMSCs均快速增殖;共培养14d时,双相磷酸钙陶瓷(BCP)组BMSCs的ALP、BMP-2、BSP和OsterixmRNA表达均明显高于羟基磷灰石(HA)组(Plt;0.05)。结论两种磷酸钙材料均能促进BMSCs增殖及向成骨方向分化,双相磷酸钙陶瓷这一能力强于羟基磷灰石陶瓷,预示出其更加优异的体外成骨诱导潜力。
磷酸钙陶瓷;骨髓基质干细胞;成骨分化
随着人口老龄化,由骨质疏松、感染、肿瘤等造成的骨缺损,以及运动和交通事故等带来的骨创伤与日俱增,已成为影响人类生命健康的重大问题。近年对骨修复材料的研究中,如何利用材料本身的成分和结构等因素设计来促进骨再生是比较热门的研究课题[1],研究证实,宿主组织会对具有不同理化性质的骨修复材料呈现出不同的生物学反应。磷酸钙陶瓷长期以来一直是临床上使用的十分重要的骨修复材料,磷酸钙陶瓷有多种相组成,常用的磷酸钙包括:羟基磷灰石(hydroxyapatite,HA),磷酸三钙(tricalcium phosphate,TCP),双相磷酸钙(biphasic calcium phosphate,BCP)等[2]。骨髓基质干细胞 (bone marrow stromal stem cells ,BMSCs)又称作间充质干细胞,在体外不同分化条件的诱导下,可以形成软骨细胞、成骨细胞和脂肪细胞,是一种多潜能干细胞[3-5]。在材料的骨诱导作用研究中,研究者将支架材料复合BMSCs后,可以在非骨环境下的体内[6]及体外[7-8]诱导BMSCs向成骨方向分化。目前对于磷酸钙陶瓷不同化学成分调控BMSCs向成骨方向分化的研究鲜有报道,已有的类似报道[9]仍缺乏充足的数据。本研究通过体外分离培养新生家兔BMSCs并作为细胞模型,考察不同成分磷酸钙陶瓷对BMSCs的影响:比较磷酸钙陶瓷不同化学成分对于诱导BMSCs成骨分化的差异,通过检测BMSCs的增殖情况和成骨分化相关基因的表达来探讨化学成分对于BMSCs成骨分化的影响,为磷酸钙材料的诱导机制及临床应用提供实验依据。
1 材料与方法
1.1 材料与仪器
1.1.1 动物新生家兔3只,体重150~200 g,购买自四川省实验动物专委会养殖场[生产许可证号:SCXK(川)2013-14]。
1.1.2 主要实验仪器和试剂医用超净工作台(哈东联BCN-13600),CO2细胞培养箱(MCO-15A,日本SANYO公司),细胞培养板(美国Corning公司),酶标仪(美国Thermo公司),TCS-SP5激光共聚焦显微镜(德国Leica公司),CFX96TM荧光定量PCR仪(美国Bio-Rad公司)。不同相成分的两组陶瓷材料:HA的成分为:纯相HA,BCP的成分为:双相比例HA/TCP=60/40(四川大学国家生物医学材料工程技术研究中心),α-MEM低糖培养基(美国Gibco公司),0.25%胰蛋白酶(美国Gibco公司),胎牛血清(美国Hyclone公司),tripsin 0.25% (1X)溶液(美国Hyclone公司),iScriptTMcDNA Synthesis kit(美国Bio-Rad公司),SsoFastTMEvaGreenSupermix(美国Bio-Rad公司)。
1.2 方法
1.2.1 细胞培养将家兔注射30 mg戊巴比托钠致死,用70%乙醇浸泡10 min,无菌条件下取胫骨和股骨,将其两端干骺端切除,显露骨髓腔,用含10%胎牛血清(FCS)的α-MEM培养基彻底冲洗骨髓腔,无菌注射器反复吹打冲出骨髓,使骨髓细胞充分分散制成单细胞悬液计数。加含10%FCS 的α-MEM培养基(含青霉素100 U/mL、链霉素100 U/mL),以2×105个/mL接种于培养皿(规格:Φ60,下同)中,置于5%CO2、37 ℃饱和湿度培养箱进行培养。细胞培养基每两天更换1次。待细胞铺满培养皿后吸去培养液采用0.25% 胰蛋白酶-0.01 %EDTA消化,以3×105个/mL细胞密度接种到培养皿中进行传代培养,取P3代细胞用于后续实验。
1.2.2 细胞接种陶瓷样品均加工为尺寸Φ=13 mm×2 mm的片材,经121 ℃水蒸气灭菌并干燥后,在无菌操作台上装入到24孔培养板内,每组材料3~5个平行样;取长势良好的P3代BMSCs,移去上层培养基,经胰酶消化后加少量培养基吹打均匀,用α-MEM培养基配成浓度为2×104个/mL的细胞悬液;再分别把混匀的细胞悬液按1mL/孔依次加入到各种材料中。培养板在超静台内静止30 min,然后置于37 ℃,5% CO2细胞培养箱内分别培养1、3、7、14 d,每2天更换一次培养液。
1.2.3 细胞增殖测定采用四唑盐比色试验(MTT)对不同材料表面的细胞增殖情况进行检测。采用24孔板进行实验,每组材料设计5个复孔,接种细胞共培养1、3、7 d后,向孔板内加入0.5 mg/mL MTT(200 μL/孔),37 ℃下孵育4 h后弃去上清液,用PBS轻柔冲洗后,将材料转移到新的24孔板内,加入二甲基亚砜振荡使蓝色结晶产物溶解,然后在酶标仪上于490 nm波长下测定溶液的吸光度。
1.2.4 细胞形态观察通过荧光素(fluorescein diacetate,FDA)和碘化丙碇(propidium iodide,PI)染色,激光共聚焦显微镜观察细胞在材料表面的形态和生长情况。采用24孔板进行实验,每组材料设计3个复孔,BMSCs与材料共培养1、3、7 d后,每种材料取出一片,用PBS 轻柔冲洗后,装入新的24孔板中。每孔中加入1 mL PBS溶液,以及FDA/PI各1 μL 进行染色,2 min后,在激光共聚焦显微镜下观察细胞的生长情况。
1.2.5 Real-time PCR检测采用24孔板进行实验,每组材料设计5个复孔,共培养3、7、14 d后,利用trizol提取每片材料上黏附细胞的总RNA,其操作步骤按照试剂盒中的说明书进行。将每种材料的3个平行样的总RNA收集在一起,利用iScriptcDNA Synthesis Kit将每种材料的1 mg RNA反转录为cDNA,PCR仪扩增。取等量的cDNA进行RT-qPCR反应以对成骨相关基因的表达进行分析。RT-qPCR在六色梯度实时定量PCR仪上进行,试剂盒为SsoFastTMEvaGreen®Supermix。本文中检测如下几个基因:碱性磷酸酶基因(alkalinephosphatase,ALP),骨形态发生蛋白基因(Bonemorphogeneticprotein2,BMP-2),骨唾液酸蛋白基因(Bonesialoprotein,BSP),转录因子Osterix和GAPDH基因,其引物序列见表1,由上海生工合成。各mRNA的表达水平表示为阈值(CT),用2-△△Ct值法来计算相对表达量,看家基因GAPDH的表达作为内参来归一化结果。
表1 PCR引物序列

基因名称 引物序列(5'-3')基因库序列号GAPDH上游ATCACTGCCAC-CCAGAAGACNM_001082253.1下游GTGAGTTTCCCGT-TCAGCTCBMP-2上游CTTGGAGGAGAAGCAAG-GTGNM_001082650下游AGTTACGAGCAAAGGCCT-GAALP上游TGGACCTCGTGGACATCTGENSOCUG00000004447下游CAGGAGTTCAGTGCGGTTCBSP上游AAACCACTGCCGCT-GAATATGENSOCUG00000001046下游TCCTGACCCTCGTAGCCCTCOsterix上游GCTGGTGTTTGCTCAGGT-GGENSOCUG00000003811下游CTTCTGTGGCAAGCGGT-TCA
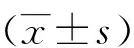
2 结果
2.1 细胞增殖情况 共培养1 d后,细胞在两种材料上的生长情况没有明显的差异。从第1天到第3天,BMSCs在HA上有较快的增殖,同它相比,在BCP上细胞的增殖较慢。从第3天到第7天,在BCP上的BMSCs表现出了较高的增殖速率,HA组的细胞虽然也在增殖,但增殖速率和1、3 d的相比已不及BCP组陶瓷材料(Plt;0.05)。总体看来,细胞在两种材料上都表现出了较快的增殖。

组间比较,*P lt; 0.05。 图1 体外共培养1、3、7 d后MSCs在不同材料表面的MTT结果
2.2 细胞形态观察 取同一培养时间的平行样进行细胞形态观察在细胞接种到材料上共培养1 d后,有部分细胞未贴壁而死亡,呈较小的圆形,被PI染料着色为红色(见图2B),随着培养时间的延长,细胞开始在材料表面增殖,照片中几乎找不到代表死细胞的红色亮点,BMSCs呈梭形、星形或完全铺展开来,绿色荧光显示出其良好的活力,说明两种材料都具有良好的生物相容性,到7 d后BCP组上生长的细胞明显比HA组铺展更开,细胞密度更大(见图2F),与2.1中结果相互应证。从照片中还可看出,随着培养时间的增加,两种材料上的活细胞数量都不断增加,这也显示出BMSCs在磷酸钙陶瓷的表面增殖情况非常好。
2.3 BMSCs成骨分化相关基因表达不同材料表面BMSCs体外培养3、7、14 d后成骨分化相关基因(BMP-2,ALP,BSP和Osterix)的表达结果如图3所示。从图3中可以看出,ALP在两中材料上均在3d时有一个较高水平的表达,随后下调并维持一个相对稳定的水平,且ALP在BCP上的表达水平均高于HA组(Plt; 0.05)(见图3A)。BMP-2在两种材料上的表达水平差别非常明显,三个时间点的结果均显示出BCP组远高于HA组的表达水平(Plt; 0.05)(见图3B)。BSP的表达与BMP-2有相似的变化趋势,BSP在BCP上的表达在3个时间点均远高于在HA上的表达(Plt; 0.05)(见图3C)。Osterix在两种材料上mRNA的表达变化趋势正好相反,在HA上是3 d时高表达,随后下调;而在BCP上则是7 d时表达下调,随后明显上调,14 d时表达水平明显高于3 d和7 d时的结果;在第14天时BCP组表达水平显著高于HA组(Plt; 0.05)(见图3D)。总体来说,4种成骨分化相关基因在BCP上的表达特别是在共培养的中后期阶段均高于HA组。

A、C、E为BMSCs与HA共培养,其中A:1 d;C:3 d;E:7 d。B、D、F为BMSCs与BCP共培养,其中B:1 d;D:3 d;F:7 d。图2 BMSCs分别与HA和BCP共培养后的激光共聚焦显微镜照片

A:ALP;B:BMP-2;C:BSP;D:Osterix,组间比较,* Plt;0.05。图3 BMSCs分别与HA和BCP共培养3、7、14 d后的成骨分化相关基因表达
3 讨论
研究证实,BMSCs在适宜的环境[10]下不仅可以分化为间充质组织,还可以分化成神经系统、上皮组织等[11-12],如何诱导干细胞定向分化是干细胞应用基础研究的重点方向之一。向成骨细胞分化是BMSCs的重要潜能,同样是骨组织诱导再生的基础,通过材料成分和结构等设计手段来有效刺激BMSCs向成骨细胞分化在骨再生和骨组织工程学中具有重要价值[1]。研究发现,BMSCs分化为成骨细胞一般要经过细胞增殖、细胞外基质成熟和基质矿化三个阶段。因此要使得BMSCs向成骨细胞分化,支架材料必须要能够促进细胞增殖,还要为细胞增殖提供一个合适的空间。在细胞增殖结果中,两种材料上BMSCs均有较快的增殖速率,尤其是从第3天到第7天的生长,激光共聚焦照片也证实了这一点,从照片中可以看到,第7天时细胞已经铺满整个孔隙表面,并逐渐向孔内生长,提示磷酸钙陶瓷材料良好的细胞相容性,为细胞后续的增殖分化奠定了良好的基础。
研究发现,BMSCs在向成骨细胞分化过程中表达多种特异性基因,如ALP、BMP-2、BSP和Osterix等。ALP是一种成骨细胞的功能性酶,在成熟的成骨细胞内高度表达,在钙盐沉积过程中起重要作用,其表达水平的高低是衡量BMSCs向成骨细胞分化的重要指标之一,通常被认为是成骨细胞分化的早期标志[13-15]。实验结果中ALP的表达在两组材料中的情况最大的区别是:在BCP组的细胞ALP表达水平均比HA组高,说明BMSCs对BCP陶瓷的反应十分迅速,细胞早期即进入分化阶段。骨形态发生蛋白基因BMP-2是另一种重要的成骨相关基因,具有刺激成骨的作用,它能诱导间充质干细胞分化为成骨细胞的前体细胞进而分化成成骨细胞,能增加ALP 的活性和胶原的合成[16]。本实验中BMP-2在HA组表达水平都不高,而在BCP组一开始就有较高表达水平,这说明了双相成分能积极促进BMSCs朝成骨方向分化;BCP组在早期就具有很高的表达量,说明BMP-2的调控机制已经启动,目前普遍认为BCP材料的骨诱导性高于HA,原因之一可能就是BCP调控细胞早期即进入分化阶段,这与ALP的结果提示相符。BSP是骨基质中主要的非胶原蛋白之一,主要表达于成熟成骨细胞,是成骨分化的晚期标志物[17]。本研究结果显示,BSP的表达趋势与BMP-2类似,BCP组在早期就具有很高的表达量,而且高表达水平一直持续到中后期,提示BCP不但调控细胞早期即进入分化阶段,且稳定持续促进骨细胞生成乃至骨形成。对于转录因子Osterix,研究结果显示,其在第14天时BCP材料上的BMSCs显著上调了Osterix的表达水平,是HA组表达水平的数倍,增强了干细胞的成骨分化能力[18-19]。因此,无论是BMSCs早期向成骨方向分化的启动,还是中晚期成骨分化的持续进行,BCP组都显示出更显著的诱导性,预示其良好骨诱导性的分子生物学机制。
综上所述,对诱导BMSCs向成骨分化的化学成分因素研究表明,BMSCs在BCP成分的多孔磷酸钙陶瓷上有较高的增殖速率和良好的细胞形态,对成骨相关基因表达的研究表明,BCP上调了BMSCs中关键性转录因子Osterix的表达,同时,各个阶段的ALP、BMP-2、BSP在BMSCs中的表达也在相应的时间点被增强,表明了BMSCs与磷酸钙陶瓷共培养后被诱导向成骨分化,且BCP比HA具有更快的体外诱导效果。
[1] Hong Y,Fan H,Li B,et al.Fabrication,biological effects,and medical applications of calcium phosphate nanoceramics[J].Materials Science and Engineering: R: Reports,2010,70(3):225-242.
[2] Dorozhkin S V.Calcium orthophosphates in nature,biology and medicine[J].Materials,2009,2(2):399-498.
[3] 庞婷婷,崔燎.骨髓基质干细胞成脂分化的调控及其对骨质疏松的影响[J].中国骨质疏松杂志,2007,13(9):675-680.
[4] 谢小伟,裴福兴,康鹏德,等.锶盐联合淫羊藿苷对大鼠骨髓基质干细胞成骨及成脂分化影响的研究[J].中国矫形外科杂志,2015,23(5):450-458.
[5] 周鑫,赵佳佳,陈莉莉.调节骨髓间充质干细胞成骨成脂分化的因素[J].中国组织工程研究,2017,21(17):2759-2765.
[6] Kasten P,Vogel J,Luginbühl R,et al.Ectopic bone formation associated with mesenchymal stem cells in a resorbable calcium deficient hydroxyapatite carrier[J].Biomaterials,2005,26(29):5879-5889.
[7] Moreau J L,Xu H H.Mesenchymal stem cell proliferation and differentiation on an injectable calcium phosphate-chitosan composite scaffold[J].Biomaterials,2009,30(14):2675-2682.
[8] Kotobuki N,Ioku K,Kawagoe D,et al.Observation of osteogenic differentiation cascade of living mesenchymal stem cells on transparent hydroxyapatite ceramics[J].Biomaterials,2005,26(7):779-785.
[9] 宋岳,林楷丰,何树,等.常温3D打印双相磷酸钙/聚乙烯醇复合支架的制备与体外成骨分化研究[J].中华创伤骨科杂志,2017,19(5):409-416.
[10]Das R K,Zouani O F.A review of the effects of the cell environment physicochemical nanoarchitecture on stem cell commitment[J].Biomaterials,2014,35(20):5278-5293.
[11]Bianco P,Riminucci M,Gronthos S,et al.Bone marrow stromal stem cells: nature,biology,and potential applications[J].Stem cells,2001,19(3):180-192.
[12]Oreffo R,Triffitt J.Future potentials for using osteogenic stem cells and biomaterials in orthopedics[J].Bone.1999,25(2):5S-9S.
[13]王晓东,虎松艳,王金枝,等.锶盐对高浓度地塞米松作用下大鼠成骨细胞的影响[J].中国骨质疏松杂志,2015,21(7):807-811.
[14]Lian J B,Stein G S.Concepts of osteoblast growth and differentiation: basis for modulation of bone cell development and tissue formation[J].Critical Reviews in Oral Biology amp;Medicine,1992,3(3):269-305.
[15]李家,林晓晟,王雅冰,等.续断皂苷Ⅵ对小鼠骨髓基质干细胞成骨分化的影响[J].口腔颌面修复学杂志,2017,18(1):28-32.
[16]Linkhart T A,Mohan S,Baylink D J.Growth factors for bone growth and repair: IGF,TGFβ and BMP[J].Bone,1996,19(1 Suppl):S1-S12.
[17]郭立达.骨髓基质干细胞的分离及骨唾液酸蛋白对其向成骨细胞分化的影响[D].广州:华南理工大学,2006.
[18]高建清,庄素新,黄小敬,等.淫羊藿对大鼠骨量及骨髓基质干细胞增殖、分化过程中Cbfa1和Osterix表达的影响[J].中华中医药学刊,2016(2):384-386.
[19]刘敏婕,刘朋飞,赵雷.麝香酮对人源骨髓间充质干细胞成骨分化的促进作用研究[J].中国实验诊断学,2016,20(7):1049-1053.
[收稿2017-05-17;修回2017-07-21]
(编辑:谭秀荣)
Effectsofdifferentcalciumphosphateceramicsonproliferationandosteogenicdifferentiationrelatedgeneexpressionofrabbitbonemarrowstromalcells
WangZhe1,AoJun2,ZhaoYanyu1,ZhangZhimin1,WuMingsong1,3,LiXueying1
(1.Department of Medical Genetics,Zunyi Medical University,Zunyi Guizhou 563099,China; 2.Department of Orthopaedics,Affiliated Hospital of Zunyi Medical University,Zunyi Guizhou 563099,China; 3.Special Key Laboratory of Oral Diseases Research,Higher Education Institutions of Guizhou Province,Research Center of Medicine and Biology,Zunyi Medical University,Zunyi Guizhou 563099,China)
ObjectiveTo compare the effects of different components of calcium phosphate ceramics on proliferation and osteogenic differentiation of rabbit bone marrow stromal cells (BMSCs).MethodsThe calcium phosphate ceramics with different phases were divided into two groups,BMSCs were isolated and cultured with ceramics.Cell proliferation was detected at day 1,3 and 7 and cell morphology was observed by FDA/PI staining.Real-time PCR was applied to detect the changes of expressions of alkaline phosphatase (ALP),bone morphogenetic protein (BMP-2),bone sialoprotein (BSP) and transcription factorOsterixat day 3,7 and 14.ResultsAfter 7 days of co-culture,BMSCs on two kinds of materials had good morphology and wellproliferation.At 14d of co-culture,the mRNA expression ofALP,BMP-2,BSPandOsterixinbiphasic calcium phosphate ceramics group were significantly higher than those in HA group (Plt; 0.05).ConclusionBoth BCP and HA could promote the proliferation and osteogenic differentiation of BMSCs.The osteogenic differentiation ability of BCP is superior to that of HA to indicate its osteoinductive activityinvitro.
Calcium phosphate ceramics; bone marrow stromal cell; osteogenic differentiation
遵义医学院博士启动基金资助项目(NO:F-703);遵义医学院基础-临床合作项目(NO:F-790)。
李学英,女,硕士,教授,研究方向:肿瘤分子生物学,E-mail:leexueying4722@163.com。
R318.08
A
1000-2715(2017)05-0510-06

