丙酮醛对人肾近端小管上皮细胞损伤的作用及机制
陈燕玲,罗 婷,吴秀香,曾洪敏,李海洲,康 毅,庄晓东,凡 栋,王晓玲,黄霜枝
(1.遵义医学院珠海校区 病理生理学教研室,广东 珠海 519041; 2.中山大学附属第一医院 心血管内科,广东 广州 510080)
丙酮醛对人肾近端小管上皮细胞损伤的作用及机制
陈燕玲1,罗 婷1,吴秀香1,曾洪敏1,李海洲1,康 毅1,庄晓东2,凡 栋1,王晓玲1,黄霜枝1
(1.遵义医学院珠海校区 病理生理学教研室,广东 珠海 519041; 2.中山大学附属第一医院 心血管内科,广东 广州 510080)
目的探讨丙酮醛对人肾近端小管上皮细胞(HK-2细胞)损伤的作用及可能机制。方法采用不同浓度的丙酮醛(100、200、400、800、1 600 μmol/L)处理HK-2细胞24 h后,应用CCK-8法检测HK-2细胞的存活率;罗丹明123染色法检测细胞线粒体膜电位;DAPI染色法观察HK-2细胞凋亡形态学变化。Western blot法检测HK-2细胞内磷酸化ERK1/2(phosphated ERK1/2,p-ERK1/2) 、Bax及cleaved- caspase-3蛋白表达水平。结果与对照组相比,不同的浓度的丙酮醛均能降低HK-2细胞存活率(Plt;0.01);且HK-2细胞经丙酮醛诱导后cleaved-caspase-3(Plt;0.01)、Bax及p-ERK1/2蛋白表达水平均明显增高(Plt;0.05)。结论丙酮醛能诱导HK-2细胞出现明显的损伤及凋亡,其机制可能与其激活ERK1/2信号通路有关。
丙酮醛;凋亡;HK-2细胞;ERK1/2
糖尿病患者若血糖控制不理想,可导致多种并发症出现,其中最常见的慢性并发症为糖尿病肾病(Diabetic Nephropathy,DN)[1]。DN主要表现为高血压、蛋白尿和肾功能不全[2]。糖尿病肾病涉及多种复杂的发病机制,包括糖脂代谢异常、肾脏血流动力学改变、炎症物质及细胞因子的异常表达[3]。近年来,从糖代谢紊乱(糖基化终末产物的形成)角度探讨糖尿病肾病的发病机制越来越受到研究者的青睐[4]。丙酮醛(methylglyoxal,MG)作为糖基化终末产物的前体[5],是一种高活性的α-二羰基化合物,在糖尿病时明显升高,与多种糖尿病相关的组织细胞损伤密切相关,是糖尿病并发症发生的关键环节[6-7]。因此,本研究选用MG来观察其对HK-2细胞的直接影响,探讨糖尿病肾病时肾脏损伤的可能机制。
1 材料与方法
1.1 实验材料
1.1.1 细胞 HK-2细胞由中山大学中山医学院王蔚东教授馈赠。
1.1.2 药品与试剂 细胞培养相关试剂(胎牛血清、DMEM/F12培养基等)均购自Gibco;MG购自上海源叶生物科技有限公司,CCK-8细胞活力检测试剂盒购于同田生物有限公司;DAPI购自Sigma;p-ERK1/2抗体、Bax抗体、cleaved- caspase-3抗体及GAPDH抗体均购自Cell Signaling Technology(CST);BCA蛋白浓度检测试剂盒购自 Thermo Scientific Pierce。
1.1.3 主要仪器 蛋白电泳仪,Bio-Rad公司(型号:Mini-PROTEAN Tetra);荧光显微镜,OLYMPUS公司(型号:IX71)。
1.2 方法
1.2.1 细胞培养及实验分组 在DMEM/F12培养基中加入10%胎牛血清配置HK-2细胞完全培养基,将HK-2细胞放在37 ℃、5% CO2培养箱中培养,每隔2天进行细胞传代,取生长状态良好的HK-2细胞进行后续实验。实验分为control组及MG不同浓度处理组(100、200、400、800、1 600 μmol/L)。
1.2.2 MG对HK-2细胞存活率的影响 取生长状态良好的细胞,用胰酶消化,然后接种于96孔板,每孔加入100 μL 密度为2×108个/L的细胞悬液,每组设5个复孔。在显微镜下观察细胞长到约85%时,按照实验分组培养细胞24 h后,弃上清,用无血清培养基洗一次,然后每孔加入含10% CCK-8的无血清培养基100 μL,于37℃孵育1.5 h,酶标仪测定450 nm处吸光度值(OD值),按照以下公式计算细胞存活率:细胞存活率(%)=(处理组OD值-空白孔OD值)/(对照组OD值-空白孔OD值)×100%。以上实验重复3次。
1.2.3 HK-2细胞内线粒体膜电位(MMP)的检测 HK-2细胞按3×107个/L的细胞密度均匀接种于6孔培养板内,按照实验分组培养细胞24 h后,弃培养基,PBS洗2遍,然后每孔加入1 mL终浓度为100 μg/L的罗丹明123,37 ℃恒温孵育20~30 min,在荧光显微镜下观察并随机选取8个不重复视野进行拍照。
1.2.4 DAPI染色法检测HK-2细胞凋亡 HK-2细胞按3×107个/L的细胞密度接种于6孔板后,按照实验分组培养细胞24h后,弃培养基,PBS洗2遍,加入4%多聚甲醛固定10min,PBS漂洗后,加入1μg/L DAPI试剂,室温避光孵育10 min后,弃染色液,每孔加入1mL PBS洗涤3次,每次5~10 min。然后在荧光显微镜下随机选取10个不重复视野进行拍照。正常细胞胞核呈现均匀的低密度蓝色荧光,而凋亡细胞胞核呈致密浓染或呈碎块状致密浓染。
1.2.5 Western blot 法检测凋亡相关蛋白(Bax及cleaved-caspase-3)和p-ERK1/2蛋白水平 HK-2细胞以2×106/L的密度接种于直径为60 mm培养皿中,当细胞生长至培养皿面积约85%时,按照实验分组培养细胞24 h后,弃培养基用预冷的PBS洗3次,加入RIPA细胞裂解液,冰上裂解20 min,然后用细胞刮把蛋白刮下来,13 255 g离心10 min后取上清,采用BCA蛋白定量试剂盒检测蛋白浓度。每组蛋白上样量为50 μg,电泳:恒压80 V 30 min,100 V 70 min。电转:恒流 220 mA 1.5 h。PVDF膜用5%脱脂牛奶溶液室温封闭1 h,随后分别加入Bax、cleaved-caspase-3和p-ERK1/2抗体(I抗滴度均为1∶1 000),4 ℃摇床孵育过夜。I抗孵育完毕后,加入Ⅱ抗孵育1 h(Ⅱ抗稀释倍数为1∶2 000),然后用TBST洗3次,每次5 min。在暗室经曝光、显影及定影后,胶片上目的条带的灰度值使用ImageJ软件进行分析。
2 结果
2.1 MG可明显降低HK-2细胞存活率 用不同浓度的MG(100、200、400、800、1 600 μmol/L)处理HK-2细胞24 h后,CCK-8法检测细胞活力。如图1所示,与control组相比,不同浓度的MG均可以降低HK-2细胞细胞活力(Plt;0.01),当MG浓度达到800 μmol/L时,细胞活力约只有control组的40%。
2.2 MG对HK-2细胞凋亡的影响 HK-2细胞经不同浓度的MG(100、200、400、800、1 600 μmol/L)处理24 h后,采用DAPI核染色法检测HK-2细胞凋亡情况。正常的HK-2细胞胞核呈现均匀的低密度蓝色荧光。如图2所示,未经处理MG处理的control组细胞胞核呈圆形,并显示均匀的蓝色低密度荧光。而使用MG处理后,部分细胞胞核出现核固缩或核分裂等典型凋亡特征,说明HK-2细胞经MG诱导后发生明显凋亡。

**:与control组相比图1 不同浓度的MG对HK-2细胞细胞活力的影响

白色箭头所指为发生凋亡的细胞。图2 MG对HK-2细胞凋亡的影响(200×)
2.3 MG对HK-2细胞线粒体膜电位的影响 用不同浓度的MG处理HK-2细胞24 h后,采用罗丹明123检测细胞线粒体膜电位。罗丹明123是一种可以显示线粒体跨膜电位高低的荧光染料,被广泛用于线粒体膜电位的检测。细胞加入罗丹明123孵育后会发出黄绿色荧光,荧光强度越强,代表细胞线粒体膜电位越高,细胞状态越好,反之,荧光强度越低,则线粒体膜电位越低。如图3所示,在荧光显微镜下观察,control组细胞可见较强的黄绿色荧光,而不同浓度的MG处理组,荧光强度均较control组明显降低,说明MG可以降低HK-2细胞线粒体膜电位。
2.4 MG对HK-2细胞Bax蛋白表达的影响 HK-2细胞经不同浓度的MG(100、200、400、800、1 600 μmol/L)处理24 h后,采用Western blot法检测细胞Bax蛋白表达水平。如图4所示,control组的Bax蛋白也有基础量的表达,而加入不同浓度MG处理后,Bax蛋白表达水平明显增高(Plt;0.05),说明MG可以诱导Bax蛋白表达。
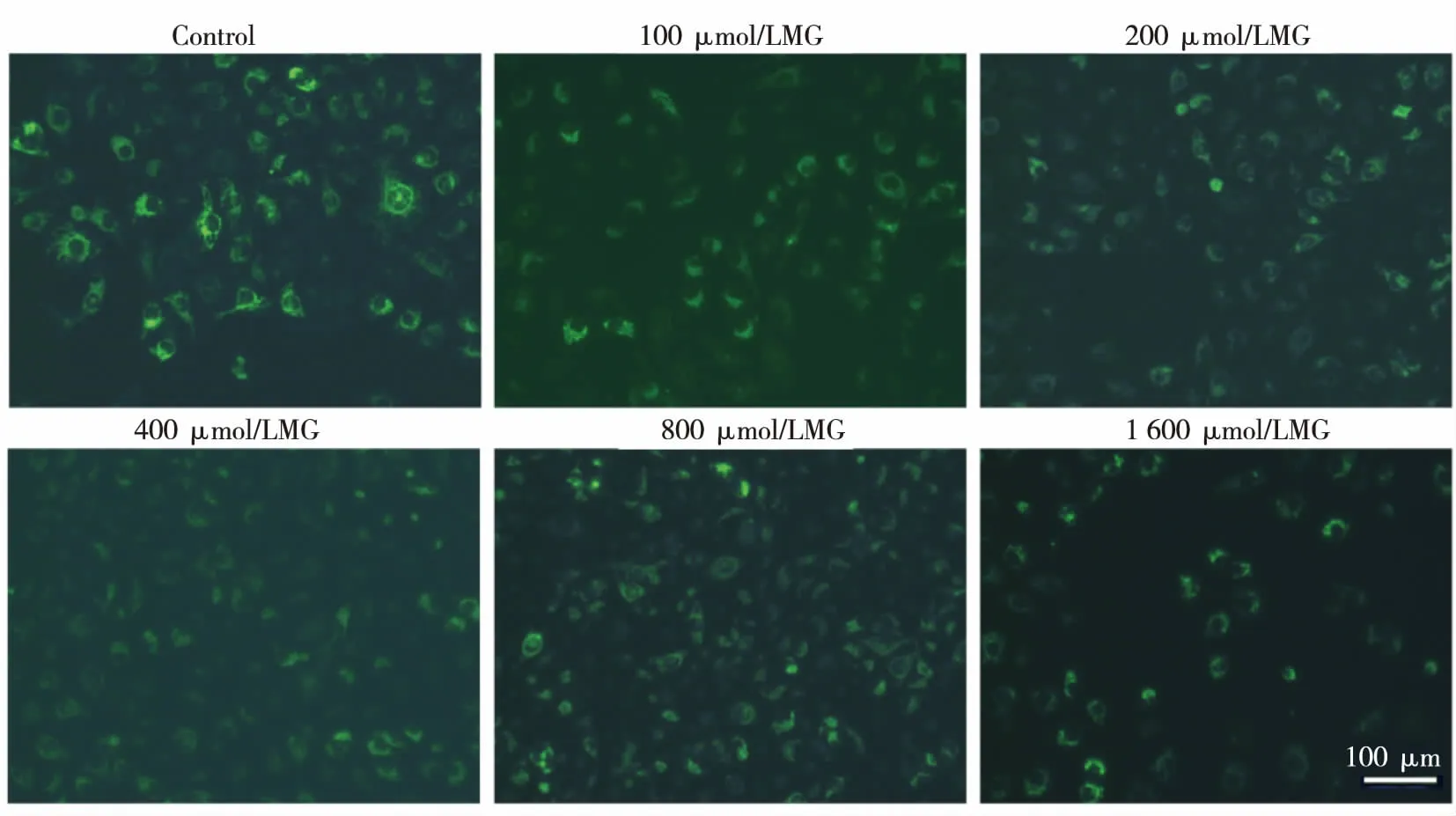
图3 MG对HK-2细胞线粒体膜电位的影响(200×)
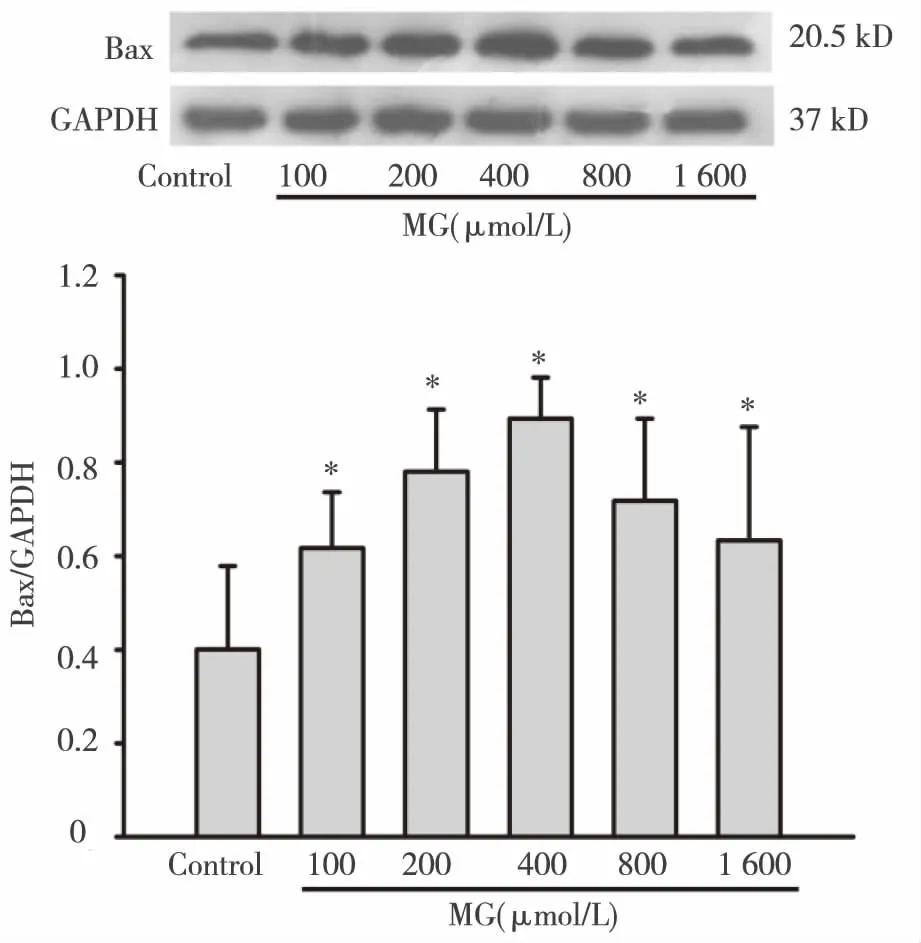
*:与control组相比图4 MG对HK-2细胞Bax蛋白表达的影响
2.5 MG对HK-2细胞cleaved-caspase-3蛋白表达的影响 如图5所示,control组仅有少量cleaved-caspase-3蛋白表达,而经不同浓度的MG处理后,cleaved-caspase-3蛋白的表达水平均明显增高(Plt;0.01)。
2.6 MG对HK-2细胞p-ERK1/2蛋白表达的影响 如图6所示,control组HK-2细胞仅有少量的p-ERK1/2蛋白表达,而经不同浓度的MG处理后,p-ERK1/2蛋白表达水平明显增加(Plt;0.05),表达量约为control组的1.5倍,说明MG可以激活ERK1/2信号通路。
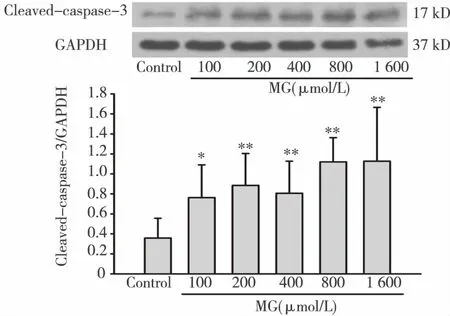
**:与control组相比,Plt;0.01;*:与control组相比 图5 MG对HK-2细胞cleaved-caspase-3蛋白表达的影响
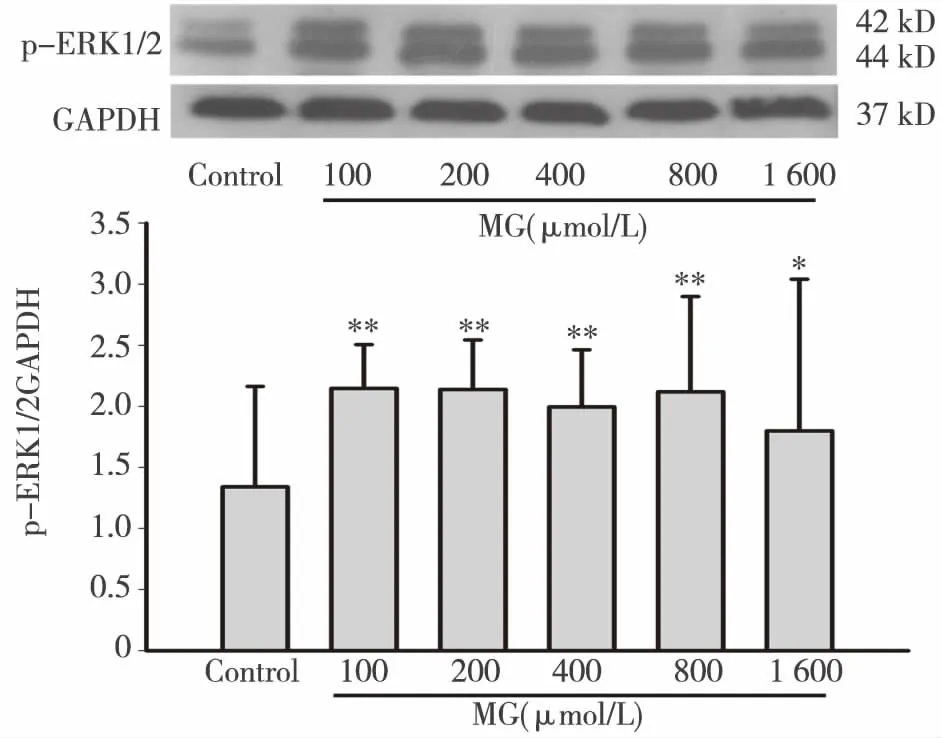
**:与control组相比,Plt;0.01;*:与control组相比图6 MG对HK-2细胞p-ERK1/2蛋白表达的影响
3 讨论
研究报道,糖基化终产物(advanced glycation end products,AGEs)可上调HK-2细胞ROS的水平及TGF-β mRNA及蛋白表达,促进糖尿病肾病的发生、发展[8]。MG作为AGEs的前体,具有快速生成AGEs的生物特性,是糖尿病组织细胞损伤的核心环节[9]。正常人体内MG水平很低,而糖尿病患者体内含量明显增高,1型糖尿病患者血清MG水平甚至可高达40.0μg/dL[10]。以往的研究认为糖尿病肾病的主要发病机制是肾小球损伤,所以关于MG的研究多数是与肾系膜细胞有关,对HK-2细胞影响研究甚少。而近年来研究发现,在糖尿病肾病中肾小管损伤可能早于肾小球损伤,且肾小管损伤在早期糖尿病肾病的形成中具有重要作用[11]。因此,研究MG对HK-2细胞的作用具有重要意义,可以为糖尿病肾病的发病机制提供实验依据。本研究结果显示,加入MG处理以后,HK-2细胞的存活率明显降低,而凋亡细胞数明显增加。提示MG对HK-2细胞具有毒性作用,可以诱导HK-2细胞发生明显损伤及凋亡。
经典的凋亡通路有2条,包括表面死亡受体通路和线粒体介导的内源性凋亡通路。由线粒体介导的凋亡通路是哺乳类动物发生凋亡的主要途径。细胞在受到凋亡信号刺激时,可引起线粒体通透性增高,跨膜电位(ΔΨm)被驱散,最终导致细胞凋亡的发生。在凋亡的发生中,还有两大家族的参与:Bcl-2家族及caspase家族。Bcl-2家族分为抑制凋亡和促进凋亡蛋白两大类。多种因素可以影响Bax和Bcl-2蛋白的表达,下调Bcl-2或上调Bax可以促进细胞凋亡。Caspase家族在凋亡中也具有重要作用,其中caspase-3是其家族中最重要的效应性蛋白裂解酶。正常情况下,在细胞质中的caspase-3是以酶原的形式存在的,当细胞接受凋亡刺激时,caspase-3被剪切成cleaved-caspase-3从而被激活,活化的caspase-3分子可以催化裂解众多的效应分子,最终诱发细胞凋亡[12]。本研究显示,HK-2细胞经MG处理后,线粒体膜电位明显降低,而Bax及cleaved-caspase-3蛋白表达水平明显增高,说明MG可能通过线粒体介导的内源性凋亡通路诱发细胞凋亡的。
MAPK是一丝/苏氨酸蛋白激酶家族,由ERK1/2、P38及JNK组成。其中ERK1/2是MAPK中的重要成员,与细胞凋亡有密切关系,其活性状态取决于磷酸化水平[13-15]。研究报道,MG通过激活p38及JNK通路介导肾系膜细胞及心肌细胞损伤,说明MG造成细胞的损伤与MAPK通路密切相关[16-17]。本研究显示,加入MG处理HK-2细胞24 h后,细胞内p-ERK1/2蛋白表达水平均比对照组增高,提示MG对HK-2细胞的损伤作用可能与其激活ERK1/2信号通路有关。
综上所述,MG可以诱导HK-2细胞发生凋亡,该作用与其降低细胞线粒体膜电位,增加Bax、cleaved-caspase-3蛋白表达及激活ERK1/2信号通路有关。因此,我们认为糖尿病肾病中肾小管损伤可能与MG有关。
[1] 王雪梅,高琳,王小春,等.血脂异常及凝血功能障碍与糖尿病肾病的关系研究[J].遵义医学院学报,2010,33(4):346-347.
[2] Eboh C,Chowdhury T A.Management of diabetic renal disease[J].Ann Transl Med,2015,3(11):154.
[3] Yamagishi S,Fukami K,Ueda S,et al.Molecular mechanisms of diabetic nephropathy and its therapeutic intervention[J].Curr Drug Targets,2007,8(8):952-959.
[4] Beisswenger P J.Methylglyoxal in diabetes:link to treatment,glycaemic control and biomarkers of complications[J].Biochem Soc Trans,2014,42(2):450-456.
[5] Singh J,Chaudhari B P,Kakkar P.Baicalin and chrysin mixture imparts cyto-protection against methylglyoxal induced cytotoxicity and diabetic tubular injury by modulating RAGE,oxidative stress and inflammation[J].Environ Toxicol Pharmacol,2017,50(4):67-75.
[6] Jensen T M,Vistisen D,Fleming T,et al.Methylglyoxal is associated with changes in kidney function among individuals with screen-detected Type 2 diabetes mellitus[J].Diabet Med,2016,33(12):1625-1631.
[7] Beisswenger P J,Howell S K,Russell G.Bearly progression of diabetic nephropathy correlates with methyglyoxal derived adcanced glycation end products[J].Diabetes Care,2013,36(10):3234-3239.
[8] Yamagishi S,Inagaki Y,Okamoto T,et al.Advanced glycation end products inhibit de novo protein synthesis and induce TGF-beta overexpression in proximal tubular cells[J].Kidney Int,2003,63(2):464-473.
[9] Ramasamy R,Yan S F,Schmidt A M.Methylglyoxal comes of AGE[J].Cell,2006,124(2):258-260.
[10]McLellan A C,Thornalley P J,Benn J,et al.Glyoxalase system in clinical diabetes mellitus and corelation with diabetic complications[J].Clin Sci (Lond),1994,87(1):21-29.
[11]刘爱东,王箐,田琳,等.外源性硫化氢对高糖诱导的肾小管上皮细胞凋亡的影响[J].遵义医学院学报,2017,40(3):264-267.
[12]赵瑞杰,李引乾,王会,等.Caspase家族与细胞凋亡的关系[J].中国畜牧杂志,2010,46(17):67-72.
[13]Zhou C H,Zhu Y Z,Zhao P P,et al.Propofol inhibits lipopolysaccharide-induced inflammatory responses in spinal astrocytes via the toll-like receptor 4/myD88-dependent nuclear factor-kappaB,extracellular signal-regulated protein kinases1/2,and p38 mitogen-activated protein kinase pathways[J].Anesth Analg,2015,120(6):1361-1368.
[14]Liu S,Sun J Y,Ren L P,et al.Propofol attenuates intermittent hypoxia induced up-regulation of proinflammatory cytokines in microglia through inhibiting the activation of NF-Bκ/p38 MAPK signalling[J].Folia Neuropathol,2017,55 (2):124-131.
[15]徐洋,李强,侯化化,等.异钩藤碱通过下调CaN、ERK2和上调MKP-1的表达抑制大鼠心肌细胞肥大[J].遵义医学院学报,2013,36(3):210-213.
[16]董小变,吴娟,庄晓东,等.N-乙酰半胱氨酸对抗丙酮醛引起的心肌细胞损伤[J].中国病理生理杂志,2016,32(3):398-404.
[17]Fukunaga M,Miyata S,Higo S,et al.Methylglyoxal induces apoptosis through oxidative stress-mediated activation of p38 mitogen-activated protein kinase in rat Schwann cells[J].Ann N Y Acad Sci,2005,1043(6):151-157.
[收稿2017-04-27;修回2017-06-28]
(编辑:谭秀荣)
临床医学研究
Effectsofmethylglyoxalontheinjuryofhumantubuleepithelialcellsanditsmechanisms
ChenYanling1,LuoTing1,WuXiuxiang1,ZengHongmin1,LiHaizhou1,KangYi1,ZhuangXiaodong2,FanDong1,WangXiaoling1,HuangShuangzhi1
(1.Department of Pathophysiology,Zhuhai Campus of Zunyi Medical University,Zhuhai Guangdong 519041,China; 2.Department of Cardiovasology,the First Affiliated Hospital of Sun Yat-sen University,Guangzhou Guangdong 510080,China )
ObjectiveTo investigate the effects of different concentrations of methylglyoxal on the injury of human tubule epithelial cells (HK-2 cells) and its mechanisms.MethodsHK-2 cells were incubated with different concentrations of methylglyoxal (100,200,400,800 and 1 600 μmol/L) for 24 h.Cell viability was evaluated by CCK-8 assay.Mitochondrial membrane potential was detected by rhodamine-123.The morphological changes in apoptotic cells were measured by DAPI.The expression of cleaved caspase-3,Bax and p-ERK was detected by western blot assay.ResultsCCk-8 assay showed that methylglyoxal significantly decreased the viability of HK-2 cells in a dose-dependent manner (Plt;0.01).Also,methylglyoxal reduced mitochondrial membrane potential in HK-2 cells.In addition,the expressions of cleaved caspase-3,Bax and p-ERK1/2 were up-regulated by methylglyoxal (Plt;0.05).ConclusionMethylglyoxal induces significant injury and apoptosis in HK-2 cells.The underlying mechanism might be involved in the activation of ERK1/2 signaling pathway.
Methylglyoxal; apoptosis; HK-2 cells; ERK1/2
国家自然科学基金资助项目(NO:81560133);贵州省科技合作计划项目(NO:黔科合LH字[2015]7529);遵义医学院博士科研启动基金(NO:F-711)。
庄晓东,男,博士,研究方向:肾脏疾病的发病机制及药物防治,E-mail:kangfuyanling@126.com。
R691.6
A
1000-2715(2017)05-0526-05

