锌胁迫对黑水虻幼虫抗氧化酶活性和血细胞凋亡率的影响
冯 群,廖 业,方 旭,杜联峰,陈 阳,夏 嫱
(遵义医学院珠海校区 免疫学教研室,广东 珠海 519041)
锌胁迫对黑水虻幼虫抗氧化酶活性和血细胞凋亡率的影响
冯 群,廖 业,方 旭,杜联峰,陈 阳,夏 嫱
(遵义医学院珠海校区 免疫学教研室,广东 珠海 519041)
目的探讨Zn2+长期胁迫对黑水虻幼虫血淋巴抗氧化酶和血细胞凋亡率的影响,为黑水虻幼虫在无害化处理粪便中的应用及其副产品的开发提供理论依据,同时丰富重金属对昆虫酶活性及凋亡率影响的研究内容。方法将不同浓度的Zn2+添加到人工饲料中,对黑水虻幼虫进行连续5代的胁迫。收集不同处理浓度第1、3、5代5龄末幼虫血淋巴,利用分光光度计测定GST、GST-Px活性及SOD活力,用流式细胞仪检测血细胞的凋亡率。结果第1、3、5代黑水虻幼虫血淋巴中GST及GSH-Px活性在75~300 mg/kg处理范围内随着Zn2+浓度的增加而升高,在600~1 200 mg/kg范围内则随Zn2+处理浓度的增加而降低;SOD活力在各浓度均随Zn2+增加而降低。随着胁迫世代增加,GSH-Px活性及SOD活力降低,GST活性升高,但GST活性在第1、5代的差异不显著。当Zn2+处理浓度增至600~1 200 mg/kg时,Zn2+胁迫显著诱导了血细胞的凋亡,且凋亡率随世代的增加而增加。结论Zn2+胁迫对黑水虻幼虫的抗氧化酶活性及血细胞凋亡率均有影响,并且随世代的增加而改变。
黑水虻;锌;酶活性;凋亡率
黑水虻(blacksoldierfly,Hermetiaillucens)属双翅目水虻科资源昆虫,广泛分布,其幼虫主要以腐烂的有机物、动物粪便和植物为食物来源,已被公认是可持续管理动物废物的一种有效方法[1-2]。研究发现,黑水虻幼虫集中取食粪便时,不仅可以减少粪便的堆积和臭气[3],还能减少粪便中大肠杆菌、沙门氏菌及寄生虫卵数量[4-5]。此外,黑水虻幼虫、预蛹和蛹中含有丰富的蛋白质、脂肪、氨基酸和微量元素[6-8],是目前经济价值较高的动物饲料来源[9]。因此,利用黑水虻幼虫进行粪便无害化处理是一条节约化、资源化的可循环道路。如今已有许多国家进行黑水虻无害化处理粪便系统的开发和应用[10],我国也进行了相应的研究和开发[11-13]。
随着对Zn的不断认识,饲料加Zn已成一种普遍现象,但过量的Zn会影响机体对其他元素的吸收利用,对饲养对象的存活构成重大威胁[14]。姚丽贤等通过对比实验发现猪饲料Zn2+含量严重超标[15-17],发现过量的Zn2+既可以影响昆虫的生长发育,还对其生理生化指标及免疫系统产生影响。吴海一研究Zn2+对扁额细首纽虫Cephalothrix simula抗氧化防御系统及脂质过氧化作用实验发现,高浓度Zn2+不仅影响扁额细首纽虫体内抗氧化酶GSH-Px(谷胱甘肽过氧化物酶)和SOD(超氧化物歧化酶)活性及脂质过氧化反应[18],还显著诱导斜纹夜蛾Spodoptera litura(Fabricius)幼虫血细胞的凋亡[19]。近年来,生物体内的抗氧化酶系统变化己被应用于评价和监测外源污染物的毒性效应[20]。目前为止,大多报道都涉及对昆虫抗氧化酶、生长发育的影响[21]。在重金属胁迫对昆虫血细胞凋亡以及凋亡与氧化应激两者之间的关系方面的研究鲜有报道。
本实验前期结果表明,超标的Zn2+可以在黑水虻体内累积且对其生长发育产生影响,然而,是否会对黑水虻幼虫的抗氧化能力及血细胞凋亡率产生影响,进而影响其免疫功能则是我们所关注的问题。
1 材料与方法
1.1 实验材料
1.1.1 实验昆虫 由珠海市现代农业发展中心提供。
1.1.2 主要仪器 UV752紫外可见分光光度计:上海佑科仪器仪表有限公司,电子分析天平(FA2004B):上海佑科仪器仪表有限公司,流式细胞仪(FACS Calibur):美国Becton Dickinson公司,台式高速冷冻离心机、台式低速离心机(SC-3610):安徽中科中佳科学仪器有限公司。
1.1.3 主要试剂 ZnSO4·7H2O:天津市大茂化学试剂厂,分析纯,GST(谷胱甘肽S-转移酶)检测试剂盒、GSH-Px检测试剂盒、SOD检测试剂盒:南京建成科技有限公司,Annexin -V/PI 凋亡检测试剂盒:Invitrogen。
1.2 试验方法
1.2.1 Zn2+胁迫下黑水虻实验种群的建立及血淋巴的制备 参照夏嫱等[22]报道的方法,在幼虫人工饲料中添加不同浓度Zn2+(75 mg/kg、150 mg/kg、300 mg/kg、600 mg/kg、1 200 mg/kg),对黑水虻实验种群进行连续5代胁迫,以不添加Zn2+饲料所饲养的黑水虻幼虫为对照组(记为0 mg/kg)。
取不同浓度Zn2+胁迫下大小相同、长势均一的第1、3、5代5龄末黑水虻幼虫各50只,用双蒸水洗去虫体表面残余饲料,酒精棉球消毒虫体,眼科剪剪掉头部,用毛细吸管自头部断面处吸取血淋巴,将采集的各世代、各处理浓度下的血淋巴分别放入预先置于冰上加有苯基硫脲的Eppendorf 管中混匀,于4 ℃离心力750 g条件下离心5 min,取上清液。
1.2.2 不同浓度Zn2+胁迫对第1、3、5代黑水虻幼虫血淋巴抗氧化酶活性的影响 按照GST、GST-Px及SOD(U/mL)试剂盒说明书配制试剂,取1.2.2中的血淋巴上清液,按相应试剂盒的上样量要求上样,利用分光光度计法分别于波长412 nm和550 nm处测定各管A值,每个处理3个重复,取平均值代入各酶活力的计算公式,得结果作图。
1.2.3 不同浓度Zn2+胁迫对第1、3、5代黑水虻幼虫血细胞凋亡率的影响 同样取1.2.1来源的血淋巴,在Eppendorf 管中加入1 mL PBS重悬细胞,于离心力80 g离心5 min,使血细胞沉淀后弃上清,留300 μL液体,加入200 μL结合液重悬细胞后,加入5 μL Annexin-v吹匀,室温避光10 min,再加入5 μL PI室温避光5 min。以正常单染的细胞为对照组,正常未染的细胞为空白对照,利用流式细胞仪在波长488 nm下检测凋亡率,每个处理3个重复。
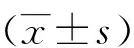
2 结果
2.1 不同浓度Zn2+胁迫对第1、3、5代黑水虻幼虫血淋巴抗氧化酶活性的影响
2.1.1 不同浓度Zn2+胁迫对GST活性的影响 不同浓度Zn2+胁迫对第1、3、5代黑水虻幼虫血淋巴中GST活性影响及方差分析见图1。第1、3、5代黑水虻幼虫血淋巴中GST活性均在75~300 mg/kg处理范围内随Zn2+浓度的增加而增加,且随世代增加而升高,处理浓度增至300 mg/kg时GST活性最高,与对照组活性相比显著增加(Plt;0.01);在600~1 200 mg/kg处理范围内GST活性随Zn2+胁迫浓度的增加而降低,当胁迫浓度为1 200 mg/kg时,各世代GST活性与对照相比均显著降低(Plt;0.05),且1 200 mg/kg Zn2+处理组中,第3代黑水虻幼虫血淋巴中GST活性高于第1、5代,但第1、5代相同浓度处理下GST活性无明显差异(Pgt;0.05)。
同一世代折线图上不同的小写字母表示同一世代不同处理组间差异显著(Plt;0.01);同一浓度处理组折线图上不同大写字母表示不同世代间差异显著(Plt;0.05)。

图1 不同浓度Zn2+胁迫下第1、3、5代黑水虻幼虫血淋巴中GST活性变化
2.1.2 不同浓度Zn2+胁迫对GSH-Px活性的影响 不同浓度Zn2+胁迫对第1、3、5代黑水虻幼虫血淋巴中GSH-Px活性影响及方差分析见图2。第1、3、5代黑水虻幼虫血淋巴中GSH-Px活性均在75~300 mg/kg处理范围内随Zn2+浓度的增加而增加,处理浓度至300 mg/kg时GSH-Px活性最高,且与对照组活性相比显著增加(Plt;0.01);在600~1 200 mg/kg处理范围内GSH-Px活性随Zn2+胁迫浓度的增加而降低,各世代GSH-Px活性与对照相比均显著降低(Plt;0.05)。第5代黑水虻幼虫血淋巴中GSH-Px活性均显著低于第1、3代在相同处理浓度下GSH-Px的活性(Plt;0.05)。
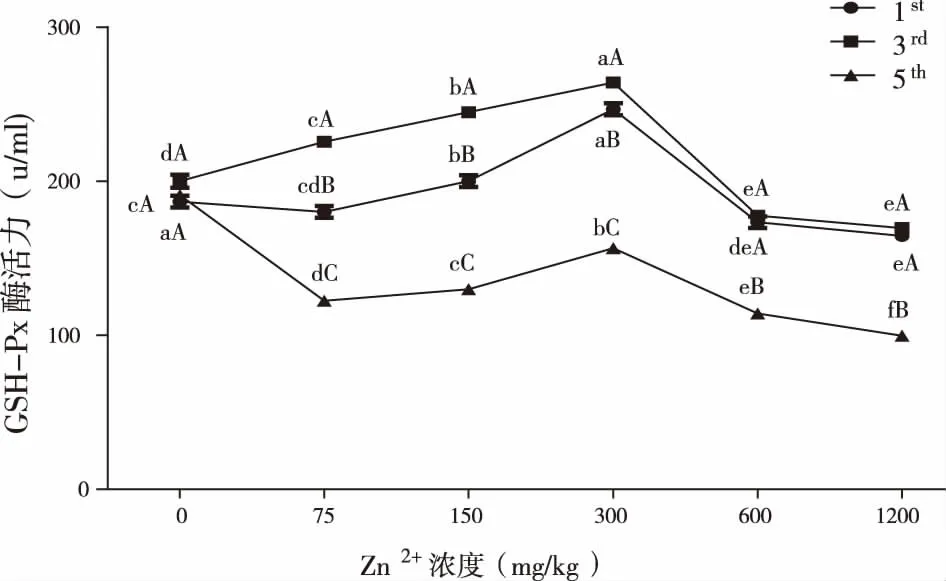
同一世代折线图上不同的小写字母表示同一世代不同处理组间差异显著(Plt;0.01);同一浓度处理组折线图上不同大写字母表示不同世代间差异显著(P lt;0.05)。 图2 不同浓度Zn2+胁迫下第1、3、5代黑水虻幼虫血淋巴中GSH-Px活性变化
2.1.3 不同浓度Zn2+胁迫对SOD活性的影响 不同浓度Zn2+胁迫对第1、3、5代黑水虻幼虫血淋巴中SOD活力影响及方差分析见图3。第1、3、5代黑水虻幼虫血淋巴中SOD活力随Zn2+浓度的增加而减弱,且随世代增加SOD活力下降。在75~300 mg/kg Zn2+处理浓度下第1、3代黑水虻幼虫血淋巴SOD活力显著高于对照组;在600 mg/kg以上处理浓度时各世代幼虫血淋巴中SOD活力均低于对照组。这趋势随世代增加而越明显,即第5代黑水虻幼虫血淋巴中SOD活力在各个浓度的Zn2+胁迫下均显著低于第1、3代幼虫血淋巴中SOD活力(Plt;0.01)。
2.2 不同浓度Zn2+胁迫对血细胞凋亡率的影响 不同浓度Zn2+胁迫对第1、3、5代黑水虻幼虫血细胞的凋亡率影响及方差分析见表1和图4~6。第1代黑水虻幼虫血细胞在75~300 mg/kg Zn2+处理浓度下的凋亡率变化不显著,且第3、5代血细胞凋亡率变化没有明显规律性;在600~1 200 mg/kg Zn2+胁迫下显著诱导了第1、3、5代黑水虻幼虫血细胞的凋亡,且其凋亡率显著高于对照组(Plt; 0.01)。随胁迫世代增加至第5代,除300 mg/kg处理浓度外,其他处理组的凋亡率均显著高于第1、3代血细胞凋亡率(Plt;0.05)。

同一世代折线图上不同的小写字母表示同一世代不同处理组间差异显著(Plt;0.01);同一浓度处理组折线图上不同大写字母表示不同世代间差异显著(Plt;0.05)。 图3 不同浓度Zn2+胁迫下第1、3、5代黑水虻幼虫血淋巴中SOD活力变化
表1不同浓度Zn2+胁迫对第1、3、5代黑水虻幼虫血细胞凋亡率的影响

处理浓度(mg/kg)血细胞凋亡率(x±s)%第1代第3代第5代03.64±0.17cA3.50±0.23eA3.96±0.64eA754.01±0.14cC5.87±0.62cB7.26±0.85cA1503.21±0.27cC4.71±0.34dB6.79±0.93cdA3002.68±0.19dB4.11±0.35deA4.79±0.46deA6006.13±0.29bC8.11±1.10bB12.09±0.65bA12007.88±0.53aB9.85±0.45aB14.83±2.36aA
表中同一列平均数后不同小写字母表示不同处理组间存在显著差异;其中,第1代,F=140.553,Plt;0.01;第3代,F=53.168,Plt;0.01;第5代,F=40.537,Plt;0.01。表中同一行平均数后不同大写字母表示不同世代间存在显著差异;其中,0 mg/kg:F=1.044,Pgt;0.05;75 mg/kg:F=21.648,Plt;0.01;150 mg/kg:F=28.330,Plt;0.01;300 mg/kg:F=28.906,Plt;0.01;600 mg/kg:F=48.772,Plt;0.01;1 200 mg/kg:F=19.115,Plt;0.01。

A:0 mg/kg; B:75 mg/kg; C:150 mg/kg; D:300 mg/kg; E:600 mg/kg; F:1 200 mg/kg,X轴为Annexin-V染色细胞数,Y轴为PI染色细胞数;左上象限:机械损伤细胞;右上象限:晚期凋亡及坏死细胞;左下象限:正常细胞;右下象限:早期凋亡细胞(下同)。图4 不同浓度Zn2+胁迫下第1代黑水虻幼虫血细胞凋亡流式分析图

A:0 mg/kg; B:75 mg/kg; C:150 mg/kg; D:300 mg/kg; E:600 mg/kg; F:1 200 mg/kg。图5 不同浓度Zn2+胁迫下第3代黑水虻幼虫血细胞凋亡流式分析图

A:0 mg/kg; B:75 mg/kg; C:150 mg/kg; D:300 mg/kg; E:600 mg/kg; F:1 200 mg/kg。图6 不同浓度Zn2+胁迫下第5代黑水虻幼虫血细胞凋亡流式分析图
3 讨论
本文研究的抗氧化酶GST、GSH-Px和SOD是清除自由基的关键酶类,其活性高低可反映细胞中过氧化物的多少及膜脂质过氧化程度[23],是预警有毒物质对生物体损害的敏感性生物标志物。结果表明,GST活性在不同浓度Zn2+胁迫下的变化趋势不同,低浓度(75~300mg/kg)胁迫升高,高浓度(600~1200mg/kg)胁迫降低,与Pb2+暴露对家蚕组织GST活性的影响相一致[24],可能机制即低浓度胁迫时昆虫机体启动了抗氧化防御保护系统,而高浓度则导致拒食,亦或高浓度胁迫产生过剩的自由基损害机体;GSH-Px是一种含硒的抗氧化酶,变化趋势与GST相同,不过在低浓度酶活性的升高还可能与GST联合清除自由基有关,缓解氧化胁迫对机体的损伤,实现解毒功能,而高浓度Zn2+胁迫造成黑水虻幼虫组织不可逆损伤,随着胁迫时间和浓度的累积,导致酶GSH-Px活性降低,由此可看出,GSH-Px具有预示组织受损严重程度的潜力;金属酶SOD对金属胁迫十分敏感,与CAT(过氧化物酶)协作构成生物体抵御逆境的第一道防线[25],参与机体免疫功能的调节,此外,其细胞内外的数量变化还与氧化应激相关的疾病密切相关。本文SOD活力与Zn2+浓度变化呈负相关,机制与高浓度作用下的GSH-Px变化类似,结果与高浓度污染物对蚯蚓[26]和果蝇[27]的报道一致。但与刘佳等[28]报道称Zn2+能促进抗氧化保护的结果不相符,可能与昆虫的类型和发育阶段及性别差异有关。
重金属的种类及价态的具有多样性,诱导细胞凋亡的机制非常复杂,本研究中高浓度Zn2+胁迫显著诱导了黑水虻幼虫血细胞的凋亡,机理可能如刘晓华等[29]所报道:即活性氧主要产生于线粒体,当生物体内氧化还原平衡一旦被打破,线粒体功能异常,产生更多的氧自由基,反过来又会加重线粒体、酶、膜脂质损伤,使线粒体释放细胞色素c(Cytc)进入胞浆,从而启动线粒体参与细胞凋亡通路介导细胞凋亡,表明抗氧化能力的减弱能促进细胞的凋亡。当然,其他机制如DNA的直接破坏、MARKs通路的激活等也可能参与其中,但具体过程还需深入研究。
综上所述,高浓度Zn2+长期胁迫影响了黑水虻幼虫抗氧化防御系统和血细胞凋亡率,且随世代变化而变化,间接影响黑水虻无害化处理粪便系统和副产品的研发,同时,就重金属严重污染的现状给了人们一个重要的提示。
[1] Cullere M,Tasoniero G,Giaccone V,et al.Black soldier fly as dietary protein source for broiler quails:apparent digestibility,excreta microbial load,feed choice,performance,carcass and meat traits[J].Animal :an International Journal of Animal Bioscience,2016,10(12):1923-1930.
[2] Zhou F,Tomberlin J K,Zheng L,et al.Developmental and waste reduction plasticity of three black soldier fly strains (diptera:stratiomyidae) raised on different Livestock manures[J].Journal of Medical Entomology,2013,50(6):1224-1230.
[3] Nguyen T T,Tomberlin J K,Vanlaerhoven S.Ability of black soldier fly (diptera:stratiomyidae) larvae to recycle food waste[J].Environmental Entomology,2015,44(2):406-410.
[4] Cecilia L,Stefan D,Maria E M, et al. Faecal sludge management with the larvae of the black soldier fly (Hermetiaillucens)-From a hygiene aspect[J].Science of the Total Environment,2013,458-460:312-318.
[5] Lee Y S,Seo S H,Yoon S H,et al.Identification of a novel alkaline amylopullulanase from a gut metagenome of Hermetia illucens[J].International Journal of Biological Macromolecules,2016,82:514-521.
[6]Cammack J A,Tomberlin J K.The impact of diet protein and carbohydrate on select life-history traits of the black soldier fly hermetia illucens (L.) (diptera:stratiomyidae)[J].Insects,2017,8(2):2075-4450.
[7] Purschke B,Scheibelberger R,Axmann S,et al.Impact of substrate contamination with mycotoxins,heavy metals and pesticides on growth performance and composition of black soldier fly larvae (Hermetia illucens) for use in the feed and food value chain[J].Food Additives amp; Contaminants.Part A,Chemistry,analysis,control,exposure amp; risk assessment,2017,34(8):1410-1420.
[8] Lee C M,Lee Y S,Seo S H,et al.Screening and characterization of a novel cellulase gene from the gut microflora of Hermetia illucens using metagenomic library[J].Journal of Microbiology amp; Biotechnology,2014,24(9):1196-1206.
[9] 代春华,何荣海,张亦飞,等.资源昆虫黑水虻的利用与开发[J].科技展望,2017,27(9):74-75.
[10]Stefan D,Christian Z,Klement T.Conversion of organic material by black soldier fly larvae:establishing optimal feeding rates[J].Waste Management amp; Research,2009,27:603-610.
[11]Yu G,Cheng P,Chen Y,et al.Inoculating poultry manure with companion bacteria influences growth and development of black soldier fly (Diptera:Stratiomyidae) larvae[J].Environmental entomology,2011,40(1):30-35.
[12]李志刚,杨森,赖剑雄,等.海南兴隆地区黑水虻的人工繁育技术研究初报[J].热带农业科学,2011,31(6):28-30.
[13]喻国辉,杨紫红,夏嫱,等.肠道共生细菌预发酵鸡粪对黑水虻生长发育影响的研究[J].昆虫知识,2010,47(6):1123-1127.
[14]高竞铎,王改玲,赵玉玺,等.高锌饲料对小鼠消化道组织学结构的影响[J].黑龙江畜牧兽医,2016,(01):214-216.
[15]姚丽贤,黄连喜,蒋宗勇,等.动物饲料中砷、铜和锌调查及分析[J].环境科学,2013,4(2):732-739.
[16]姜萍,盛杨,郝秀珍,等.重金属在猪饲料一粪便一土壤一蔬菜中的分布特征研究[J].农业环境科学学报,2010,29(5):942-947.
[17]索超,李艳霞,张增强,等.北京集约化养殖畜禽饲料Zn含量及粪便Zn残留特征研究[J].农业环境科学学报,2009,28(10):2173-2179.
[18]吴海一.重金属对扁额细首纽虫抗氧化防御系统及脂质过氧化作用的影响[D].青岛:中国海洋大学,2008.
[19]穆孜颉.大气与重金属污染对昆虫个体及群落的影响[J].河北林业科技,2013,41(6):62-64.
[20]Yuan H X,Sima Y H,Xu S Q.Differential effects of 4-n-nonylphenol on glutathione,glutathione S-transferase,and glutathione peroxidase on gonads in different developmental stages in the bombyx mori (lepidoptera:bombycidae)[J].Annals of the Entomological Society of America,2013,106(6):832-839.
[21]Rashid K,Sinha K,Sil P C.An update on oxidative stress-mediated organ pathophysiology[J].Food and Chemical Toxicology:an International Journal Published for the British Industrial Biological Research Association,2013,62:584-600.
[22]夏嫱,但家立,朱伟,等.Zn2+胁迫对黑水虻生长发育的影响[J].环境昆虫学报,2013,35(3):294-299.
[23]施蔡雷,张杭君,贾秀英.黑斑蛙精巢MDA和抗氧化酶对铅、镉暴露的生态毒性响应[J].生态学报,2010,30(13):3569-3574.
[24]李艳梅,袁红霞,徐旭,等.重金属铅暴露对家蚕组织GSTs和GSH-Px酶活力及基因表达的影响[J],蚕业科学,2011,37(3):425-434.
[25]尹素真,于冲,李光德,等.高Cu、高Zn对白星花金龟幼虫的毒性作用[J].生态毒理学报,2016,11(1):313-322.
[26]Du L,Li G,Liu M,et al.Biomarker responses in earthworms (Eisenia fetida) to soils contaminated with di-n-butyl phthalates[J].Environmental Science amp; Pollution Research International,2015,22(6):4660-4669.
[27]Huang S F,Li Z Y,Wang X Q,et al.Cerium caused life span shortening and oxidative stress resistance in Drosophi-la melanogaster[J].Ecotoxicology and Environmental Safety,2010,73 (1):89-93.
[28]刘佳,李肖楠,孙思铭,等.硫酸锌对血管内皮细胞氧化应激保护作用的研究[J].基础免疫学,2017(33):170-173.
[29]刘晓华.谷胱甘肽对凡纳滨对虾抗氧化防御的调控机理[D].武汉:华中农业大学,2010.
[收稿2017-07-14;修回2017-09-10]
(编辑:谭秀荣)
基础医学研究
基础医学研究
EffectsofdietaryzincstressonantioxidantenzymeactivityandbloodcorpuscleapoptosisrateinH.illucenslarvae
FengQun,LiaoYe,FangXu,DuLianfeng,ChenYang,XiaQiang
(Department of Immunology,Zhuhai Campus of Zunyi Medical University,Zhuhai Guangdong 519041,China)
ObjectiveTo investigate the effects of Zn2+stress on antioxidant enzymes in the haemolymph and blood corpuscleapotosis rate ofH.illucenslarvae,and further provide the theoretical basis for the application ofH.illucenslarvae harmless treatment manure and the development of subsidiary products.MethodsDifferent concentrations of Zn2+into artificial diets stress were added onH.illucenslarvae for continuous 5 generations.Hemolymph of different treatment concentration of 1st,3rd and 5th generations of 5 instar larva was collected.The activity of GST,GST-Px and SOD activity were measured by spectrophotometry and the blood corpuscle apoptosis rate was measured by flow cytometry.ResultsThe activity of GST and GSH-Px in the haemolymph of 1st,3rd and 5th generationsH.illucenslarvae were increased with the increase of Zn2+concentration in the range of 75~300 mg/kg,but were decreased with the increase of Zn2+concentration in the range of 600~1 200 mg/kg.The SOD activity was decreased with the increase of Zn2+concentration at each treatment concentration.As the increase of the stress generations,the GSH-Px and SOD activity were decreased and GST activity was increased,but no significant difference of GST activity between 1st and 5th stress generations was shown.When Zn2+was increased to 600~1 200 mg/kg,Zn2+significantly induced the blood corpuscle ofH.illucenslarvae apoptosis,and the apoptosis rate was increased with the increase of the sress generations.ConclusionZn2+stress onH.illucenslarvae has effects on antioxidant enzyme activity and blood corpuscle apoptosis rate along with the increase of the generations.
Hermetia illucens; zinc; enzymes activity; apoptosis rate
国家自然科学基金资助项目(NO:31260528);贵州省教育厅创新群体重大研究项目(NO:黔教合KY字[2016]037)。
夏嫱,女,教授,硕士生导师,研究方向:Zn2+、Cu2+在黑水虻体内累积及其影响,E-mail:xiaqiang1973@126.com。
S899
A
1000-2715(2017)05-0504-06

