米诺环素对人类胶质瘤U87和LN229细胞体外增殖及凋亡的影响
赵海龙,严婉约,李巧巧,李 科,刘 丽,李丽娟
(1.遵义医学院 基础医学院病理生理学教研室,贵州 遵义 563099;2.遵义医学院 基础医学院2014级卓越医生班,贵州 遵义 563099)
米诺环素对人类胶质瘤U87和LN229细胞体外增殖及凋亡的影响
赵海龙1,严婉约2,李巧巧2,李 科2,刘 丽2,李丽娟1
(1.遵义医学院 基础医学院病理生理学教研室,贵州 遵义 563099;2.遵义医学院 基础医学院2014级卓越医生班,贵州 遵义 563099)
目的探讨米诺环素对人类胶质瘤U87和LN229细胞体外增殖及凋亡的影响,为米诺环素治疗临床胶质瘤提供基础。方法采用MTT法和BrdU标记法检测不同浓度米诺环素(0、50、100、200 μmol/L)对人类胶质瘤细胞株U87和LN229细胞增殖水平的影响;软琼脂克隆形成实验检测米诺环素对胶质瘤细胞自我更新能力的影响;通过免疫荧光标记自噬相关蛋白LC3B和Annexin V-FITC/PI双染细胞凋亡法分别检测米诺环素处理胶质瘤细胞中自噬水平和凋亡水平;使用3-甲基腺嘌呤(3-MA)阻断细胞自噬通路后,分别观察米诺环素对胶质瘤细胞自噬水平和凋亡水平的影响;qRT-PCR法和Western blot法检测米诺环素作用下促凋亡蛋白Bax、抑凋亡蛋白Bcl-2的基因和蛋白表达水平。结果米诺环素对人类胶质瘤细胞的增殖和自我更新能力有明显抑制作用,并呈剂量依赖性;米诺环素可诱导人类胶质瘤细胞发生广泛的细胞自噬与凋亡,但凋亡水平呈现剂量依赖性,而不同浓度处理下的自噬水平无显著性差异;使用3-MA阻断自噬通路对细胞凋亡水平、细胞增殖水平和自我更新能力无显著性影响;米诺环素处理后的胶质瘤细胞中Bax蛋白表达上调,Bcl-2蛋白表达下调。结论米诺环素可以诱导细胞发生自噬和凋亡,进而抑制人类胶质瘤细胞的增殖和自我更新能力,其中主要依赖于细胞凋亡通路的激活。因此,米诺环素可能成为潜在的胶质瘤治疗药物。
米诺环素;胶质瘤;增殖;凋亡;Bax;Bcl-2
人类神经胶质瘤是最常见的原发性中枢神经系统肿瘤,约占所有颅内原发肿瘤的44.7%,发病率高达48%,其恶性度高,病死率高,严重威胁着人类的生命和健康[1]。目前恶性胶质瘤的首选治疗方式仍然是手术切除,但对病人伤害很大,且对总生存率无明显改善[1-3]。此外,系统性化疗是手术切除肿瘤外常用的治疗方法,但大多数化疗药物效果较差,且毒副作用大[4]。因此,寻找更为有效的抗胶质瘤细胞的药物将具有重要的临床学意义。
米诺环素(Minocycline),又称半合成四环素,是一种已在临床上广泛应用的高度亲脂性、浸润组织和血液的抗生素[2,4]。除作为四环素药物的耐药性改良替代品治疗多种感染外,米诺环素还在抗炎和神经系统保护方面有更为广泛的应用[4-6]。近期大量动物疾病模型研究表明,米诺环素可以在体内外抑制诸如胶质瘤、卵巢癌、肝癌等多种常见肿瘤细胞的增殖以及肿瘤形成[2-3,6-9]。然而米诺环素抗肿瘤作用的具体机制却不尽相同,主要包括细胞周期阻滞、诱导细胞凋亡、激活自噬通路以及调节小胶质细胞的增殖或激活等[4-5,8-9]。更为让人困扰的是,用于肿瘤治疗的米诺环素剂量非常高,为治疗感染炎症的5~10倍[2]。而在米诺环素处理胶质瘤细胞研究中主要着眼的是自噬相关机制的作用,其他机制少有提及[3,8]。因此,研究米诺环素在恶性胶质瘤细胞增殖中的其他可能作用机制,将为恶性胶质瘤的治疗提供新的靶点和多种药物联合的协同作用,提高米诺环素在临床治疗肿瘤的安全性。
1 材料与方法
1.1 主要试剂与仪器 人类胶质瘤细胞株U87细胞和LN229细胞由本教研室常规保存;DMEM/F12培养基、胎牛血清、MTT染色液、台盼蓝染色液、RNA提取及逆转录PCR试剂盒、SYBR荧光定量试剂盒、Annexin V/PI凋亡检测试剂盒分别购自GIBCO公司、碧云天生物技术公司、Invitrigen公司、Premega公司、BD公司;兔源LC3B一抗购自Cell Signaling Technology公司、兔源Bax和Bcl-2一抗购自Abcam公司,大鼠源BrdU一抗购自Santa Cruz公司,山羊源抗兔荧光二抗、山羊源抗大鼠荧光二抗购自Life Technologies,辣根过氧化物酶标记山羊抗兔二抗购自KPL公司,辣根过氧化物标记二抗购自碧云天生物技术公司。仪器:细胞培养箱(德国Eppendorf公司),酶标仪(美国Promega公司),激光共聚焦显微镜(日本奥林巴斯公司),倒置显微镜(日本奥林巴斯公司),细胞计数器及计数板、荧光定量PCR仪、凝胶成像系统(美国Bio-Rad公司),流式细胞仪(美国BD公司)。
1.2 细胞培养 细胞于DMEM/F12培养基(含10%胎牛血清、100 mg/L链霉素和1×105U/L青霉素)中培养,置于含5% CO2、饱和湿度、37℃恒温培养箱中,每2d换液或传代一次,取对数生长期细胞用于后续实验。
1.3 MTT检测U87和LN229细胞增殖 待细胞生长至对数生长期消化重悬,调整细胞浓度至1×104个/mL,于96孔板中200 μL/孔进行接种。次日分别加入终浓度0(DMSO作为对照)、50、100、200 μmol/L的米诺环素培养72 h。实验终止前4 h按20 μL/孔添加MTT溶液继续培养,在酶标仪上读取波长560 nm的吸光值(OD值)。每天相同时间重复添加MTT并检测,持续5 d并重复3次绘制时间变化曲线,比较各组细胞增殖能力。
1.4 培养细胞计数并绘制生长曲线 按1.2中以DMSO或100 μmol/L米诺环素处理细胞,每个处理组以相同细胞浓度置于96孔板中,每组15孔。每隔24 h使用台盼蓝染色以及TC10自动细胞计数仪选取每组3孔细胞进行计数,持续5 d绘制时间变化曲线,完成细胞生长曲线。
1.5 BrdU染色实验 按1.3中消化重悬细胞后,调整细胞浓度至1×104个/mL,每孔500 μL加入24孔板中培养过夜后。每孔加入3 μg BrdU继续培养1 h后,4%多聚甲醛固定;2M盐酸冰浴处理10 min后,0.1%Triton 100室温处理5 min,山羊血清室温封闭2 h;加入稀释好的大鼠源BrdU一抗,4 ℃孵育过夜;加入稀释好的山羊源抗大鼠荧光二抗200 μL,室温孵育2 h;Hoechst33342染色15 min,PBS漂洗后在倒置荧光显微镜下观察并拍照,然后统计同一视野下细胞总数与BrdU阳性细胞数。
1.6 软琼脂克隆形成检测U87和LN229细胞自我更新能力 将含有0.6% Agarose溶液的DMEM/F12培养基按每孔1 mL加入6孔板中静置至完全凝固。按1.3中消化处理的细胞重悬至含有0.6% Agarose溶液的DMEM/F12培养基加至下层凝固琼脂上,静置至上层琼脂完全凝固。15~20 d后,显微镜观察单克隆形成情况。
1.7 免疫荧光染色检测U87和LN229细胞自噬水平 细胞以适当浓度重悬至铺有细胞爬片的12孔板中,过夜贴壁后,分别加入终浓度0(DMSO作为对照)、10、50、100 μmol/L的米诺环素培养72 h(其余按照相应处理方式操作)后,使用4%多聚甲醛固定,0.3%Triton 100室温处理5 min,5%BSA封闭2 h,依次加入兔源LC3B一抗(1∶500)4 ℃过夜,山羊源抗兔荧光二抗(1∶10 000)室温孵育2 h,Hoechst33342染色15 min,PBS漂洗后取出爬片置于载玻片上在激光共聚焦显微镜下观察。
1.8 流式细胞术检测U87和LN229细胞凋亡水平 胰酶消化并搜集细胞,PBS洗两遍,每个样本中加入500 μL的结合缓冲液(Binding buffer)使细胞重悬,再分别加入5 μL Annexin V和10 μL PI染料,室温下避光孵育10~30 min;立刻进行流式细胞仪进行检测,并用Flowjo软件进行分析。
1.9 qRT-PCR检测Bax和Bcl-2的mRNA表达 分别提取对照组和米诺环素处理组培养72 h的U87和LN229细胞,裂解后按Trizol提取试剂盒(Invitrigen公司)说明书提取总RNA,按逆转录试剂盒(Invitrigen公司)说明书转录为cDNA。以β-actin为内参,进行qRT-PCR进行检测,每组重复3次,采用2-ΔΔCT方法计算细胞中Bax和Bcl-2的mRNA表达量。其中,根据NCBI查找Bax、Bcl-2和β-actin的基因序列(基因库序列号依次为NM_138761.3、EU287875.1、DQ407611.1),按照引物设计原则利用Primer5.0软件设计引物,而引物序列分别为:Bax: F:TCCACCAAGAAGCTGAGCGAG;R:GTCCAGCCCATGATGGTTCT。Bcl-2: F:ATGTGTGTGGAGAGCTCAAC;R:AGCAGCCAGGAGAAATCA。β-actin:F:TGGCATCCACG-AGACCACCTTCA;R:GACTGCTGTCACCTTCACCGTTCC。以上引物于上海生工公司合成,PCR反应体系如下:H2O 7 μL、Mix(2R)10 μL、CXR0.2 μL、正反向引物各0.4 μL、DNA模板2 μL,反应条件95 ℃变性5 s,60 ℃退火延伸30 s,同时收集荧光信号,设置40个循环,最后温度上升至95 ℃,绘制溶解曲线。
1.10 Western blot检测Bax和Bcl-2的蛋白量 分别提取对照组和米诺环素处理组培养72 h的U87和LN229细胞,使用RIPA高效裂解液提取细胞全蛋白,测定蛋白浓度后以每组30 μg,加入上样缓冲液,进行SDS-PAGE电泳分离蛋白质,转膜至PVDF膜上,5%BSA常温封闭1h,依次加入兔源Bax或Bcl-2一抗(1∶500)4 ℃过夜,辣根过氧化物酶标记山羊抗兔二抗(1∶10 000)室温孵育2 h,以β-actin为内参,使用ImageJ比较蛋白条带灰度值测定。
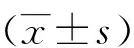
2 结果
2.1 米诺环素对人类胶质瘤细胞增殖能力的影响 MTT结果显示在胶质瘤细胞U87和LN229中,与不加入米诺环素的DMSO对照组相比较,米诺环素在50、100和200 μmol/L浓度时细胞增殖受到明显抑制(Plt;0.05),且抑制效果呈现剂量依赖性,即随着加入培养环境的米诺环素浓度的增加,不同实验组中同一时间内细胞数量与细胞活力逐渐明显降低(见图1)。同时,细胞生长曲线计数结果显示100 μmol/L浓度的米诺环素可以显著抑制肿瘤细胞的增殖速度(Plt;0.05)(见图2)。随后,通过BrdU标记荧光染色计数分别对U87和LN229细胞系的对照组(DMSO)和实验组(100 μmol/L的米诺环素)细胞增殖能力进行检测,实验结果表明,第5天时实验组细胞的BrdU阳性标记率显著低于同期对照组细胞(Plt;0.05),说明米诺环素可以显著减弱胶质瘤细胞的增殖能力(见图3)。

A:米诺环素对U87细胞增殖能力的影响;B:米诺环素对LN229细胞增殖能力的影响。图1 米诺环素对人胶质瘤细胞增殖能力的影响

A:米诺环素对U87细胞数量的影响;B:米诺环素对LN229细胞数量的影响。图2 米诺环素对人胶质瘤细胞存活能力的影响
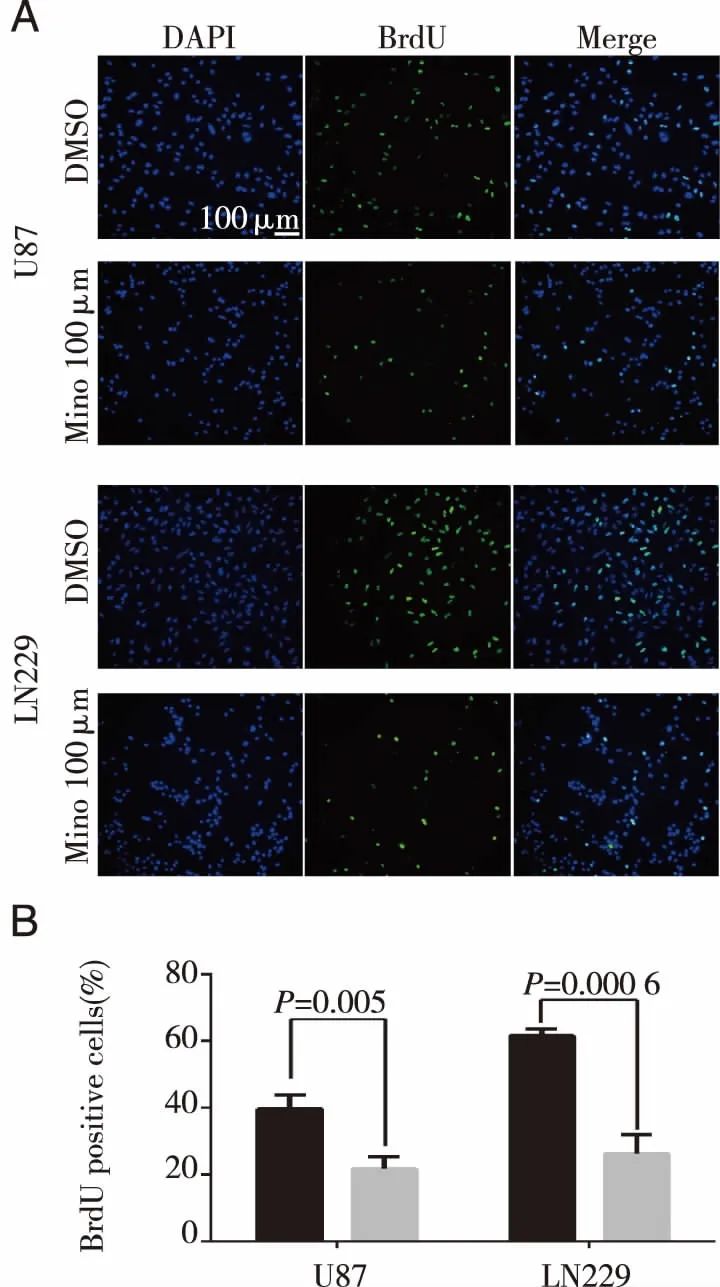
A:米诺环素处理后U87和LN229细胞中BrdU的免疫荧光染色情况;B:米诺环素处理后U87和LN229中BrdU阳性细胞占总细胞的比率。 图3 BrdU染色显示米诺环素对人胶质瘤细胞增殖的影响
2.2 米诺环素对人胶质瘤细胞自我更新能力的影响 实验结果表明,与对照组相比较,米诺环素处理后,U87和LN229细胞形成克隆的数目显著减少(Plt;0.05),克隆体积减小(见图4),说明米诺环素抑制恶性胶质瘤细胞的自我更新能力。
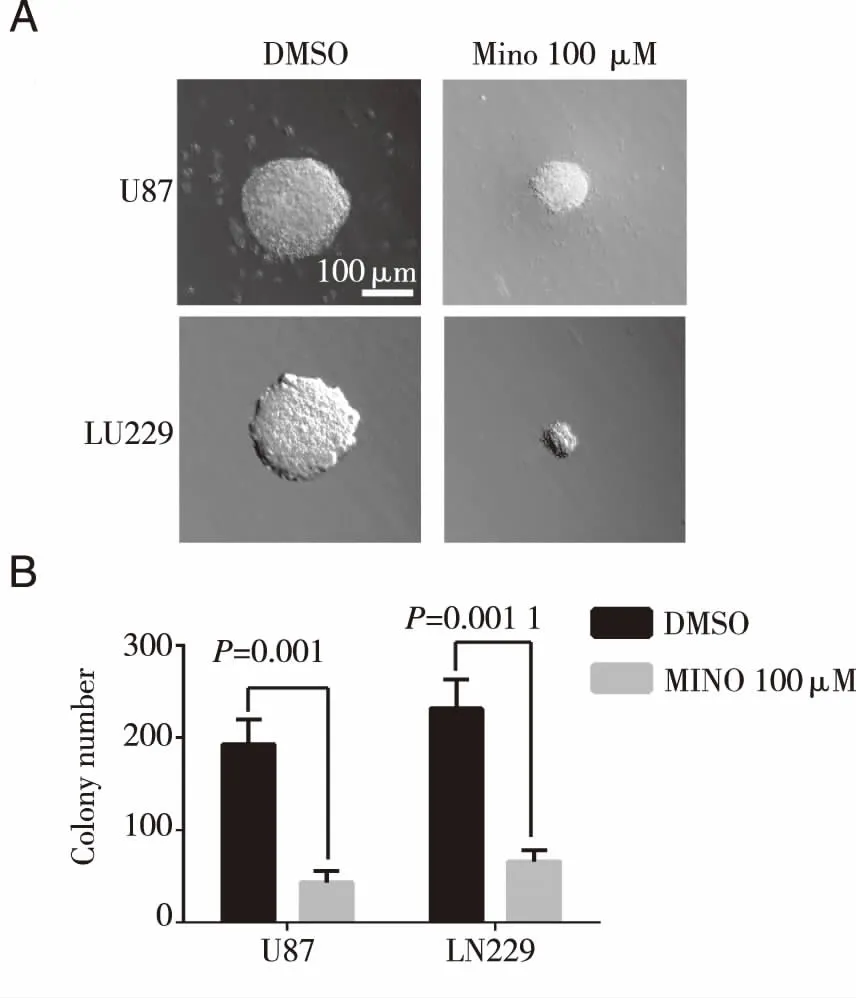
A:米诺环素处理后U87和LN229细胞集落形成情况;B:米诺环素处理后U87和LN229形成的细胞集落数量。 图4 米诺环素处理后的人胶质瘤Soft agar克隆成瘤情况
2.3 米诺环素对U87和LN229细胞自噬和凋亡的影响 实验结果表明,与对照组相比较,经过不同浓度米诺环素(10、500、100μmol/L)处理后的U87和LN229细胞胞浆内LC3B荧光斑点数量呈现明显增加(Plt;0.05),但同一细胞不同米诺环素浓度组之间LC3B荧光斑点数量变化不显著(Pgt;0.05),并没有呈现剂量依赖性(见图5)。经过统计分析,U87和LN229细胞凋亡率随着米诺环素浓度的升高而呈现显著增加趋势(Plt;0.05),具有显著的剂量依赖性(见图6)。

A:米诺环素处理后U87和LN229细胞LC3B的免疫荧光染色;B:米诺环素处理后U87和LN229细胞LC3B斑点数比值。图5 免疫荧光检测米诺环素处理后的人胶质瘤细胞LC3B的变化
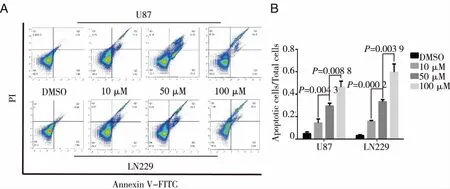
A:米诺环素处理后U87和LN229中凋亡细胞的流式分布情况;B:米诺环素处理后U87和LN229中凋亡细胞数量占细胞总数的比率。图6 米诺环素处理后的人胶质瘤中细胞凋亡情况流式分析
为了进一步探究细胞自噬和凋亡在米诺环素抑制胶质瘤细胞增殖过程中发挥的各自作用,我们使用10umol/L的3-甲基腺嘌呤(3-MA,一种广泛自噬抑制剂)对细胞进行处理4h以降低其自噬水平。LC3B免疫荧光染色检测结果显示,经100umol/L米诺环素处理后的U87和LN229细胞在3-MA作用下,LC3B荧光斑点数均发生显著降低(Plt;0.05),说明3-MA可以在一定程度上阻断米诺环素处理后的胶质瘤细胞内自噬途径激活(见图7)。与之相对的是,米诺环素处理后的U87和LN229细胞凋亡情况在3-MA处理前后差异不显著(Pgt;0.05)(见图8)。这些结果表明自噬水平的下降并不影响米诺环素诱发胶质瘤细胞发生凋亡。
此外,米诺环素处理后的U87和LN229细胞的增殖能力和克隆形成能力在3-MA处理前后差异也不显著(Pgt;0.05)(见图9~10)。上述信息说明自噬水平的改变并不影响米诺环素对胶质瘤细胞增殖能力的抑制作用。因此我们推测米诺环素抑制胶质瘤细胞增殖能力和自我更新能力主要依赖于直接诱导细胞凋亡途径,而细胞自噬水平的激活可能是米诺环素的间接或次要途径。

A:3-MA处理前后米诺环素对87和LN229细胞中LC3B的免疫荧光染色的影响;B:3-MA处理前后米诺环素对87和LN229细胞中LC3B斑点数与细胞数的比值的影响。图7 3-MA处理前后米诺环素对人胶质瘤细胞LC3B表达情况的影响

A:3-MA处理前后米诺环素对U87和LN229中凋亡细胞的流式分布的影响;B:3-MA处理前后米诺环素对U87和LN229中凋亡细胞数量占细胞总数的比率的影响。图8 3MA处理前后米诺环素对人胶质瘤中细胞凋亡情况的影响

A:3-MA处理前后米诺环素对U87细胞活力的影响;B:3-MA处理前后米诺环素对LN229细胞活力的影响影响。图9 3MA处理前后米诺环素对人胶质瘤中细胞增殖能力的影响
2.4 米诺环素对U87和LN229细胞表达Bax和Bcl-2的影响 qRT-PCR检测结果表明,与对照组相比,100μmol/L米诺环素处理后的U87和LN229细胞中,促凋亡基因BaxmRNA表达水平显著升高(Plt;0.05),抑凋亡基因Bcl-2 mRNA表达水平显著降低(Plt;0.05)(见图11)。Western blot检测结果表明Bax和Bcl-2在蛋白表达水平上也呈现相同的变化趋势(见图12)。
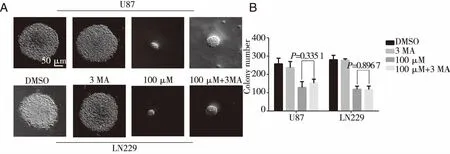
A:3-MA处理前后米诺环素对U87和LN229细胞集落形成的影响;B:3-MA处理前后米诺环素对U87和LN229形成的细胞集落数量的影响。图10 3MA处理前后米诺环素对人胶质瘤中细胞成瘤能力的影响
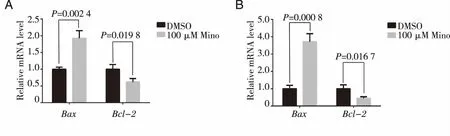
A:米诺环素处理后U87中Bax和Bcl-2 mRNA表达水平变化;B:米诺环素处理后LN229中Bax和Bcl-2 mRNA表达水平变化。图11 米诺环素对人胶质瘤中Bax和Bcl-2 mRNA表达水平的影响

A:米诺环素处理后U87中Bax和Bcl-2 蛋白表达水平变化;B:米诺环素处理后LN229中Bax和Bcl-2 蛋白表达水平变化。图12 米诺环素对人胶质瘤中Bax和Bcl-2蛋白表达水平的影响
3 讨论
米诺环素属于第二代四环素类药物,具有广谱、药力持久、不具光敏性等优点,在临床上主要用于治疗表皮和软组织细菌感染等[4,10]。近年来许多研究表明米诺环素在抗肿瘤和神经组织保护方面有很好的临床应用前景[5-6,8,11]。Liu等[2]发现,米诺环素可以通过自噬通路抑制胶质瘤细胞的增殖能力[8];Liu等也证实在肝癌细胞中米诺环素可以通过诱导细胞周期S期阻滞和凋亡发生抑制癌细胞增殖能力[2];同时,Ataie-kachoie等对卵巢癌的离体和在体研究中发现米诺环素可以同时调控P53介导的凋亡信号通路和AKT/mTOR介导的自噬信号通路的表达[6];此外,米诺环素在多种神经疾病的动物模型中通过抑制小胶质细胞的激活、缓解神经细胞的凋亡和自噬、减少活性氧的产生等方式发挥神经保护作用[12]。
现有研究证实,米诺环素可以通过诱导细胞凋亡或自噬产生较强的抗肿瘤作用,然而在胶质瘤方面除自噬以外的可能机制则未见报道。本研究从细胞增殖能力和自我更新能力两方面证实米诺环素对人类胶质瘤细胞有很强的抑制作用,并具有剂量依赖性。肿瘤细胞增殖能力和活力的降低通常与抗癌药物诱导细胞发生死亡有关,而常见的细胞程序性死亡包括细胞自噬和凋亡。因此本研究使用免疫荧光和流式细胞术检测米诺环素处理72h后的细胞,结果发现U87和LN229细胞中出现广泛性的细胞自噬和凋亡现象,然而自噬水平相对于凋亡水平并不具有剂量依赖性。这一发现提示米诺环素诱导胶质瘤细胞发生自噬可能是通过某种间接途径实现而并没有直接作用于相应的自噬信号通路。因此接下来选择自噬抑制剂3-MA阻断胶质瘤细胞中自噬的发生,结果发现自噬水平的下降并不影响米诺环素诱导细胞凋亡和抑制细胞增殖的发生,并且相应凋亡相关蛋白发生显著性下调。
综上所述,本研究表明米诺环素可以在体外通过诱导细胞凋亡和自噬,抑制人类恶性胶质瘤细胞U87和LN229增殖和自我更新,潜在的机制可能更直接依赖于诱导细胞凋亡,在此过程中间接激活细胞自噬。而由于米诺环素在临床上已广泛使用,其极有可能成为潜在的胶质瘤治疗药物,但临床实用性有待进一步探讨。
[1] Yang R,Wu Y,Wang M,et al.HDAC9 promotes glioblastoma growth via TAZ-mediated EGFR pathway activation [J].Oncotarget,2015,6(10):7644-7656.
[2]Liu F Y,Wu Y H,Zhou S J,et al.Minocycline and cisplatin exert synergistic growth suppression on hepatocellular carcinoma by inducing S phase arrest and apoptosis [J].Oncol Rep,2014,32(2):835-844.
[3]Markovic D S,Vinnakota K,Van rooijen N,et al.Minocycline reduces glioma expansion and invasion by attenuating microglial MT1-MMP expression [J].Brain,Behavior,and Immunity,2011,25(4):624-628.
[4]Garrido-mesa N,Zarzuelo A,Galvez J.Minocycline:far beyond an antibiotic [J].British Journal of Pharmacology,2013,169(2):337-352.
[5]Wu Z H,Zou X,Zhu W,et al.Minocycline is effective in intracerebral hemorrhage by inhibition of apoptosis and autophagy [J].J Neurol Sci,2016,371:88-95.
[6]Ataie-kachoie P,Pourgholami M H,Bahrami B F,et al.Minocycline attenuates hypoxia-inducible factor-1alpha expression correlated with modulation of p53 and AKT/mTOR/p70S6K/4E-BP1 pathway in ovarian cancer:in vitro and in vivo studies [J].American Journal of Cancer Research,2015,5(2):575-588.
[7]Desjarlais M,Pratt J,Lounis A,et al.Tetracycline derivative minocycline inhibits autophagy and inflammation in concanavalin-a-activated human hepatoma cells [J].Gene Regulation and Systems Biology,2014,2014(8):63-73.
[8]Liu W T,Lin C H,Hsiao M,et al.Minocycline inhibits the growth of glioma by inducing autophagy [J].Autophagy,2011,7(2):166-175.
[9]Hour M J,Liu W T,Lu I,et al.Aggravated DNA damage as a basis for enhanced glioma cell killing by MJ-66 in combination with minocycline [J].Am J Cancer Res,2014,4(5):474-483.
[10]Shao L L,Guo R,Shi W J,et al.Could lengthening minocycline therapy better treat early syphilis? [J].Medicine,2016,95(52):e5773.
[11]Zhou Z W,Li X X,He Z X,et al.Induction of apoptosis and autophagy via sirtuin1- and PI3K/Akt/mTOR-mediated pathways by plumbagin in human prostate cancer cells [J].Drug Design,Development and Therapy,2015,9:1511-1554.
[12] 陶涛,付洁,刘永刚,等.米诺环素抑制脑缺血再灌注后小胶质细胞激活的机制研究 [J].四川大学学报:医学版,2017,48(2):221-224.
[收稿2017-06-17;修回2017-08-10]
(编辑:谭秀荣)
基础医学研究
EffectsofminocyclineoncellproliferationandapoptosisinU87andLN229glioblastomacells
ZhaoHailong1,YanWanyue2,LiQiaoqiao2,LiKe2,LiuLi2,LiLijuan1
(1.Department of Pathophysiology,School of Basic Medical Sciences,Zunyi Medical University,Zunyi Guizhou 563099,China;2.Excellent Doctor Educational Reform Class of 2014,School of Basic Medical Sciences,Zunyi Medical University,Zunyi Guizhou 563099,China)
ObjectiveTo explore the effects of minocycline on proliferation and apoptosis of U87 and LN229 glioblastoma cells and the involved mechanisms and further provide the evidence for promising target for the treatment of glioblastoma.MethodsMTT assay and BrdU staining were performed to detect the proliferation of U87 and LN229 cells treated with minocycline at different concerntrations (0,50,100 and 200 μmol/l).The self-renewal ability was measured by soft agar clonogenic assay.The activation of autophagy was detected by immunofluorescence analysis against autophagy-associated protein light chain 3B (LC3B) and the apoptosis level was detected by Annexin V-FITC/PI assay.Pretreatment with autophagy inhibitor 3-methyladenine (3-MA) was employed to investigate the mechanisms underlying the autophagy and apoptosis regulation associated with minocycline.The expression of apoptotic protein Bax and Bcl-2 in glioblastoma cells followed by minocycline treatment was determined by qRT-PCR and western blot assays.ResultsMinocycline significantly inhibited the proliferation and self-renewal ability of U87 and LN229 cells in a dose-dependent manner.The activation of autophagy and apoptosis in glioblastoma cells were induced by minocycline treatment.The significant differences of apoptosis rates among different concerntrations but not autophagy levels were shown.The autophagy pathway blockage in treatment of 3-MA showed no significant effect on apoptosis level,cells proliferation and self-renewal ability.Minocycline induced the apoptosis of glioblastoma cells through up-regulation of Bax and down-regulation of Bcl-2.ConclusionMinocycline inhibits glioblastoma cells proliferation and self-renewal through an increase of autophagy and apoptosis,which is mainly associated with activation of apoptotic pathway.Thus,minocycline is a promising agent in the treatment of glioblastoma.
Minocycline; glioblastoma; proliferation; apototosis; Bax; Bcl-2
国家自然科学基金资助项目(NO:81260131);遵义医学院博士科研启动基金资助项目(NO:F-818);遵义医学院大学生创新创业训练计划项目(NO:20163726)。
李丽娟,女,博士,教授,硕士生导师,研究方向:肿瘤药物靶点筛选,E-mail:LiLijuan@zmc.edu.cn。
R739.41
A
1000-2715(2017)05-0496-08

