酸碱度对兔肉肌原纤维蛋白功能性质的影响
周心雅,贺稚非,2,李洪军,2*,王兆明
1(西南大学,食品科学学院,重庆,400715) 2(重庆市特色食品工程技术研究中心,重庆,400715)
酸碱度对兔肉肌原纤维蛋白功能性质的影响
周心雅1,贺稚非1,2,李洪军1,2*,王兆明1
1(西南大学,食品科学学院,重庆,400715) 2(重庆市特色食品工程技术研究中心,重庆,400715)
研究了不同酸碱度条件对兔肉肌原纤维蛋白功能特性的影响,以及肌原纤维蛋白功能特性指标间的相关性,并通过蛋白质三级结构的变化对其机理进行初探。研究发现,随着pH逼近等电点范围,蛋白质内部芳香族氨基酸不断暴露,蛋白的三级结构展开,表面疏水性不断变大,使得蛋白质分子间疏水相互作用增加。肌原纤维蛋白结构的变化引起蛋白质溶解度下降,并且伴随着乳化活性减小以及乳化稳定性的变化。同时这种结构变化导致肌原纤维蛋白流变学特性的变化,pH值减小导致剪切应力变小,并且在近等电点时,剪切应力存在明显变化。随着pH值不断减小,肌源性蛋白凝胶硬度不断增大,并且在近等电点时变小;同时凝胶保水性不断下降,而凝胶白度不断增大。
pH值;兔肉;肌原纤维蛋白;功能性质
我国是世界兔肉生产大国,据联合国粮食及农业组织(FAO)统计[1],在过去的50年,世界兔肉产量增长了3.4倍,2013年世界兔肉产量为210万 t,我国以72.7万 t的产量,位居世界首位。兔肉因其高消化率、高不饱和脂肪酸、低能量、低胆固醇以及油腻感低的特点,特别受当代消费者青睐[2]。
兔肉肌肉蛋白中主要含肌原纤维蛋白、肌浆蛋白和基质蛋白,肌原纤维蛋白占肌肉总蛋白的40%~60%,是一类具有重要生物学功能的结构蛋白质群。肌原纤维蛋白的功能特性不仅影响着兔肉制品的感官品质,也对兔肉加工和储存过程的物理特性起重要作用。影响蛋白质功能特性的因素很多,除蛋白质本身固有的性质决定肌原纤维蛋白的功能特性外,pH、盐离子、氧化还原电位以及表面活性剂等环境因素对其也有重要的影响。pH是肌原纤维蛋白功能特性的重要影响因素之一,可通过改变氨基酸侧链电荷的数量及分布,改变蛋白质分子的折叠状态及蛋白质间的相互作用,从而引起蛋白质功能特性的改变。目前,国内外在pH对的肌原纤维蛋白功能特性的影响研究主要集中在pH对蛋白质凝胶作用的影响[3-4],而对其他功能特性的研究较少,并且不同来源肌原纤维蛋白功能特性差异很大,针对兔肉的研究更是少之又少。
本文以兔背最长肌为原料,研究了pH对兔肉肌原纤维蛋白功能特性的影响,并通过肌原纤维结构的变化分析功能特性变化机理。旨在为兔肉的综合利用及兔肉产品的开发提供理论依据。
1 材料与方法
1.1主要试验材料与试剂
试验材料为150日龄成年伊拉公兔,购于重庆市高校草食动物中心种兔场,按常规方式屠宰后,采集10只兔的全部背部最长肌,0.5 h内运回实验室,-18 ℃冷冻。牛血清蛋白为生化试剂,其余试剂均为分析纯。
1.2主要仪器设备
冷冻离心机(Avanti J-30I),美国贝克曼库尔特公司;质构分析仪(CT-3),美国Brookfield公司;超低温冰箱(DF8517),韩国ilshin公司;真空冷冻干燥机(ALPHA1-4LSC),德国Christ公司;紫外分光光度计(UV-2450),日本岛津公司;红外光谱(Spectrun100),美国PerkinElmer公司;流变仪(HR-1),美国Brookfield公司;荧光分光光度计(F-2500), 日本岛津公司;测色仪(UltraScan PRO),美国Hunter Lab公司;可见分光光度计(722 型),上海元析仪器有限公司。
1.3实验方法
1.3.1 肌原纤维蛋白的提取
肌原纤维蛋白的提取参照XIONG[5]、姜启星[6]的方法,作适当修改。具体操作过程为:将兔肉绞碎,加入4倍体积的冰浴0.05 mol/L磷酸盐缓冲液(0.1 mol/L NaCl,0.001 mol/L EDTA,0.002 mol/L MgCl2,pH 7.0),7 000 r/min条件下均质处理30 s,停歇3 min后再次均质30 s,均质液在4 ℃、8 000 r/min条件下离心15 min,重复上述操作3次。沉淀中加入0.1 mol/L NaCl(内含0.001 mol/L NaN3,pH 6.25),7 000 r/min条件下均质处理30s,均质液在8 000 r/min条件下离心15 min,重复上述操作3次,最后一次离心前经双层纱布过滤,以上操作均质冰浴条件下进行。
1.3.2 肌原纤维蛋白溶解度
肌原纤维蛋白溶解度的测定参照TANG[7]的方法。称取0.5 g肌原纤维蛋白,溶于20 mL NaCl溶液中,冰浴条件下2 800 r/min均质处理30 s,将均质液在4 ℃、8 000 r/min条件下离心15 min,测定离心前后蛋白质浓度。
(1)
1.3.3 乳化活性指数和乳化稳定性
乳化能力的测定基于AGYARE[8]等的方法,作适当的修改。用0.1 mol/L、pH 6.5磷酸盐缓冲溶液溶解肌原纤维蛋白溶解,制成蛋白质质量浓度为1 mg/mL的溶液。将5.0 mL大豆油和20.0 mL蛋白质溶液放入直径为2.5 cm的塑料离心管中,10 000 r/min条件下高速均质60 s,均质结束后立即从距离心管底5 mm处取均质液50 μL(剩下的均质液备用),加入到5 mL、0.1% SDS溶液中,振荡混匀,静置10 min,用分光光度计在500 nm波长处测定吸光度值,记作A0,以0.1% SDS溶液做空白。10 min后在离心管相同位置再次取均质液50 μL,进行上述处理,吸光度值记作A10。肌原纤维蛋白乳油均质液的乳化活性指数(EAI)和乳化稳定性(ESI)的计算公式如下:
EAI={(2×2.303)/[C×(1-φ)×104]}×A500×稀释倍数
(2)
ESI=100×A10/A0
(3)
式中:C,乳化前的蛋白质浓度,g / mL;φ,乳化液中油的体积分数;A500,在500 nm处的吸光度值。
1.3.4 肌原纤维蛋白表面疏水性
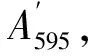
(4)
1.3.5 紫外吸收光谱及其二阶导图
基于QIU[10]的方法适当修改测定。用0.6 mol/L NaCl溶液溶解肌原纤维蛋白,制成蛋白质质量浓度为0.5 mg/mL的溶液。以0.6 mol/L NaCl作为空白,波长230~320 nm,测定肌原纤维蛋白的紫外吸收光谱。
1.3.6 内源荧光光谱测定
基于XU[11]的方法适当修改测定。用0.6 mol/L NaCl溶液溶解肌原纤维蛋白,制成蛋白质质量浓度为0.5 mg/mL的溶液。以0.6 mol/L NaCl溶液作为空白,仪器参数设置激发波长为295 nm,发射光谱范围为 300~400 nm,扫描范围为 300~400 nm,扫描速度为1 500 nm/min,激发和发射狭缝均为2.5 nm,扫描3次。
1.3.7 氢键含量
参照周光宏[12]等方法测定。用0.02 mol/L、pH 6.5的磷酸盐缓冲液溶解肌原纤维蛋白,制成蛋白质质量浓度为5 mg/mL的溶液。取肌原纤维蛋白样液,分别加入0.5 mL的S1溶液(0.02 mol/LTris,1% SDS,pH 8.0)和S2溶液(0.5 mol/L NaOH),振荡均匀后室温放置1 h,8 000 r/min离心30 min,测定上清液蛋白浓度,同时取0.6 mL上清液加入50%三氯乙酸(TCA)溶液,使上清液的最终TCA浓度达到10%,样品在4 ℃条件下放置15 min后4 000 r/min离心10 min,沉淀用S2溶液溶解,测定蛋白浓度,氢键含量以S1溶解的蛋白含量占S2溶解的蛋白质含量的百分比表示,用0.02 mol/L、pH 6.5的磷酸缓冲液做空白。
1.3.8 肌原纤维蛋白凝胶特性
1.3.8.1 肌原纤维蛋白凝胶的制备
用0.6 mol/L NaCl,0.05 mol/L、pH 6.0的磷酸盐缓冲液溶解肌原纤维蛋白,制成蛋白质质量浓度为50 mg/mL的溶液。用直径25 mm的离心管盛放蛋白溶液,置于温度20~70 ℃、以1 ℃/min的速率上升的水浴锅中,并在70 ℃的条件下保温20 min制备成凝胶。凝胶加热结束后,迅速在流水中冷却,置于4 ℃的冰箱中过夜,测定各项指标。
1.3.8.2 凝胶硬度
采用CT-3质构仪对凝胶硬度进行测定。仪器参数设置如下:测量长度10 mm,圆柱直径20 mm,形变30%,始发点负载4 g,测试速度1.00 mm/s,探头TA5。
1.3.8.3 凝胶持水性
基于SALVADOR[13]的方法,适当的修改测定。取2 g蛋白凝胶,置于5 mL的离心管中,在4 ℃下8 000 r/min离心10 min,测定凝胶离心前后的重量。结果以前后重量的百分比进行表示,重复3次。
1.3.8.4 凝胶白度
凝胶白度值在测定其L*(亮度值)、a*(红度值)、b*(黄度值)后,按照PARK[14]的方法计算求得,其计算公式如下:
白度=100-[(100-L*)2+a*2+b*2]1/2
(5)
1.3.8.5 凝胶作用力分析
参照PÉREZ-MATEOS[15]等的方法,测定凝胶作用力。取2 g凝胶,分别加入10 mL 0.05 mol/L NaCl(SA)、0.6 mol/L NaCl(SB)、0.6 mol/L NaCl+1.5 mol/L脲(SC)和0.6 mol/L NaCl+8 mol/L脲(SD),混合后高速均质30 s,4 ℃静置1 h,8 500 r/min离心10 min,双缩脲法测定其上清液蛋白质含量。离子键的贡献以SB与SA溶液中蛋白质含量之差表示;氢键的贡献以SC与SB溶液中蛋白质含量之差表示;疏水性相互作用的贡献以SD与SC溶液中蛋白质含量之差表示。
1.3.9 流变性特性
用0.6 mol/L NaCl,0.05 mol/L、pH 6.0的磷酸盐缓冲液溶解肌原纤维蛋白,制成蛋白质质量浓度为20 mg/mL的溶液,测定其流变性特性。静态流变学特性流变仪条件为:夹具为40 mm平行板,狭缝500 μm,应变1%,频率0.1 Hz,剪切速率0.1~100 s-1。
1.4数据分析
采用SPSS 19.0 对实验数据进行单因素方差分析,Origin 8.0 进行图形绘制。
2 结果
2.1pH值对肌原纤维蛋白功能特性的影响
2.1.1 pH对溶解度的影响
蛋白质溶解度是蛋白质-蛋白质和蛋白质-溶剂相互作用之间平衡的热力学表现形式[16],由图1可知,随着pH值逼近肌原纤维蛋白等电点范围(肌原纤维等电点约为5~5.2[17]),其蛋白质溶解度显著减小,在pH 5.5时达到最小值,而随着pH值偏离其等电点范围,其溶解度极显著增大,并且在一定范围内,随着pH值的增加而增加。
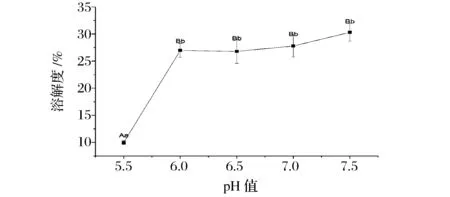
图1 pH值对肌原纤维蛋白溶解度的影响Fig.1 Effect of pH on the solubility of myofibrillar protein
2.1.2 pH值对乳化性的影响
蛋白质的乳化性是蛋白质的界面性质,由图2所示,兔肉肌原纤维蛋白的乳化活性随着pH值的升高而增大,而乳化稳定性随着pH值的升高呈现出先增大后减小的趋势,在pH 6.5处达到最大值。随着pH值减小,蛋白质的溶解度下降,蛋白凝聚,乳化微粒增大,肌原纤维蛋白表面电荷减少,蛋白分子间静电排斥力减小这使得肌原纤维蛋白的乳化性最低[18]。
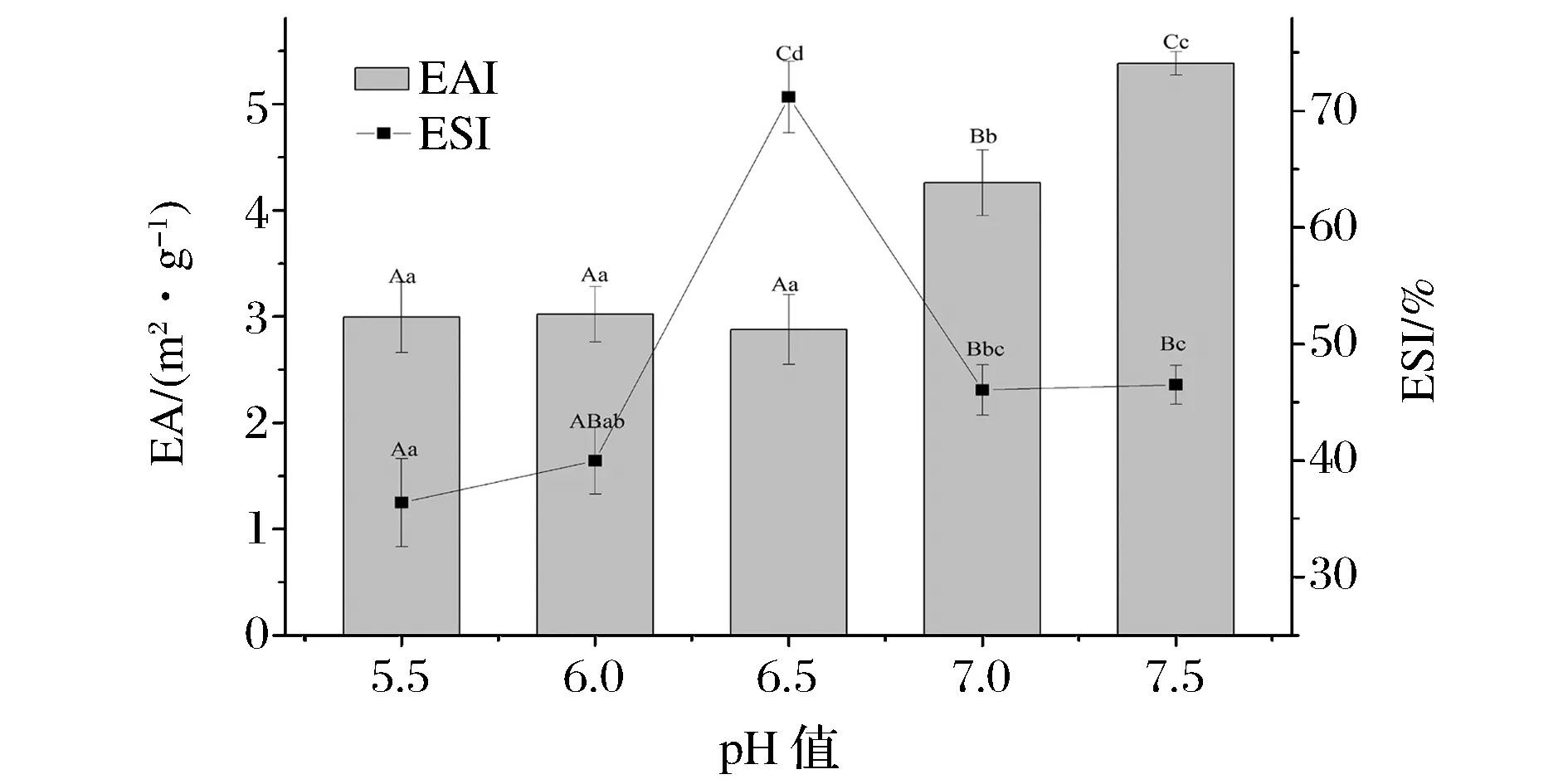
图2 pH值对肌原纤维蛋白乳化性的影响Fig.2 Effect of pH on the emulsification of myofibrillar protein
2.1.3 pH值对凝胶特性的影响
肌原纤维蛋白胶凝性是肌原纤维蛋白重要的功能性质,其对肉类食品而言,不仅可以形成半固态黏弹性质地,还具有保水、稳定脂肪和黏结的作用。在凝胶的评价体系中,凝胶强度、保水性以及白度具有重要意义。由图3可知,随着pH值逼近等电点范围,肌原纤维蛋白凝胶硬度先增大后减小。在pH值为6.0时,得到最大凝胶硬度,这是因为随着pH值的减小,蛋白质分子间静电斥力较小,使蛋白质疏水作用和二硫键作用增大[19],而随着pH值增大,静电斥力越大,蛋白质网状结构过于松散,对凝胶强度产生不利影响[20],使其硬度减小(plt;0.05);在pH值逼近等电点范围时,蛋白质分子间疏水相互作用增强,蛋白溶解度部分丧失或全部丧失,蛋白质分子无序聚集,形成容易渗水且强度弱的凝胶,引起凝胶硬度的极显著减小(plt;0.01)。同时,本研究可以证明在肌原纤维蛋白凝胶体系中,尽管蛋白质溶解度不是蛋白质胶凝作用的必需条件,但其丧失程度会对蛋白质胶凝作用产生一定的影响,丧失程度严重会引起凝胶硬度的减小。
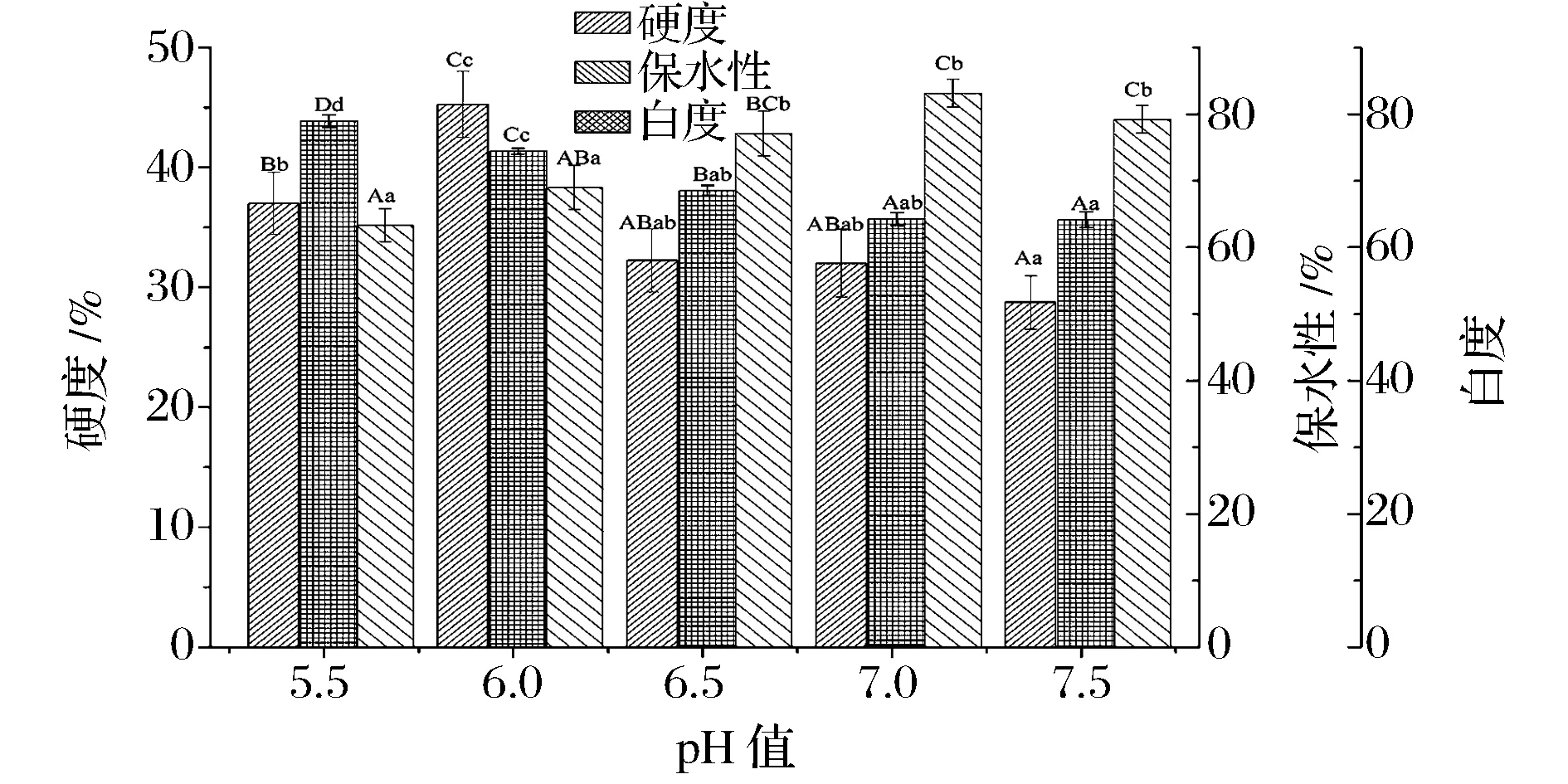
图3 pH值对肌原纤维蛋白凝胶硬度、保水性和白度的影响Fig.3 Effect of pH on the hardness, water retention and degree of whiteness of myofibrillar protein gel
肌原纤维蛋白凝胶持水性是蛋白质溶液与蛋白质沉淀的中间状态,也是蛋白质相互结合并将水包容,形成三维网络结构。由图3可知,随着pH值逼近等电点范围,兔肉肌原纤维蛋白凝胶保水性显著下降(plt;0.05)。这是因为蛋白质分子间静电斥力减小,并且与水分子结合的氢键位点也明显变少[21],导致水合作用表面积减小,持水性下降。
凝胶白度值是凝胶色泽的表观体现,与肌原纤维蛋白的变小程度有关[22]。随着pH值逼近等电点范围,肌原纤维蛋白白度值显著增大(plt;0.05)。这可能是因为pH的不同导致凝胶形成机制存在差异,在相同的凝胶制作条件下,引起蛋白质变性程度不同。

图4 pH值对维持肌原纤维蛋白凝胶作用力的影响Fig.4 Effect of pH on the maintenance of myofibrillar protein gel
凝胶的蛋白质网状结构是由蛋白质-蛋白质相互作用、蛋白质-水相互作用以及邻近肽链间的吸引力和排斥力共同平衡时的结果,其涉及的作用力由涉及疏水相互作用、氢键、静电作用、二硫键等,pH值可通过改变蛋白质分子的离子化作用和净电荷值,进而影响维持凝胶的作用力[23]。由图4可知,pH对凝胶维持的作用力重要的影响。随着pH偏离蛋白质等电点范围,氢键贡献先增大后减小,在pH 6.5时有氢键最大贡献;离子键贡献也呈现出先增大后减小的趋势,其在pH 7.0时有最大贡献值;而疏水相互作用贡献则呈现出先减小后增大的趋势,在pH 6.0时贡献值最小。
2.2pH值对肌原纤维蛋白静黏弹性流变学特性的影响
肌原纤维蛋白静态流变性可以反映其溶液在外力作用下的运动速度和运动阻力。根据幂率定律τ=K×δn(τ为剪切应力,K为黏度系数,δ为剪切速度,n为流变指数)可以判定肌原纤维蛋白的流体特性,在幂率定律中,当nlt;1时,流体为假塑性流体,当n=1时,流体为牛顿流体,当ngt;1时,流体为胀塑性流体[24]。本研究中,在pH 5.5、pH 6.0、pH 6.5、pH 7.0、pH 7.5时流变指数n分别为0.447、0.446 8、0.534 9、0.619 8、0.666,均小于1,说明该条件下肌原纤维蛋白为假塑性流体,剪切变稀。
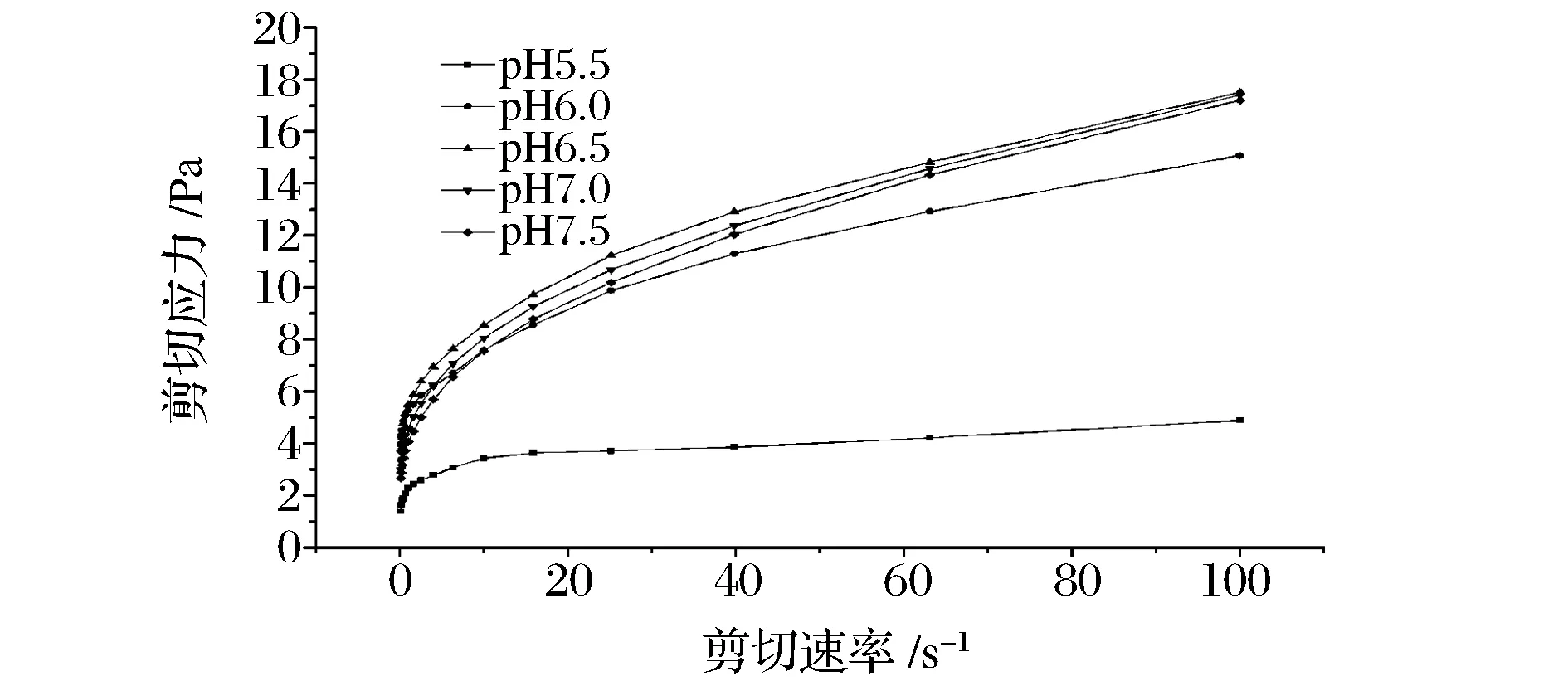
图5 pH值对肌原纤维蛋白流变学特性的影响Fig.5 Effect of pH onthe rheological properties myofibrillar protein
由图5可知,随着剪切速率的增大,剪切应力不断增大,在低剪切速率0.1~1 s-1区,剪切应力随着剪切速率的增大呈线性增大趋势,这是由于剪切速率过低,高分子链段未显现出弹黏性形变,表现出牛顿流体的性能;当进入高剪切速率40~100 s-1区时,剪切应力随着剪切速率的增大再次呈现线性增大趋势,这可能是因为在高的剪切速率下,肌原纤维蛋白自身来不及在流动过程中显示出黏弹性的变化或已经完成了流动取向,再次呈现出牛顿流体的特性[25]。
在同一剪切速率条件下,随着pH逼近等电点范围,剪切应力不断减小,并且在pH 5.5时,其剪切应力明显变小,这主要是由蛋白质分子间作用力过小引起的。
2.3表面疏水性
蛋白质疏水基团间的相互作用是一种非共价键的相互作用,是维持蛋白质三级结构的重要因素,尽管构成蛋白质的非极性氨基酸侧链大多数分布于蛋白质分子内部,但其非极性基团仍有一部分暴露在蛋白质表面,使其表面具有一定的疏水作用[26-27]。表面疏水性说明蛋白质分子内部疏水基团的暴露程度,表面疏水基团暴露的越多,肌原纤维蛋白的表面疏水性越大。由图6可知,随着pH值逼近等电点范围,肌原纤维蛋白表面疏水性显著增大,蛋白质暴露的非极性基团不断增多,这些基团受水分子的排斥而相互靠范德华力或疏水键结合的更加紧密[28],当非极性基团暴露到一定程度时,蛋白质就会聚集,同时伴随着溶解度的部分丧失或全部丧失。
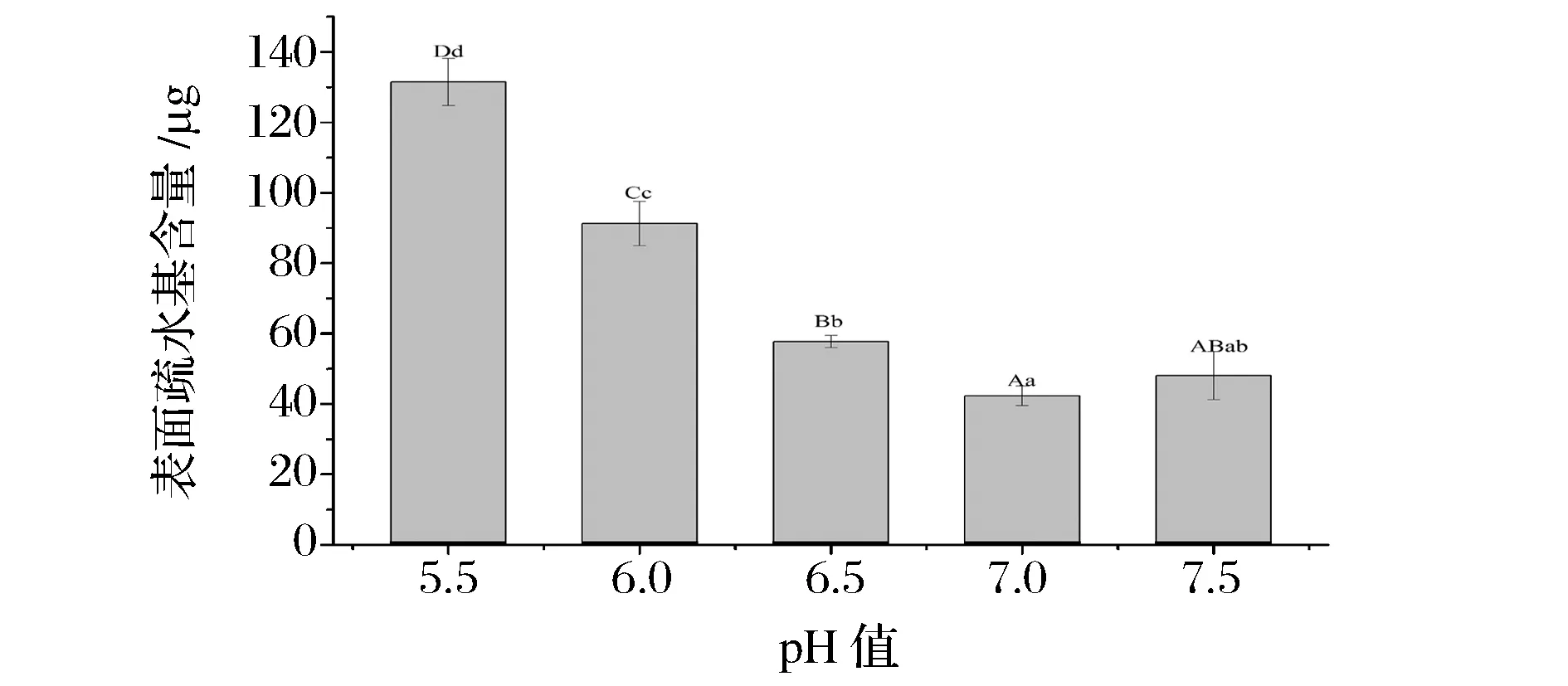
图6 pH值对肌原纤维蛋白表面疏水性的影响Fig.6 Effect of pH on the hydrophobicity of myofibrillar protein
2.4氢键含量
在肌原纤维蛋白中,肌球蛋白分子尾部的α-螺旋结构是依靠多肽链中—CO与—NH之间的氢键来维持稳定的[29],当氢键的稳定性发生变化时,α-螺旋结构会发生破坏和丢失,继而引起蛋白质二级结构的变化。由图7可知,随着pH值逼近等电点范围,肌原纤维蛋白氢键含量逐渐减小,说明在实验范围内随着pH值的减小,肌原纤维蛋白的氢键稳定性不断减小,这逐渐引发酸性条件下α-螺旋的破坏和丢失,即α-螺旋含量逐渐减少。 这与LIU[30]得到的结果一致。
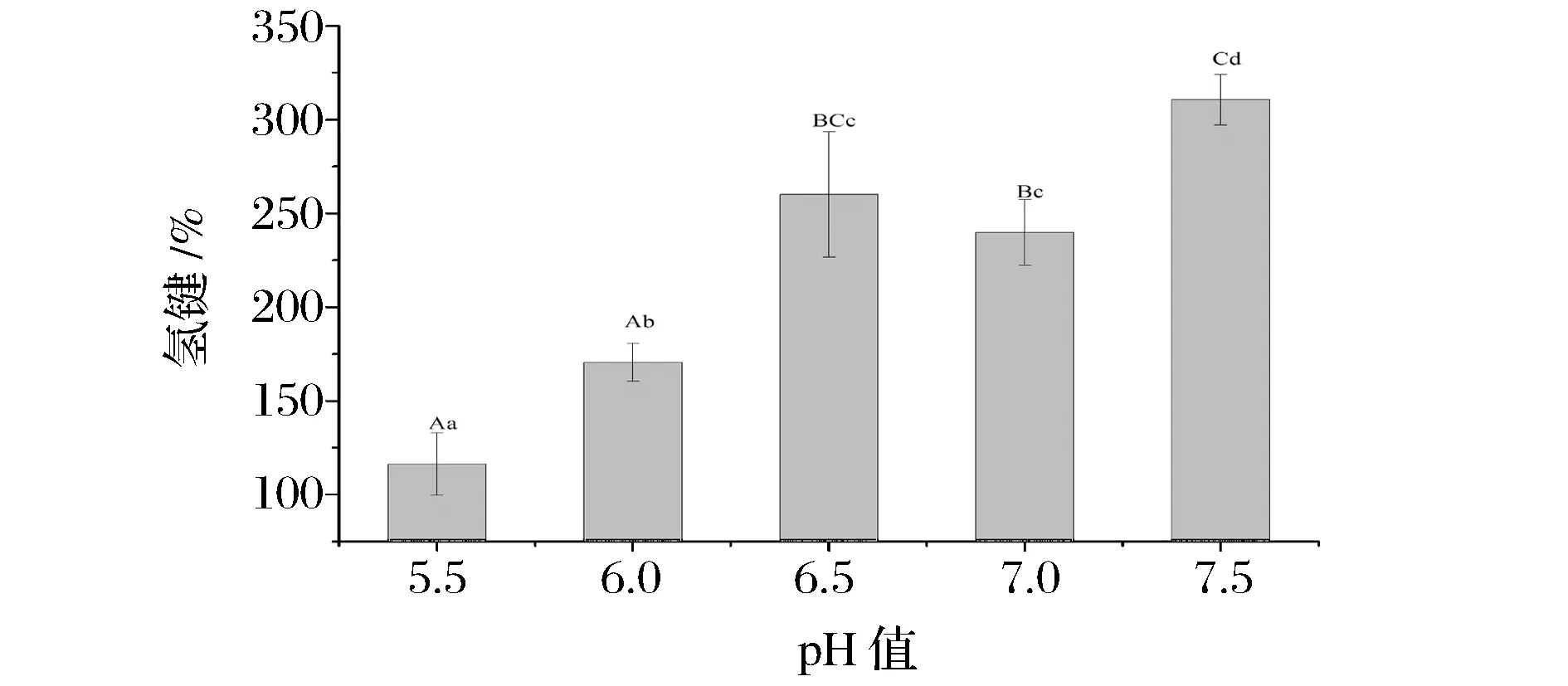
图7 pH值对肌原纤维蛋白氢键含量的影响Fig.7 Effects of pH on the hydrogen bonding content of myofibrillar protein
2.5色氨酸内源荧光光谱分析
蛋白质的内源荧光主要来源于芳香族氨基酸残基,在295 nm处肌原纤维蛋白分子中由于酪氨酸残基荧光熄灭和色氨酸残基荧光增加,其荧光发射光谱主要是由色氨酸所发射,可用其用于监测色氨酸残基微环境变化[31]。由图8可得,不同pH对肌原纤维蛋白的荧光光谱形状影响不显著,但对其荧光强度有显著影响;随着pH值逼近等电点范围,肌原纤维蛋白内源荧光强度逐渐减弱。pH减小引起肌原纤维蛋白排列顺序的变化,内部色氨酸基团暴露,引起蛋白分子间作用增强,使得蛋白分子再聚集,并且再聚集作用将更多色氨酸残基包裹于分子内部更加疏水的环境中,引起内源荧光强度的下降[32]。
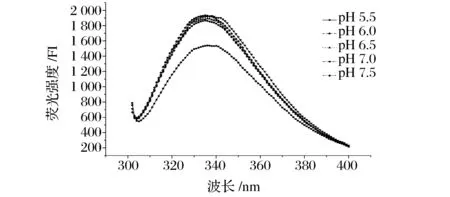
图8 pH对肌原纤维蛋白内源荧光强度的影响Fig.8 Effects of pH on the endogenous fluorescence intensity of myofibrillar protein
图9是不同pH条件下肌原纤维蛋白的紫外图谱及其二阶导图谱,由图9-A可知,随着pH值逼近等电点范围,表征色氨酸与酪氨酸残基的276 nm[33]紫外吸收强度上升,这表明肌原纤维蛋白结构发生了变化。由图9-B可知,肌原纤维蛋白在紫外二阶导图谱在289 nm与296 nm处有2个正吸收峰,在284 nm和292 nm处有2个负吸收峰。紫外二阶导图谱在289 nm和296 nm处,以pH 7.0为对照,在其逼近等电点范围时,发生不同程度的蓝移,吸收峰的蓝移表明处理后蛋白分子展开,所处环境极性增加,导致表面疏水性增强[34],这与前文中表面疏水性的研究一致。
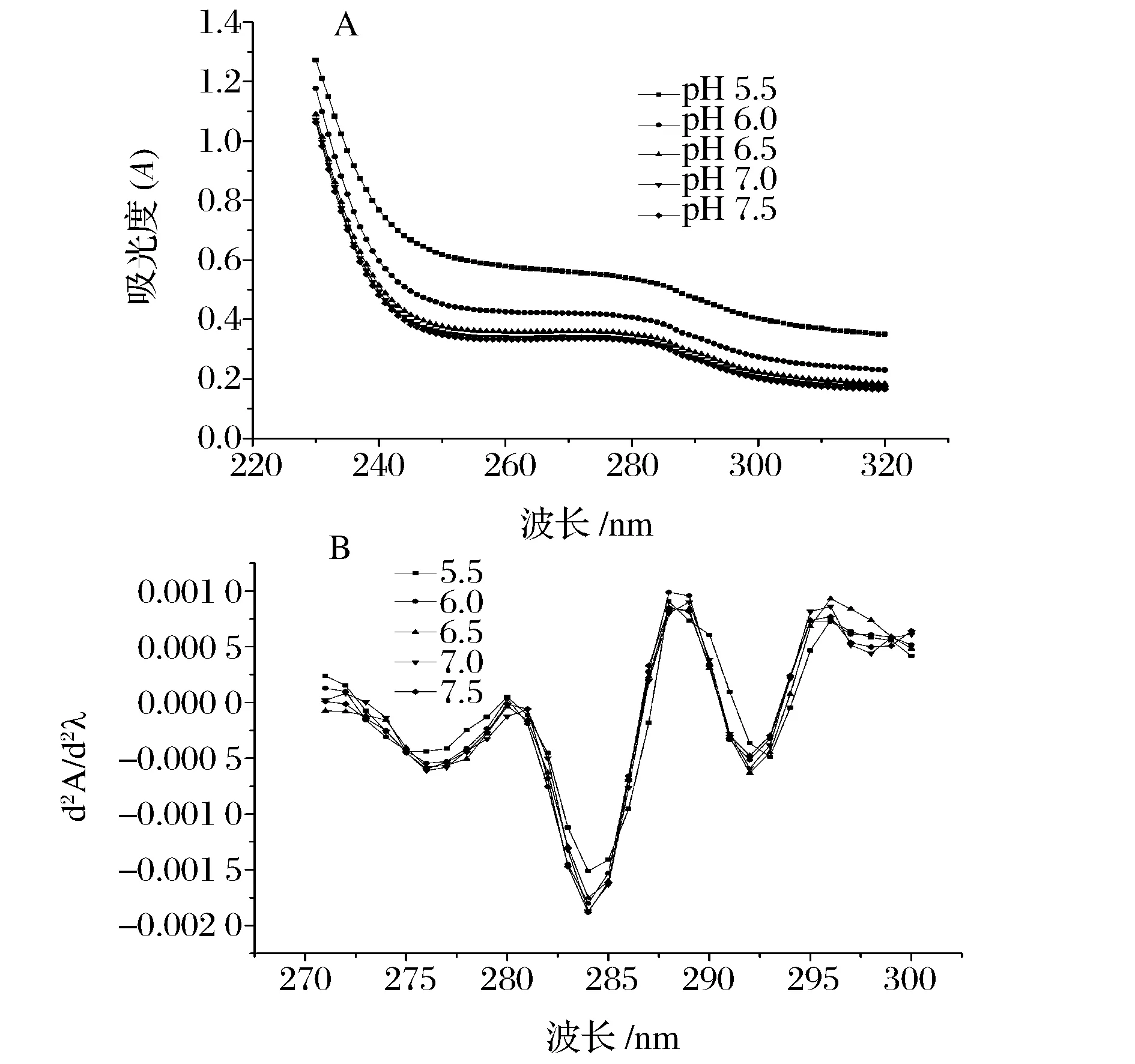
图9 不同pH条件下肌原纤维蛋白的紫外图谱及其二阶导图谱Fig.9 Ultraviolet map and second-order map of myofibrillar protein at different pH
在处理肌原纤维二阶导图谱时,可依据正负吸收峰峰谷和峰顶距离的比例(r=a/b,其中a为284 nm吸收峰与289 nm吸收峰的距离,b为292 nm吸收峰与296 nm吸收峰的距离)的变化来推断酪氨酸的贡献,随着pH值逼近等电点范围,其r值分别为2.00, 2.22,1.66,1.91,2.19,“r”值越大表明蛋白的三级结构展开程度越大,酪氨酸残基暴露出来越严重[35]。
2.6肌原纤维蛋白功能特性品质指标相关性分析
pH对肌原纤维蛋白的离子化作用和净电荷值均有影响,这直接导致蛋白分子间作用力以及蛋白分子与水分子的结合能力的变化[36]。
根据相关性分析结果,pH对与肌原纤维蛋白中氢键含量、溶解度、乳化活性和凝胶保水性极显著正相关(plt;0.01),与表面疏水性、凝胶硬度以及白度极显著负相关(plt;0.01),说明在实验范围内pH值越低,肌原纤维蛋白氢键含量、溶解度、乳化活性以及凝胶保水性越差。氢键含量与蛋白质溶解度、乳化活性和凝胶保水性极显著正相关极显著正相关(plt;0.01),与凝胶硬度以及白度极显著负相关(plt;0.01),表明α-螺旋结构的破坏或丢失程度越大,蛋白质溶解度、乳化活性以及凝胶保水性越差。表面疏水性与凝胶硬度和凝胶白度极显著正相关(plt;0.01),与蛋白质溶解度、乳化活性以及凝胶保水性极显著负相关(plt;0.01),表明疏水基团的暴露程度越大,蛋白质溶解度、乳化活性以及凝胶保水性越差。
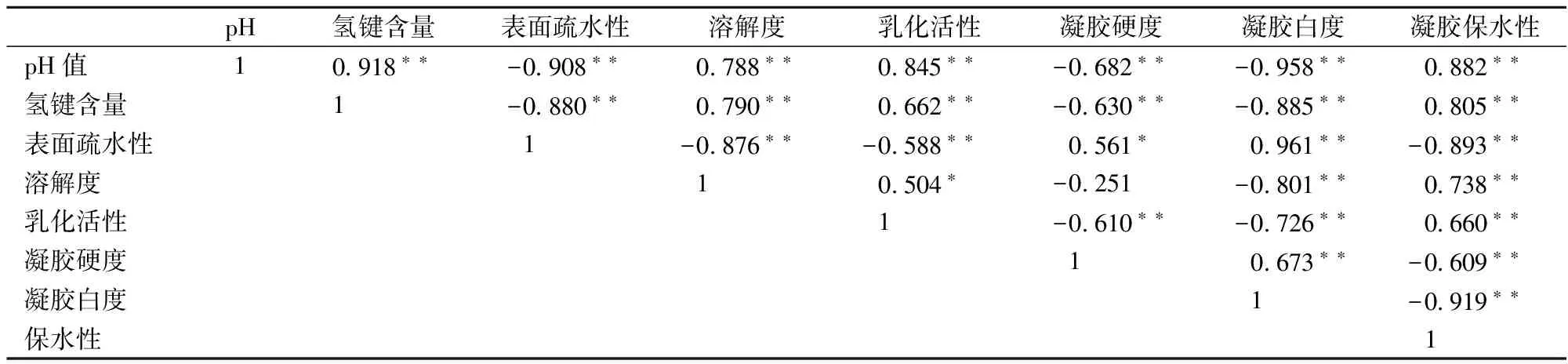
表1 肌原纤维蛋白功能特性品质指标相关性分析
3 结论
随着pH值逼近等电点范围,维持肌原纤维蛋白α-螺旋结构的氢键稳定性降低,α-螺旋结构发生破坏和丢失,内部疏水性芳香族氨基酸不断暴露,蛋白的三级结构展开,表面疏水性不断变大,使得蛋白质分子间疏水相互作用增加。
肌原纤维蛋白结构的变化引起蛋白质溶解度下降,并且伴随着乳化活性减小以及乳化稳定性的变化。同时这种结构变化导致肌原纤维蛋白流变学特性的变化,pH值减小导致剪切应力变小,并且在近等电点时,剪切应力存在明显变化。
肌原纤维蛋白结构的变化导致热诱导凝胶形成机制的差异,引起维系凝胶的作用力不同,继而对凝胶特性产生影响。随着pH值不断减小,肌源性蛋白凝胶硬度不断增大,并且在近等电点时变小;同时凝胶保水性不断下降,而凝胶白度不断增大。
[1] FAOSTAT,http://faostat.fao.org/site/569/DesktopDefault.aspx?PageID=569#ancor.
[2] NAKYINSIGE K, SAZILI A Q, AGHWAN Z A, et al. A. Development of microbial spoilage and lipid and protein oxidation in rabbit meat[J]. Meat Science, 2005, 108: 125-131.
[3] 费英,韩敏义,杨凌寒,等. pH 对肌原纤维蛋白二级结构及其热诱导凝胶特性的影响[J]. 中国农业科学, 2010, 43(1): 164-170.
[4] 韩敏义,费英,徐幸莲,等. 低场 NMR 研究 pH 对肌原纤维蛋白热诱导凝胶的影响[J]. 中国农业科学, 2009, 42(6): 2 098-2 104.
[5] XIONG Y L, LOU X, WANG C, et al. Protein extraction from chicken myofibrils irrigated with various polyphosphate and NaCl solutions[J]. Journal of Food Science, 2000, 65(1): 96-100.
[6] 姜启兴. 鳙鱼肉热加工特性及其机理研究[D]. 无锡:江南大学, 2015.
[7] TANG C H. Functional properties and in vitro digestibility of buckwheat protein products: Influence of processing[J]. Journal of Food Engineering, 2007, 82(4): 568-576.
[8] AGYARE K K, ADDO K, XIONG Y L. Emulsifying and foaming properties of transglutaminase-treated wheat gluten hydrolysate as influenced by pH, temperature and salt[J]. Food Hydrocolloids, 2009, 23(1): 72-81.
[9] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note: A simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683.
[10] QIU C, XIA W, JIANG Q. Pressure-induced changes of silver carp (Hypophthalmichthysmolitrix) myofibrillar protein structure[J]. European Food Research and Technology, 2014, 238(5): 753-761.
[11] XU Y, XIA W, JIANG Q. Aggregation and structural changes of silver carp actomyosin as affected by mild acidification with d-gluconic acid δ-lactone[J]. Food Chemistry, 2012, 134(2): 1 005-1 010.
[12] 吴菊清,邵俊花,周光宏,等. 离子强度对猪肉肌原纤维蛋白乳化特性和理化特性的影响[J]. 食品科学, 2014, 35(23): 3.
[13] SALVADOR P,TOLDRM, SAGUER E, et al. Microstructure-function relationships of heat-induced gels of porcine haemoglobin[J]. Food Hydrocolloids, 2009, 23(7): 1 654-1 659.
[14] PARK J A E W.Functional protein additives in surimi gels[J]. Journal of Food Science, 1994, 59(3): 525-527.
[15] PÉREZ-MATEOS M, LOURENÇO H, MONTERO P, et al. Rheological and biochemical characteristics of high-pressure-and heat-induced gels from blue whiting (Micromesistiuspoutassou) muscle proteins[J]. Journal of Agricultural and Food Chemistry, 1997, 45(1): 44-49.
[16] 彭增起,周光宏. 肌肉盐溶蛋白质溶解性和凝胶特性研究[D]. 南京:南京农业大学, 2005.
[17] 费英,韩敏义,杨凌寒,等. pH 对肌原纤维蛋白二级结构及其热诱导凝胶特性的影响[J]. 中国农业科学, 2010, 43(1): 164-170.
[18] 李明清. 鲤鱼肌原纤维蛋白功能特性的研究[D]. 哈尔滨:东北农业大学, 2010.
[19] SUREL O, FAMELART M H. Heat induced gelation of acid milk: balance between weak and covalent bonds[J]. The Journal of Dairy Research, 2003, 70(2): 253.
[20] KRISTINSSON H G, HULTIN H O. Role of pH and ionic strength on water relationships in washed minced chicken-breast muscle gels[J]. Journal of Food Science, 2003, 68(3): 917-922.
[21] 费英,韩敏义,杨凌寒,等. pH 对肌原纤维蛋白二级结构及其热诱导凝胶特性的影响[J]. 中国农业科学, 2010, 43(1): 164-170.
[22] HWANG J S, LAI K M, HSU K C. Changes in textural and rheological properties of gels from tilapia muscle proteins induced by high pressure and setting[J]. Food Chemistry, 2007, 104(2): 746-753.
[23] 倪娜,王振宇,韩志慧,等. pH 对羔羊背最长肌肌原纤维蛋白热诱导凝胶的影响[J]. 中国农业科学, 2013, 46(17): 3 680-3 687.
[24] 游远,彭晓蓓,杨玉玲,等. 鸡肉肌原纤维蛋白静态流变特性的研究[J]. 食品工业科技, 2013, 34(1): 102-104.
[25] 许柯. 不同条件下兔骨骼肌肌球蛋白流变学特性的研究[D]. 南京: 南京农业大学, 2010.
[26] YUKSEL Z, AVCL E, UYMAZ B,et al. General composition and protein surface hydrophobicity of goat, sheep and cow milk in the region of Mount Ida[J]. Small Ruminant Research, 2012,106(2/3):137-144.
[27] DAMODARAN S. Refolding of thermally unfolded soy proteins during the cooling regime of the gelation process: effect on gelation[J]. Journal of Agricultural and Food Chemistry, 1988, 36(2): 262-269.
[28] 阚建全. 食品化学[M]. 第二版.北京:中国农业大学出版社,2008:65-66.
[29] SANO T,OHNO T, OTSUKA-FUCHINO H, et al. Carp natural actomyosin: thermal denaturation mechanism[J]. Journal of Food Science, 1994, 59(5): 1 002-1 008.
[30] LIU R, ZHAO S,XIONG S, et al. Role of secondary structures in the gelation of porcine myosin at different pH values[J]. Meat Science, 2008, 80(3): 632-639.
[31] QIU C, XIA W, JIANG Q. Pressure-induced changes of silver carp (Hypophthalmichthysmolitrix) myofibrillar protein structure[J]. European Food Research and Technology, 2014, 238(5): 753-761.
[32] LEFEVRE F, FAUCONNEAU B, THOMPSON J W, et al. Thermal denaturation and aggregation properties of Atlantic salmon myofibrils and myosin from white and red muscles[J]. Journal of Agricultural and Food Chemistry, 2007, 55(12): 4 761-4 770.
[33] LIU R, ZHAO S, YANG H, et al. Comparative study on the stability of fishactomyosin and pork actomyosin[J]. Meat Science, 2011, 88(2): 234-240.
[34] 邱春江. 超高压对鲢鱼中关键酶与结构蛋白质构影响的研究[D]. 无锡:江南大学, 2014.
[35] 蒋将. pH 偏移处理诱导熔球态大豆蛋白的结构变化及功能性质的改善 [D]. 无锡:江南大学, 2011.
[36] 费英,韩敏义,周光宏,等. pH 对肌原纤维蛋白二级结构及其热诱导凝胶特性的影响[J]. 中国农业科学, 2010, 43(1): 164-170.
[37] AN H, PETERS M Y, SEYMOUR T A. Roles of endogenous enzymes insurimi gelation[J]. Trends in Food Science amp; Technology, 1996, 7(10): 321-327.
EffectofpHonthefunctionalpropertiesofrabbitmyofibrillarprotein
ZHOU Xin-ya1, HE Zhi-fei1,2, LI Hong-jun1,2*, WANG Zhao-ming1
1(College of Food Science, Southwest University, Chongqing 400715, China) 2(Chongqing Engineering Research Center of Regional Food,Chongqing 400715,China)
This study investigated the effects of different pH conditions on the function of myofibrillar protein in rabbit meat and the correlation between functional indexes of myofibrillar protein and mechanism of protein tertiary structure. It was found that, with the pH approaching the isoelectric point range, the aromatic amino acids inside the protein were exposed and the tertiary structure of the protein was unfolded; the surface hydrophobicity became larger, which resulted in the increase of the hydrophobic interaction between proteins. Changes in myofibrillar protein structure causes the decrease of protein solubility and emulsifying activity as well as emulsion stability. At the same time, this structural change leads to the change of myofibrillar protein rheological properties. The decrease of pH leads to the decrease of shear stress, and obvious shear stress changes at near isoelectric point. With the decrease of pH, the hardness of myogenic protein gel increases and becomes smaller at near isoelectric point. At the same time, the gel retention is decreased while gel whiteness is increased.
pH; rabbit meat; myofibrillar protein; functional properties
10.13995/j.cnki.11-1802/ts.014272
硕士研究生(李洪军教授为通讯作者,E-mail: 983362225@ ̄qq.com)。
重庆市特色食品工程技术研究中心能力提升项目(cstc2014pt-gc8001);2017年国家自然科学基金项目(31671787)
2017-03-09,改回日期:2017-04-25

