仿刺参采苗板上细菌的分离与鉴定
卢晓平,许艳蕊,范秋苹,王春蕾,郝鲁江
(齐鲁工业大学 山东省微生物工程重点实验室,山东 济南 250353)
仿刺参采苗板上细菌的分离与鉴定
卢晓平,许艳蕊,范秋苹,王春蕾,郝鲁江*
(齐鲁工业大学 山东省微生物工程重点实验室,山东 济南 250353)
为了解仿刺参采苗板时期细菌的多样性,对分离自仿刺参采苗板上的细菌进行了分离和鉴定。应用常规生理生化鉴定、16S rDNA序列分析和构建系统发生树对其进行分子鉴定。结果表明:共分离得到19株海洋细菌,鉴定为7个属,包括短芽孢杆菌属(Brevibacillussp.)、假交替单胞菌属(Pseudoalteromonassp.)、Cobetia属、肠杆菌属(Enterobactersp.)、芽孢杆菌属(Bacillussp.)、普罗威登斯菌属(Providenciasp.)和海洋螺菌属(Oceanospirillaceaesp.)。从海洋环境中分离筛选细菌对海洋资源的开发与利用具有重要意义,此外对仿刺参育苗时期进行细菌种类的鉴定有助于疾病的预防和治疗,对仿刺参的水产养殖具有一定的指导意义。
仿刺参;细菌;分离鉴定
0 引言
海洋是生命资源的宝库,地球上的生物80%存在于海洋中,海洋生物物种远比陆地生物丰富和复杂[1]。和植物、动物一样,海洋微生物也是重要的海洋自然资源。由于其耐盐、耐冷、耐压、耐碱等优势与特性,海洋微生物具有不同于陆源微生物的各种化学成分,可产生结构新颖、功能独特的化合物[2]。因此对海洋环境中的微生物进行分离鉴定,有助于筛选产活性物质的菌株,也是生产新型医药品的一个潜在来源[3]。大量研究表明,海洋细菌能够分泌多种活性物质,具有各种各样的功能,如抗病毒、抗氧化、抗肿瘤等[4-6]。因此分离海洋细菌,筛选有价值的菌株具有重要意义。
海洋微生物资源的研究开发与应用越来越受到重视,本文对仿刺参采苗板上的细菌进行了分离与鉴定,以期为海洋资源的开发与利用提供一定的参考。
1 材料和方法
1.1 材料
样品取自山东荣成寻山海珍品养殖场,自开始投放幼苗附着基开始,到幼苗从附着基上剥离,每隔一周采集样品一次,共采集3个苗期采苗板上样品(表1),将采集自仿刺参采苗板上的样品采用梯度稀释法用无菌海水稀释为1 000,10 000和100 000倍,采用涂布平板法接入2216E固体培养基中,置于25 ℃培养箱中倒置培养24~48 h。仔细观察平板上细菌菌落形态,挑取显著差异的菌落,采用平板划线法纯化得到异养菌。然后将其转接入含有80%甘油的离心管中于4 ℃保存备用。将分离得到的细菌命名为RS1~RS3,WS1,WS2,PS8,RSG1,RB1~RB6和PB1~PB6。

表1 样品采集时间表Tab.1 Time of samples collected
1.2 培养基
固体培养基:Zobell 2216E培养基:蛋白胨 5 g,酵母膏 1 g,磷酸铁 0.01 g,琼脂 17 g,海水素 35 g,蒸馏水 1 L,调节pH至7.6~7.8。
液体培养基:Zobell 2216E培养基:蛋白胨5 g,酵母膏 1 g,磷酸铁 0.01 g,海水素 35 g,蒸馏水1 L,调节pH至7.6~7.8。
1.3 细菌的鉴定
1.3.1 细菌形态学鉴定
观察细菌菌落形态、革兰氏染色和显微镜观察细菌形态[7]。
1.3.2 生理生化鉴定
参照文献[8]对细菌进行淀粉水解试验、V-P试验、甲基红试验、明胶液化试验、硫化氢试验、吲哚试验、柠檬酸盐利用试验。
1.4 海洋细菌DNA的提取
按照说明书使用细菌基因组DNA快速抽提盒(上海生工生物有限公司)提取基因组DNA,取3 μL DNA产物进行电泳,并将产物于-20 ℃保存。
1.5 16S rDNA基因的PCR扩增
以上述方法提取的DNA为模板进行16S rDNA基因片段的扩增,所使用的引物为GM5F和907R,所用引物由上海生工生物工程有限公司合成。PCR反应体系为25 μL,其中10×Buffer 2.5 μL,Mg2+1 μL,dNTP 0.5 μL,GM5F 1 μL, 907R 1 μL,DNA 1 μL,Taq酶 0.5 μL。PCR条件为94 ℃ 5 min;94 ℃ 30 S,55 ℃ 1 min,72 ℃ 1 min,30 个循环;72 ℃ 10 min,4 ℃保存。
反应结束后,取3 μL PCR产物进行电泳。0.5×TBE为电泳缓冲液,1.0%琼脂糖凝胶,100 V电泳30 min,在紫外灯下观察结果,记录照片。
将上述所得PCR产物送往上海生工公司进行测序,得到序列后,将序列输入到NCBI数据库(http://blast.ncbi.nlm.gov)进行序列比对,使用软件BioEdit, clustal 1.83和MEGA 4,通过Neighbor-joining构建菌株的系统发生树[9-10]。
2 结果与分析
2.1 菌株形态学鉴定结果
经分离纯化共分离出19株菌,其中16株是革兰氏阴性菌,3株为革兰氏阳性菌。菌落形态大多是圆形,少数为片状;菌落颜色以乳黄色和淡乳白色为主,少数为无色;菌落形状多为隆起,边缘较为圆整,少数呈触手状;菌落多为不透明;少数具有迁移性;菌体形状多为杆状。19株细菌具体形态学特征见表2。
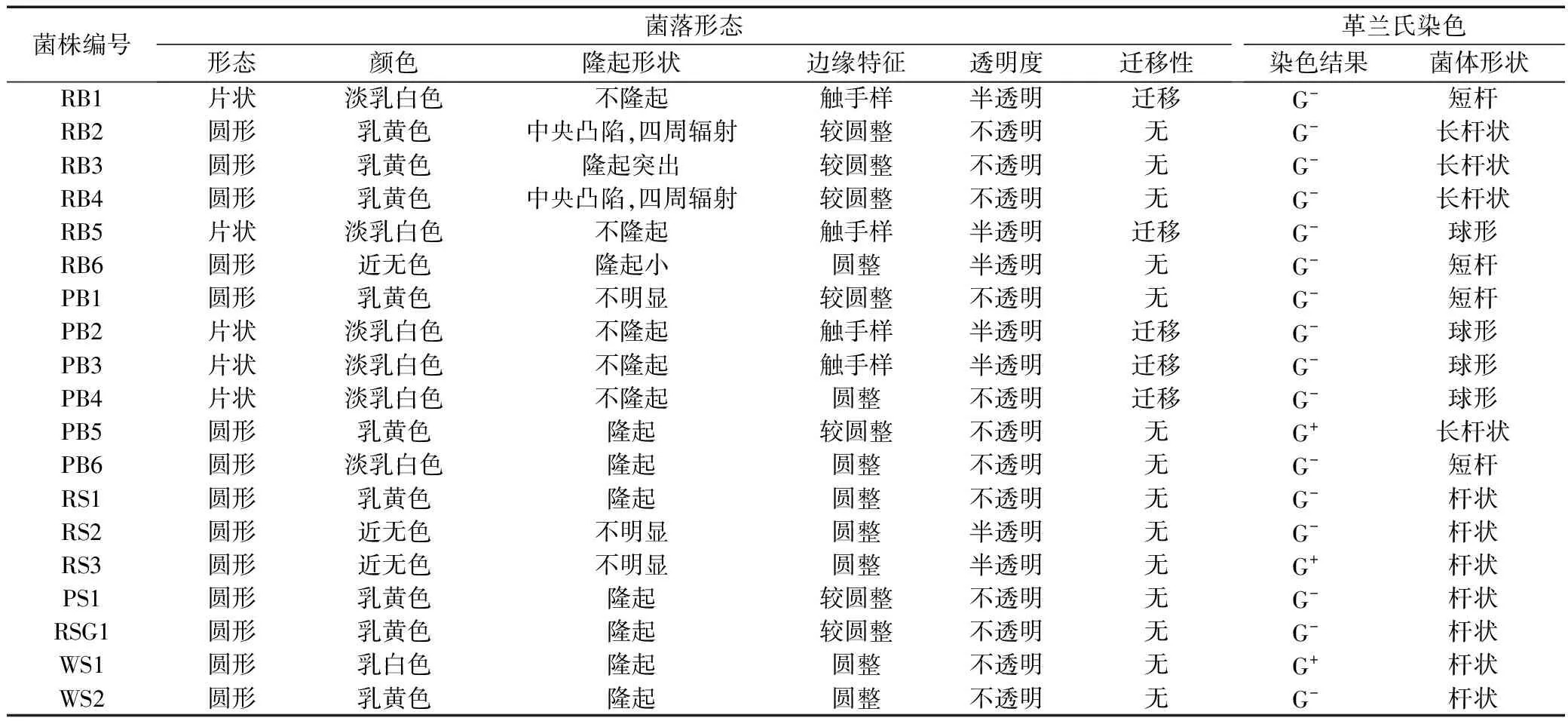
表2 菌株的形态特征Tab.2 Morphological characteristics of strains
2.2 菌株生理生化结果
对分离纯化出的19株细菌进行生理生化鉴定,结果如表3所示。其中PB1淀粉水解试验、甲基红试验、硫化氢试验、吲哚试验、V-P试验、柠檬酸盐利用试验结果均为阴性,明胶液化试验结果为阳性,参考文献[7],初步判断PB1为假交替单胞菌属。
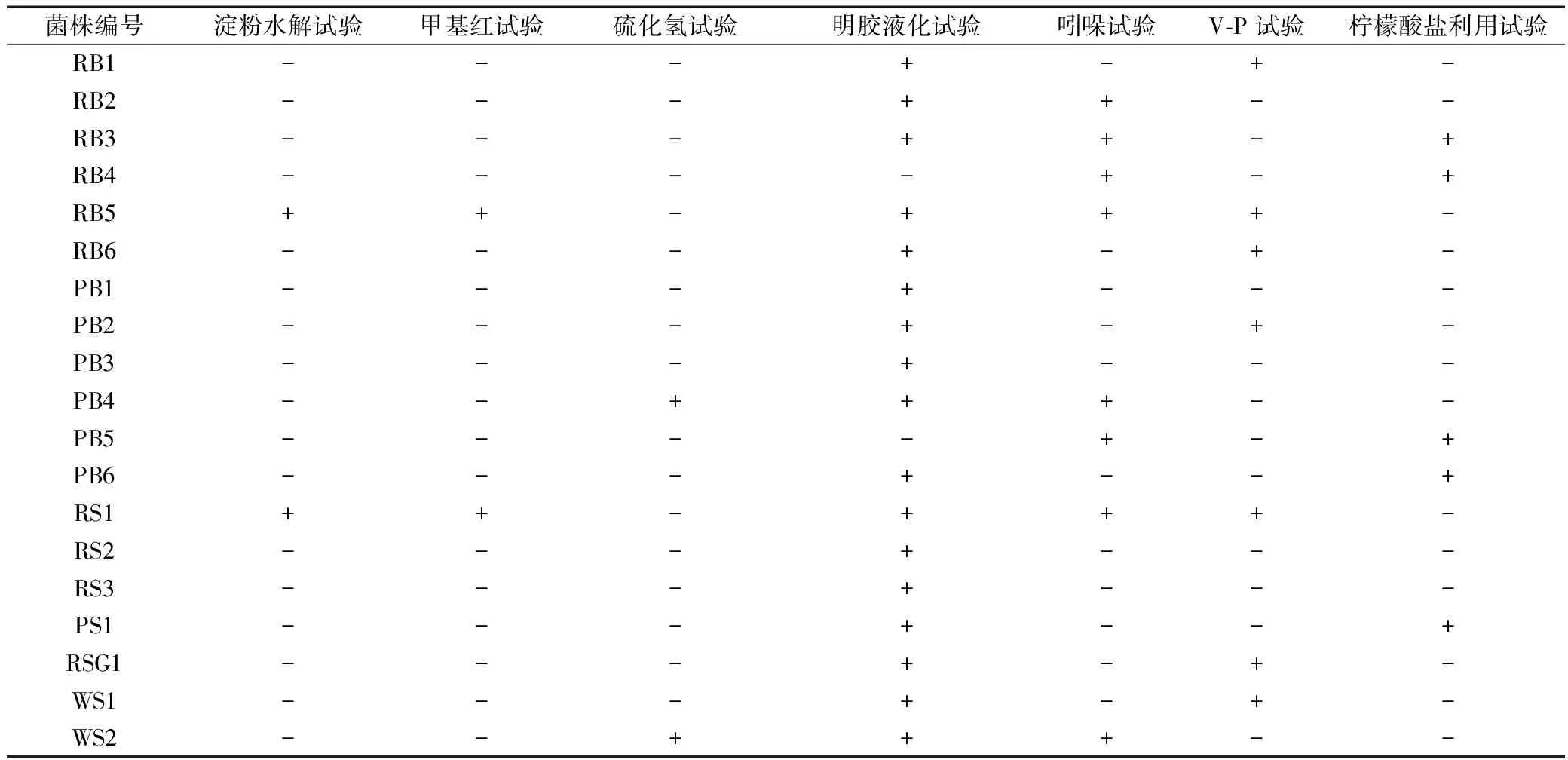
表3 菌株的生理生化特征Tab.3 Physiological and biochemical characteristics of strains
注:“+”为阳性反应;“-”为阴性反应
2.3 分子鉴定
2.3.1 细菌DNA的提取
利用细菌基因组DNA快速抽提盒对19株细菌进行总DNA提取,经过琼脂糖凝胶电泳检测提取的部分DNA结果如图1所示,位于23 kb处有一明显条带,可用于后续PCR反应等。
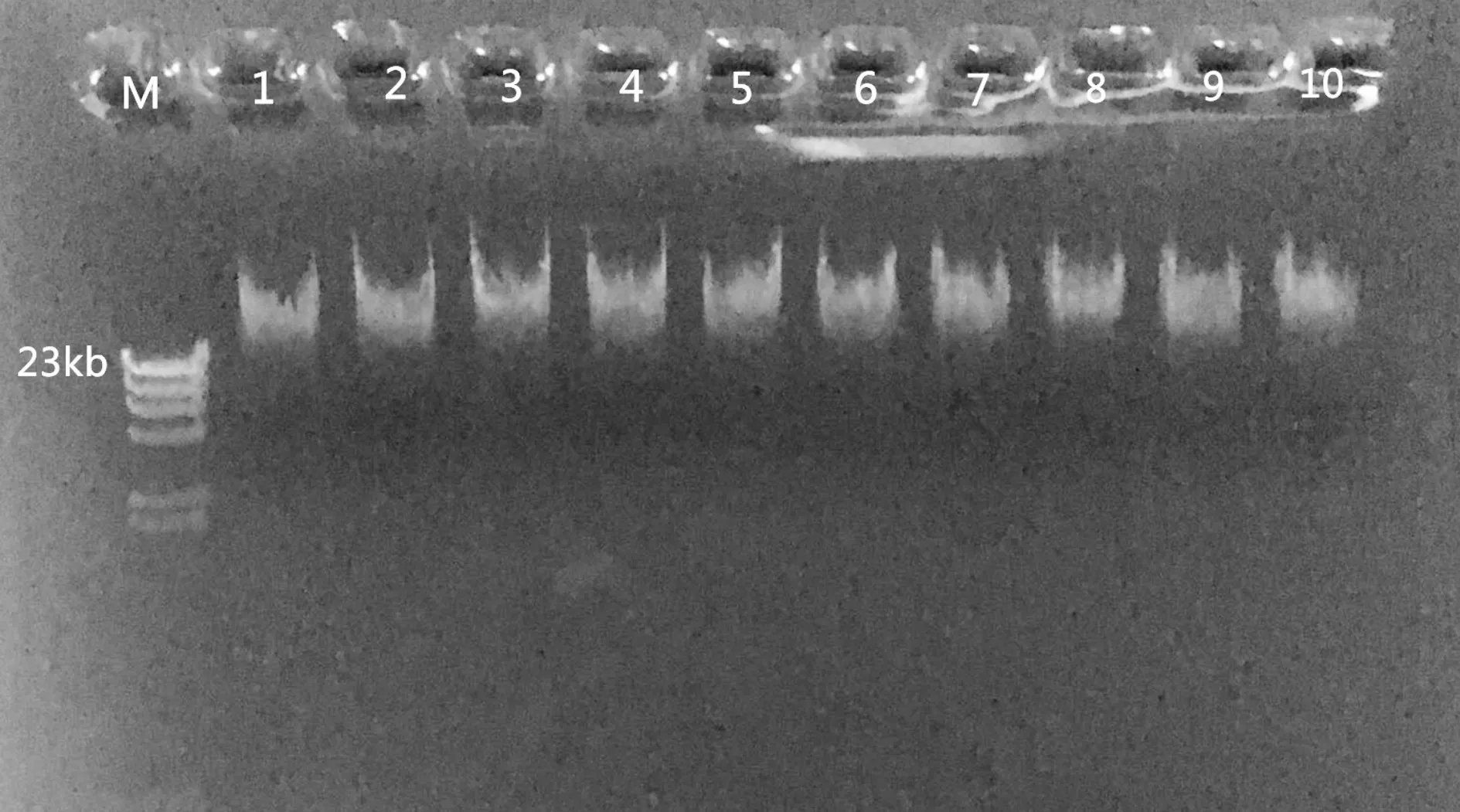
图1 部分细菌DNA的提取结果Fig.1 Profile of genomic DNA extracted from partial bacterial strainsM: λ-DNA/Hind III。泳道1~10为10株不同的细菌菌株M: λ-DNA / Hind III. Lane 1-10 is 10 strains of different bacterial strains
2.3.2 16S rDNA扩增结果
利用细菌通用引物GM5F和907R对19株细菌基因组DNA进行扩增,从图2中可以看出在600 bp左右有一条清晰的条带,说明细菌的DNA模板经过PCR扩增都得到了特异性扩增。
2.3.3 测序结果分析
将PCR产物送往上海生工生物工程有限公司进行测序,将测得的结果与NCBI已知的16S rDNA 进行同源性比对,下载同源性最高的16S rDNA序列,利用MEGA 5.0进行序列分析,构建系统发生树,如图3所示。一般来说16S rDNA 序列相似性高于99%,属于同一种,相似性低于98%可以认为属于不同的种,相似性低于93%~95%,可以认为属于不同的属[11-12]。从NCBI中下载的所有序列相似度均在97%以上,系统发生树显示了菌株之间的亲缘关系,结合之前的形态学鉴定确定了19株细菌在微生物系统发育学上的地位,结果表明19株细菌属于7个属,包括短芽孢杆菌属(Brevibacillus)、假交替单胞菌属(Pseudoalteromonassp.)、Cobetia属、肠杆菌属(Enterobactersp.)、芽孢杆菌属(Bacillussp.)、普罗威登斯菌属(Providenciasp.)和海洋螺菌属(Oceanospirillaceae sp.)。
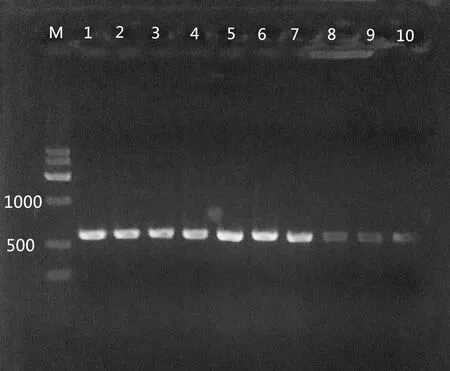
图2 部分细菌16S rDNA扩增产物Fig.2 Partial bacterial 16S rDNA amplification productM: DNA Marker G。泳道1~10为不同菌株16Sr DNA扩增产物M: DNA Marker G. Lanes 1-10 is16Sr DNA amplification products of different strains
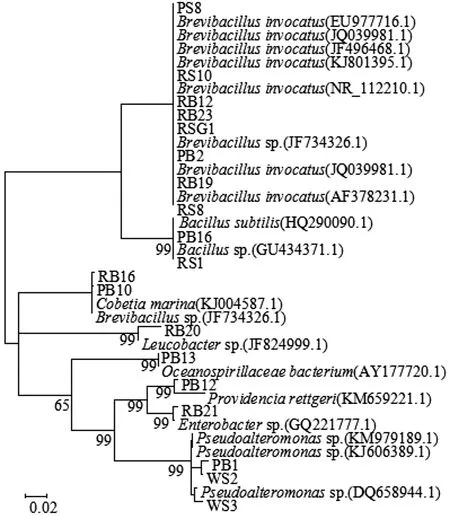
图3 19株细菌16S rDNA序列的系统发生树Fig.3 Phylogenetic tree of bacterial 16S rDNA from 19 typical strains
3 讨论与结论
海洋是生命资源的宝库,海洋微生物多样性是生物多样性的重要组成部分。海洋微生物不仅参与物质能量循环[13],还能产生新型的活性物质,为现代化工业生产提供重要的药物资源和酶资源[14]。近年来,随着全球气候变暖,海洋微生物对气候变化的影响研究对于生态系统的保护具有一定的指导意义[15]。因此,海洋微生物多样的研究一直是国内外学者的研究重点[16]。汪琳 等[17]对九孔鲍鲍苗脱板期养殖环境中细菌的多样性进行研究,分离得到3大类群9个属的细菌,发现这些细菌与分离自发病的水产养殖生物的细菌最相似,表明这些细菌与水产病害存在一定的关系。其中分离得到的假交替单胞菌属(Pseudoalteromonassp.)和Cobetia属与本文分离得到的细菌同属,提示本研究分离到的细菌可能与仿刺参水产养殖灾害有关,这些细菌是否是引起仿刺参发病的致病菌以及发病的具体机制还需要深入的后续研究加以证实。
海洋微生物的开发利用,关键是从海洋中分离得到产生特殊物质的菌株,本文从仿刺参采苗板上得到的菌株做了初步的分离鉴定,共鉴定出7个属,查阅文献得知,假交替单胞菌属能够产生胞外多糖、胞外酶、毒素等活性物质[18],其中胞外多糖能够帮助细菌附着在寄主表面增强其生存机会[19],细菌分泌高浓度的胞外多糖也可保护自身免受冰晶的伤害[20]。LI et al[21]对Pseudoalteromonassp. SM9913所产胞外多糖的功能进行了研究,发现其具有絮凝和吸附作用。本研究对分离得到的假交替单胞菌进行了菌株发酵试验,利用苯酚硫酸法检测发现其具有产生胞外多糖的潜力,下一步将进行胞外多糖的功能性试验,进一步挖掘海洋微生物的潜力,为海洋微生物的资源开发利用做出贡献。
[1] SUN Hai-hong, MAO Wen-jun, QIAN Ye-miao, et al. Advances on the characteristics and bioactivities of exopolysaccharides from marine microorganism[J].Marine Sciences,2011,35(11):134-138.
孙海红,毛文君,钱叶苗,等.海洋微生物活性胞外多糖的研究进展[J].海洋科学,2011,35(11):134-138.
[2] JIANG Jian, YANG Bao-ling, YUAN Qi, et al. Isolation and identification of marine bacteria with antimicrobial activity[J].Biotechnology,2004,14(6):28-30.
姜健,杨宝灵,元起,等.具有抑菌活性的海洋细菌的分离与鉴定[J].生物技术,2004,14(6):28-30.
[3] BERNAN V S, GREENSTEIN M, MAIESE W M. Marine microrgnisms as a source of new natural products[J]. Applied Microbial,1997,43(4):57-90.
[4] MATSUDA M, SHIGETA S, OKUTANI K. Antiviral activities of marine pseudomonas polysaccharides and their oversulfated derivative[J].Marine Biotechnology,1999,1(1):68-73.
[5] SUN Cheng, WANG Jian-wen, LEI Fang, et al. Free radical scavenging and antioxidant activities of EPS2,an exopolysaccharide produced by a marinefilamentousfungusKeissleriellasp. YS 4108[J]. Life Science,2004,75(9):1 063-1 073.
[6] LI Jiang, CHEN Kao-shan, LI Ying-yu, et al. Phylogenetic analysis of antarctic bacteriumPseudoalteromonassp. S-15-13 and the effect of its extracellular polysaccharide on proliferation of murine lymphocytes[J].Chinese Journal of Marine Drugs,2006,25(1):1-5.
李江,陈靠山,李莹玉,等.南极细菌Pseudoalteromonassp.S-15-13的分子鉴定及其胞外多糖促进小鼠脾淋巴细胞转化的作用[J].中国海洋药物杂志,2006,25(1):1-5.
[7] DONG Xiu-zhu, CAI Miao-ying. Common bacterial system identification manual[M].Beijing:Science Press,2001:365-375.
东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:365-375.
[8] ZHOU De-qing.Microbiology experiment tutorial[M].2nd ed. Beijing: Higher Education Press,2006:367-385.
周德庆.微生物学实验教程[M].第2版.北京:高等教育出版社,2006:367-385.
[9] THOMPSON J D, GIBSON T J, PLEWNIAK F, et al. The Clustal-X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research,1997,25(24):4 876-4 882.
[10] SAITOU N, NEI M. The neighbor-joining method: a new method for reconstructing phylogenetic trees[J]. Molecular Biology and Evolution,1987,4(4):406-425.
[11] DEVEREUX R, HE S H, DOYLE C L, et al. Diversity and origin of Desulfovibrio species: Phylogenetic definition of a family[J].J Bacteriol,1990,172(7):3 609-3 619.
[12] FRY N K, WARWICK S, SAUNDERS N A, et al. The use of 16S ribosomal RNA analyses to investigate the phylogeny of the family Legionellaceae[J].J Gen Microbiol,1991,137(5):1 215-1 222.
[13] DAS S, MANGWANI N. Ocean acidification and marine microorganisms: Responses and consequences[J].Oceanologia,2015,57(4):349-361.
[14] LI Wei, ZHENG Wei, ZHENG Tian-ling. Advances in research of marine microbial diversity and molecular ecology[J].Microbiology China,2013,40(4):655-668.
李炜,郑伟,郑天凌.海洋微生物多样性及其分子生态学研究进展[J].微生物学通报,2013,40(4):655-668.
[15] AZAM F, WORDEN A Z. Microbes, molecules, and marine ecosystems[J].Science,2004,303(5664):1 622-1 624.
[16] XUE Chao-bo, WANG Guo-liang, JIN Shan, et al.Advances in marine microbial diversity research[J].Advances in Marine Science,2004,22(3):377-384.
薛超波,王国良,金珊,等.海洋微生物多样性研究进展[J].海洋科学进展,2004,22(3):377-384.
[17] WANG Lin, YANG Qiu-ming, HAO Jian-dong, et al.Isolation and identification of bacteria from the environment of mass mortality during Haliotisdiversicolorsupertextalarvae stage[J].Journal of Oceanography in Taiwan Strait,2009,28(2):210-216.
汪琳,杨秋明,郝剑东,等.九孔鲍鲍苗脱板期养殖环境细菌分离及分子鉴定[J].台湾海峡,2009,28(2):210-216.
[18] XI Yu, ZHU Da-heng, LIU Hong-tao, et al.Advances onPseudoalteromonasspecies and their extracellular bioactive compounds[J].Microbiology China,2005,32(3):108-112.
席宇,朱大恒,刘洪涛,等.假交替单胞菌及其胞外生物活性物质研究进展[J].微生物学通报,2005,32(3):108-112.
[19] POLI A, ANZELMO G, NICOLAUS B. Bacterial exopolysaccharides from extreme marine habitats: production, characterization and biological activities[J]. Mar Drugs,2010,8(6):1 779-1 802.
[20] NICHOLS C M, lARDIRE S G, BOWMAN J P, et al. Chemical characterization of exopolysaccharides from Antarctic marine bacteria[J]. Microb Ecol,2005,49(4):578-589.
[21] LI W W, ZHOU W Z, ZHANG Y Z, et al. Flocculation behavior and mechanism of an exopolysaccharide from the deep-sea psychrophilic bacteriumPseudoalteromonassp. SM9913[J]. Bioresour Technol,2008,99(15):6 893-6 899.
IsolationandidentificationofbacteriainApostichopusjaponicusseedlinginaquacultureenvironments
LU Xiao-ping, XU Yan-rui, FAN Qiu-ping, WANG Chun-lei, HAO Lu-jiang*
(QiluUniversityofTechnology,ShandongProvincialKeyLaboratoryofMicrobialEngineering,Ji’nan250353,China)
To understand the diversity of bacteria during the seedling stage ofApostichopusjaponcicus, bacteria were isolated and identified. On the basis of the morphology, physiology and biochemistry, 16S rDNA sequence homology analysis, the 19 marine bacteria were identified to beBrevibacillussp.,Pseudoalteromonassp.,Cobetiasp.,Enterobactersp.,Bacillussp.,Providenciasp., andOceanospirillaceaesp.. Isolation and screening of bacteria from the marine environment is of great significance to the development and utilization of marine resources. In addition, the identification of the bacterial species in the period of seedling stage ofApostichopusjaponcicusis helpful to the prevention and treatment of disease, and it has a certain guiding significance for the aquaculture ofApostichopusjaponcicus.
Apostichopusjaponcicus; bacteria; isolation and identification
卢晓平,许艳蕊,范秋苹,等.仿刺参采苗板上细菌的分离与鉴定[J].海洋学研究,2017,35(3):85-90,
10.3969/j.issn.1001-909X.2017.03.010.
LU Xiao-ping,XU Yan-rui,FAN Qiu-ping, et al. Isolation and identification of bacteria inApostichopusjaponicusseedling in aquaculture environments[J].Journal of Marine Sciences,2017,35(3):85-90, doi:10.3969/j.issn.1001-909X.2017.03.010.
2016-09-19
2017-02-26
山东省自然科学基金项目资助(ZR2012CM019)
卢晓平(1992-),男,山东胶州市人,主要从事海洋细菌活性物质筛选方面的研究。E-mail:15288863082@163.com
*
郝鲁江(1972-),男,副教授,主要从事海洋细菌活性物质的筛选、微生物酶资源的开发等研究。E-mail:lujiang_hao@163.com
Q93-331
A
1001-909X(2017)03-0085-06
10.3969/j.issn.1001-909X.2017.03.010

