2013年夏季西南印度洋表层浮游动物群落分布格局
杨 娟,吕 靖,张荣欣,苏 新,孙 栋
(1.中国地质大学(北京) 海洋学院,北京,100083; 2. 国家海洋局 第二海洋研究所,浙江 杭州 310012; 3. 海洋生态系统与生物地球化学海洋局重点实验室,浙江 杭州 310012)
2013年夏季西南印度洋表层浮游动物群落分布格局
杨 娟1,吕 靖1,张荣欣1,苏 新1,孙 栋2,3
(1.中国地质大学(北京) 海洋学院,北京,100083; 2. 国家海洋局 第二海洋研究所,浙江 杭州 310012; 3. 海洋生态系统与生物地球化学海洋局重点实验室,浙江 杭州 310012)
本研究基于2013年夏季“大洋一号”船大洋第30航次西南印度洋海区科学考察走航线路,对西南印度洋21°S到38°S海域表层浮游动物群落进行连续采样调查,研究了该海域表层中型浮游动物群落结构和物种多样性及空间分布格局。结果显示,研究海域表层中型浮游动物群落组成包括:桡足类、磷虾类、端足类、十足类、介形类、毛颚动物、被囊类、异足类、翼足类、刺胞动物及多毛类等11大类,总计50属69种;优势类群为桡足类(69%)和磷虾类(27%)。多样性指数随经度和纬度的变化特征:H′、D多样性指数及J均匀度指数随纬度的升高均呈下降趋势;在经度梯度上,几种多样性指数也大致呈现出东高西低的趋势。聚类分析表明,研究区可大致以36°S附近为界划分为南部和北部两大类群,分别以北部桡足类(平均粒径小),南部磷虾类(平均粒径大)Euphausia属为优势群落。群落相似性结果反映出,南部类群与南极克罗克海峡和南极长城湾水域群落,北部类群与西北印度洋海域群落的联通性不高。
西南印度洋;浮游动物;群落结构;空间格局;相似性
0 引言
海洋浮游动物因其极大的生物量和较高的多样性(包括物种多样性、生活史的多样性和粒径多样性),在大洋生态系统中占据着重要地位。浮游动物的粒径谱能够指示能量沿食物网的传递,构成了海洋能流的重要基础环节;不同粒级浮游生物的营养摄食与代谢过程在海洋生物地球化学循环中发挥着关键作用;而浮游动物群落的物种组成和群落结构还受到水环境中的“上行效应”和“下行效应”的影响。因此,浮游动物常被作为研究大洋生态系统能量流动规律、海洋生态学动力学模拟以及环境胁迫响应机制研究的重要指标[1-3]。全球已描述入库的海洋浮游动物(主要为终生性浮游动物)大约为7 000种。在众多浮游生物类群中,海洋桡足类(Copepods)几乎在所有的季节和海洋环境中广泛分布,因其极高的数量以及在初级生产者与更高级捕食者间的紧密联系,而被视为海洋生态系统最重要的次级生产者,在大洋生态系统能流中发挥着显著作用[4]。类似具有显著地位的还有磷虾类(Eupausiacea)。然而越来越多的研究表明,小型浮游动物,特别是小型海洋桡足类(<1 mm)才是构成大洋生态系统最丰富的类群,他们不仅是构成浮游生物群落的重要组成部分,其高生长速率对群落生产力也造成很大影响[5-7]。
相对于陆地,海洋浮游生物的地理隔离较少,且分布更加分散,因此,浮游动物的生物地理分区也相对较少[8]。对全球或区域性大洋生物类群(大部分是浮游生物类群)的地理分布格局的研究可追溯到20世纪40年代。代表性的成果如:LONGHURST[9]提出4个主要生态区(ecological domains),约50个生物地球化学省(biogeochemical provinces);近期,SPALDING et al[10]提出的将全球大洋生物地理分布划分为4界(realms) 37个省。值得一提的是,任何对大洋生物地理进行分区的研究都是建立在不断发展的数据收集基础之上的。例如:20世纪60年代以后,全球建立了多个大尺度的长时间序列CPR(浮游生物连续采样记录仪)调查观测区,取得丰富的全球大尺度浮游动物基础数据[11-16]。国际海洋生物普查计划(CoML)自2000年启动至今,极大地丰富了海洋生物多样性数据库[17]。但目前全球大洋生物地理分区研究仍以气候带、洋流与水团、温、盐及营养盐等非生物分类手段为主,急待生物分类手段的地理分区研究成果的支持。
近年来随着大洋科考的不断深入,相关大洋浮游生物群落研究成果开始不断涌现[18-25]。自2005年我国在西南印度洋中脊发现第一个水柱浊度异常以来,目前已在超慢速扩张洋脊热液活动区展开了多个航次的调查和研究[26]。与此同时,对这一海区的深海热液生物调查也陆续展开[27-28]。相对而言,对研究区上层浮游动物调查报道较少。据此,本研究以2013年夏季“大洋一号”科学考察船30航次第1航段浮游动物表层样品为对象,分析这一海域浮游动物群落的优势种、多样性、粒径分布特征及其变化规律,这将有利于揭示表层浮游动物群落与深海生物群落的物质、能量联系。其成果不仅对多金属硫化物勘探区的环境保护基线等研究提供重要的数据基础,还将为这一海域精细尺度的生态动力学研究、生物地理分区研究提供基础数据支持。
1 材料与方法
1.1 浮游动物样品的采集
本研究中的表层浮游动物样品来源于2013年12月16至2014年1月5日“大洋一号”科学考察船执行中国大洋30航次科学考察任务期间,利用船底走航水泵连续采集水样获得。采水泵入水管口距水面约3.5 m,在出水管处用小型浮游生物网(网口内径20 cm、网长50 cm、网衣孔径0.064 mm)连续滤水。白天每采集4 h、夜间每采集6 h收集一次样品(各样品的采集时间段分别为6∶00—10∶00、10∶00—14∶00、14∶00—18∶00、18∶00—24∶00和24∶00—6∶00),样品采集后使用终体积分数为8%的中性甲醛溶液固定。考虑到浮游动物的昼夜垂直迁移习性对空间格局分析的影响,样品分析时将每昼、夜采集的3份样品和2份样品分别合并后再进行鉴定分析和计数(合并后共得到31个站位样品)。样品采集纬度范围为21°~38°S,经度范围为49°~80°E。因现场调查时的不可控因素,故最初3个站位(站位1,2,3)仅包括白天采集的样品。站位分布见图1。
1.2 浮游动物样品分析与数据处理
实验室内对各站位样品进行物种鉴定,主要类群的系统分类依据参考文献[29-36]。除了统计浮游动物的物种组成和数量,计算各站位浮游动物物种优势度、群落结构多样性指数、均匀度指数和丰富度指数外,对每个站位浮游动物大类的粒径等级也进行了数量统计,方法是对每个站位样品利用实体镜进行显微拍照测量,并估算样品总体数量和各粒径级百分含量。粒径等级以<200 μm,200 μm~1 mm,1~2 mm,2~10 mm,10~20 mm,>20 mm等几个级别划分。
浮游动物的优势属(种)根据每个属(种)的优势度(Y)来确定:
Y=(ni/N)×fi
(1)
式中:ni为第i种的个体数,N为所有种类总个体数,fi为出现频率。Y≥0.02的种类为优势种类。由于研究区样品采集的地理范围经纬跨度较大,纬度21°~38°S,经度49°~80°E,本研究按照纬度跨度将样品按走航采样编号分为3个地理亚区,即编号1~9,10~15和16~31,计算每个亚区优势种的优势度。
Shannon-Weaver多样性指数计算公式:
(2)
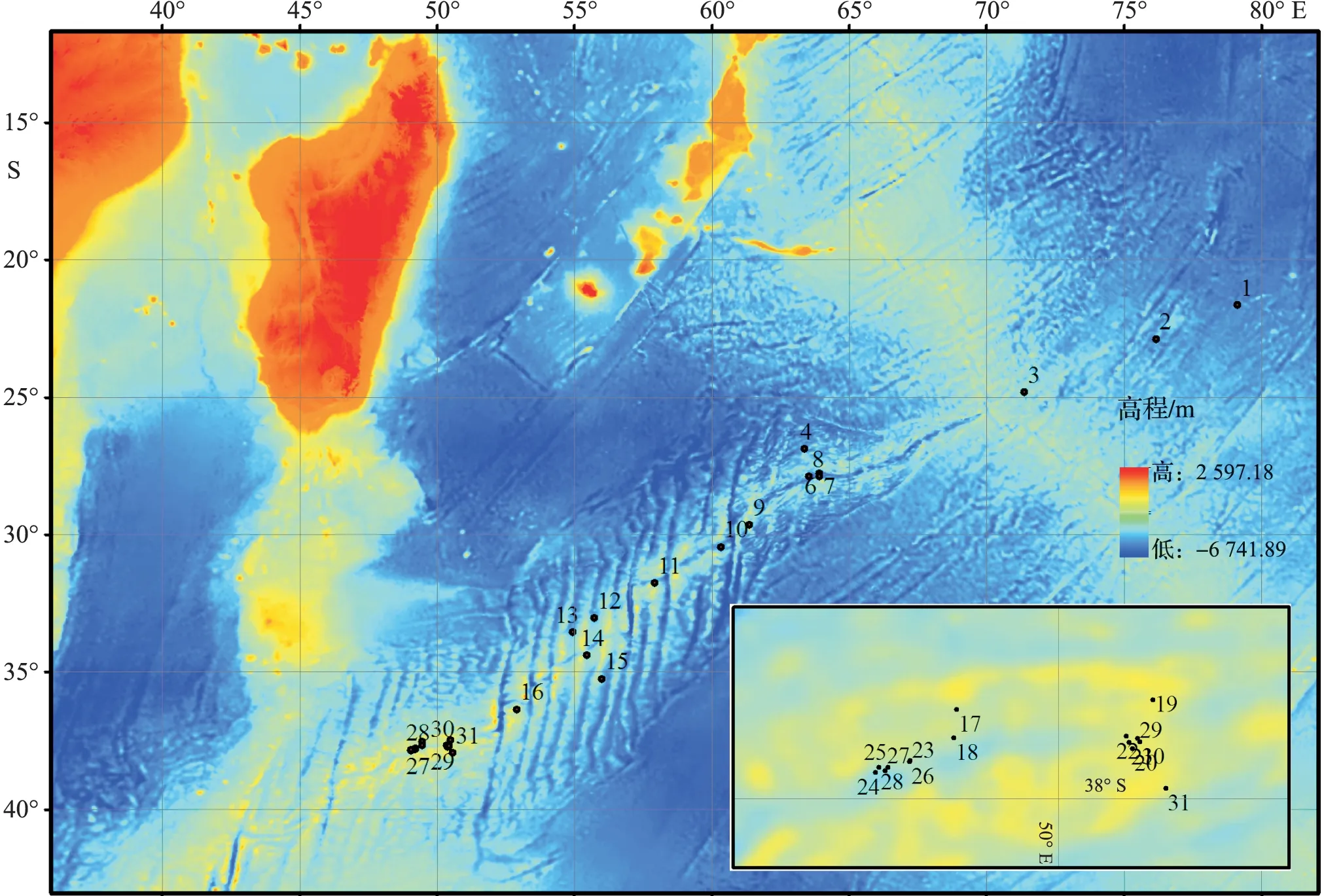
图1 浮游动物采样点分布图Fig.1 The distribution of zooplankton sampling locations底图来源于ETOPO1-海洋水深图The base map was derived from ETOPO1 ocean bathymetry data
式中:H′为多样性指数,S为种类数,ni为第i种的个体数,N为总个体数。
辛普森物种多样性指数的计算公式:
(3)
均匀度采用Pielou均匀度指数计算公式:
J=H′/InS
(4)
式中:J为均匀度指数,S为种类数。J值在0~1之间,接近1,分布均匀;趋于0,分布不均。
丰富度(Richness)指数计算公式:
R=S
(5)
为探讨多样性指数随纬度和经度的变化,根据各站位地理分布特征,将浮游动物样品按空间距离进行分组。考虑到实际采样密度的不均匀性,纬度分组间隔约3°,经度分组间隔最高约8°,最低约1°。计算不同分区的样品平均多样性指数及标准差,并以不同区间样品的平均多样性指数与经度或纬度进行线性或多项式拟合。
此外,聚类分析方法被用于分析研究区内以及研究区与相邻海区浮游动物群落组成的相似性及其空间连通性。选取西北印度洋公海海域(12°~21°30′N,58°~65°E)、南极长城湾附近水域和南极克罗克海峡三个海区[20-21,37],将其与研究区浮游动物属种名录重合出现的浮游动物属种挑选出来,采用0-1数据进行汇总,出现记1,未出现记0。其中,33,32,34号和36,35,37号样品分别代表西北印度洋海域、南极克罗克海峡、南极长城湾附近水域种和属水平的浮游动物样品,分别按照属、种水平的0(无),1(有)数据集进行聚类分析。本文采用了布雷-柯蒂斯距离(Bray-Curtis Measure)法进行聚类分析,利用Primer 6软件完成。布雷-柯蒂斯距离的具体公式为:
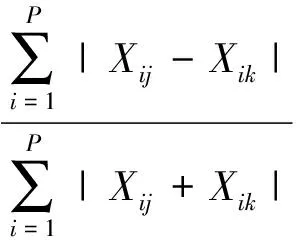
(6)
式中:B代表的是Bray-curtis相异度,相似性系数S=1-B;Xij,Xik代表每个样本中,种类数量标准化并进一步经平方根转换后的数值;P代表总样本数。
2 结果
2.1 浮游动物群落种类组成与优势属种
经鉴定统计,研究区浮游动物包括桡足类、磷虾类、端足类、十足类、介形类、毛颚动物、被囊类、异足类、翼足类、刺胞动物及多毛类等,总计50属69种(含未定种)。其中数量最多的是桡足类和磷虾类,桡足类有23属32种(含未定种),而磷虾类有2属4种(含未定种),名录见附录1。优势度>0.02的种类见表1。
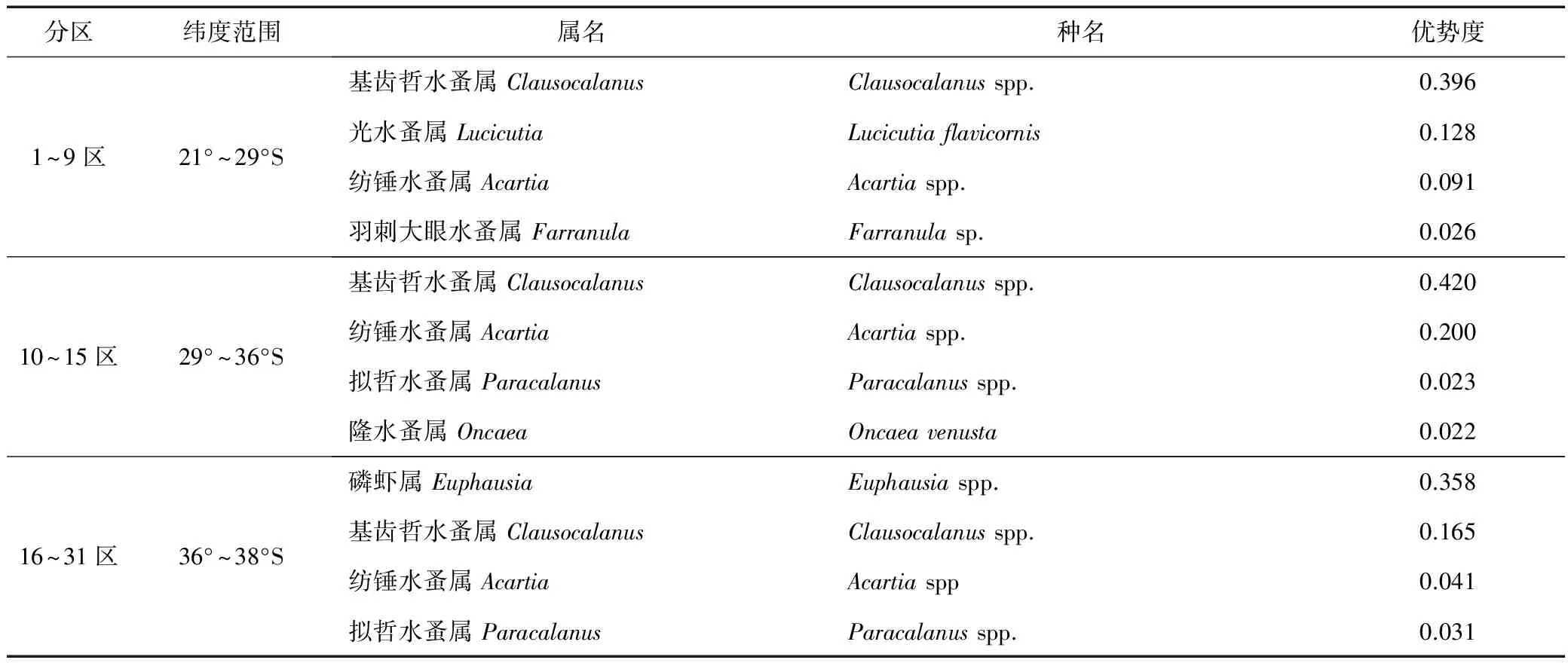
表1 研究海域优势属及优势度Tab.1 Dominant genus and their dominance index in the study area
1~9区(纬度范围21°~29°S)优势度最高的是Clausocalanus属,其次是Lucicutia属,Acartia属和Farranula属;10~15区(纬度范围29°~36°S)优势度最高的也是Clausocalanus属,其次是Acartia属,Paracalanus属和Oncaea属;16~31区(纬度范围36°~38°S),优势度最高的是Euphausia属,其次是Clausocalanus属,Acartia属,Paracalanus属。Clausocalanus属和Acartia属在三个区的优势度都较高,为常见属。1~9区的特有优势属为Farranula属和Lucicutia属;10~15区的特有优势属为Oncaea属;16~31区的特有优势属是Euphausia属。
2.2 浮游动物群落物种组成与粒径级
整个调查海域中,数量占优势的类群是桡足类,占总浮游动物丰度的69%,其次是磷虾类,占27%,二者丰度占到调查区总体的96%。其他浮游动物还包括:端足类、介形类、毛颚动物、刺胞动物、被囊类、异足类、翼足类、多毛类、十足类、仔鱼和鱼卵,但其在数量上要远少于桡足类和磷虾类(图2)。对本调查区的优势类群桡足类和磷虾类进行粒径分级统计发现,磷虾类粒径大,相对多度以夜间占优势,而桡足类粒径小,相对多度以白天占优势,结果见图3和图4。
2.3 浮游动物群落的多样性指数与地理分布
2.3.1 多样性指数
总体而言,研究区的H′多样性指数范围在0~2.5之间。研究区大部分样品的H′多样性指数集中分布于1≤H′ ≤2,占总样品数的71%,多样性指数H′ >2的样品包括4,5和13号,多样性指数H′ <1的样品为21,25,28,22,24和26号(图5)。
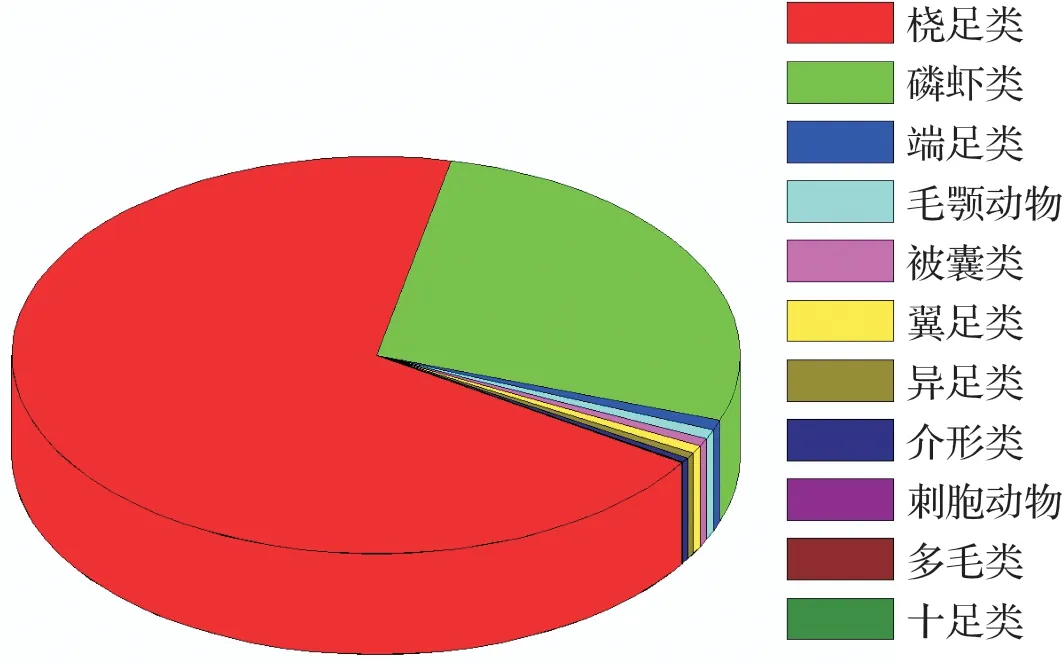
图2 研究区的浮游动物群落类群组成Fig.2 Groups composition of zooplankton in the study area
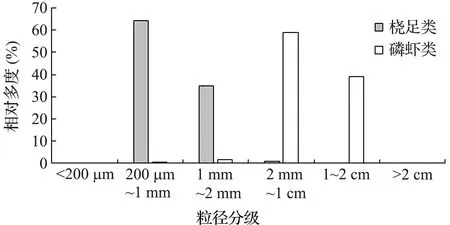
图3 优势类群粒径分布Fig.3 Particle size distribution of dominant groups
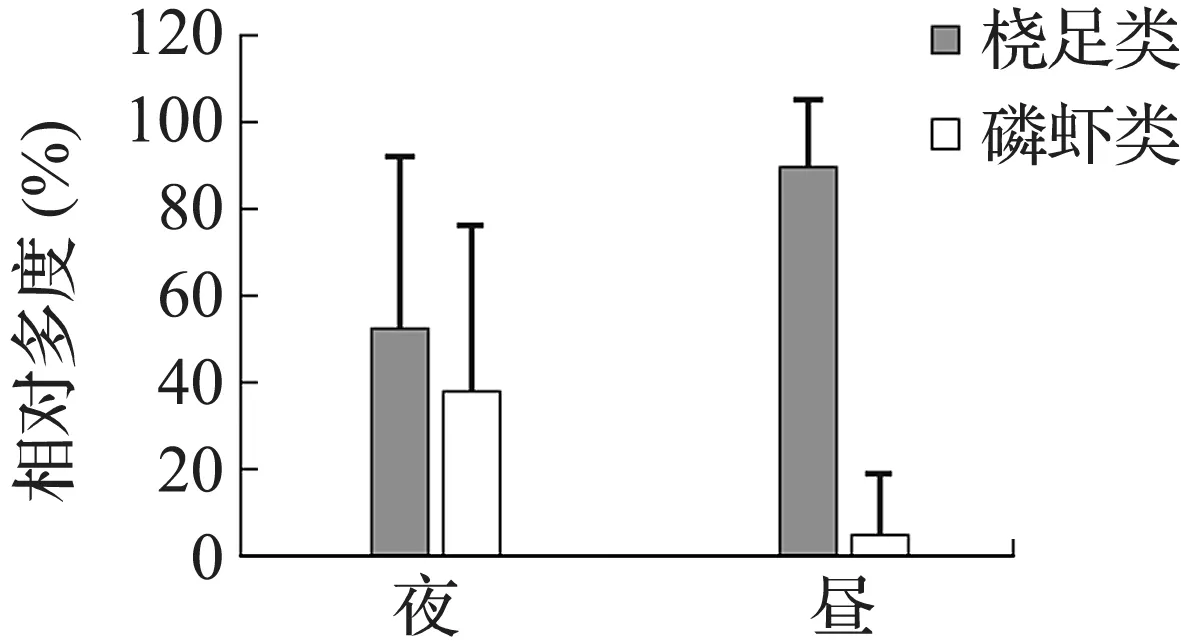
图4 优势类群的昼夜分布Fig.4 Circadian distribution of dominant groups
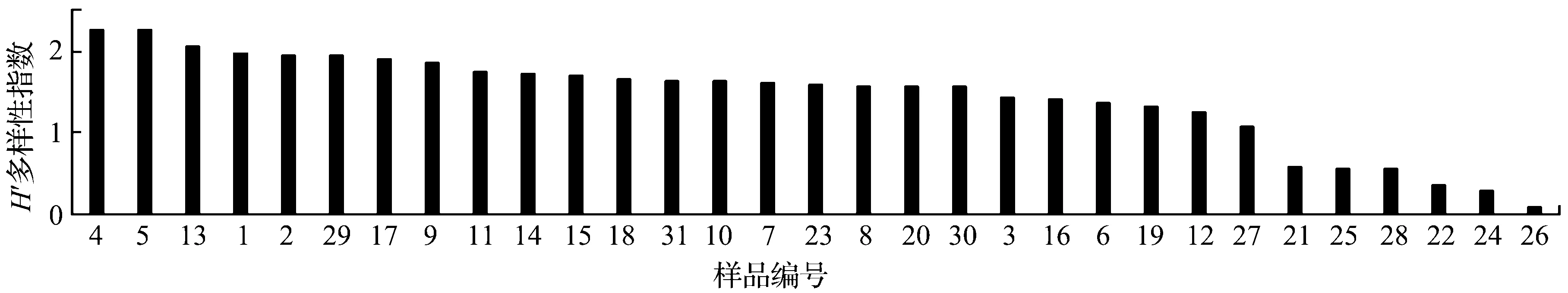
图5 研究区样品H′多样性排序图Fig.5 The sorting of H′ diversity index in the study area
2.3.2 多样性指数与经纬度的关系
从图6a~6d可见,除丰富度指数外,H′,D多样性指数,J均匀度指数均随纬度的变化趋势为线性相关,即随着纬度的增高,指数下降;越接近于赤道,群落H′和D多样性指数越高,均匀度越接近于1,群落分布越均匀。而S丰富度指数与纬度则表现为二次项关系,即位于27°S附近的物种丰富度较高。H′,D多样性指数和J均匀度指数与纬度的相关性较高,相关系数均在0.6以上。同时,较高纬度区域多样性指数的标准差较大,这与较高纬度区域样品的昼夜优势种的差别较大,夜间样品中磷虾的优势度明显增加有关。
从图6e~6h可见,研究区H′和D多样性指数变化趋势相似。H′和D多样性指数随纬度的降低增高,而随经度的变化趋势表现为:西部较中东部略低,且H′,D多样性指数、S丰富度指数与经度的关系以二次项拟合的相关系数和显著度较高(表2),即位于中部65°E附近的H′,D多样性指数和S丰富度指数显著较高。J均匀度指数随经度呈不显著线性正相关。
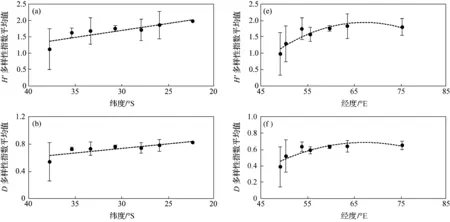
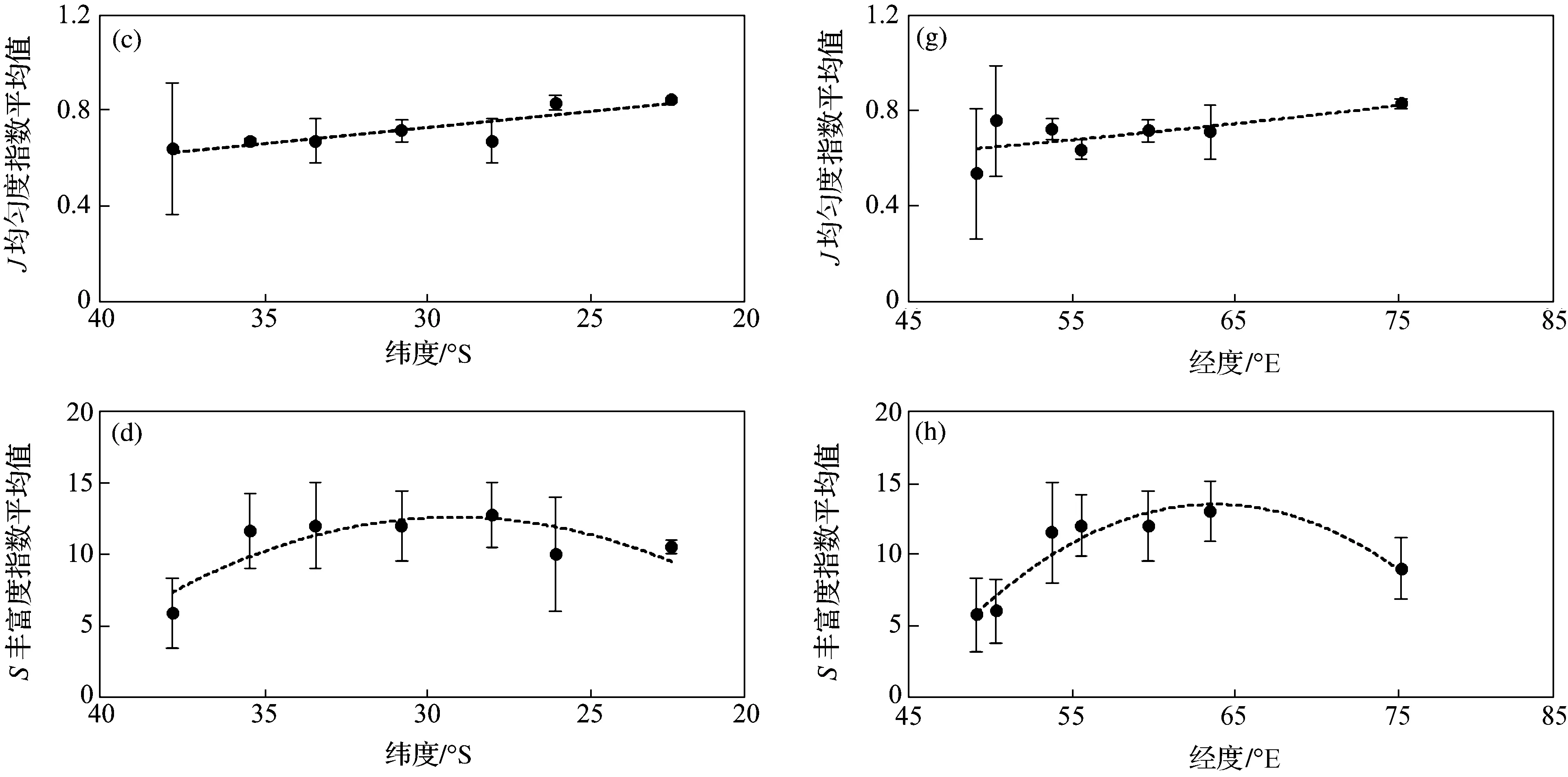
图6 西南印度洋表层浮游动物群落多样性指数的分布变化Fig.6 Distribution variation of diversity indices of zooplankton communities in the Southwest Indian Ocean
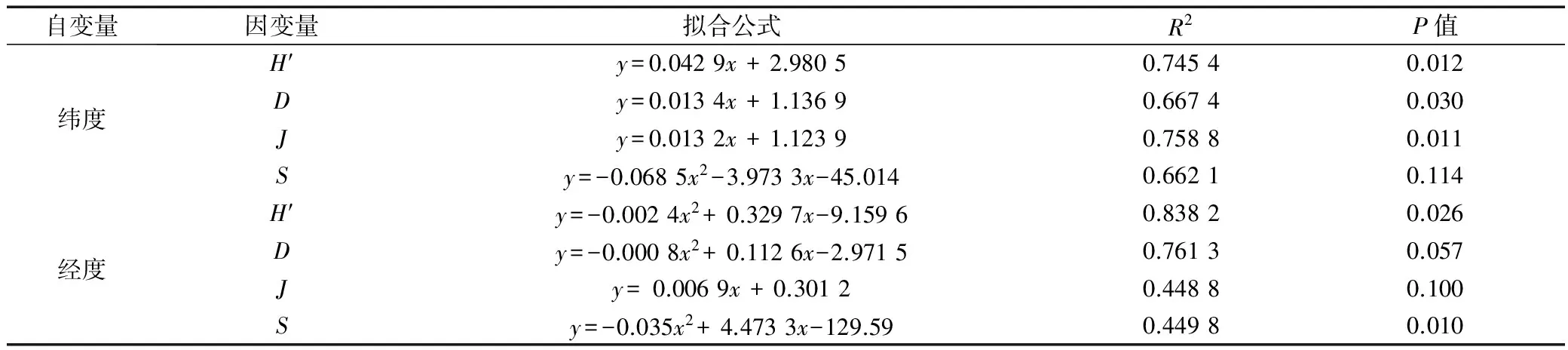
自变量因变量拟合公式R2P值纬度H′y=0.0429x+2.98050.74540.012Dy=0.0134x+1.13690.66740.030Jy=0.0132x+1.12390.75880.011Sy=-0.0685x2-3.9733x-45.0140.66210.114经度H′y=-0.0024x2+0.3297x-9.15960.83820.026Dy=-0.0008x2+0.1126x-2.97150.76130.057Jy=0.0069x+0.30120.44880.100Sy=-0.035x2+4.4733x-129.590.44980.010
2.3.3 浮游动物群落相似性和群落的空间连通性
对31个站位的浮游动物样品的物种相对多度数据进行聚类分析,结果见图7。
结果表明,各站位的相似性有昼夜的区分,也有一定的纬度梯度。在30%相似性程度上大致可以分成2个类群。其中20,29,22,24,26,28,18,23和27为一类群,均为南部站位且以夜间样品为主。另一类群以北部站位以及南部站位的白天样品为主,并可进一步划分为若干小群。相对而言,南部白天和夜间站位的相异性较北部区站位更显著。造成南部区夜间站位相似性较高且与南部白天部分站位、北部区站位存在显著差异的原因,推测与磷虾类的夜间集中出现有一定关系。
3 讨论
3.1 研究区与周围海区浮游动物群落的相似性
为进一步探究研究区浮游动物群落的地理分布格局,结合已报道的邻近南极海区和西北印度洋海域浮游生物群落物种组成[20-21,37]进行相似性聚类分析,结果见图8。
结果表明,在种的水平上,研究区内的所有样品仍可大致划分为南北两个分区(如图8a所示),研究区外的群落组成与区内的相似性较低。研究区浮游动物群落与印度洋北部热带区及南大洋的连通性都不好,在24%相似度水平上大致可分为4个区:西北印度洋区、南极海区、研究区南部海区和研究区北部海区。南极海区与研究区南部站位的浮游动物群落的相似性高于研究区南、北部海区之间的相似性。而属水平的聚类结果显示,西北印度洋海区与研究区北部的群落空间连通性更显著(图8b),而南极海区在属水平上与研究区的差异较大。此外,研究区内部南部和北部海区的群落差异也因属水平的合并相对弱化。在28%的属相似度水平上,大致也分为4个类群:南极海区、北部海区(含西北印度洋海区)、南部海区和混合海区。由此推测,由于西南印度洋位于亚热带涡流区的南部边缘,洋流的独立性可能是造成其与周围海域群落相似性较低的原因。
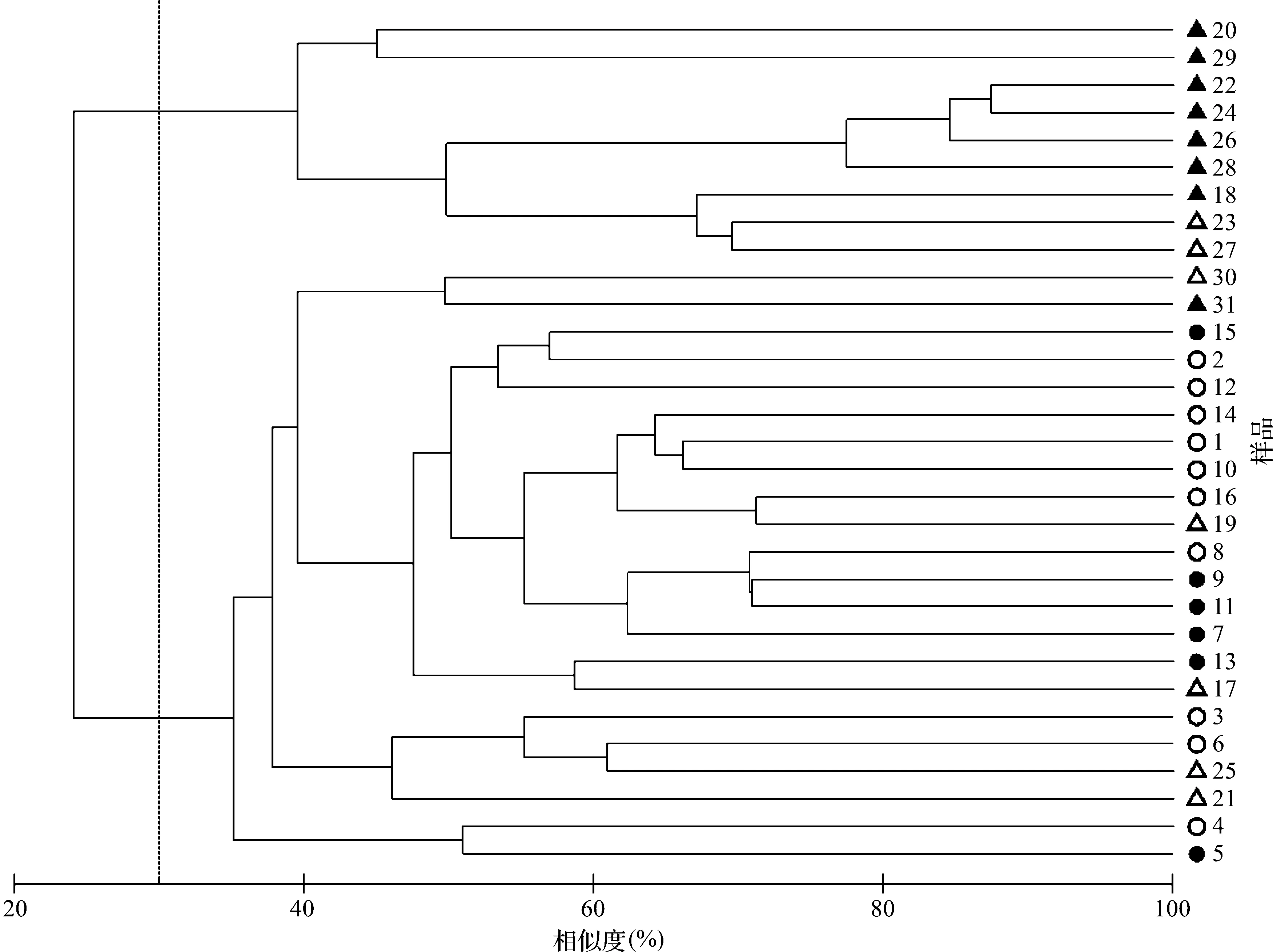
图7 研究区浮游动物群落种水平聚类树Fig.7 Clustering tree of species composition of zooplankton communities in the study area注:○和●分别表示北部(1~16号站位)白天和夜间样品;△和▲分别表示南部(17~31号站位)白天和夜间样品Note: ○ and ● denote samples (1-16) collected from the northern study area in the daytime and nighttime respectively; △ and ▲denote samples(17-31) collected from the southern study area in the daytime and nighttime respectively
3.2 西南印度洋浮游动物群落分布格局的控制因素
表层浮游动物群落的空间分布格局受很多因素的影响,如水温、光照、温跃层、营养盐及初级生产、洋流等特征[9,38]。从洋流的因素看,印度洋的洋流分布格局大致分为几个区域:南印度洋终年受逆时针方向的环流控制。西北印度洋洋流主要受季风控制,以顺时针方向环流为主,但冬季受东北季风的影响,形成逆时针方向的环流,其中,10°~25°S 区域的海表面温度(SST)终年受到自东向西的南赤道流(SEC)影响,其中包括来自太平洋西部的水体通过印度尼西亚贯穿流(ITF)[39]。这可能是造成西南印度洋海域与西北印度洋隔离,本研究区北部站位与西北印度洋海域的表层浮游动物群落保持较弱连通性的原因。
相对而言,印度洋20°~40°S海区最重要的环流系统是南印度洋副热带涡流(IOSG),其中涡流的一部分以厄加勒斯洋流(AC)的形式沿着非洲大陆东海岸南向运输(图9)。这也是影响本研究区最重要的洋流系统。MACHU et al[40]的研究中将西南印度洋划分为副热带涡流区(IOSG)、副热带聚集区(SCZ) 和次南极海区(SAW)。这三大区域与南极绕极流(ACC)和厄加勒斯回流(AC)在西南印度洋海域相距比较近,其相互作用正是在35°~40°S副热带聚集区(SCZ),并由此形成一系列锋面。这些锋面将高温、高盐的副热带水体和低温、低盐的亚南极水体分开,锋之间存在明显的温度和盐度差异,从而形成了浮游植物、浮游动物和海鸟等生物分布的地理学上的障碍[41]。在LONGHURST[9]的全球生物海洋学分区中,也标识出了类似的南亚热辐聚省(South Subtropical Convergy,SSTC),位置大约为40°S,是南大洋环流最北部与南大西洋、印度洋和太平洋反气旋型亚热带环流的分隔区,常出现急剧的表层温度梯度(夏季14~18 ℃,冬季11~15 ℃,盐度不连续度约为0.5,距离<20 km,锋面足以形成涡流场并可包括多个表层不连续锋面)。本研究中,大量磷虾的出现正是反映出了副热带聚集区(SCZ)锋面汇集区的特点,与北部副热带涡流区(IOSG)浮游动物群落有较大差异,并由此以36°S附近为界区分出南部和北部两大类群。此结果与洪丽莎 等[41]对本研究区的营养盐质量浓度和浮游植物粒径组成的分布格局相一致。
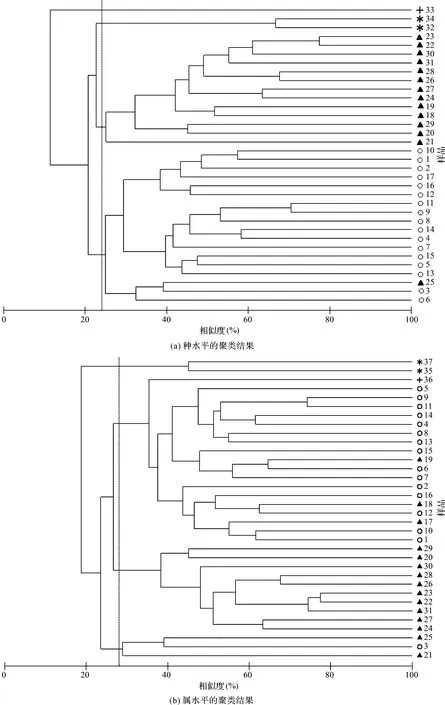
图8 研究区与邻近海区浮游动物组成的聚类树Fig.8 Clustering tree of mesozooplankton composition in the study area and adjacent sea area注:○代表研究区北部(1~16号站位),▲代表研究区南部(17~31号站位),*代表南极海区,+代表西北印度洋海区Note: ○ denotes samples (1-16) from the northern study area, ▲ denotes samples (17-31) from the southern study area, *denotes samples from the Antarctica Ocean, + denotes sample from the Northwest Indian Ocean

图9 西南印度洋海域冬季海流分布示意图 (依据文献[39]改绘)Fig.9 Diagram of current distribution in Southwest Indian Ocean in winter (based on the reference [39])
除洋流因素以外,调查还发现,南部海区夜间群落物种组成与白天群落相似度较低,表明浮游动物群落构成的昼夜差异是造成群落分布格局变化的重要因素。如图4所示,磷虾类和桡足类这2个优势类群在群落中的相对多度均存在昼夜间的差异。进一步的显著性t检验表明,磷虾类整体表现出夜间群落中的相对多度显著高于白天,而桡足类则表现为白天显著高于夜间。推测与浮游动物的垂直迁移习性相关。大多数浮游动物昼夜垂直迁徙的习性被认为是对付捕食者防卫的行为适应,即浮游动物面临的表层水体被捕食高风险及深层水层低增长选择相互博弈的结果[42]。但不同物种垂直迁徙习性的进化可能是一个有多因素影响的过程,而迁徙的强度、规模和格局(昼升夜降、昼降夜升等)同时也受到物种年龄、大小、季节以及环境因素等影响[43],因此值得进一步的深入研究。
此外,热液活动对本研究区的表层浮游动物群落分布格局没有显著影响。国内外目前关于热液活动对表层浮游动物影响的研究报道还很少。已有的研究表明,热液口群落的浮游动物具有高度的地方特有性。在热液口上方1~5 m 水柱中采集到许多底栖种类的幼体,也有水母类和桡足类等终生浮游生物集中于羽流附近[27]。但由于本次调查海域水体普遍较深,加之底部热液的影响范围受底流和上层温跃层的影响较强,因此,表层浮游动物群落受热液活动影响的指示作用相对而言不及洋流的控制作用明显。已有的资料表明,本研究区洋中脊已发现的热液活动点较多,但本研究并未发现浮游动物群落物种组成特殊性的证据。
4 结论
本研究对西南印度洋21°~38°S海域表层水体浮游动物群落采样调查,获得以下结论:
(1)经鉴定统计,研究区浮游动物包括桡足类、磷虾类、端足类、十足类、介形类、毛颚动物、被囊类、异足类、翼足类、刺胞动物及多毛类等多类,总计50属69种。总数量以桡足类(69%)和磷虾类(27%)占优势。
(2)统计结果表明,除Clausocalanus和Acartia属在各纬度带的优势度都较高外,南北海区的优势属种差异较大,且南部优势度较高的磷虾类粒径高出北部优势度较高的桡足类的粒径一个数量级。生物多样性指数随经度和纬度的变化特征:平均多样性指数随纬度的变化趋势为线性相关,即随着纬度的增高,多样性指数下降;与经度的变化趋势表现为,多样性指数随经度增高而上升,且65°E附近的多样性指数略高。
(3)研究区各采样点及其与周边海域的群落相似性对比结果表明,大致以36°S附近为界区分出南部和北部海区两大类群。洋流是控制表层浮游动物群落结构的主要因素。
[1] YANG Yu-feng, HUANG Xiang-fei. Advances in ecological studies on zooplankton[J]. Journal of Lake Sciences,2000,12(1):81-89.
杨宇峰,黄祥飞.浮游动物生态学研究进展[J].湖泊科学,2000,12(1):81-89.
[2] LIU Zhen-sheng, DU Ming-min, ZHANG Jing. International research advances in marine zooplankton [J]. Acta Oceanologica Sinica: in Chinese,2013,35(4):1-10.
刘镇盛,杜明敏,章菁.国际海洋浮游动物研究进展[J].海洋学报,2013,35(4):1-10.
[3] SHANG Shao-ling, CHAI Fei, HONG Hua-sheng. An overview of marine biogeochemical modeling [J]. Advances in Earth Science,2004,19(4):621-629.
商少凌,柴扉,洪华生.海洋生物地球化学模式研究进展[J].地球科学进展,2004,19(4):621-629.
[4] STIBOR H, VADSTEIN O, DIEHL S, et al. Copepods act as a switch between alternative trophic cascades in marine pelagic food webs [J]. Ecology Letter,2004,7(4):321-328.
[5] UYE S, SANO K. Seasonal reproductive biology of the small cyclopoid copepodOithonadavisaein a temperate eutrophic inlet [J]. Mar Ecol Prog Ser,1995,118(1-3):121-128.
[6] TURNER J F. The importance of small planktonic copepods and their roles in pelagic marine food webs [J]. Zoological Studies,2004,43(2):255-266.
[7] DIGBY P S B. The biology of the small planktonic copepods of Plymouth [J]. Journal of the Marine Biological Association of the United Kingdom,1950,29(2):393-438.
[8] BOLTOVSKOY D, CORREA N, BOLTOVSKOY A. Marine zooplanktonic diversity: A view from the South Atlantic[J]. Oceanologica Acta,2002,25(5):271-278.
[9] LONGHURST A. Seasonal cycles of pelagic production and consumption[J]. Prog Oceanog,1995,36(2):77-167.
[10] SPALDING M D, AGOSTINI V N, RICE J, et al. Pelagic provinces of the world: A biogeographic classification of the world’s surface pelagic waters [J]. Ocean & Coastal Management,2012,60:19-30.
[11] RECORD N R, PERSHING A J, JOSSI J W. Biodiversity as a dynamic variable in the gulf of marine continuous plankton recorder transect [J]. J Plankton Res,2010,32(32):1 675-1 684.
[12] PATRICIAN M R, KENNEY R D. Using the continuous plankton recorder to investigate the absence of North Atlantic right whales (Eubalaenaglacialis) from the Roseway Basin foraging ground [J]. J Plankton Res,2010,32(12):1 685-1 695.
[13] SYDEMAN W J, THOMPSON S A, SANTORA J A, et al. Macro-ecology of plankton-seabird associations in the North Pacific Ocean [J]. J Plankton Res,2010,32(12):1 697-1 713.
[14] MARQUES S C, AZEITEIRO U M, MARTINHO F, et al. Evaluation of estuarine mesozooplankton dynamics at a fine temporal scale: The role of seasonal, lunar and diel cycles[J]. J Plankton Res,2009,31(10):1 249-1 263.
[15] TURNER J T. The importance of small planktonic copepods and their roles in pelagic marine food webs [J]. Zool Stud,2004,43(2):255-266.
[16] TAKAHASHI K T. Comparison of zooplankton distribution patterns between four seasons in the Indian Ocean sector of the Southern Ocean [J]. Polar Science,2011,4(2):317-331.
[17] KERRYL H. A benthic classification system to aid in the implementation of marine protected area networks in the deep/high seas of the NE Atlantic[J]. Biological Conservation,2010,143(5):1 041-1 056.
[18] LIN Mao, WANG Chun-guang, WANG Yan-guo, et al. Zooplanktonic diversity in the western Pacific[J]. Biodiversity Science,2011,19(6):646-654.
林茂,王春光,王彦国,等.西太平洋浮游动物种类多样性[J].生物多样性,2011,19(6):646-654.
[19] ZHANG Guang-tao, SUN Song. The species composition and geographic distribution of zooplankton communities in the western Arctic Ocean in the summer of 2003[J]. Acta Oceanologica Sinica,2011,33(2):146-156.
张光涛,孙松.2003年夏季西北冰洋浮游动物群落结构和地理分布研究[J].海洋学报,2011,33(2):146-156.
[20] YE Xu-chang, CHEN Xin-jun, TIAN Si-quan, et al. Spatial distribution and species composition of zooplankton in the Northwestern Indian Ocean[J]. Marine Fisheries Research,2007,28(4):96-103.
叶旭昌,陈新军,田思泉,等.印度洋西北海域表层浮游动物数量组成及其分布[J].海洋水产研究,2007,28(4):96-103.
[21] HUANG Feng-peng, WU bao-ling. Species composition and quantitative variation of zooplankton in the great wall bay, Antarctica and its adjacent waters[J]. Antarctic Research:Chinese Edition,1992,4(4):40-46.
黄凤鹏,吴宝铃.南极长城湾及其附近水域浮游动物的种类组成和数量变化[J].南极研究:中文版,1992,4(4):40-46.
[22] ZHANG Guang-tao, SUN Song. Community ecology of zooplankton in Prydz Bay Ⅰ . Distribution and structure[J]. Chinese Journal of Polar Research,2000,12(2):89-96.
张光涛,孙松.普里兹湾的浮游动物群落生态研究Ⅰ:分布和结构[J].极地研究,2000,12(2):89-96.
[23] LIU Hui-lian, SUN Song, JI Peng. Study on the distribution, abundance and growth condition of Antarctic Krill (Euphausia superba) in the Prydz Bay region, Antarctica during the Austral summer of 1999/2000 [J]. C Advances in Polar Science: English edition,2002,13(2):117-128.
[24] YANG Guang, LI Chao-lun, ZHANG Yong-shan, et al. Vertical distribution of zooplankton community in south Shetland Island, Antarctica, during austral summer[J]. Chinese Journal of Polar Research,2015,1(7):17-24.
杨光,李超伦,张永山,等.南极夏季南设得兰岛海域浮游动物群落垂直分布[J].极地研究,2015,1(7):17-24.
[25] SUN Dong, WANG Chun-sheng. Latitudinal distribution of zooplankton communities in the Western Pacific along 160°E during summer 2014[J]. Journal of Marine System,2017,169:52-60.
[26] TAO C, LIN J, GUO S, et al. Discovery of the first active hydrothermal vent field at the ultraslow spreading Southwest Indian Ridge: The Chinese DY115-19 Cruise [J]. Ridge Crest News,2007,16:25-26.
[27] WANG Chun-sheng, YANG Jun-yi, ZHANG Dong-sheng, et al. A review on deep-sea hydrothermal vent communities[J]. Journal of Xiamen University: Natural Science,2006,45(2):141-149.
王春生,杨俊毅,张东声,等.深海热液生物群落研究综述[J].厦门大学学报:自然科学版,2006,45(2):141-149.
[28] ZHANG Dong-sheng, ZHOU Ya-dong, CHENG Hong, et al. The complete mitochondrial genome of a yeti crabKiwatyleriThatje, 2015 (Crustacea: Decapod: Anomura: Kiwaidae) from deep-sea hydrothermal vent[J]. Mitochondrial DNA Part B,2017,2(1):141-142.
[29] ZHENG Zhong, LI Shao-jing, XU Zhen-zhu. Marine Planktology[M]. Beijing: China Ocean Press,1984.
郑重,李少菁,许振祖.海洋浮游生物学[M].北京:海洋出版社,1984.
[30] ZHENG Zhong, ZHANG Song-zong, LI Song. Chinese marine copepods I[M]. Shanghai: Shanghai Science and Technology Press,1965.
郑重,张松踪,李松.中国海洋浮游桡足类(上卷)[M].上海:上海科学技术出版社,1965.
[31] ZHENG Zhong, LI Shao-jing, GUO Dong-hui. Biology of marine krill [M]. Xiamen: Xiamen University Press,2011.
郑重,李少菁,郭东辉.海洋磷虾类生物学[M].厦门:厦门大学出版社,2011.
[32] XU Zhen-zu. The superclass Hydrozoa of the phylum Cnidaria in China, volume 1 and 2[M]. Beijing: China Ocean Press,2014.
许振祖.中国刺胞动物门水螅虫总纲:上.下册[M].北京:海洋出版社,2014.
[33] SU Yun-fang, HAN Mao-sen. Chinese marine plankton atlas [M]. Beijing: China Ocean Press,1992.
束蕴芳,韩茂森.中国海洋浮游生物图谱[M].北京:海洋出版社,1992.
[34] ZHANG Wu-chang. Atlas of Planktonic copepods of Chinese seas [M]. Beijing: Science Press,2010.
张武昌.中国海浮游桡足类图谱[M].北京:科学出版社,2010.
[35] XIAO Yi-chang. Chinese fauna: invertebrate, the thirty-eighth volume [M]. Beijing: Science Press,2004.
萧贻昌.中国动物志:无脊椎动物第三十八卷:毛颚动物门箭虫纲[M].北京:科学出版社,2004.
[36] BAKER A D C, BODEN B P,BRINTON E. A practical guide to the euphausiids of the world[M]. London: Natural History Museum Publications,1990.
[37] HOPKINS T L. The zooplankton community of croker passage, Antarctic Peninsula [J].Polar Biol,1985,4(3):161-170.
[38] FENG Shi-zuo, LI Feng-qi, LI Shao-jing. Introduction to ocean science[M]. Beijing: Higher Education Press,1999:165-179.
冯士筰,李凤歧,李少菁.海洋科学导论[M].北京:高等教育出版社,1999:165-179.
[39] SCHOTT F A, JULIAN P, MCCREARY Jr. The monsoon circulation of the Indian Ocean[J]. Progress in Oceanography,2001,51(1):1-123.
[40] MACHU E, BIASTOCH A, OSCHLIES A, et al.Phytoplankton distribution in the Agulhas system from a coupled physical-biological model [J]. Deep-Sea Research Part I: Oceanographic Research Papers,2005,52(7):1 300-1 318.
[41] HONG Li-sha, WANG Chun-sheng, ZHOU Ya-dong, et al. The distribution of chlorophyllain the Southwestern Indian Ocean in summer[M]. Acta Ecologica Sinica,2012,32(14):4 525-4 534.
洪丽莎,王春生,周亚东,等.夏季西南印度洋叶绿素a分布特征[J].生态学报,2012,32(14):4 525-4 534.
[42] LOOSE C J, DAWIDOWICZ P. Trade-offs in diel vertical migration by zooplankton: The costs of predator avoidance [J]. Ecology,1994,75(8):2 255-2 263.
[43] PEARRE S. Eat and run? The hunger/satiation hypothesis in vertical migration: history, evidence and consequences [J]. Biol Rev,2003,78(1):1-79.
DistributionpatternsofzooplanktoncommunitystructureofthesurfacewaterfromSouthwestIndianOceaninthesummerof2013
YANG Juan1, LÜ Jing1, ZHANG Rong-xin1, SU Xin1, SUN Dong2,3
(1.SchoolofOceanScience,ChinaUniversityofGeosciences,Beijing100083,China; 2.SecondInstituteofOceanography,SOA,Hangzhou310012,China; 3.LaboratoryofMarineEcosystemandBiogeochemistry,Hangzhou310012,China)
Surface zooplankton samples were collected between 21°S and 38°S during the Dayang-1 scientific cruise in Southwest Indian Ocean in summer of 2013. By using zooplankton community structure analysis and clustering method, the distribution pattern of community structure and biodiversity of this region were explored. The results showed that the zooplankton species belonged to 69 species of 50 genus, including copepods, euphausiids, amphipods, decapods, ostracods, chaetognaths, tunicates, heteropods, pteropods, cnidarians, polychaetes and etc. In terms of abundance, copepods and euphausiids accounted for the largest percentages (69% and 27%, respectively). The variation ofH′,D,Jbiodiversity indices with the latitude accorded a linear trend, i.e. most biodiversity indices decreased with the increase of latitude. In contrast, a binomial relationship was found between the biodiversity indices and longitude. Most biodiversity indices increased with the longitude. The clustering results showed that northern and southern zones could be distinguished by the latitude boundary around 36°S, with the predominant species of copepods (small particle) in northern zone and euphausiids (large particle) in southern zone respectively. Moreover, the similarity of species composition indicated that the spatial connectivity of zooplankton communities was week between the southern zone and Crocker Strait or Great Wall Bay in Antarctica, as well as between the northern zone and Northwest Indian Ocean.
Southwest Indian Ocean; zooplankton; community structure; spatial pattern; similarity
杨娟,吕靖,张荣欣,等.2013年夏季西南印度洋表层浮游动物群落分布格局[J].海洋学研究,2017,35(3):54-66,
10.3969/j.issn.1001-909X.2017.03.007.
YANG Juan, LÜ Jing, ZHANG Rong-xin, et al. Distribution patterns of zooplankton community structure of the surface water from Southwest Indian Ocean in the summer of 2013[J].Journal of Marine Sciences,2017,35(3):54-66, doi:10.3969/j.issn.1001-909X.2017.03.007.
2017-03-13
2017-08-17
2014年“大洋一号”航次洋中脊沉积物与热液活动调查研究项目资助(2-8-2014-03-A);中国大洋协会项目资助(DY125-11-R-01)
杨娟(1976-),女,湖北应城市人,副教授,主要从事海洋群落与系统生态学及生物地球化学研究。
E-mail:yangjuan@cugb.edu.cn
Q178.53
A
1001-909X(2017)03-0054-13
10.3969/j.issn.1001-909X.2017.03.007

附表1 研究区浮游动物名录Appendix 1 Zooplankton list in the study oceanic area

类别属名种名磷虾类磷虾属EuphausiaEuphausiaspp.卷叶磷虾Euphausiarecurva柔弱磷虾Euphausiatenera线脚磷虾属NematoscelisNematoscelissp.十足类莹虾属LuciferLucifersp.端足类慎(虫戎)属PhronimaPhronimasp.小矛(虫戎)属LanceolaLanceolasp.近海精(虫戎)属Parapronoe甘氏近海精(虫戎)Parapronoecampbelli真海精(虫戎)属EupronoeEupronoesp斑点真海精(虫戎)Eupronoemaculata近泉(虫戎)属Hyperoche水母近泉(虫戎)Hyperochemedusarum地中海近泉(虫戎)Hyperochemediterranea长足似泉(虫戎)Hyperioideslongipes桡足类乳点水蚤属PleuromammaPleuromammasp.叶水蚤属SapphirinaSapphirinasp.猛水蚤属Miracia奇嫩猛水蚤Miraciaefferata长毛猛水蚤属MacrosetellaMacrosetellasp.瘦长毛猛水蚤Macrosetellagracilis暴猛水蚤属Clytemnestra硬鳞暴猛水蚤Clytemnestrascutellata光水蚤属Lucicutia黄角光水蚤Lucicutiaflavicornis隆水蚤属OncaeaOncaeasp.丽隆水蚤Oncaeavenusta厚壳水蚤属Scolecithrix丹氏厚壳水蚤Scolecithrixdanae伯氏厚壳水蚤Scolecithrixbradyi纺锤水蚤属AcartiaAcartiaspp.大眼水蚤属CorycaeusCorycaeussp.羽刺大眼水蚤属FarranulaFarranulasp.胸刺水蚤属CentropagesCentropagessp.紫胸刺水蚤Centropagesviolaceus拟哲水蚤属ParacalanusParacalanusspp印度拟哲水蚤Paracalanusindicus强额孔雀拟哲水蚤Paracalanuscrassirostris小拟哲水蚤Paracalanusparvus似哲水蚤属Calanoides隆线似哲水蚤Calanoidescarinatus舟哲水蚤属Scaphocalanus长叉舟哲水蚤Scaphocalanuslongifurca短角舟哲水蚤Scaphocalanusbrevicornis新哲水蚤属Neocalanus瘦新哲水蚤Neocalanusgracilis隆哲水蚤属Acrocalanus长角隆哲水蚤Acrocalanuslongicornis间哲水蚤属Mesocalanus细角间哲水蚤Mesocalanustenuicornis筛哲水蚤属Cosmocalanus达氏筛哲水蚤Cosmocalanusdarwini基齿哲水蚤属ClausocalanusClausocalanusspp.长尾基齿哲水蚤Clausocalanusfurcatus哲水蚤属Canthocalanus微刺哲水蚤Canthocalanuspauper额水蚤属Bradyidius武刺额水蚤Bradyidiusarmatus褐水蚤属Phaenna刺褐水蚤Phaennaspinifera介形类海萤科Halocyprididae未定属未定种介形亚纲Ostracoda刺肋小浮萤Microconchoeciaacuticosta毛颚动物箭虫属SagittaSagittasp.多变箭虫Sagittadecipiens太平洋箭虫Sagittapacifica双斑箭虫Sagittabipunctata被囊类住筒虫属FritillariaFritillariasp.纽鳃樽属SalpaSalpasp.双尾纽鳃樽属Thalia双尾纽鳃樽Thaliademocratica海鞘纲未定属未定种
——以“不同咖啡因饮料对水蚤心率的影响”为例

