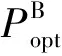2009年冬季南海北部浮游植物粒度分级生物量和初级生产力
曾祥茜,乐凤凤,周文礼,蔡昱明,郝 锵
(1. 天津农学院 水产学院,天津 300384;2. 国家海洋局 第二海洋研究所,浙江 杭州 310012;3.天津市水产生态及养殖重点实验室,天津 300384;4. 国家海洋局 海洋生态系统与生物地球化学重点实验室,浙江 杭州 310012;5.卫星海洋环境动力学国家重点实验室,浙江 杭州 310012)
2009年冬季南海北部浮游植物粒度分级生物量和初级生产力
曾祥茜1,2,3,乐凤凤2,4,周文礼1,3,蔡昱明2,4,郝 锵*2,5
(1. 天津农学院 水产学院,天津 300384;2. 国家海洋局 第二海洋研究所,浙江 杭州 310012;3.天津市水产生态及养殖重点实验室,天津 300384;4. 国家海洋局 海洋生态系统与生物地球化学重点实验室,浙江 杭州 310012;5.卫星海洋环境动力学国家重点实验室,浙江 杭州 310012)
2009年2月在南海北部海域现场观测粒度分级叶绿素a质量浓度和初级生产力(PP)的分布。结果表明,调查海域水柱平均叶绿素a质量浓度的变化范围为0.11~8.37 mg/m3,平均为(1.28±2.23) mg/m3,高值区出现在珠江口及近岸海域;初级生产力的范围为344.8~1 222.5 mgC/(m2·d),平均为(784.2±351.4) mgC/(m2·d),高值区位于近岸及陆架海域。浮游植物粒度分级测定结果表明,在生物量较高的近岸海域,叶绿素a的粒级结构以小型浮游植物占优势,其贡献率为40.9%,微型和微微型浮游植物对总叶绿素a的贡献率分别为34.6%和24.5%;而在生物量较低的陆坡和开阔海域,各粒级浮游植物对叶绿素a的贡献率由大到小依次为微微型浮游植物(78.9%),微型浮游植物(17.2%)和小型浮游植物(3.9%)。相关性分析结果表明,调查海域分级叶绿素a的区域化分布特征与洋流运动下营养盐的分布密切相关,同时叶绿素a又高度影响着此区域PP的分布。此外,我们将调查海域实测所得浮游植物最佳光合作用速率与采用垂向归一化初级生产力模型估算的数据进行对比,发现后者明显低于前者,这说明通过水温估算最佳光合作用速率的算法在冬季南海北部可能存在低估。
冬季;南海北部;浮游植物生物量;初级生产力;粒级结构
0 引言
浮游植物是海洋中的主要初级生产者,其光合作用是海洋生态系统中无机碳向有机碳转化的关键过程。浮游植物的现存量和光合作用产量通常用叶绿素a质量浓度(Chla)和初级生产力(PP)来表示,它们的分布和时空演变过程深刻影响着海洋生物资源潜力以及吸收CO2的能力[1-2],是海洋生态系统以及碳循环研究的基础资料。此外,浮游植物的粒级组成可以看作其群落结构的简化形式,不同粒级浮游植物光合作用效率不一[3]、对环境因子的响应也有明显差异[4]。因此,了解浮游植物的粒级分布有助于我们进一步理解环境对浮游群落的驱动及其对初级生产的影响。
南海北部海域生态环境复杂,既有富营养盐、低盐度的河口和近岸海域,又有营养盐和盐度相对适中的陆架区以及寡营养盐、高盐度的陆坡及开阔海;既有低温、高营养盐的气旋涡,又存在高温、低营养盐的反气旋涡;同时在季风和地形特征的影响下,各种环境因子的区域化特征显著。不同海域环境特征的差异对浮游植物生物量和初级生产力的分布存在着错综复杂的影响。LIU et al[5]和NING et al[6]通过分析南海北部“季风-环流-营养盐”等一系列变化,认为南海大、中型尺度范围内的生物活动受物理-化学-生物耦合过程的影响。CHEN[7]对南海北部初级生产力的现场观测和营养盐加富实验结果表明,浮游植物和初级生产力的分布依赖于硝酸盐的供应。乐凤凤 等[8]通过比较南海北部冬季不同区域浮游植物生物量和初级生产力的分布,指出生产力的分布可能还受可利用光和水体稳定度的影响。随着遥感和模型的广泛应用,诸多报道[9-12]从大尺度上阐述了浮游植物生物量和初级生产力与关键环境因子的关系。
本文基于2009年冬季在南海北部现场观测获得的粒度分级叶绿素a及初级生产力数据,结合物理、化学资料,分析了不同环境因子对浮游植物现存量和初级生产力分布的影响,并对初级生产力相关参数的实测与模型结果进行了比较。以期为南海北部海域浮游生态研究和相关模型工作等提供基础资料。
1 材料与方法
1.1 研究区域和样品采集
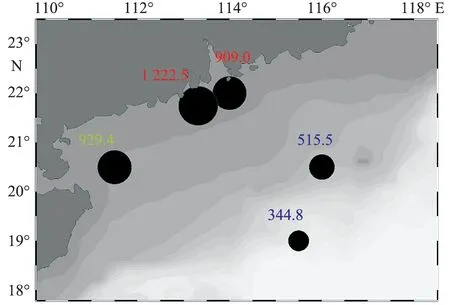
2009年2月11-23日,在南海北部海域(18°~23°N,110°~117°E),布设4个断面共22个站位(图1)进行叶绿素a和初级生产力观测实验。其中S1和S2断面为垂直于岸线的南北向断面,另有平行于岸线的近岸和外海两条东西向断面。初级生产力受限于培养时间,每天只进行1个站位的观测。为了便于比较,按不同水深(小于50 m、50~200 m、大于200 m)将调查海域划分为近岸海域、陆架海域和开阔海域。

图1 2009年冬季南海北部海域采样观测站位Fig.1 Sampling stations in northern South China Sea (nSCS) during the winter of 2009
物理海洋和海洋化学参数样品的获取采用颠倒式采水器,生物样品的获取使用球阀式采水器,按表层、10 m、25 m、50 m、75 m、100 m、150 m和200 m等 8个层次进行采集。海水透明度使用赛克盘测定,并根据海水透明度确定各不同光透射率层次的深度[13]。现场初级生产力测定用水样按海面入射光强的100%,衰减至50%,32%,10%,3%和1%的深度进行采集,并同时采集对应层次的叶绿素a水样。叶绿素和初级生产力水样先经过200 μm筛网过滤,以除去大部分的微型浮游动物。
1.2 方法
粒度分级叶绿素a质量浓度的测定采用萃取荧光法[16]。水样预过滤后,依次经孔径20 μm的筛绢、孔径2 μm的核孔滤膜和Whatman GF/F玻璃纤维滤膜过滤,对Net(20~200 μm)、Nano(2~20 μm)和Pico(< 2 μm)级浮游植物进行截留。截留浮游植物的滤膜用90%的丙酮低温萃取约24 h,在室温下用Turner 10-AU荧光计对萃取液进行测定。分级叶绿素的计算参照《海洋调查规范》进行[17],总叶绿素a质量浓度由粒度分级叶绿素a质量浓度(Net-Chla,Nano-Chla和Pico-Chla)求和所得。
光合作用速率和初级生产力的测定使用由Nielsen建立,经Evans和 Ning等改进的14C同位素示踪法进行[18-20]。水样预过滤后分别注入到2个250 cm3的白色培养瓶和1个250 cm3的黑色培养瓶中,各培养瓶中依次加入3.7×105Bq的NaH14CO3溶液,置于甲板以表层水温模拟现场培养。模拟培养器通过选用不同中性光密度的筛网以模拟原采样层次的光强,同时循环泵取表层海水以控制水温。培养完毕后,水样经Whatman GF/F玻璃纤维滤膜过滤,截留有颗粒物的滤膜经浓盐酸熏蒸处理,而后放置闪烁瓶中低温干燥保存,带回实验室后在PE-2900型液体闪烁计数器上测定,用外标准道比法进行萃灭校正。潜在初级生产力(PPP)和现场初级生产力(PP)按照Parsons推荐的公式计算[21],光合作用速率(PB)为各水层的PPP与Chla的比值。
Chla与环境因子的关系采用统计分析软件SPSS进行分析,平面作图采用Ocean Data View软件。
2 结果
2.1 环境参数
如表1可知,调查海域冬季呈现高温、高盐、高营养盐的特征。调查期间南海北部水温、盐度和DIN的均值分别为(21.8±2.1)℃,(33.68±3.09)和(7.37±14.67) μmol/L。水平分布上,近岸海域水温和盐度显著低于陆架、陆坡及开阔海,而溶解氧由近岸向开阔海域逐渐降低。DIN呈现出近岸显著高于陆架、陆坡及开阔海的趋势,低值区位于陆架海域。受海水深度和颗粒物多寡的影响,真光层深度呈现出由近岸向开阔海域逐渐升高的趋势(表1)。垂直分布上,各断面水温随深度的增加而降低,而盐度则大体呈现随深度的增加而增加的趋势。近岸海域水体垂直混合相对均匀,水温、盐度垂直方向变化不大,真光层内DIN水平较高,平均为(14.69±27.54) μmol/L,高值出现在水体底部区域。而陆架、陆坡和开阔海域水体开始出现层化,S1断面温、盐跃层均位于100~150 m,而S2断面温、盐跃层出现在75~150 m,跃层内DIN质量浓度显著低于跃层以下水体。此外,从断面分布来看,S1断面位于珠江口延伸线上,受河水注入和陆源输出的影响,该断面表层水温、盐度均低于S2断面,而DIN则显著高于S2断面(图2)。
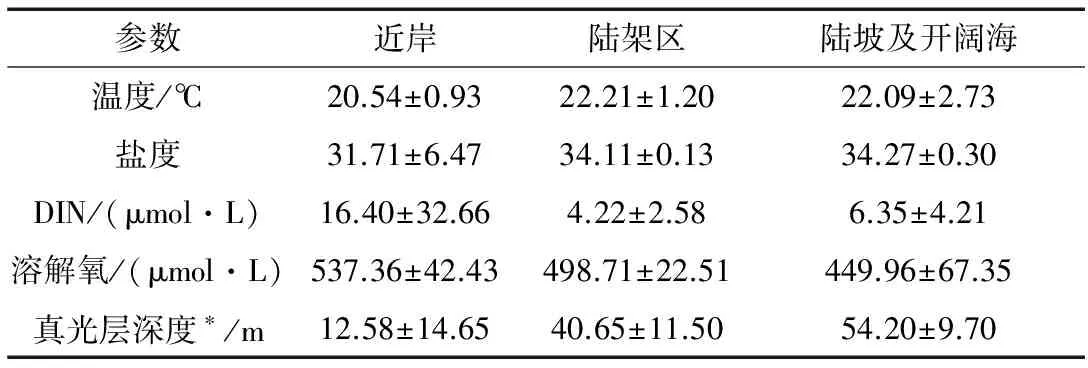
表1 2009年2月南海北部不同海域物理、化学、 生物参数比较(Mean±SD)Tab.1 Mean ± SD of physical, chemical and biological parameters in the different regions of nSCS in Feb., 2009
注:*真光层测站在近岸站位数为7,在陆架站位数为2,在陆坡及开阔海站位数为6。
2.2 浮游植物现存量
2.2.1 粒度分级叶绿素a质量浓度平面分布
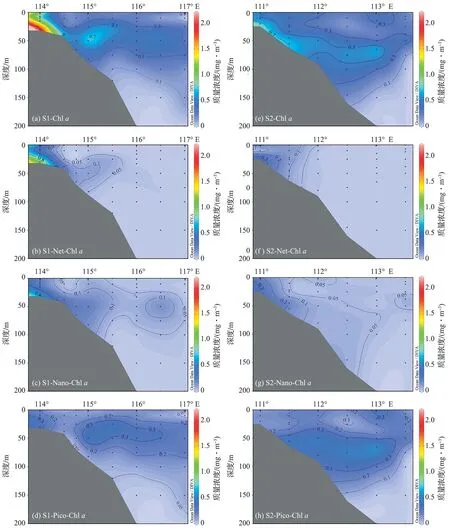
图3给出了调查区域各粒级Chla的水柱积分平均值分布情况。从平面分布来看,水柱平均Chla质量浓度的变化范围为0.11~8.37 mg/m3,平均为(1.28±2.23) mg/m3;近岸海域水柱平均Chla质量浓度为(3.05±3.05) mg/m3,远高于陆架[(0.39±0.09) mg/m3]及开阔海域[(0.18±0.04) mg/m3],Chla高值区主要位于珠江口及沿岸海域。各粒级Chla(Net-Chla、Nano-Chla和Pico-Chla)与总Chla的分布趋势一致,均由近岸向开阔海域逐渐降低,最高值出现在珠江口的A1和A2站位。然而随着离岸距离的增加,各粒级Chla对总Chla的贡献存在着明显差别(表2)。在生物量较高的河口和近岸海域,Net-Chla对总Chla的贡献最高(40.9%),Nano-Chla次之(34.6%),Pico-Chla最低(24.5%);而在生物量较低的陆坡和开阔海域,Chla的粒级结构则以Pico-Chla占优势,其贡献率高达78.9%,Net-Chla和Nano-Chla对总Chla的贡献率分别为3.9%和17.2%。
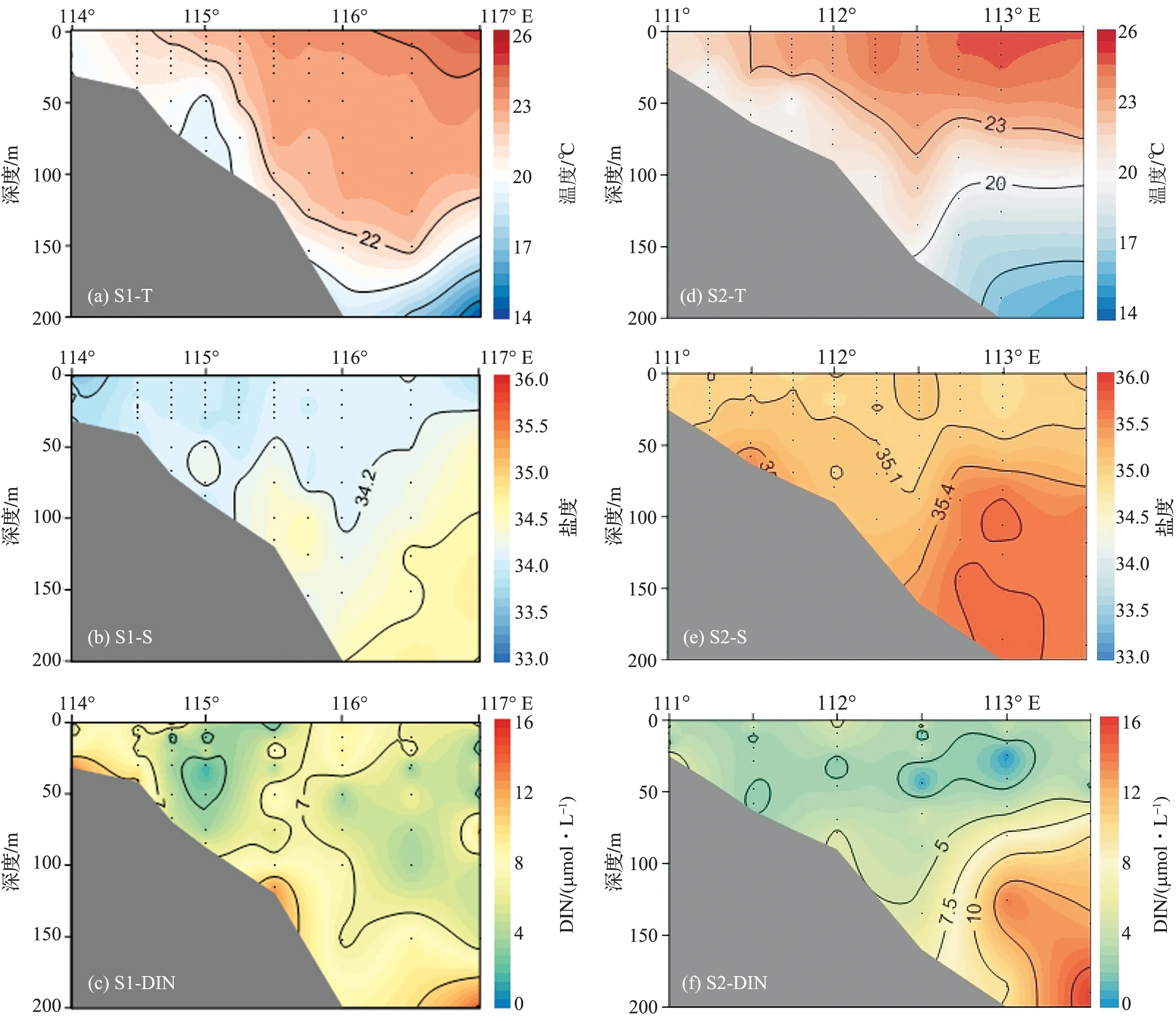
图2 2009年冬季南海北部温度、盐度和DIN的垂直分布Fig.2 Vertical distributions of temperature, salinity and DIN in nSCS during the winter of 2009

图3 2009年冬季南海北部水柱积分平均分级Chl a平面分布Fig.3 Spatial distributions of integral average size-fractionated Chl a concentration in nSCS during the winter of 2009
2.2.2 粒度分级叶绿素a质量浓度垂直分布
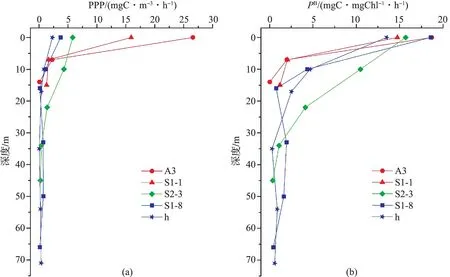
在垂直分布方面(表2,图4),Chla质量浓度分布区域化特征明显。近岸海域Chla质量浓度分布相对均匀,高值位于水体底部(25~50 m);而在陆架及开阔海域,次表层Chla最大值(SCM)现象明显,Chla质量浓度最大值出现在50~75 m,次表层以下Chla质量浓度急剧下降。表层Chla质量浓度均值为(1.23±2.38) mg/m3,SCM 均值为(1.63±2.54) mg/m3,二者均由近岸向开阔海域逐渐降低。与总Chla质量浓度的分布一致,各粒级Chla的高值区也出现在次表层,随着水深的增加,各粒级Chla对总Chla质量浓度的贡献情况变化不大。在近岸海域的表层和SCM,各粒级Chla对总Chla质量浓度的贡献均为Net-Chla> Nano-Chla> Pico-Chla;而在陆架及开阔海域的表层和SCM,各粒级Chla对总Chla质量浓度的贡献均为Pico-Chla> Nano-Chla> Net-Chla。此外,表2还给出了初级生产力对应站位各粒级Chla质量浓度的真光层积分均值(Ceu)和最大光合作用速率水层的Chla质量浓度(Copt)。本次调查中,最大光合作用速率所在水层均位于表层水体。同时结合水柱积分均值、Ceu和Copt分析可知,陆架及开阔海域总Chla质量浓度高值出现在真光层以内(水柱积分值 表2 2009年冬季南海北部不同水层粒度分级Chl a质量浓度(Mean±SD)Tab.2 The size-fractionated Chl a concentration of different water layers in nSCS during the winter of 2009 (Mean±SD) mg/m3 注:*近岸站位数为2,陆架站位数为1,陆坡和开阔海站位数为3。 图4 2009年冬季南海北部各粒级Chl a质量浓度垂直分布Fig.4 Vertical distributions of size-fractionated Chl a concentration along transect S1 and S2 during the winter of 2009 2.3 初级生产力 2.3.1 初级生产力的平面分布 初级生产力的分布与Chla类似,表现出近岸高、外海低的特征。调查结果显示(图5),调查期间南海北部的初级生产力分布范围为344.8~1 222.5 mgC/(m2·d),平均为(784.2±351.4) mgC/(m2·d)。高Chla的近岸海域初级生产力较高,最大值出现在近岸海域的A3站;陆坡及开阔海域初级生产力较低,最小值位于开阔海域的h站。 2.3.2 光合作用速率的垂直分布 图6显示了南海北部潜在初级生产力(PPP)和光合作用速率(PB)的垂直分布。从图6a中可以看出,南海北部海域各站位初级生产力和光合作用速率的最大值均出现在表层,其中近岸表层PPP(15~30 mgC·m-3·h-1)远高于陆架区、陆坡和开阔海域,从表层以下迅速降低至2 mgC·m-3·h-1以下。陆架海域表层PPP(5.8 mgC·m-3·h-1)介于近岸海域与开阔海域之间,表层以下缓慢降低。开阔海域PPP高值出现在表层,表层以下各水层垂直分布相对均匀,PPP均小于2 mgC·m-3·h-1。不同于PPP的区域化分布,调查海域光合作用速率在各海域分布相对均匀。由图6b可知,冬季南海北部各站位光合作用速率的最大值均出现在表层,且差异不大(13~20 mgC·mgChl-1·h-1)。其中近岸及陆架海域(S2-3站)光合作用速率从表层以下迅速降低,在底层出现最小值;而陆坡和开阔海域的光合作用速率从表层迅速降低,至30~50 m之后略有升高,S1-8站光合作用速率最低值出现在底层,h站位光合作用速率最低值出现在35 m层。 图5 2009年冬季南海北部初级生产力的平面分布 [单位:mgC/(m2·d)]Fig.5 Spatial distribution of primary production in nSCS during the winter of 2009[unit: mgC/(m2·d)] 图6 2009年冬季南海北部潜在初级生产力和光合作用速率的垂直分布Fig.6 Vertical distribution of potential primary productivity and photosynthesis rate in nSCS during the winter of 2009 3.1 海区环境特征与浮游植物现存量 调查区域生物量的这种区域化分布特征与洋流运动下生态因子的分布密切相关[6-9]。冬季,南海北部盛行东北季风,近岸的表层水在季风的驱动下经台湾海峡向西南方向运动,将丰富的营养盐输送至调查海域的中部;与此同时,整个南海西部形成一支强劲的大尺度气旋式西边界流,底层海水冲破跃层向上涌升[7,22-23],海水垂直混合剧烈,跃层以上水体营养盐得到补充。我们的观测也证实了这一系列现象。在沿岸流和珠江冲淡水的双重影响下,近岸海域营养物质丰富。如表1所示,珠江河口及近岸海域DIN高达(16.4±32.66) μmol·L-3。近岸相对较高的营养盐质量浓度使得群落生物量增加,并向大颗粒Net级浮游植物演替。Chla的分布结果显示,南海北部近岸海域水柱平均Chla质量浓度均值为(3.05±3.05) mg·m-3,高出陆架和外海Chla近一个数量级,且其中超过40%由Net级组份所贡献(表2)。这主要是因为Net级浮游植物有较大的营养盐半饱和吸收常数,在高营养盐条件下竞争能力更强,因而在近岸水体浮游植物群落中占比较高[4,24]。 陆架海域及开阔海域离岸距离远,受陆源输送和径流的影响较弱,冬季营养物质主要依赖于沿岸水在东北季风驱动下向陆架的输送、以及本地的垂向混合。然而,陆架外反气旋涡和相对明显的温、盐跃层限制了营养盐的补充,使得陆架海域及开阔海域的营养盐(尤其是DIN)质量浓度显著低于近岸海域。调查结果显示,陆架海域和开阔海域的DIN质量浓度分别为(4.22±2.58) μmol·L-3和(6.35±4.21) μmol·L-3。由于营养盐质量浓度下降,陆架海域及开阔海域浮游植物现存量不及近岸海域的50%。与近岸区域不同,浮游植物生物量以Pico级组份为主,这是因为Net级浮游植物营养盐半饱和常数大,比表面积小,对细胞周围营养盐的耗散速率较快,当细胞外的营养盐质量浓度较低时,营养盐供给不能继续维持其细胞的生长。而Pico级浮游植物体积小,比表面积大,营养盐半饱和常数小,更适应营养盐质量浓度低的环境,因此在寡营养海域中占据优势[24]。 表3给出了水柱平均Chla与环境因子的Pearson相关性分析结果(其中温度、盐度、溶解氧和DIN数据均采用水柱平均值进行分析)。从表中可以看出,调查海域各粒级Chla质量浓度均与DIN呈显著正相关,进一步证实了营养盐对浮游植物生物量的促进作用。在各粒级浮游植物中,以Net级浮游植物与营养盐的相关性最高(R2=0.86,P<0.01),这说明Net级浮游植物受营养盐的限制强于粒级较小的浮游植物,进一步印证了此前的观点。Chla质量浓度与溶解氧呈显著正相关(R2=0.75,P<0.01),显示出水体中溶解氧的变化受浮游植物光合作用的控制。随着水体浮游植物颗粒物增多,透射光迅速衰减,水体透明度下降,这也是近岸水体真光层深度低于陆架及开阔海域的主要原因[25]。一般而言,浮游植物生长有较强的温度依赖性,在光照和营养盐适宜的条件下,浮游植物生长率随水温的升高而增加[26],而我们的结果显示Chla质量浓度与温度呈显著的负相关,其原因可能是,水温升高会引起水体分层现象,跃层强度增强,跃层以下富营养水很难输送至上层水体,低营养盐限制了浮游植物的生长。此外,调查结果显示,调查期间Chla与盐度呈显著的负相关。尽管不同浮游植物对盐度的耐受性各不相同,但在以往的海洋藻类盐度耐受性试验[27-28]中,盐度梯度设置多以10~15为间距,以便于观测盐度对浮游植物生长的影响,这意味着微小的盐度变化对浮游植物生长的影响相对较小。调查海域盐度梯度变化小于3 (图2),盐度对浮游植物生长的影响相对较弱。相关性分析结果中盐度与Chla的负相关可能是因为受冲淡水和陆源输出的影响,盐度与营养盐的分布往往密切相关,且方向相反[29]。 表3 水柱积分平均分级Chl a与环境因子的Pearson相关性Tab.3 Pearson correlation analysis between integral average size-fractionated Chl a concentration of various phytoplankton size classes and various environmental factors 注:*显著性水平小于0.05,**显著性水平小于0.01。 3.2 初级生产力与光合作用速率 与浮游植物现存量的分布相似,调查期间南海北部初级生产力同样表现出近岸高而外海低的特征。调查结果显示,南海北部的初级生产力分布范围为344.8~1 222.5 mgC/(m2·d),最大值出现在近岸海域的A3站位,同样处于较高水平的还有近岸海域的S1-1站和陆架海域的S2-3站,分别为909.0 mgC/(m2·d)和929.4 mgC/(m2·d),初级生产力最小值位于开阔海域的h站[344.8 mgC/(m2·d)]。这与此前的调查结果略有不同,乐凤凤 等[8]对冬季南海北部初级生产力的调查结果显示,初级生产力的最大值位于调查海域的中部S2-8站[1 040.0 mgC/(m2·d)],而最低值出现在近岸海域的e站[41.3 mgC/(m2·d)]。通过对比两个航次的相关环境参数,发现2006年冬季航次近岸海域的真光层深度显著低于本次调查深度,究其原因,可能是2006年冬季航次的e站离岸距离较近,易受到珠江口沿岸浊度带的影响,水体浊度较高,表层以下的浮游植物生物量和光合作用速率受到光的抑制,从而导致此站位的初级生产力极低;而本航次初级生产力的近岸调查站位离岸距离较远,受沿岸高浊度水体的影响较小。 从各站位不同水层潜在初级生产力的分布来看(图6),调查海域各站位PPP最大值均出现在表层水体中,各站位表层光合作用速率约为光衰减至50%层的2倍。尽管Chla质量浓度在次表层出现最大值,但受表层高PB的影响,水柱内PPP的最大值依然出现水体的表层。此外,浮游植物生物量对潜在初级生产力的作用也不容忽视,从图6中可以看出,在PB水平相当的表层水体(如A3和S1-8,S1-1和S2-3),PPP的最高值出现在近岸站位(A3和S1-1),且明显高于其他三个站位,这说明近岸海域表层较高的Chla质量浓度支持了此区域较高的潜在初级生产力。 3.3 实测最大光合作用速率数据与模型估算的对比 致谢感谢国家海洋局南海分局环境监测中心提供温度、盐度和溶解氧数据。此研究亦得到“中国海监81”调查船全体船员提供的帮助,在此谨致谢忱。 [1] WARE D M, THOMSON R E. Bottom-up ecosystem trophic dynamics determine fish production in the Northeast Pacific[J]. Science,2005,308(5726):1 280-1 284. [2] FIELDC B, BEHRENFELD M J, RANDERSON J T, et al. Primary production of the biosphere: integrating terrestrial and oceanic components[J]. Science,1998,281(5374):237-240. [3] TAGUCHI S. Relationship between photosynthesis and cell size of marine diatoms[J]. Journal of Phycology,1976,12(2):185-189. [4] PARSONS T R, TAKAHASHI M. Environmental control of phytoplankton cell size[J]. Limnology and Oceanography,1973,18(4):511-515. [5] LIU K K, CHAO S Y, SHAW P T, et al. Monsoon-forced chlorophyll distribution and primary production in the South China Sea: observations and a numerical study[J]. Deep Sea Research Part I: Oceanographic Research Papers,2002,49(8):1 387-1 412. [6] NING Xiu-ren, CHAI Fei, XUE Hui-jie, et al. Physical-biological oceanographic coupling influencing phytoplankton and primary production in the South China Sea[J]. Journal of Geophysical Research: Oceans,2004,109(C10). [7] CHEN Y L. Spatial and seasonal variations of nitrate-based new production and primary production in the South China Sea[J]. Deep Sea Research Part I: Oceanographic Research Papers,2005,52(2):319-340. [8] LE Feng-feng, NING Xiu-ren, LIU Cheng-gang, et al. Standing stock and production of phytoplankton in the northern South China Sea during winter of 2006[J]. Acta Ecologica Sinica,2008,28(11):5 775-5 784. 乐凤凤,宁修仁,刘诚刚,等.2006年冬季南海北部浮游植物生物量和初级生产力及其环境调控[J].生态学报,2008,28(11):5 775-5 784. [9] HAO Qiang, NING Xiu-ren, LIU Cheng-gang, et al. Satellite and in situ observations of primary production in the northern South China Sea[J]. Acta Oceanological Sinica,2007,29(3):58-68. 郝锵,宁修仁,刘诚刚,等.南海北部初级生产力遥感反演及其环境调控机制[J].海洋学报,2007,29(3):58-68. [10] TANG Dan-ling, KESTER D R, NI I H, et al. In situ and satellite observations of a harmful algal bloom and water condition at the Pearl River estuary in late autumn 1998[J]. Harmful Algae,2003,2(2):89-99. [11] LI Xiao-bin, CHEN Chu-qun, SHI Ping, et al. Estimation of primary production of South China Sea from 1998 to 2002 by remote sensing and its spatio-temporal variation mechanism[J]. Journal of Tropical Oceanography,2006,25(3):57-62. 李小斌,陈楚群,施平,等.南海1998~2002年初级生产力的遥感估算及其时空演化机制[J].热带海洋学报,2006,25(3):57-62. [12] CHEN Chu-qun, SHI Ping, MAO Qing-wen. Satellite remotely-sensed analysis of distribution characters of chlorophyll concentration in South China Sea[J]. Journal of Tropical Oceanography,2000,20(2):66-70. [13] POOLE H H, ATKINS W R G. Photo-electric measurements of submarine illumination throughout the year[J]. Journal of the Marine Biological Association of the United Kingdom (New Series),1929,16(1):297-324. [14] GB/T 12763.2—2007 Specifications for oceanographic survey Part 2: Marine hydrographic observation[S]. GB/T 12763.2—2007海洋调查规范 第2部分:海洋水文观测[S]. [15] GB/T 12763.4—2007 Specifications for oceanographic survey Part 4: Survey of chemical parameters in sea water[S]. GB/T 12763.4—2007海洋调查规范 第4部分:海水化学要素调查[S]. [16] HOLM-HANSEN O, LORENZEN C J, HOLMES R W, et al. Fluorometric determination of chlorophyll[J]. Journal du Conseil,1965,30(1):3-15. [17] GB/T 12763.6—2007 Specifications for oceanographic survey Part 6: Marine biological survey[S]. GB/T 12763.6—2007海洋调查规范 第6部分:海洋生物调查[S]. [18] NIELSEN E S. The use of radio-active carbon (C14) for measuring organic production in the sea[J]. Journal du Conseil,1952,18(2):117-140. [19] EVANS C A, O’REILLY J E, THOMAS J P. A handbook for the measurement of chlorophyll and primary production[M]. Texas: Texas A and M University,1987:1-114. [20] NING Xiu-ren. Standing stock and production of phytoplankton in the estuary of the Changjiang (Yangtze River) and the adjacent East China Sea[J]. Marine Ecology Progress,1988,49(1-2):141-150. [21] PARSONS T R, MAITA Y, LALLI C M. A manual of chemical and biological methods for seawater analysis[M]. Oxford: Pergamon Press,1984:101-173. [22] XUE Hui-jie, CHAI Fei, XU Dan-ya, et al. Characteristics and seasonal variation of the coastal currents in the South China Sea[M]//Oceanography in China: 13 sets. Beijing: China Ocean Press,2001:64-75. 薛惠洁,柴扉,徐丹亚,等.南海沿岸流特征及其季节变化[M]//中国海洋学文集:第13集.北京:海洋出版社,2001:64-75. [23] XUE Hui-jie, CAI Fei, WANG Li-ya, et al. Zhujiang River estuarine circulation model[M]//Oceanography in China: 13 sets. Beijing: China Ocean Press,2001:138-151. 薛惠洁,柴扉,王丽娅,等.珠江口及其邻近海域环流模式结构[M]//中国海洋学文集:第13集.北京:海洋出版社,2001:138-151. [24] FALKOWSKI P G, OLIVER M J. Mix and match: how climate selects phytoplankton[J]. Nature Reviews Microbiology,2007,5(10):813-819. [25] NING Xiu-ren, LIU Zi-lin, SHI Jun-xian, et al. Standing crop and productivity of phytoplankton and POC in Prydz Bay and the adjacent waters[J]. Antarctic Research,1993(4):50-62. 宁修仁,刘子琳,史俊贤.南极普里兹湾及其邻近海域浮游植物粒度分级生物量和初级生产力[J].极地研究,1993(4):50-62. [26] EPPLEY R W. Temperature and phytoplankton growth in the sea[J]. Fishery Bulletin-National Oceanic and Atmospheric Administration,1972,70(4):1 063-1 085. [27] CHO S H, JI S C, HUR S B, et al. Optimum temperature and salinity conditions for growth of green algaeChlorellaellipsoideaandNannochlorisoculata[J]. Fisheries Science,2007,73(5):1 050-1 056. [28] RADCHENKO I G, IL’YASH L V. Growth and photosynthetic activity of diatomThalassiosiraweissflogiiat decreasing salinity[J]. Biology Bulletin,2006,33(3):242-247. [29] SONG Shu-qun, SUN Jun, SHEN Zhi-liang, et al. Size-fractionated biomass of phytoplankton in the Yangtze River estuary and its adjacent waters in winter and spring[J]. Chinese Journal of Applied Ecology,2008,19(3):658-666. 宋书群,孙军,沈志良,等.长江口冬季和春季浮游植物的粒级生物量[J].应用生态学报,2008,19(3):658-666. [30] BEHRENFELD M J, FALKOWSHI P G. Photosynthetic rates derived from satellite-based chlorophyll concentration[J]. Limnology and Oceanography,1997,42(1):1-20. [31] FALKOWSKI P G, RAVEN J A. Aquatic photosynthesis[M].2nd ed. New Jersey, USA: Princeton Unversity Press,2007:128-162. Distributionsofsize-fractionatedchlorophyllaandprimaryproductivityinnorthernSouthChinaSeaduringthewinterof2009 ZENG Xiang-xi1,2,3, LE Feng-feng2,4, ZHOU Wen-li1,3, CAI Yu-ming2,4, HAO Qiang*2,5 (1.FisheryScience,TianjinAgriculturalUniversity,Tianjin300384,China; 2.SecondInstituteofOceanography,SOA,Hangzhou310012,China; 3.TheKeyLaboratoryofAquacultureEcologyandCultivation,Tianjin300384,China; 4.LaboratoryofMarineEcosystemandBiogeochemistry,SOA,Hangzhou310012,China; 5.StateKeyLaboratoryofSatelliteOceanEnvironmentDynamics,Hangzhou310012,China) winter; northern South China Sea; phytoplankton standing stock; primary production; size structure 曾祥茜,乐凤凤,周文礼,等.2009年冬季南海北部浮游植物粒度分级生物量和初级生产力[J].海洋学研究,2017,35(3):67-78, 10.3969/j.issn.1001-909X.2017.03.008. ZENG Xiang-xi,LE Feng-feng,ZHOU Wen-li, et al. Distributions of size-fractionated chlorophyllaand primary productivity in northern South China Sea during the winter of 2009[J].Journal of Marine Sciences,2017,35(3):67-78, doi:10.3969/j.issn.1001-909X.2017.03.008. 2017-03-03 2017-03-24 国家自然科学基金项目资助(90711006,41306162);全球变化和海气相互作用专项项目资助(GASI 03-01-03-03);国家海洋局第二海洋研究所基本科研业务费专项项目资助(JG200816) 曾祥茜(1990-),女,天津市人,主要从事渔业资源管理方面的研究。E-mail:zengxiangxi1221@163.com * 郝锵(1979-),男,副研究员,主要从事海洋初级生产力方面的研究。E-mail:haoq@sio.org.cn Q178.53 A 1001-909X(2017)03-0067-12 10.3969/j.issn.1001-909X.2017.03.008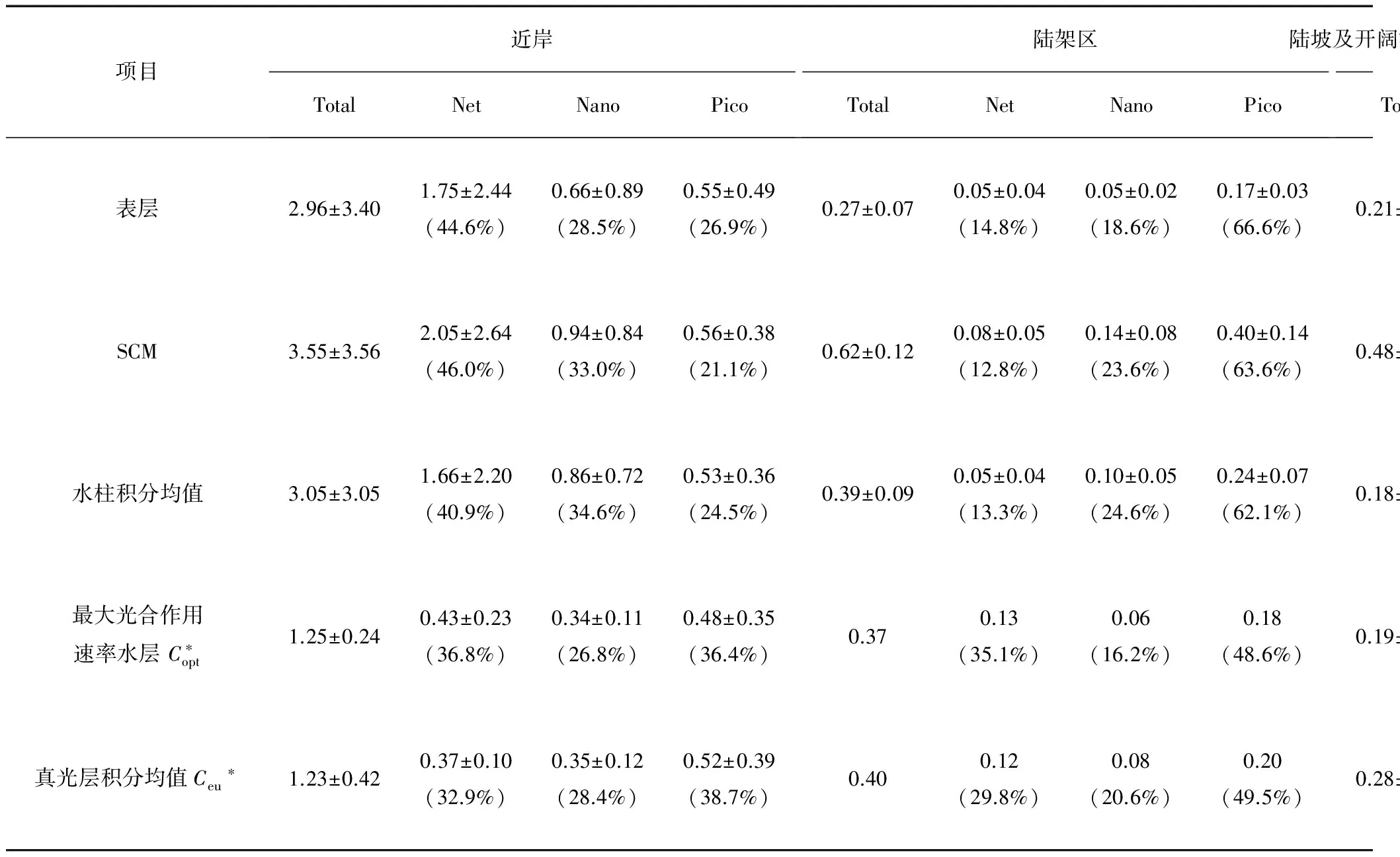
3 讨论