PGC-1α过表达逆转OGD/R诱导的神经元线粒体功能降低和凋亡*
耿慧霞, 李莺歌, 石贞玉, 厉永强, 王 来△
(河南大学 1护理与健康学院, 2生命科学学院, 河南 开封 475001)
PGC-1α过表达逆转OGD/R诱导的神经元线粒体功能降低和凋亡*
耿慧霞1, 李莺歌2, 石贞玉1, 厉永强1, 王 来2△
(河南大学1护理与健康学院,2生命科学学院, 河南 开封 475001)
目的探讨过氧化物酶体增殖物激活受体γ辅助活化因子1α(PGC-1α)基因过表达对氧糖剥夺/复氧(OGD/R)诱导的神经元线粒体功能及细胞凋亡的影响。方法采用RT-PCR的方法从C57BL/6乳鼠大脑皮层获取PGC-1α的全基因序列,并克隆到真核表达载体pEGFP-N1上,经PCR初步鉴定后转染原代皮层神经元,Western blot鉴定PGC-1α的表达情况,成功构建PGC-1α真核表达载体pEGFP-N1-PGC-1α。分别将转染pEGFP-N1和pEGFP-N1-PGC-1α载体的皮层神经元进行OGD/R处理,分别采用MitoTracker Red染色、流式细胞术、ATP代谢检测试剂盒和TUNEL细胞凋亡检测试剂盒检测线粒体质量分数、活性氧簇(ROS)和ATP生成、细胞凋亡以及caspase-3激活的变化。结果PGC-1α过表达可抑制OGD/R诱导的神经元线粒体生成能力的降低和ROS的生成(P<0.05),增强ATP的合成能力(P<0.01),抑制神经元的凋亡(P<0.01)并降低caspase-3的激活(P<0.05)。结论PGC-1α过表达可通过促进线粒体生成、抑制ROS的产生和维护线粒体功能而抑制OGD/R诱导的神经元凋亡。PGC-1α可以作为开发脑缺血再灌注损伤药物的靶标之一。
过表达; 皮层神经元; 氧糖剥夺/复氧; 细胞凋亡; 过氧化物酶体增殖物激活受体γ辅助活化因子1α
脑卒中是心脑血管疾病中最严重的疾病类型,占心脑血管疾病死亡患者的三分之一,严重威胁着人类的身体健康。然而,目前对脑卒中患者神经元损伤和凋亡的机制研究表明,兴奋性毒性、Ca2+超载、氧自由基形成和炎症损伤等都不能完全阐明该病理过程,因此在临床上对该疾病的治疗缺少有效的治疗药物。最近的研究表明,脑缺血再灌注后,神经元内线粒体生成能力降低、超微结构破坏和动力学内稳态紊乱等引起的线粒体功能降低,导致能量枯竭,以及线粒体凋亡途径的激活可能是脑缺血再灌注后神经元损伤和凋亡的重要机制之一[1-5]。
过氧化物酶体增殖物激活受体γ辅助活化因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α),作为细胞内重要的共转录因子,参与多种生理和病理过程,在能量代谢、炎症、糖尿病以及神经系统疾病发病过程中发挥重要的作用[6-9]。研究表明,PGC-1α是促进线粒体基因转录和表达的重要转录因子,同时可促进细胞内线粒体的生成[10]。研究表明,缺血再灌注后,神经元内线粒体动力学过程紊乱,生成能力降低,PGC-1α表达下降,ATP生成能力降低,导致神经元的凋亡[11-12]。pEGFP-N1是一类增强型的真核生物表达载体,已成功在肝细胞、神经细胞系、原代神经元和大脑内过表达外源基因[13-15]。因此,本文构建PGC-1α的pEGFP-N1真核表达载体并转染原代皮层神经元,观察PGC-1α过表达对氧糖剥夺/复氧(oxygen glucose deprivation/reoxygenation, OGD/R)诱导神经元线粒体质量分数、功能和细胞凋亡的影响,为开发以维护线粒体功能为靶标的治疗药物提供科学依据。
材 料 和 方 法
1材料和试剂
真核表达质粒pEGFP-N1和大肠杆菌DH5α由本实验室保存。原代皮层神经元来源于C57BL/6乳鼠(出生后24 h内)的大脑皮层。
转染试剂Lipofectamine 2000、BCA蛋白定量试剂盒、高糖和无糖DMEM培养基、Neurobasal培养基、B27和MitoTracker Red等试剂购自Life Techno-logies;限制性核酸内切酶XhoⅠ、BamHⅠ以及T4 DNA 连接酶购自NEB;活性氧簇(reactive oxygen species,ROS)测定荧光探针购自碧云天生物技术有限公司,鼠抗PGC-1α抗体、鼠抗caspase-3抗体和兔抗β-actin抗体购自Santa;ATP代谢检测试剂盒(CellTiter-Glo® 2.0 Assay)购自Promega;质粒提取试剂盒和凝胶纯化试剂盒购自TransGen Biotech;RIPA裂解液、反转录试剂盒和Trizol提取液购自康为世纪生物科技有限公司;一步法TUNEL细胞凋亡检测试剂盒购自江苏凯基生物技术股份有限公司;其它试剂均为分析纯。
2方法
2.1载体构建及转染 根据GenBank中的小鼠PGC-1α基因序列(NM_008904),采用Primer 5软件设计引物,上游引物为5’-CGCCTCGAGCCACCATGGCTTGGGACATGT-3’,下游引物为5’-CGCGGATCCTTACCTGCGCAAGCTTCTCTG-3’,分别在引物的5’端添加XhoⅠ和BamHⅠ的酶切位点,引物由上海生工生物工程股份有限公司合成。根据Trizol提取液说明书,提取乳鼠大脑皮层总mRNA,依照反转录试剂盒的说明步骤以Oligo(dT)为引物反转录cDNA,以cDNA为模板,添加上、下游引物。反应条件为: 96 ℃预变性5 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 45 s,共30个循环; 72 ℃再延伸10 min。扩增产物凝胶回收后,与真核表达质粒pEGFP-N1分别进行XhoⅠ和BamHⅠ双酶切,T4 DNA 连接酶连接构建重组质粒pEGFP-N1-PGC-1α,并转化感受态大肠杆菌DH5α,挑取阳性克隆,PCR初步鉴定。将阳性质粒转染原代皮层神经元,Western blot检测PGC-1α的表达情况。
2.2原代神经元培养 在培养原代皮层神经元前,以0.5%多聚赖氨酸铺板,37 ℃过夜。次日取出以超纯水冲洗3次,超净台内晾干备用。乳鼠用乙醚麻醉,快速取脑,解剖显微镜下分出两侧皮层并仔细剥除脑膜和血管等纤维成分,用眼科剪剪切至约1 mm×1 mm×1 mm的小块。以0.25%的胰蛋白酶(1∶250)溶液,37 ℃水浴消化15 min后,含10%胎牛血清的高糖DMEM培养基终止消化。加入适量脱氧核糖核酸酶(DNase, 1×105U/L),反复吹打成细胞悬液。200目不锈钢筛网过滤后,滤液以1 000 r/min离心5 min,弃去上清。以DMEM培养基重悬细胞后计数,以1×109/L的密度接种于培养板中。细胞置于37 ℃、5% CO2培养箱中培养。接种4 h后更换为神经元培养液(Neurobasal+10% B27)。此后每3 d以神经元培养液半量换液。在体外培养6 d时进行pEGFP-N1和pEGFP-N1-PGC-1α质粒的转染。
2.3构建氧糖剥夺/复氧模型 将分别转染有pEGFP-N1和pEGFP-N1-PGC-1α质粒的皮层神经元,采用氧糖剥夺/复氧方法造模[4,11],用预温不含钙离子的D-Hanks液冲洗2次后,加入无糖DMEM培养基,置于缺氧罐内,以95% N2和5% CO2混合气置换缺氧罐内氧气,37 ℃培养箱内进行2 h氧糖剥夺。氧糖剥夺后,添加神经元培养液,于37 ℃、5% CO2培养箱中培养22 h模拟复氧过程。
2.4线粒体质量分数检测 将OGD/R处理后的神经元弃上清,缓慢用预温PBS冲洗3遍。添加含30 nmol/L MitoTracker Red的神经元培养液,37 ℃培养箱内避光培养30 min。PBS冲洗3遍,4%多聚甲醛室温固定20 min,PBS冲洗3遍,用含DAPI的65%磷酸甘油封片,激光共聚焦显微镜观察线粒体形态。
2.5ROS及ATP含量的检测 OGD/R处理后的原代皮层神经元弃上清,添加含10 μmol/L超氧阴离子探针的培养基,避光培养30 min,弃上清,预温PBS重新3次,0.25%胰蛋白酶消化,离心,重悬于PBS溶液,流式细胞仪检测细胞内ROS的生成情况。根据CellTiter-Glo® 2.0 Assay试剂盒样品操作说明书,将处理的样品用96微孔板发光检测仪(Microplate Luminometer)检测神经元内ATP的相对含量。
2.6TUNEL检测细胞凋亡 原代神经元爬片、转染,经OGD/R处理后,弃培养基。4%多聚甲醛室温固定细胞爬片20 min,PBS清洗3次,每次5 min。根据一步法TUNEL细胞凋亡检测试剂盒说明书依次添加相应试剂。荧光显微镜下拍照。
2.7Western blot实验 RIPA法提取细胞总蛋白,BCA法进行蛋白定量。12% SDS-PAGE分离目的蛋白,湿转至PVDF膜上,5%脱脂牛奶室温封闭1 h,4 ℃过夜孵育 I 抗,TBST冲洗3遍,添加辣根过氧化物酶标记的 II 抗,室温1 h,TBST冲洗3遍,ECL试剂盒显影曝片。Quantity One 4.62图像分析软件进行条带灰度分析。
3统计数据处理
用GraphPad Prism 6.0软件进行统计分析。实验数据均以均数±标准差(mean±SD)表示,组间比较时采用t检验。以P<0.05 为差异有统计学意义。
结 果
1PGC-1α过表达质粒的构建
将连接产物转化感受态DH5α,挑取阳性克隆进行PCR初步检测,在2 300 bp处具有目的片段,见图1A。提取阳性质粒,用脂质体法瞬时转染原代皮层神经元,48 h后提取神经元总蛋白,Western blot检测PGC-1α的表达情况,与转染pEGFP-N1组相比较,转染pEGFP-N1-PGC-1α组中PGC-1α的表达显著增高(P<0.01),见图1B。
2PGC-1α过表达对OGD/R诱导的神经元线粒体质量和功能的影响
MitoTracker Red检测结果显示,OGD/R处理后,pEGFP-N1-PGC-1α组神经元的线粒体质量分数高于pEGFP-N1组,差异具有统计学意义(P<0.05),见图2A;神经元内超氧化物的检测结果显示,PGC-1α的过表达降低OGD/R诱导的神经元ROS的产生,见图2B;线粒体生成ATP能力的检测结果显示,OGD/R处理后,pEGFP-N1-PGC-1α组神经元ATP的生成能力大于pEGFP-N1组(P<0.01),见图2C。

Figure 1. Construction of recombinant plasmid pEGFP-N1-PGC-1α. A: recombinant plasmid pEGFP-N1-PGC-1α was identified by PCR; B: recombinant plasmid pEGFP-N1-PGC-1α was identified by Western blot. Mean±SD.n=3.**P<0.01vspEGFP-N1 group.
图1PGC-1α过表达重组质粒的构建
3PGC-1α过表达对OGD/R诱导神经元凋亡的影响
OGD/R处理后,转染pEGFP-N1的神经元凋亡个数明显增加,而pEGFP-N1-PGC-1α质粒的转染抑制了神经元的凋亡(P<0.01),见图3。
4PGC-1α过表达对凋亡执行蛋白表达的影响
提取皮层神经元总蛋白,对细胞凋亡执行蛋白caspase-3的检测结果显示,OGD/R诱导原代皮层神经元caspase-3的激活形式增加,而转染pEGFP-N1-PGC-1α质粒的皮层神经元抑制了caspase-3激活形式的增加,表明PGC-1α的过表达抑制OGD/R诱导的原代皮层神经元caspase-3的激活,见图4。
讨 论
脑缺血再灌注损伤是脑卒中患者神经损伤的主要病理过程,兴奋性毒性、Ca2+超载、氧自由基形成和炎症反应等理论并不能详细阐明该机制,最近的研究表明,线粒体生成能力降低和动力学紊乱等导致的线粒体功能降低可能是该病理过程的重要机制[16-18]。线粒体作为细胞内的重要细胞器,主要通过氧化磷酸化产生ATP给细胞供能,因此,代谢活跃且能量需求较高的细胞或组织内线粒体的含量较高,如心肌细胞和神经元,研究表明,这两类细胞内线粒体总体积分数约占细胞体积的30%[19-20]。因此,这些组织的细胞内线粒体生成能力破坏导致线粒体数量减少,能量产生能力降低,最终导致细胞凋亡。本研究显示,氧糖剥夺/复氧处理原代皮层神经元后,确实发现神经元内线粒体的质量分数降低、活性氧生成增加、功能损伤, ATP生成能力降低等,该结果与前期的研究一致[11]。
Figure 2. The effect ofPGC-1αover-expression on mitochondrial mass and function in cortical neurons induced by OGD/R. A: mitochondrial mass was stained by MitoTracker Red; B: ROS was detected by flow cytometry; C: ATP level was detecfed by ATP metabolic assay kit. Mean±SD.n=3.*P<0.05,**P<0.01vspEGFP-N1 group.
图2PGC-1α过表达对OGD/R诱导皮层神经元线粒体质量和功能的影响
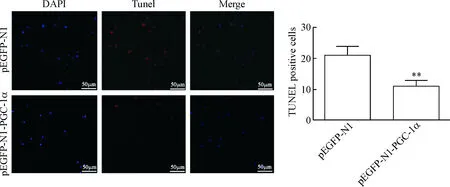
Figure 3. The effect ofPGC-1αover-expression on TUNEL positive cells in cortical neurons induced by OGD/R. Mean±SD.n=3.**P<0.01vspEGFP-N1 group.
图3PGC-1α过表达对OGD/R诱导皮层神经元TUNEL阳性细胞数的影响
PGC-1α、核呼吸因子(nuclear respiratory factor,NRF)和线粒体转录因子A(mitochondrial transcription factor A,TFAM)是参与细胞内线粒体生成的重要调控因子,三者之间彼此具有上下游的线性关系,如PGC-1α调控NRF1的表达,以及辅助NRF1调控TFAM的转录和表达,由此可见, PGC-1α是调控线粒体生成的关键因子[21]。本研究构建PGC-1α的真核表达载体,转染皮层神经元,观察氧糖剥夺/复氧对神经元线粒体质量分数和功能以及神经元凋亡的影响,结果发现,PGC-1α过表达抑制OGD/R诱导的皮层神经元线粒体质量分数降低,逆转氧糖剥夺复氧诱导的神经元线粒体生成的降低。对线粒体功能的研究表明,OGD/R增加转染空质粒的神经元内ROS的生成,降低神经元内ATP的生成,PGC-1α过表达逆转该过程,抑制神经元内超氧化物的升高,增强ATP的生成能力。TUNEL结果显示,OGD/R增强转染空质粒的皮层神经元的凋亡,促进caspase-3的激活,PGC-1α过表达抑制OGD/R诱导的皮层神经元凋亡的增加,抑制caspase-3的激活,说明pEGFP-N1-PGC-1α质粒的转染增加神经元内PGC-1α的过表达,增加线粒体的生成,抑制神经元内超氧化物的增加,维护线粒体的功能,从而降低氧糖剥夺/复氧诱导的神经元凋亡。

Figure 4. The effect ofPGC-1αover-expression on the protein levels of caspase-3 in cortical neurons induced by OGD/R. Mean±SD.n=3.*P<0.05vspEGFP-N1 group.
图4PGC-1α过表达对OGD/R诱导皮层神经元caspase-3的影响
综上所述,神经元过表达PGC-1α可以促进线粒体生成、降低超氧化物的产生并增强线粒体的功能,最后抑制氧糖剥夺复氧诱导的神经元凋亡,从而发挥神经保护作用。这提示PGC-1α可以作为开发治疗脑缺血再灌注损伤药物的靶标之一。
[1] 王 来, 祝世功. 线粒体生成与脑缺血再灌注损伤的研究进展[J]. 中国病理生理杂志, 2016, 32(8):1478-1483.
[2] Kumar R, Bukowski MJ, Wider JM, et al. Mitochondrial dynamics following global cerebral ischemia[J]. Mol Cell Neurosci, 2016, 76:68-75.
[3] Calo L, Dong Y, Kumar R, et al. Mitochondrial dyna-mics: an emerging paradigm in ischemia-reperfusion injury[J]. Curr Pharm Des, 2013, 19(39):6848-6857.
[4] Geng HX, Li RP, Li YG, et al.14,15-EET suppresses neuronal apoptosis in ischemia-reperfusion through the mitochondrial pathway[J]. Neurochem Res, 2017, 42(10): 2841-2849.
[5] 赵士弟, 陈 耀, 姜丽娜, 等. 大豆异黄酮对脑缺血/再灌注诱导的线粒体损伤和脑细胞凋亡的影响[J]. 中国病理生理杂志, 2014, 30(12):2172-2178.
[6] Villena JA. New insights into PGC-1 coactivators: redefining their role in the regulation of mitochondrial function and beyond[J]. FEBS J, 2015, 282(4):647-672.
[7] Greene NP, Lee DE, Brown JL, et al. Mitochondrial quality control, promoted by PGC-1α, is dysregulated by Western diet-induced obesity and partially restored by moderate physical activity in mice[J]. Physiol Rep, 2015, 3(7): e12470.
[8] Eisele PS, Furrer R, Beer M, et al. The PGC-1 coactivators promote an anti-inflammatory environment in skeletal muscleinvivo[J]. Biochem Biophys Res Commun, 2015, 464(3):692-697.
[9] Su X, Chu Y, Kordower JH, et al. PGC-1α promoter methylation in Parkinson’s disease[J]. PLoS One, 2015, 10(8):e0134087.
[10] Rowe GC, Arany Z. Genetic models of PGC-1 and glucose metabolism and homeostasis[J]. Rev Endocr Metab Disord, 2014, 15(1):21-29.
[11] Wang L, Chen M, Yuan L, et al. 14,15-EET promotes mitochondrial biogenesis and protects cortical neurons against oxygen/glucose deprivation-induced apoptosis[J]. Biochem Biophys Res Commun, 2014, 450(1):604-609.
[12] Hasegawa K, Yasuda T, Shiraishi C, et al.Promotion of mitochondrial biogenesis by necdin protects neurons against mitochondrial insults[J]. Nat Commun, 2016, 7:10943.
[13] 马晓娟, 刘爱翠, 马巧丽, 等. pEGFP-N1-VirB8真核表达载体的构建及其在大鼠脑内的表达[J]. 宁夏医科大学学报, 2016, 38(4):372-375.
[14] 舒晓明, 逯 丹, 王 珍, 等. pEGFP-HSP70重组质粒的构建及其在大鼠神经干细胞中的表达[J]. 中国病理生理杂志, 2014, 30(5):842-846.
[15] 刘 曼, 何 月, 张吉翔.Nrf2 过表达对乙醇刺激下肝星状细胞激活与增殖及合成I 型胶原的影响[J]. 中国病理生理杂志, 2013, 29(9):1590-1596.
[16] Villa RF, Gorini A, Ferrari F, et al. Energy metabolism of cerebral mitochondria during aging, ischemia and post-ischemic recovery assessed by functional proteomics of enzymes[J]. Neurochem Int, 2013, 63(8):765-781.
[17] Bi J, Li H, Ye SQ, et al. Pre-B-cell colony-enhancing factor exerts a neuronal protection through its enzymatic activity and the reduction of mitochondrial dysfunctioninvitroischemic models[J]. J Neurochem, 2012, 120(2):334-346.
[18] Wappler EA, Institoris A, Dutta S, et al. Mitochondrial dynamics associated with oxygen-glucose deprivation in rat primary neuronal cultures[J]. PLoS One, 2013, 8(5):e63206.
[19] Schaper J, Meiser E, Stämmler G. Ultrastructural morphometric analysis of myocardium from dogs, rats, hamsters, mice, and from human hearts[J]. Circ Res, 1985, 56(3):377-391.
[20] Page E, McCallister LP. Quantitative electron microscopic description of heart muscle cells. Application to normal, hypertrophied and thyroxin-stimulated hearts[J]. Am J Cardiol, 1973, 31(2):172-181.
[21] Scarpulla RC. Nucleus-encoded regulators of mitochondrial function: integration of respiratory chain expression, nutrient sensing and metabolic stress[J]. Biochim Biophys Acta, 2012, 1819(9-10):1088-1097.
(责任编辑: 林白霜, 罗 森)
Over-expression of PGC-1α reverses mitochondrial function reduction and apoptosis in OGD/R-induced neurons
GENG Hui-xia1, LI Ying-ge2, SHI Zhen-yu1, LI Yong-qiang1, WANG Lai2
(1SchoolofNursingandHealthSciences,2SchoolofLifeScience,HenanUniversity,Kaifeng475001,China.E-mail:wanglai@henu.edu.cn)
AIM: To investigate the effect of over-expression of peroxisome proliferator-activated receptor γ coactivator-1α (PGC-1α) on mitochondrial morphology and cell apoptosis in the cortical neurons with oxygen glucose deprivation/reoxygenation (OGD/R).METHODSThe whole gene sequence ofPGC-1αwas obtained from the cerebral cortex of C57BL/6 mice by RT-PCR and cloned into the eukaryotic expression vector pEGFP-N1. The pEGFP-N1-PGC-1α was identified by PCR, and transfected into cortical neurons. The level of PGC-1α expression was identified by Western blot. The cortical neurons transfected with pEGFP-N1 and pEGFP-N1-PGC-1α vectors were treated with OGD/R. The mitochondrial mass, reactive oxygen species (ROS) and ATP production, cell apoptosis and changes of cleaved caspase-3 were detected by MitoTracker Red staining, flow cytometry, ATP metabolic assay kit and TUNEL.RESULTSOver-expression ofPGC-1αinhibited the decrease in mitochondrial biogenesis capacity and the ROS formation of OGD/R neurons (P<0.05), enhanced the ability of ATP synthesis (P<0.01), inhibited neuronal apoptosis (P<0.01) and decreased the activation of caspase-3 (P<0.01).CONCLUSIONPGC-1αover-expression inhibits neuronal apoptosis with OGD/R treatment by promoting mitochondrial biogenesis, inhibiting the production of ROS and maintaining mitochondrial function. PGC-1α may be used as a target for the development of cerebral ischemia/reperfusion injury drugs.
Over-expression; Cortical neurons; Oxygen-glucose deprivation/reoxygenation; Apoptosis; Peroxisome proliferator-activated receptor γ coactivator-1α
1000- 4718(2017)11- 2078- 06
2017- 05- 02
2017- 07- 20
河南省基础与前沿技术研究计划(No. 162300410102);河南省博士后科研资助项目(No. 2015051);河南省高等学校重点科研项目(No. 15A180031)
△通讯作者 Tel: 0371-23880292; E-mail: wanglai@henu.edu.cn
R743; R363
A
10.3969/j.issn.1000- 4718.2017.11.025

