基于骨肉瘤高表达抗原PBF CTL表位改造及鉴定*
张建新, 时冉冉
(1许昌学院, 河南 许昌 461000; 2漯河医学高等专科学校, 河南 漯河 462002)
基于骨肉瘤高表达抗原PBF CTL表位改造及鉴定*
张建新1, 时冉冉2△
(1许昌学院, 河南 许昌 461000;2漯河医学高等专科学校, 河南 漯河 462002)
目的观察骨肉瘤高表达抗原乳头瘤病毒结合因子(PBF)的改造表位是否有HLA-A2限制性抗肿瘤能力,开发基于骨肉瘤的多肽免疫治疗。方法首先运用RT-PCR和Western blot方法检测PBF在骨肉瘤细胞系U2OS和Saos-2的表达情况。然后通过NetCTL 1.2、SYFPEITHI和IEDB软件预测打分来选取PBF的HLA-A2限制性表位。替换PBF抗原锚定位点氨基酸获得改造肽。候选表位肽的合成方法是标准的Fmoc化学合成法,结合力实验用于检测候选表位与T2A2细胞表面HLA-A2分子的结合能力,ELISPOT实验检测候选表位肽诱导细胞毒性T淋巴细胞(CTL)分泌干扰素γ(IFN-γ)的能力,乳酸脱氧酶(LDH)释放实验和羧基荧光素琥珀酰亚胺脂(CFSE)细胞毒实验检测候选肽诱导CTL的能力。结果PBF在骨肉瘤细胞系U2OS和Saos-2均有表达,候选肽P75-1Y2L、P412-1Y、P416-1Y2L9V、P107-1Y和P435-1Y2L具有较好的结合力,且改造肽与HLA-A2的结合力高于原肽。ELISPOT实验结果显示表位肽P412、P412-1Y、P416、P416-1Y2L9V和P435-1Y2L诱导的CTL具有分泌IFN-γ的能力;P412-1Y和P416-1Y2L9V诱导特异性T细胞免疫分泌的IFN-γ略高于原肽。LDH释放实验和CFSE细胞毒实验结果显示表位P412、P412-1Y、P416和P416-1Y2L9V对U2OS细胞均有一定的杀伤作用,P412-1Y和P416-1Y2L9V特异性CTLs对U2OS细胞杀伤率高于原肽特异性CTLs。结论PBF抗原改造表位P412-1Y和P416-1Y2L9V与天然表位P412和P416相比有更高的HLA-A2分子亲和力,保留了原有的免疫原性,并且改造肽抗肿瘤免疫效应强于天然表位。P412-1Y和P416-1Y2L9V是优秀的PBF抗原的HLA-A*0201限制性CTL候选表位,可以成为新的抗肿瘤多肽免疫治疗疫苗的候选表位。
乳头瘤病毒结合因子; 表位; 细胞毒性T淋巴细胞; 骨肉瘤
骨肉瘤是骨科最常见的原发性恶性肿瘤。1970年前,骨肉瘤患者的生存率低于20%。辅助化疗和手术治疗准则的建立,使患者五年存活率提高为60%~70%[1-2]。 这些进展掩盖了近年来的辅助免疫治疗,尽管使用自身肿瘤疫苗的辅助免疫治疗具有一定的治疗功效[3-5], 但是,骨肉瘤患者的存活率在过去10年已经进入停滞期[6-7],这又重新激起了免疫治疗方法的开展[8-9]。乳头瘤病毒结合因子(pa-pillomavirus-binding factor,PBF)被鉴定为调节人乳头瘤病毒8型基因组上的启动子活性的转录因子[10]。PBF是由自体细胞毒性T淋巴细胞(cytoto-xic T-lymphocytes,CTL)克隆识别的骨肉瘤相关抗原[11]。 免疫组织化学分析显示,92%的骨肉瘤活检标本表达PBF。 此外,PBF阳性骨肉瘤具有比PBF阴性表达更差的预后[12]。 通常,常规骨肉瘤是间充质来源的恶性肿瘤,没有特定的病因,例如病毒感染。 PBF不仅在人乳头瘤病毒基因组的转录中具有某些功能,而且在骨肉瘤[13-14]、先天免疫[15]和脂肪形成[16]的细胞增殖和凋亡中具有某些功能。本次研究使用NetCTL 1.2、SYFPEITHI和IEDB生物信息学软件进行综合预测,筛选出综合打分较高的表位,并对优势表位进行适当替换,通过进一步的实验分析,鉴定筛选出PBF的HLA-A*0201限制性CTL表位[17-19],为未来构建多表位疫苗和重组蛋白融合疫苗打下基础。
材 料 和 方 法
1材料
T2A2细胞、U2OS细胞(HLA-A2+)和Saos-2细胞(HLA-A2-)由漯河医学高等专科学校分子医学实验室常规保存,采用37 ℃、5% CO2、饱和湿度培养条件下常规培养。外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)由HLA-A2+健康供者捐赠。HLA-A2+外周血健康供者来自课题组寻找的健康供者。
2方法
2.1PBF 在肿瘤细胞中的表达 采用RT-PCR和Western blot法检测PBF在骨肉瘤细胞系U2OS和Saos-2中的表达情况。参照说明书提取总RNA,反转录得到cDNA,以cDNA为模板行PCR。扩增条件为: 95 ℃预变性30 s; 95 ℃变性30 s, 63 ℃退火45 s, 72 ℃延伸45 s,共30个循环; 72 ℃终止延伸5 min。将PCR产物行1%琼脂糖凝胶电泳,采用凝胶成像系统观察结果,ImageJ软件测定各条带灰度值。PBF的上游引物序列为 5’-TGTGCACAGGTGTCTTTGGT-3’,下游引物序列为5’-CCTGAGCGAAGTTCCCATGT-3’,产物大小278 bp。GAPDH的上游引物序列为5’-GAAGGTGAA GGTCGGAGTC-3’, 下游序列引物为5’-GAAGATGGTGATGGGATTTC-3’,产物大小为226 bp。裂解细胞提取总蛋白,BCA法定量,行SDS-PAGE并转移PVDF膜。封闭液封闭1 h,加入已稀释的 I 抗,4 ℃孵育过夜,TBST洗膜3次,加入 II 抗,室温下孵育1 h, TBST洗膜3次,加入ECL进行发光反应。用ImageJ软件测定各条带灰度值。
2.2HLA-A*0201限制性CTL表位肽的预测 结合NetCTL 1.2(http://www.cbs.dtu.dk/services/NetCTL/)、SYFPEITHI(http://www.syfpeithi. de/ bin/MHCServer.dll/EpitopePrediction.htm)和IEDB(http://tools.iedb.org/main/tcell/)软件对PBF氨基酸序列的预测打分,分别打开这3种预测软件的主页,进入 CTL 表位预测界面,本次研究以A2超型为主,参数设定为CTL表位限制性 MHC类型——HLA-A*0201。预测抗原肽长度nonamers (9 aa)。根据各个预测软件所推选的前30个优势表位进行综合选择,选出在各种软件打分较好的HLA-A*0201限制性表位。
2.3HLA-A*0201限制性CTL表位肽的合成、纯化、分析及质谱鉴定 候选表位肽由上海生工生物工程有限公司合成,经HPLC分析纯化后,其纯度大于95%,质谱分析其相对分子质量符合理论值。
2.4表位肽与HLA-A2分子结合力实验 收集T2A2细胞,用无血清RPMI-1640培养基洗3次,调整细胞浓度至1×109/L,铺于24孔板中,每孔1 mL,每实验孔加入待测肽50 mg/L,β2-M 2.5 mg/L,37 ℃、5% CO2共孵育18 h后,冷PBA洗涤3次,加入500 μL稀释度为1∶100的 I 抗(鼠抗人β2-M),4 ℃避光静置40 min。之后冷PBA洗涤3次,加入50 μL稀释度为1∶50的 II 抗(FITC标记的羊抗鼠IgG溶液),4 ℃静置40 min,PBA洗涤1次后上流式细胞仪检测。其结果用荧光指数(fluorescence index, FI)表示,FI=(表位肽平均荧光强度-背景平均荧光强度)/背景平均荧光强度。FI>1.0表示高等结合力,1.0>FI>0.5表示中等结合力,FI<0.5表示低结合力[20]。
2.5CTL的体外诱导 抽取HLA-A2+健康供者的外周血,将外周血加入含肝素钠的离心管中,经常规聚蔗糖-泛影葡胺分层液梯度离心,获取PBMCs,用含10%胎牛血清的IMDM培养基调整细胞浓度为1.5×109/L。第2天分别加入10 mg/L的候选肽共培养,第3天加入5×104U/L的rIL-2继续培养。每周收集细胞,1 000 r/min离心10 min,除去上清,加入新鲜的10%胎牛血清的IMDM培养基,同时加入上述条件的候选肽和rIL-2。刺激3轮后于最后一次刺激的第3天收集细胞。调整细胞浓度作为效应细胞,用无血清IMDM培养基调整细胞浓度作为靶细胞[21]。
2.6干扰素γ(Interferon-γ,IFN-γ)分泌水平检测 酶联免疫斑点实验(enzyme-linked immunospot assay,ELISPOT)试剂盒购自达科为生物技术有限公司。取出板条,加200 μL无血清的IMDM培养基进行封闭,静置10 min;诱导的CTL作为效应细胞,荷肽的T2A2作为刺激细胞,细胞浓度均调整为2×109/L;设立对照孔和实验孔,37 ℃、5% CO2孵育18 h;倾尽孔中培养基,每孔加入200 μL无菌的去离子水,4 ℃ 裂解细胞10 min;倾尽孔内液体,加入200 μL 1×Washing Buffer进行洗涤,洗涤6次,每次停留60 s;加入 100 μL生物素标记的抗体,37 ℃ 孵育1 h;倾尽孔内液体,加入200 μL 1×Washing Buffer进行洗涤,洗涤方法同上,在吸水纸上拍干;加入100 μL酶联亲和素,37 ℃ 孵育1 h;每孔加入200 μL 1×Washing Buffer进行洗涤,洗涤方法同上;加入100 μL现配的AEC显色液,25 ℃避光静置30 min;结束后置于通风处,室温静置干燥;结果用 ELISPOT 图像分析仪计数 96 孔板中每孔的斑点数[22]。
2.7乳酸脱氢酶(lactate dehydrogenase,LDH)释放实验检测CTL的细胞毒性 调整CTL浓度为5×109/L;调整靶细胞U2OS细胞浓度为1×108/L;按50∶1、25∶1和12.5∶1的不同效靶比(effector/target,E/T)铺于96孔板中,同时设立效应细胞自发释放组、靶细胞自发释放组、靶细胞最大释放组、体积校正组和背景对照组,每孔终体积为100 μL。37 ℃、5% CO2培养4 h。于孵育结束前45 min在靶细胞最大释放组及体积校正组中加入10 μL裂解液,1 000 r/min离心4 min,转移50 μL上清至另一干净96孔板中,每孔加入50 μL底物混合液,室温避光孵育30 min;每孔再加入50 μL终止液。用酶标仪检测其在490 nm波长处的吸光度(A)。杀伤率(%)=(实验孔值-效应细胞自发释放值-CTL自发释放值)/(靶细胞值-效应细胞自发释放值)×100%[23]。
2.8羧基荧光素琥珀酰亚胺酯(carboxyfluorescein succinimidyl ester,CFSE)荧光染色检测CTL的细胞毒性 离心收集靶细胞,并将细胞重悬于含1% 胎牛血清的PBS中,并将细胞浓度调节至1×109/L。按下法制备致敏靶细胞:每1 mL细胞悬浮液加入0.5 μL 5 mmol/L CFSE,室温光照孵育4 min;对照靶细胞:每1 mL细胞悬液中加入0.5 μL 100 μmol/L CFSE,室温光照孵育4 min。将细胞用5% FCS-PBS洗涤1次,离心并除去上清液,重悬于无血清IMDM培养基中。将效应细胞在无血清IMDM培养基中洗涤1次,并以(1.25~5)×109/L的浓度重悬于无血清IMDM培养基中。将效应细胞(分别为12.5∶1、25∶1和50∶1)与致敏的靶细胞在离心管中混合,靶细胞数为2×104,37 ℃温育4 h后,用含有1% 胎牛血清和0.1%叠氮化钠的PBS(FACS缓冲液)处理相同E/T致敏的靶细胞组和对照靶细胞组,并用FACS缓冲液洗涤。离心,重悬在4%多聚甲醛的PBS溶液中,流式细胞仪检测。杀伤率(%)=(对照样品中致敏靶细胞的数量-测试样品中致敏靶细胞的数量)/对照样品中致敏靶细胞的数量×100%。
3统计学处理
实验数据用均数±标准差(mean±SD)表示,多组间均数比较采用单因素方差分析, 以P<0.05为差异有统计学意义。统计图均由GraphPad Prism 5.0软件绘制。
结 果
1PBF在骨肉瘤细胞系中的表达
分别使用RT-PCR以及Western blot的方法检测PBF在骨肉瘤细胞系中的表达,从图1中可以看出,PBF在U2OS和Saos-2骨肉瘤细胞系中均有表达。
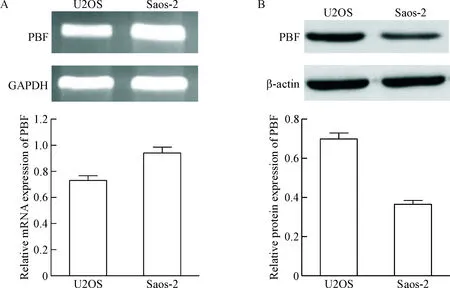
Figure 1. The mRNA (A) and protein (B) expression of PBF in the osteosarcoma cell lines determined by RT-PCR and Western blot.
图1骨肉瘤细胞系中PBF的表达
2PBFHLA-A2限制性CTL表位的预测结果
依据NetCTL 1.2、SYFPEITHI和IEDB软件的结果,选取在各个预测软件中分值排名靠前的表位肽,根据这3个预测软件进行综合打分,筛选出分值在各个软件中打分较好的CTL表位肽,对筛选的表位肽进行氨基酸替换,软件预测的改造表位的打分情况见表1。
表1PBFHLA-A2限制性CTL表位的预测结果
Table 1. Prediction scores of the HLA-A2 restricted epitope peptides derived from PBF
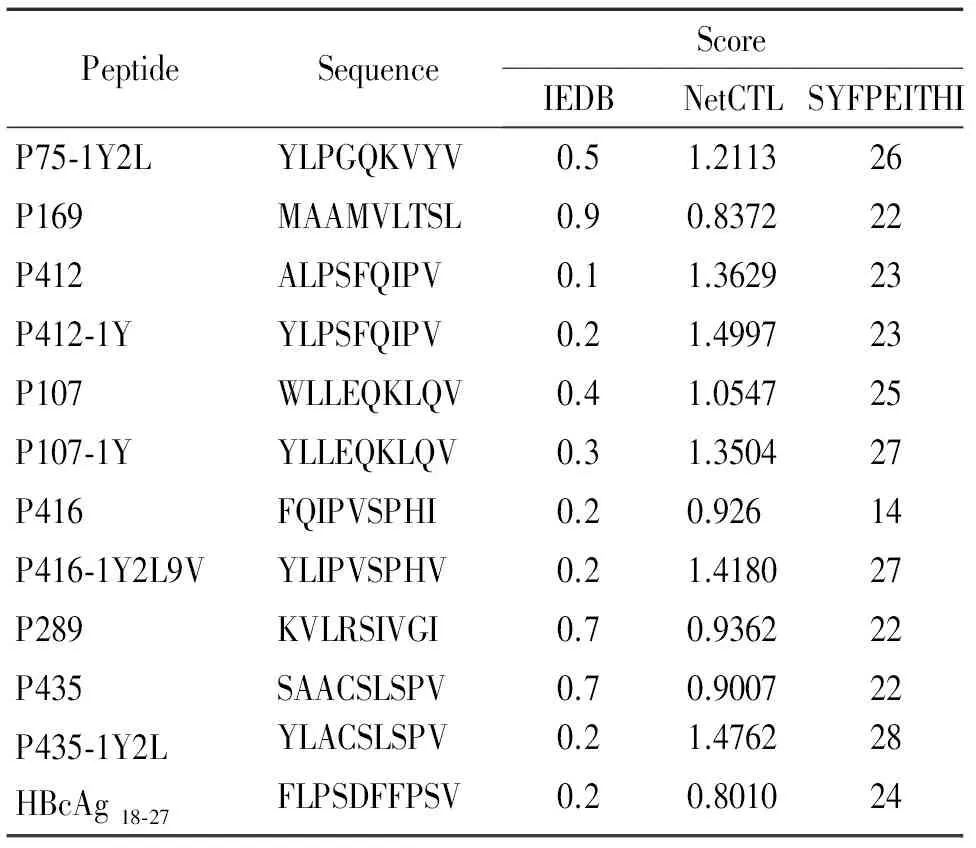
PeptideSequence ScoreIEDBNetCTLSYFPEITHIP75⁃1Y2LYLPGQKVYV0.51.211326P169MAAMVLTSL0.90.837222P412ALPSFQIPV0.11.362923P412⁃1YYLPSFQIPV0.21.499723P107WLLEQKLQV0.41.054725P107⁃1YYLLEQKLQV0.31.350427P416FQIPVSPHI0.20.92614P416⁃1Y2L9VYLIPVSPHV0.21.418027P289KVLRSIVGI0.70.936222P435SAACSLSPV0.70.900722P435⁃1Y2LYLACSLSPV0.21.476228HBcAg18⁃27FLPSDFFPSV0.20.801024
3表位肽/HLA-A2分子结合力实验结果
P75-1Y2L、P412-1Y、P416-1Y2L9V、P107-1Y和P435-1Y2L具有较好的HLA-A2结合力(FI>1);经过改造后的表位肽明显提高与MHC分子结合能力,见表2。
表2候选肽与HLA-A*0201分子结合力结果
Table 2. The data of the HLA-A*0201-binding affinity of the candidate peptides derived from PBF
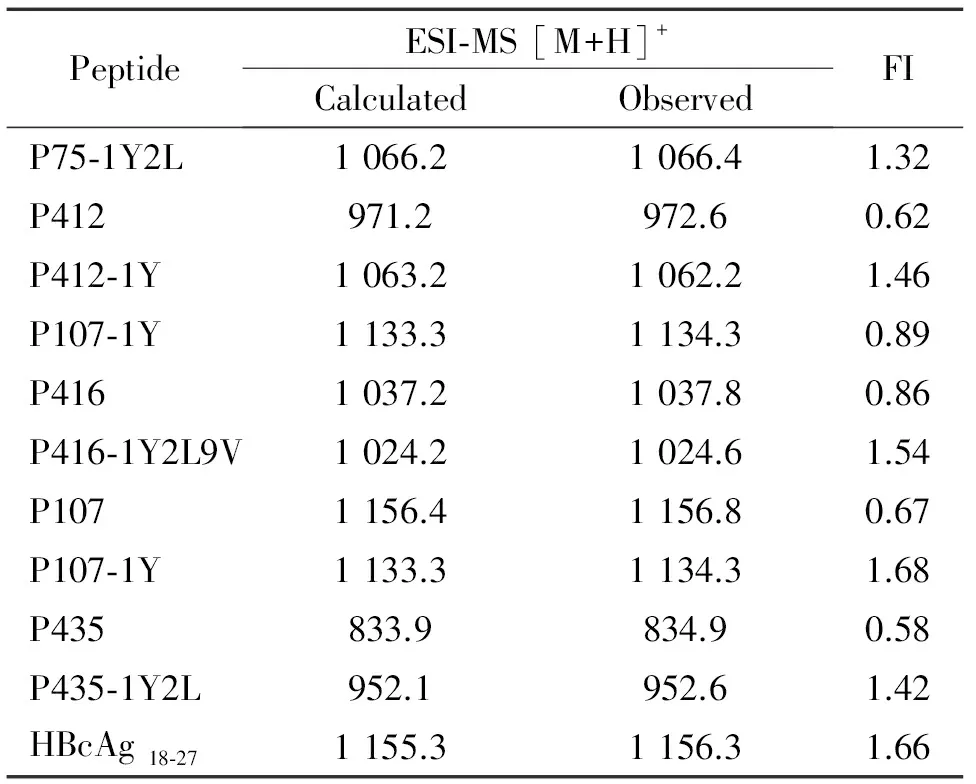
PeptideESI⁃MS[M+H]+CalculatedObservedFIP75⁃1Y2L1066.21066.41.32P412971.2972.60.62P412⁃1Y1063.21062.21.46P107⁃1Y1133.31134.30.89P4161037.21037.80.86P416⁃1Y2L9V1024.21024.61.54P1071156.41156.80.67P107⁃1Y1133.31134.31.68P435833.9834.90.58P435⁃1Y2L952.1952.61.42HBcAg18⁃271155.31156.31.66
FI = [mean fluorescence intensity (MFI) of the peptide-MFI background]/MFI background.4IFN-γ分泌水平的检测
根据结合力的实验结果,我们选择了高结合力的多肽进行实验,结果显示: P412、P412-1Y、P416、P416-1Y2L9V和P435-1Y2L多肽疫苗能检测到特异性T细胞免疫,能分泌较多的IFN-γ;P412-1Y、P416-1Y2L9V和P435-1Y2L诱导特异性T细胞免疫分泌的IFN-γ略高于原肽,见图2。
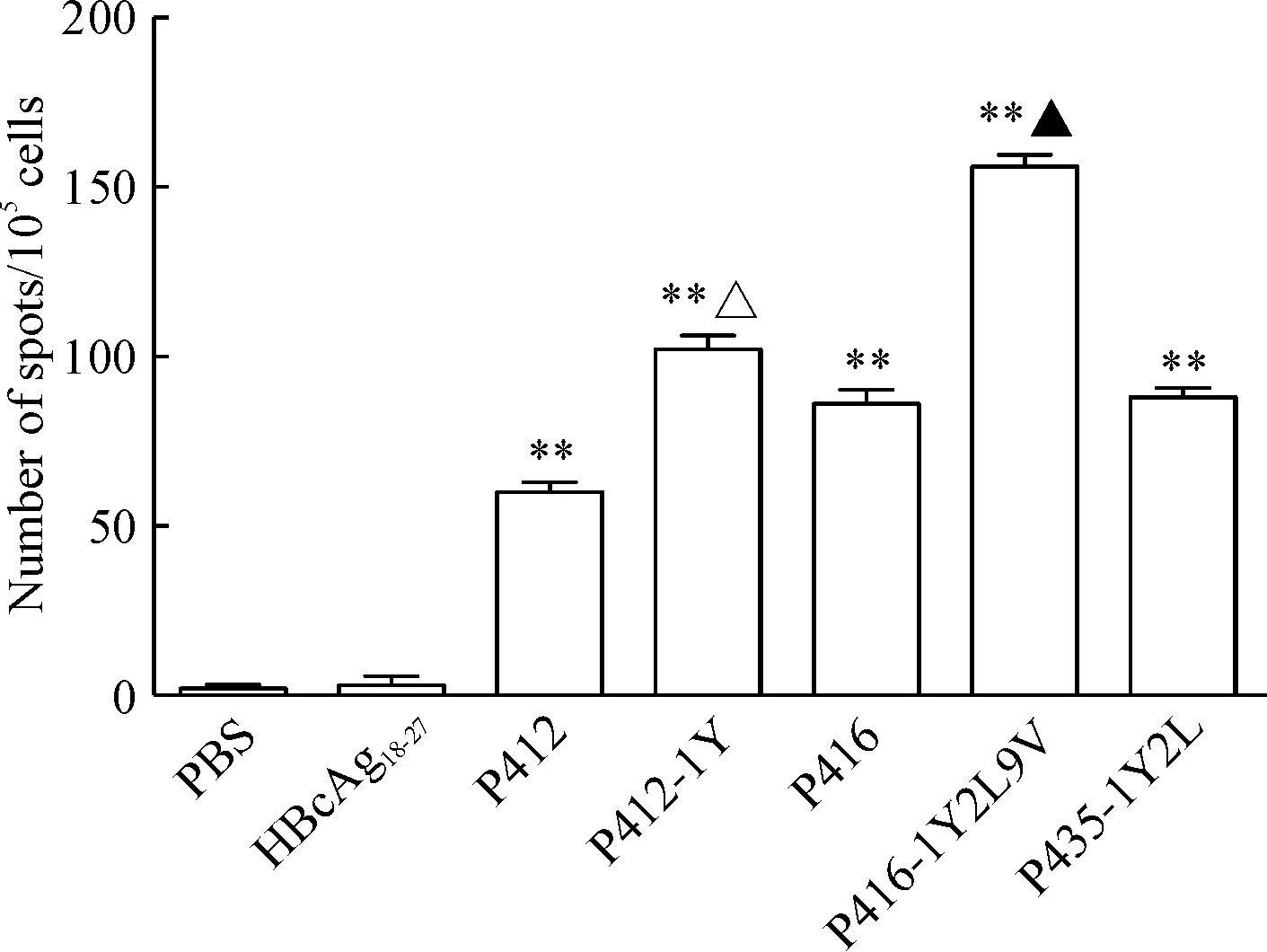
Figure 2. ELISPOT assay to measure IFN-γ release by CTLs induced from PBMCs of healthy donors. CTLs induced by PBS and irrelevant peptide HBcAg18-27were taken as negative control. Mean±SD.n=3.**P<0.01vsPBS group;△P<0.05vsP412 group;▲P<0.05vsP416 group.
图2ELISPOT法检测PBF候选表位肽特异性CTL分泌IFN-γ的能力
5LDH法检测细胞毒性
根据IFN-γ分泌水平结果,我们将有效果的P412、P412-1Y、P416和P416-1Y2L9V做进一步的免疫活性检测。LDH释放实验结果显示,P412、P412-1Y、P416和P416-1Y2L9V诱导得到的CTL在不同效靶比(12.5∶1、25∶1和50∶1)时对PBF表达阳性的骨肉瘤细胞系U2OS(HLA-A2+)的杀伤率均明显高于阴性对照(PBS)组和无关肽(HBcAg18-27)组(P<0.01),见图3。
6CFSE荧光染色检测细胞毒性的实验结果
候选肽所诱导产生的CTL,随着效靶比的提高杀伤效果相应提高。P412和P412-1Y诱导得到的CTL在效靶比为50∶1时对荷肽T2A2的杀伤率分别是23.0%和35.2%,P416和P416-1Y2L9V诱导得到的CTL在效靶比为50∶1时对荷肽T2A2的杀伤率分别是25.5%和32.3%,见图4。
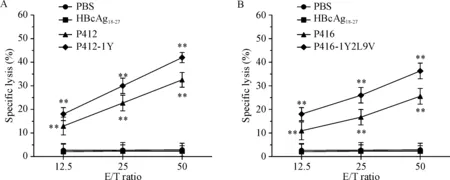
Figure 3. Specific lysis of U2OS cells (HLA-A2+) by the CTLs generated from PBMCs of healthy donors. CTLs were induced by PBF-derived peptides and their analogues. A: P412 and P412-1Y; B: P416 and P416-1Y2L9V. The effector/target (E/T) ratios were 12.5∶1, 25∶1 and 50∶1. The levels of LDH release were detected. CTLs induced by PBS and irrelevant peptide HBcAg18-27were used as negative control. Mean±SD.n=3.**P<0.01vsPBS group.
图3P412和P416候选肽及其类似物诱导得到的CTL在不同效靶比时对靶细胞U2OS的杀伤情况
讨 论
骨与软组织肉瘤在分子靶向治疗方面近年来取得了很大的进展,但是除了胃肠道间质瘤外,其它类型的肉瘤对分子靶向治疗的疗效仍不理想,可能是由于药物针对的靶点特异性不强和功能不够关键所致。免疫治疗和基因治疗在软组织肉瘤和胶质细胞肿瘤中尚处于研究阶段,尽管在动物肿瘤模型中取得了很好的结果,但在临床上尚未能达到预期的结果,其原因是尚未掌握很好的、控制高度复杂的免疫系统的方法,因此目前还存在很多问题有待于解决,如何选择分子靶向治疗药物并克服耐药、选择高效的免疫治疗和基因治疗的靶点、构建具有高度特异性和高免疫源性的疫苗、提高基因治疗的转染效率、靶向性和安全性等是目前急需解决的问题。深人研究骨科肿瘤发展的分子机制将有利于开发更多、更特异、更有效的新型靶向治疗药物。肿瘤抗原特异性疫苗含有多种表位,包括Th表位、CTL表位和B细胞表位等,因此免疫原性也强,仅次于肿瘤细胞疫苗,可诱导特异性CTL产生和抗体产生,杀死靶细胞,抑制肿瘤生长,使一些肿瘤患者缓解。细胞毒性T细胞是T淋巴细胞的一部分,具有细胞毒性,在体细胞免疫中起重要作用,CTL是抗肿瘤免疫的主要效应细胞,同时还在抗病毒、抗细菌中作用突出。

Figure 4. Detection of antigen-specific cytotoxicity by FACS-CTL assay. A: P412 and P412-1Y; B: P416 and P416-1Y2L9V. The effector/target (E/T) ratios were 12.5∶1, 25∶1 and 50∶1. CTLs induced by PBS and irrelevant peptide HBcAg18-27were used as negative control.**P<0.01vsPBS group.
图4CFSE法特异性CTL的体外细胞毒实验结果
在本研究中,我们检查了肿瘤相关抗原PBF的HLA-A*0201结合肽的免疫原性。CTL识别肿瘤相关抗原是发展抗原特异性癌症免疫治疗的首要条件。然而,鉴于在建立自体肿瘤-CTL的技术难度,基于自体的抗原鉴定主要来自黑素瘤和肾细胞癌。在其它肿瘤,包括骨和软组织肉瘤,已经使用反向免疫学方法,并且已经定义了来自肿瘤特异性融合基因的抗原肽,例如滑膜肉瘤中的SYT-SSX[24-25]、尤文氏肉瘤中的EWS-FLI1[23]和肺泡横纹肌肉瘤中的PAX3-FKHR[26-27]。因为通过反向方法定义的肽不都是在肿瘤细胞中加工,所以在临床应用之前需要严格评价这些合成肽。事实上,来自12名患有慢性骨髓性白血病[28],12名患有尤文氏肉瘤[26]和4名患有肺泡横纹肌肉瘤的患者中,仅在具有尤文氏肉瘤的单个患者中导致肿瘤缓解。PBF来源的多肽可以进一步有效地提高骨肉瘤患者的存活率,特别是对当前化疗方案没有效果的患者。抗原肽-MHC-I 类分子复合物的形式表达于细胞表面,供特异性 CD8+T 细胞识别[28-29]。天然 CTL 表位与 MHC-I 的亲和力较弱,也容易引起机体的免疫耐受,并且在体内易受蛋白酶的攻击水解。针对这些不足,国内外许多学者采用了不同的方法对天然 CTL 表位进行改造[22]。1993年,Sundara等[30]证明HLA-A2.1结合基序可以被定位在位置2(P2)的亮氨酸(L)或甲硫氨酸(M)和位置9(P9)的亮氨酸(L)、缬氨酸(V)或异亮氨酸(I)。Tourdot等[31]表明,酪氨酸P1的替代可以提高HLA-A2-限制性表位的免疫原性。
预测T细胞表位的生物信息学方法很多,在本次研究中,选择NetCTL 1.2、SYFPEITHI和IEDB等预测软件,综合这3个软件的打分结果进行初步的表位筛选,筛选出的优势表位,在氨基酸1、2、9位置进行适当的替换,所有的表位进行结合力实验,从结合力实验看出,经过氨基酸替换后的表位,可以提高MHC分子与表位肽的结合。随后对亲和力较高的表位进行体外免疫活性检测,结果显示,P412、P412-1Y、P416和P416-1Y2L9V多肽表位疫苗能检测到特异性T细胞免疫,可以分泌较多的IFN-γ。并且这4条肽对靶细胞具有杀伤作用。表位的改造可以增强HLA的结合能力和T细胞(抗原)受体(T-cell receptor,TCR)的识别能力,可以更加有效的打破免疫耐受,氨基酸替换在多肽表位中可以有效地诱导肽特异性CTLs。多肽进行修饰可增加多肽在体内的半衰期,防止酶类的降解,提高其稳定性。对天然性多肽进行修饰是一条值得探索的肿瘤免疫治疗途径。
[1] Ferrari S, Palmerini E. Adjuvant and neoadjuvant combination chemotherapy for osteogenic sarcoma[J]. Curr Opin Oncol, 2007, 19(4):341-346.
[2] Ebata T, Yokoyama Y, Sugawara G, et al. Concept of perihilar cholangiocarcinoma in the General Rules for Cli-nical and Pathological Studies on Cancer of the Biliary Tract, 6th edition[J]. Nihon Geka Gakkai Zasshi, 2014, 115(4):201-205.
[3] Jahdasani R, Jamnani FR, Behdani M, et al. Identification of the immunogenic epitopes of the whole venom component of theHemiscorpiuslepturusscorpion using the phage display peptide library[J]. Toxicon, 2016, 124:83-93.
[4] Marasini N, Giddam AK, Khalil ZG, et al. Double adjuvanting strategy for peptide-based vaccines: trimethyl chitosan nanoparticles for lipopeptide delivery[J]. Nanome-dicine (Lond), 2016, 11(24):3223-3235.
[5] Walker KB, Guo M, Guo Y, et al. Novel approaches to preclinical research and TB vaccine development[J]. Tuberculosis (Edinb), 2016, 99 (Suppl 1):S12-S15.
[6] Alam A, Ali S, Ahamad S, et al. From ZikV genome to vaccine: in silico approach for the epitope-based peptide vaccine against Zika virus envelope glycoprotein[J]. Immunology, 2016, 149(4):386-399.
[7] Kwon AJ, Moon JY, Kim WK, et al. Protection efficacy of the Brucella abortus ghost vaccine candidate lysed by the N-terminal 24-amino acid fragment (GI24) of the 36-amino acid peptide PMAP-36 (porcine myeloid antimicrobial peptide 36) in murine models[J]. J Vet Med Sci, 2016, 78(10):1541-1548.
[8] Maki RG. Future directions for immunotherapeutic intervention against sarcomas[J]. Curr Opin Oncol, 2006, 18(4):363-368.
[9] Sato N, Hirohashi Y, Tsukahara T, et al. Molecular pathological approaches to human tumor immunology[J]. Pathol Int, 2009, 59(4):205-217.
[10] Boeckle S, Pfister H, Steger G. A new cellular factor recognizes E2 binding sites of papillomaviruses which mediate transcriptional repression by E2[J]. Virology, 2002, 293(1):103-117.
[11] Tsukahara T, Nabeta Y, Kawaguchi S, et al. Identification of human autologous cytotoxic T-lymphocyte-defined osteosarcoma gene that encodes a transcriptional regulator, papillomavirus binding factor[J]. Cancer Res, 2004, 64(15):5442-5448.
[12] Tsukahara T, Kawaguchi S, Torigoe T, et al. Prognostic impact and immunogenicity of a novel osteosarcoma antigen, papillomavirus binding factor, in patients with osteosarcoma[J]. Cancer Sci, 2008, 99(2):368-375.
[13] Sichtig N, Silling S, Steger G. Papillomavirus binding factor (PBF)-mediated inhibition of cell growth is regulated by 14-3-3β[J]. Arch Biochem Biophys, 2007, 464(1):90-99.
[14] Tsukahara T, Kimura S, Ichimiya S, et al. Scythe/BAT3 regulates apoptotic cell death induced by papillomavirus binding factor in human osteosarcoma[J]. Cancer Sci, 2009, 100(1):47-53.
[15] Jordanovski D, Herwartz C, Pawlowski A, et al. The hypoxia-inducible transcription factor ZNF395 is controlled by IκB kinase-signaling and activates genes involved in the innate immune response and cancer[J]. PLoS One, 2013, 8(9):e74911.
[16] Hasegawa R, Tomaru Y, de Hoon M, et al. Identification of ZNF395 as a novel modulator of adipogenesis[J]. Exp Cell Res, 2013, 319(3):68-76.
[17] Tsukahara T, Kawaguchi S, Torigoe T, et al. HLA-A*0201-restricted CTL epitope of a novel osteosarcoma antigen, papillomavirus binding factor[J]. J Transl Med, 2009, 7:44.
[18] 范柳笛, 刘 辉, 袁 磊, 等. 胰腺癌高表达抗原MUC4 CTL表位肽的筛选与改造[J]. 中国病理生理杂志, 2017, 33(5):811-816.
[19] 时冉冉, 李伯和, 袁 磊, 等. 肿瘤抗原PIWIL2的HLA-A2限制性CTL表位鉴定[J]. 中国病理生理杂志, 2015, 31(7):1315-1319.
[20] Zhu YH, Gao YF, Chen F, et al. Identification of novel T cell epitopes from efflux pumps of Mycobacterium tuberculosis[J]. Immunol Lett, 2011, 140(1-2): 68-73.
[21] Wu ZY, Gao YF, Wu YH, et al. Identification of a novel CD8+T cell epitope derived from cancer-testis antigen MAGE-4 in oesophageal carcinoma[J]. Scand J Immunol, 2011, 74(6):561-567.
[22] Liu W, Zhai M, Wu Z, et al. Identification of a novel HLA-A2-restricted cytotoxic T lymphocyte epitope from cancer-testis antigen PLAC1 in breast cancer[J]. Amino Acids, 2012, 42(6):2257-2265.
[23] Zhu B, Chen Z, Cheng X, et al. Identification of HLA-A*0201-restricted cytotoxic T lymphocyte epitope from TRAG-3 antigen[J]. Clin Cancer Res, 2003, 9(5):1850-1857.
[24] Li J, Shayan G, Avery L, et al. Tumor-infiltrating Tim-3+T cells proliferate avidly except when PD-1 is co-expressed: evidence for intracellular cross talk[J]. Oncoimmunology, 2016, 5(10):e1200778.
[25] Bacchi M, Jullian M, Sirigu S, et al. Total chemical synthesis, refolding, and crystallographic structure of fully active immunophilin calstabin 2 (FKBP12.6) [J]. Protein Sci, 2016, 25(12):2225-2242.
[26] Zou C, Zhao P, Xiao Z, et al. γδ T cells in cancer immunotherapy[J]. Oncotarget, 2017, 8(5):8900-8909.
[27] 陈红莲, 刘 辉, 杨旭光, 等. Notch3信号通路介导SAHA诱导的小细胞肺癌H446细胞凋亡[J]. 中国病理生理杂志, 2016, 32(9):1556-1561.
[28] Rosenberg SA, Restifo NP, Yang JC, et al. Adoptive cell transfer: a clinical path to effective cancer immunotherapy[J]. Nat Rev Cancer, 2008, 8(4):299-308.
[29] Xu X, Gu Y, Bian L, et al. Characterization of immune response to novel HLA-A2-restricted epitopes from zinc transporter 8 in type 1 diabetes[J]. Vaccine, 2016, 34(6):854-862.
[30] Sundara YT, Kostine M, Cleven AH, et al. Increased PD-L1 and T-cell infiltration in the presence of HLA class I expression in metastatic high-grade osteosarcoma: a ra-tionale for T-cell-based immunotherapy[J]. Cancer Immunol Immunother, 2017, 66(1):119-128.
[31] Tourdot S, Scardino A, Saloustrou E, et al. A general strategy to enhance immunogenicity of low-affinity HLA-A2.1-associated peptides: implication in the identification of cryptic tumor epitopes[J]. Eur J Immunol, 2000, 30(12): 3411-3421.
(责任编辑: 卢 萍, 罗 森)
Identification and molecular modification of cytotoxic T-lymphocyte epitopes from osteosarcoma high-expressing antigen PBF
ZHANG Jian-xin1, SHI Ran-ran2
(1XuchangUniversity,Xuchang461000,China;2LuoheMedicalCollege,Luohe462002,China.E-mail:ranranpeptide@163.com)
AIM: To observe whether modified epitopes from osteosarcoma high-expressing antigen papillomavirus-binding factor (PBF) have HLA-A2 restricted antitumor ability, and to develop peptide-based immunotherapy for osteosarcoma.METHODSRT-PCR and Western blot were used to determine the expression of PBF in the osteosarcoma cell lines U2OS and Saos-2. HLA-A2 epitopes from PBF protein were predicted by NetCTL 1.2, SYFPEITHI and IEDB. The modified peptides from PBF containing HLA-A2 binding anchor motifs were designed by replacing the anchor residues. The peptides were synthesized by standard solid-phase methods, and the binding affinity of the peptides to HLA-A*0201 was evaluated by T2A2 cell binding assay. ELISPOT assay was used to investigate the seretion of interferon-γ (IFN-γ) from the peptide-induced specific cytotoxic T-lymphocytes (CTLs). The ability of inducing T-cell response was analyzed by lactate dehydrogenase (LDH) release assay and carboxyfluorescein succinimidyl ester (CFSE) cytotoxicity assayinvitro.RESULTSThe expression of PBF was observed in the U2OS and Saos-2 cells. The candidate peptides P75-1Y2L, P412-1Y, P416-1Y2L9V, P107-1Y and P435-1Y2L showed moderate affinity toward HLA-A2 molecule. The modified peptides showed significantly higher affinity with HLA-A2 than the native peptide. ELISPOT assay showed that P412, P412-1Y, P416, P416-1Y2L9V and P435-1Y2L induced specific CTLs to secrete IFN-γ, and P412-1Y and P416-1Y2L9V induced more secretion of IFN-γ than the native peptide. The CTLs induced by P412, P412-1Y, P416 and P416-1Y2L9V lysed U2OS cells. P412-1Y and P416-1Y2L9V peptide-specific CTLs showed higher cytotoxicity against U2OS cells than the native peptide-specific CTLs.CONCLUSIONCompared with the native peptide, modified epitopes P412-1Y and P416-1Y2L9V have higher binding affinity with HLA-A*0201 and retain immunogenecity. In addition, the anti-tumor immunity effects of modified epitopes P412-1Y and P416-1Y2L9V are stronger than the native peptide. The peptides P412-1Y and P416-1Y2L9V is excellent HLA-A*0201 restricted CTL epitopes from tumor antigen PBF, which could serve as new candidates towards antitumor peptide vaccines.
Papillomavirus-binding factor; Epitopes; Cytotoxic T-lymphocyte; Osteosarcoma
1000- 4718(2017)11- 1993- 07
2017- 05- 04
2017- 06- 06
河南省科技厅科技发展计划项目(No. 142102310203);漯河医学高等专科学校科研基金资助项目(No. 2017-S-LMC-3)
△通讯作者 Tel: 0395-2964509; E-mail: ranranpeptide@163.com
R738.1; R392.3
A
10.3969/j.issn.1000- 4718.2017.11.012

