低强度超声联合微泡通过提高ROS水平促进甲状腺癌细胞自噬性死亡*
刘美快, 袁哲英, 黄凯西, 李 慧, 姜海丹, 陈 斌
(温州医科大学附属第一医院超声科, 浙江 温州 325000)
低强度超声联合微泡通过提高ROS水平促进甲状腺癌细胞自噬性死亡*
刘美快, 袁哲英, 黄凯西, 李 慧, 姜海丹, 陈 斌△
(温州医科大学附属第一医院超声科, 浙江 温州 325000)
目的探讨低强度超声联合微泡造影剂对甲状腺癌细胞自噬性死亡的作用,并分析自噬的激活机制及其对细胞活力的影响。方法采用频率20 kHz、功率80 mW的低强度超声联合微泡造影剂处理人甲状腺癌TPC1细胞,处理细胞60、120和240 s后,采用Live/Dead 实验和CCK-8实验分析细胞死亡和活力;Western blot分析微管相关蛋白1轻链3Ⅱ(microtubule-associated protein 1 light chain 3-Ⅱ,LC3-Ⅱ)、自噬相关蛋白5(autophagy-related protein 5,ATG5)和SQSTM1/P62的蛋白水平变化;单丹磺酰戊二胺(monodansylcadaverine,MDC)染色、绿色荧光蛋白(green fluorescent protein,GFP)-LC3转染和透射电镜观察细胞内自噬体的数量;2′, 7′-二氯二氢荧光素二乙酸脂(DCFDA)染色分析细胞活性氧簇(reactive oxygen species,ROS)的水平,用N-乙酰半胱氨酸(N-acetyl-L-cys-teine,NAC)抑制氧化应激水平,分析ROS在自噬激活中的作用;ATG5 siRNA转染抑制自噬水平并分析自噬性死亡的作用。结果低强度超声联合微泡显著促进TPC1细胞死亡,抑制TPC1细胞活力(P<0.05),并与处理时间显著相关。相对于单纯低强度超声组和微泡组,超声联合微泡显著升高LC3-Ⅱ和ATG5蛋白水平,抑制P62蛋白水平(P<0.05)。MDC染色、GFP-LC3转染和透射电镜观察发现,超声联合微泡明显增加TPC1细胞中自噬体的数量。超声联合微泡与单纯低强度超声组和微泡组相比,提高了细胞的ROS水平,而NAC显著降低超声联合微泡提高的LC3-Ⅱ蛋白水平(P<0.05)。ATG5 siRNA抑制自噬并显著增加细胞活力(P<0.05)。结论本研究说明低强度超声联合微泡可能通过提高甲状腺癌细胞中的ROS水平促进细胞的自噬性死亡,从而引起甲状腺癌细胞死亡。
甲状腺癌; 低强度超声; 微泡; 自噬; 活性氧簇
甲状腺癌是最常见的内分泌系统恶性肿瘤,近来其发病率快速上升,在中国城市居民所有的恶性肿瘤中排名第十[1]。虽然手术治疗和放射性碘治疗对大多数的甲状腺癌具有较好的效果,但是不同的病理类型、晚期、放射性碘耐受及复发和转移导致其在临床的处理上仍较为棘手[2-3]。近年来,低强度超声(low-intensity ultrasound,LIUS)在肿瘤治疗中逐渐得到应用,相对于高强度超声通过产生高热量来直接或者间接破坏肿瘤组织,低强度超声主要依靠直接抑制肿瘤细胞的增殖活力、促进肿瘤细胞的死亡或提高化疗药物的抗肿瘤作用来治疗肿瘤,而联合微泡(microbubbles,MBs)往往可以促进超声的治疗效果[4]。但是在甲状腺癌细胞中,低强度超声联合微泡的作用尚不明确。
既往研究显示自噬(autophagy)是细胞在应激时的自我保护机制,但是其同样是一种与凋亡相似的程序性死亡方式,过度的自噬会引起细胞的自噬性死亡(autophagic cell death)[5]。甲状腺癌细胞中同样发现存在自噬性死亡,近来发现自噬是治疗甲状腺癌的潜在靶点之一。研究报道低强度超声联合微泡可以促进肿瘤的凋亡[3, 6],但是对于自噬性死亡的作用尚不清楚。本文拟将低强度超声联合微泡作用于人甲状腺癌PTC1细胞,通过检测细胞活力、自噬和活性氧簇(reactive oxygen species,ROS)等指标来了解低强度超声联合微泡对PTC1细胞自噬性死亡的作用,以及自噬的激活机制及其在促进PTC1细胞死亡中的作用。
材 料 和 方 法
1试剂
RPMI-1640培养基、胎牛血清(fetal bovine se-rum,FBS)和0.25%胰蛋白酶购自HyClone; Live/Dead试剂盒购自Invitrogen;CCK-8试剂盒购自上海东仁化学科技公司;2’, 7’-二氯二氢荧光素二乙酸脂(2’, 7’-dichlorodihydrofluorescein diacetate,DCFDA)染色试剂盒和总蛋白提取试剂购自碧云天公司;抗微管相关蛋白1轻链3-Ⅱ(microtubule-associate protein 1 light chain 3-Ⅱ,LC3-Ⅱ)、自噬相关蛋白5(autophagy-related protein 5,ATG5)、P62和β-actin抗体均购自CST;N-乙酰半胱氨酸(N-acetyl-L-cys-teine,NAC)和单丹磺酰戊二胺(monodansylcadave-rine, MDC)荧光染料购自Sigma;绿色荧光蛋白(green fluorescent protein,GFP)-LC3腺病毒购自上海汉恒生物公司。
2方法
2.1PTC1细胞的培养及分组 人甲状腺癌TPC1细胞购自中科院上海细胞库,置于含10% FBS的RPMI-1640培养基中 37 ℃、5% CO2湿化培养箱中培养, 2~3 d换1次培养基,每2~3 d传代1 次。
实验将细胞随机分为4组:对照(control)组、单纯低强度超声(LIUS)组、单纯微泡(MBs)组和低强度超声联合微泡(LIUS+MBs)组。上述处理后,细胞均继续培养24 h。
根据文献进行低强度超声处理[3, 6], 0.25%胰酶消化后将细胞转移至平底的35 mm 培养皿 。在超声探头与培养皿管间涂有耦合剂,将探头辐射面垂直向上放置于培养皿底部,80 mW、20 kHz低强度超声联合微泡造影剂,作用于细胞达60、120和240 s。当联合微泡处理时, SonoVue超声造影剂在DMEM培养基中稀释成2×109MBs/L的终浓度。超声处理后,细胞继续培养24 h。
2.2Live/Dead 实验检测细胞死亡率 24孔板中每孔种植1×105个细胞培养过夜。用80 mW、20 kHz低强度超声联合微泡造影剂处理60、120和240 s后,更换新鲜的培养基继续培养24 h, 吸弃培养液,PBS清洗3次。稀释Calcein-AM成4 μmol/L,稀释PI成6 μmol/L,加入含有Calcein-AM和PI的培养基,培养箱中继续孵育30 min。激光共聚焦显微镜下选用488 nm激发波长观察细胞的死亡率。每组重复观察6个平行样品。
2.3CCK-8实验检测细胞活力 PTC1细胞经过上述处理后,在96孔板每孔铺5 000个细胞,培养24 h后,将处理的液体更换成100 μL新鲜的培养基,再在每个孔中加入10 μL的CCK-8反应剂,37 ℃中孵育1 h,最后在酶标仪上于450 nm波长测量并读取吸光度(A),所得值为相对于对照组的数值。
2.4Western blot实验 使用含有1%苯甲基磺酰氟 (phenylmethylsulfonyl fluoride,PMSF)的RIPA裂解液提取细胞总蛋白,BCA法来测定蛋白质浓度。将细胞总蛋白进行SDS-PAGE,然后通过湿转的方法将蛋白转移到PVDF膜上。5%脱脂牛奶封闭2 h后,使用抗LC3-Ⅱ、P62和ATG5的抗体(1∶1 000稀释)4 ℃孵育过夜,TBST清洗3遍后,使用辣根过氧化物酶标记的 II 抗在常温下孵育2 h,再使用ECL发光液在成像系统上进行曝光。蛋白质条带的半定量分析使用AlphaEaseFC 4.0软件进行分析。
2.5MDC 染色 MDC用来标记细胞中酸性自噬泡。PTC1细胞经处理后, 用PBS清洗3遍, 0.05 mmol/L MDC加入细胞中,37 ℃孵育30 min。PBS清洗3遍,紫外激发光倒置荧光显微镜下观察细胞。为了观察细胞的自噬率,上述染色后的细胞用流式细胞术进行检测。
2.6GFP-LC3转染 消化细胞后,将细胞密度调整至50%~70%,培养基液体量为2 mL。使用GFP-LC3腺病毒进行感染,MOI值为100,腺病毒滴度为1×1013/L。根据实验操作手册,腺病毒使用1 mL的无血清培养基进行稀释,具体计算方式为,6孔板细胞数量为(1~2)×106,MOI值为100,病毒数量为2×108,加入的腺病毒剂量为20 μL。加入腺病毒前,将培养基换成无血清的培养基1 mL,把上述剂量的腺病毒溶解在无血清的培养基中。加入腺病毒后,在37 ℃孵育2 h,将无血清的培养基更换成正常培养基,然后将PTC1细胞转移至培养箱孵育过夜,在荧光显微镜下观察转染效果和转染效率。当绿色荧光的细胞数量占据大部分细胞的时候,再进行处理。处理后在玻璃培养皿中培养24 h,使用激光共聚焦显微镜观察。GFP-LC3阳性细胞率在200倍下进行计数。
2.7透射电镜(transmission electron microscope,TEM)观察 上述低强度超声联合微泡处理后,在培养瓶中培养24 h,再分别使用刮刀将细胞从培养瓶上刮下来,注意避免过分损伤细胞,防止细胞破碎。将细胞离心收集转移至EP管,加入2%戊二醛4 ℃固定过夜,PBS漂洗,使用1%锇酸4 ℃固定2 h,醋酸铀4 ℃染色,70%→80%→90%→100%丙酮梯度脱水,预包埋,Epon 812环氧树脂包埋,半薄切片及甲苯胺蓝染色进行细胞定位,LKB-V型超薄切片机超薄切片,透射电镜下观察PTC1细胞。
2.8DCFDA染色 用DCFDA染色分析细胞内ROS水平。PTC1细胞培养在玻璃底的培养皿中,细胞经过处理后,将10 μmol/L的DCFDA染液加入到细胞中, 37 ℃中孵育20 min。0.25%胰酶蛋白消化细胞,于激发光波长488 nm和发射光波长525 nm下,流式细胞仪分析荧光强度。
2.9ATG5siNRA的转染ATG5 siRNA的设计参考文献[19],正义序列为5’-AAUUCGUCCAAACCACACAUCUCGA-3’,并由上海吉玛公司合成。PTC1细胞消化后计数,在6孔板中每孔加入2×105的细胞,培养过夜。转染使用Lipofectamine 2000进行。转染后48 h,根据实验设计中的处理方法进行干预。以非特异性的非靶向的siRNA作为对照RNA。转染后,提取细胞总蛋白行Western blot检测分析转染的效果。
3统计学处理
使用SPSS 15软件包进行统计分析。实验数据用均数±标准差(mean±SD)表示,不同组之间的差异使用单因素方差分析(one-way ANOVA),使用SNK-q检验进行各组均数间的两两比较。以P<0.05为差异有统计学意义。
结 果
1低强度超声联合微泡促进PTC1细胞死亡并抑制细胞活力
本研究首先使用Live/Dead和CCK-8实验分别分析低强度超声联合微泡对人甲状腺癌PTC1细胞死亡和活力的影响。正常对照组和单纯低强度超声组中,以胞浆的绿色荧光(活细胞)为主,偶见胞核的红色荧光(死细胞)。在低强度超声联合微泡组中,随着处理时间的延长,胞核的红色荧光逐渐增多,而胞浆的绿色荧光逐渐减少,见图1A。Live/Dead半定量分析发现低强度超声联合微泡处理120 s和240 s后,细胞死亡率相对对照组显著增加(P<0.05),见图1B。CCK-8实验分析发现低强度超声联合微泡处理后,细胞的活力显著下降(P<0.05),见图1C。
2低强度超声联合微泡促进PTC1细胞中自噬标志蛋白表达升高
Western blot方法进一步分析低强度超声联合微泡对PTC1细胞自噬水平的影响,低强度超声联合微泡作用PTC1细胞120 s,继续培养24 h后,分析自噬标志蛋白LC3-Ⅱ、ATG5和P62的蛋白表达水平。单纯微泡组与对照组相比,LC3-Ⅱ、ATG5和P62的蛋白水平的差异无统计学显著性,但低强度超声联合微泡组相对单纯低强度超声组和对照组,LC3-Ⅱ和ATG5水平均显著提高(P<0.05),P62水平显著降低(P<0.05),见图2。这提示低强度超声联合微泡在PTC1细胞中激活自噬。
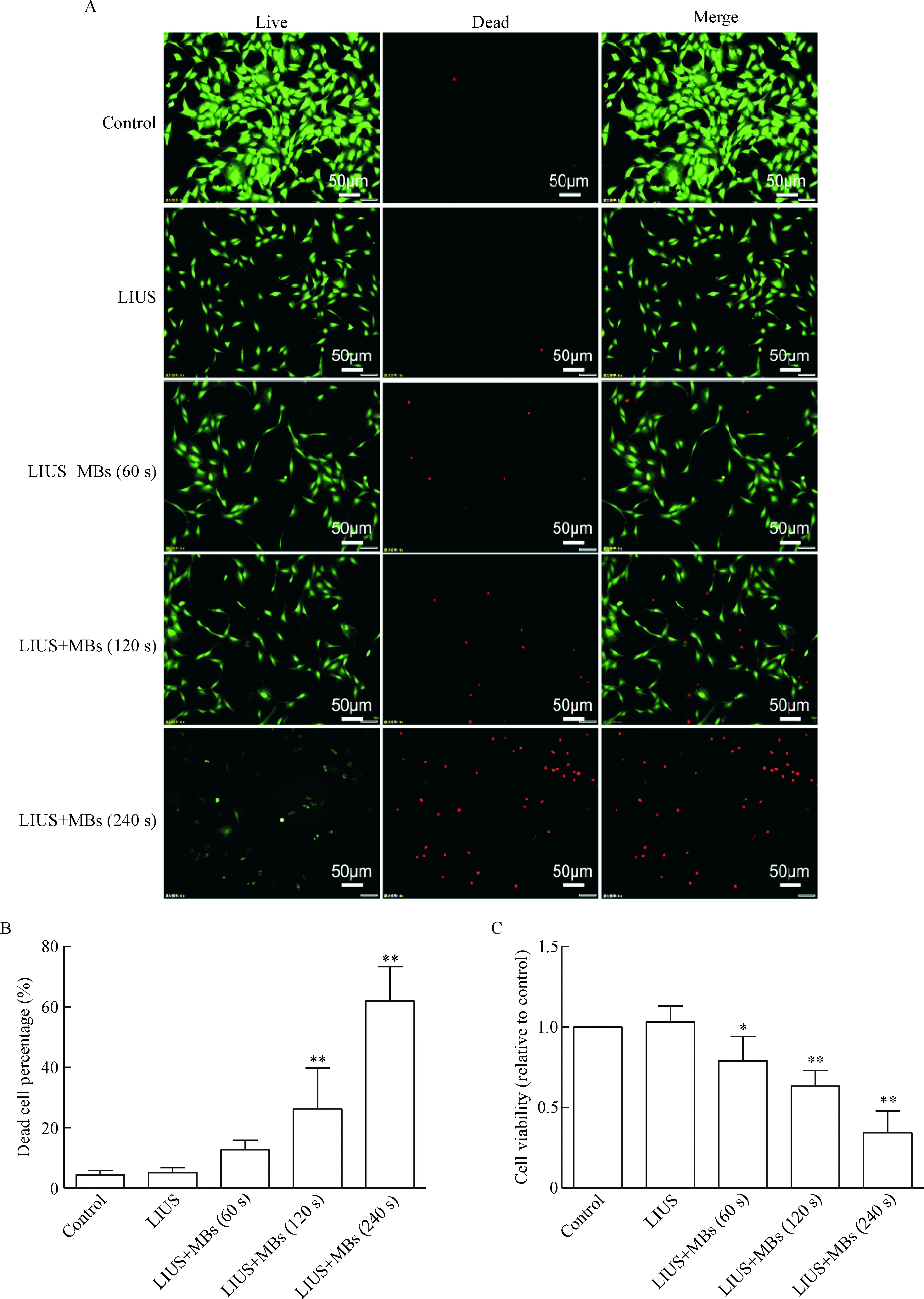
Figure 1. The effect of the low-intensity ultrasound (LIUS) combined with microbubbles (MBs) on PTC1 cell death and viability. A: Live/Dead assay for PTC1 cells treated with LIUS combined with MBs for 60 s, 120 s and 240 s; B: semi-quantity analysis of cell death percentage; C: the cell viability detected by CCK-8 assay. Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group.
图1低强度超声联合微泡对PTC1细胞死亡和活力的影响
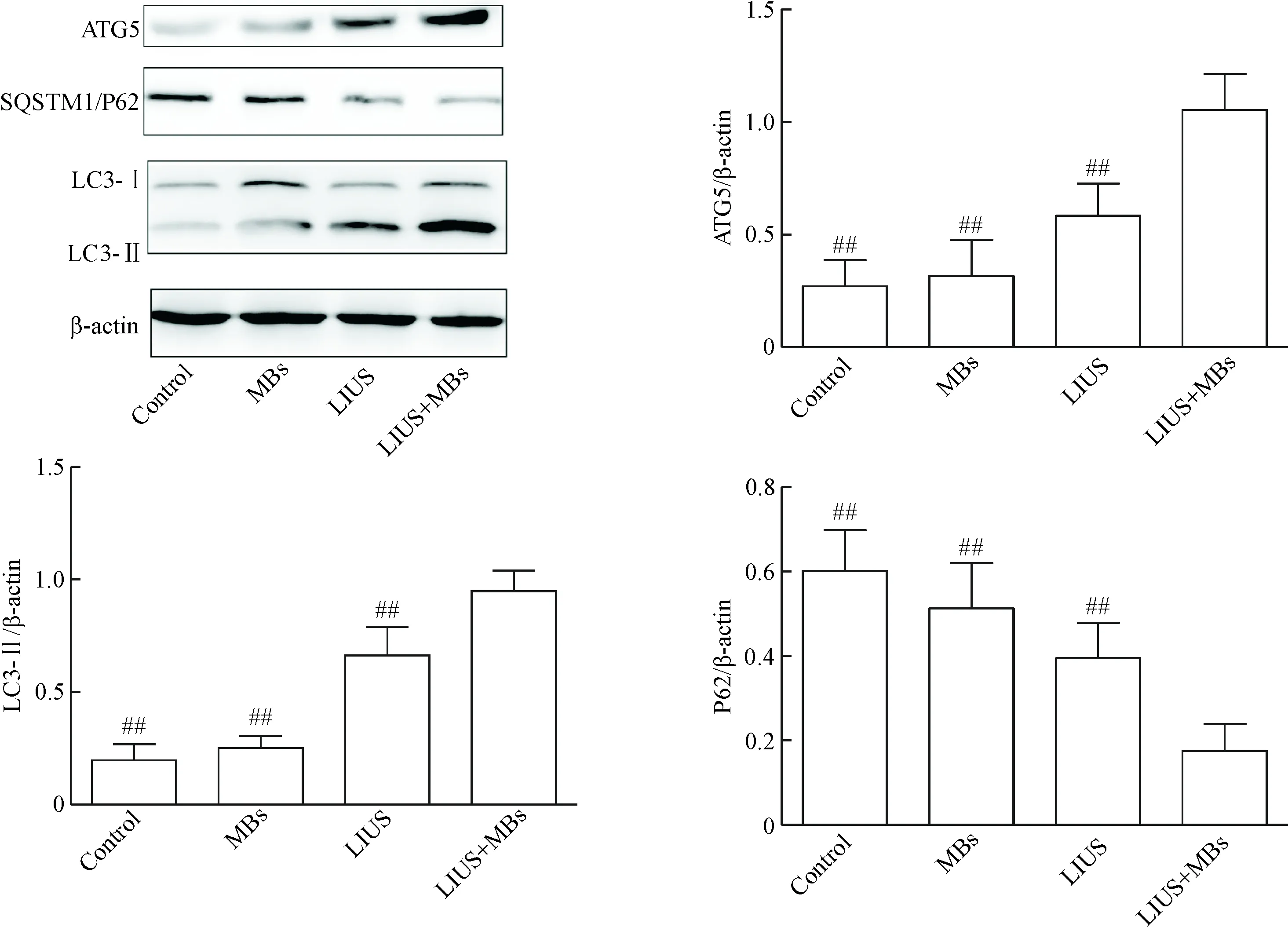
Figure 2. The effect of the low-intensity ultrasound (LIUS) combined with microbubbles (MBs) on autophagy-related proteins in the PTC1 cells. Mean±SD.n=6.##P<0.01vsLIUS+MBs group.
图2低强度超声联合微泡对人甲状腺癌PTC1细胞中自噬标志蛋白水平的影响
3低强度超声联合微泡促进PTC1细胞中自噬体的增加
为进一步证实低强度超声联合微泡对自噬的激活作用,用MDC染色、GFP-LC3转染和TEM观察细胞中酸性自噬泡和自噬体的数量。与对照组相比,低强度超声组细胞中绿色荧光斑点明显增加,而低强度超声联合微泡处理120 s后进一步促进了细胞中酸性的绿色荧光斑点数量的增加;GFP-LC3转染细胞后,低强度超声联合微泡比单纯超声和微泡组显著增加细胞中绿色的点状LC3荧光;TEM观察发现低强度超声联合微泡组中双层膜结构的自噬体数量显著增加,见图3。上述3个实验说明低强度超声联合微泡促进PTC1细胞中自噬体数量增加。
4PTC1细胞内ROS水平在低强度超声联合微泡激活自噬中的作用
DCFDA染色分析PTC1细胞内ROS水平,来探索自噬激活的机制。低强度超声联合微泡相对于对照组和单纯超声组,显著增加细胞中ROS水平(P<0.01),见图4A。公认的氧化应激抑制剂NAC可以显著地逆转低强度超声联合微泡导致的LC3-Ⅱ蛋白质水平升高(P<0.01),说明低强度超声联合微泡导致的ROS水平升高,可能是自噬激活的机制之一,见图4B。
5低强度超声联合微泡引起的自噬性死亡对人甲状腺癌PTC1细胞死亡和活力的影响
用RNAi方法沉默ATG5抑制自噬水平,进一步分析自噬在低强度超声联合微泡对PTC1细胞的作用。细胞转染ATG5 siRNA 48 h后, Western blot发现与转染control siRNA的细胞比较,ATG5表达明显下降(P<0.05),证实ATG5沉默的成功,见图5A。低强度超声联合微泡作用120 s,相对于转染control siRNA的细胞,Western blot发现转染了ATG5 siRNA的细胞LC3-Ⅱ表达明显下降,证实ATG5沉默降低了细胞中自噬水平(P<0.05),见图5B。Live/Dead实验发现,自噬抑制后细胞死亡率比低强度超声联合微泡组明显下降(P<0.05),CCK-8实验发现抑制自噬水平可以部分逆转低强度超声联合微泡对细胞活力的抑制作用(P<0.05),上述2个实验证实低强度超声联合微泡引起的自噬性死亡参与了PTC1细胞的死亡或活力的下降,见图5C、D。
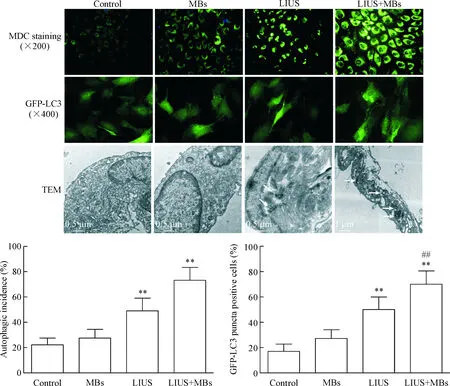
Figure 3. Low-intensity ultrasound (LIUS) combined with microbubbles (MBs) increased the number of autophagosome in PTC1 cells. Mean+SD.n=6.**P<0.01vscontrol group;##P<0.01vsLIUS group.
图3低强度超声联合微泡促进人甲状腺癌PTC1细胞自噬体的增加
讨 论
通过化学、物理或生物方法抑制甲状腺癌细胞的增殖或促进甲状腺癌细胞的死亡被认为是治疗甲状腺癌可行方法之一[2],尤其是耐受手术和放射性碘治疗的甲状腺癌,通过低强度超声结合微泡抑制PTC1细胞生长或许是将来有希望的一种治疗方式。
不同于高强度超声,低强度超声的生物学作用需要依靠机械效应和空化效应。直径小于10 μm的微泡是常用的超声造影剂[7]。在低强度超声作用下,微泡发生击破和塌陷,一方面可以导致细胞出现氧化应激, 另一方面在微泡和低强度超声的联合作用下引起细胞内骨架损伤和DNA链断裂,最终引起肿瘤细胞的死亡,但是自噬性死亡在其引起的细胞死亡中的作用尚不清楚[3, 8]。本文首先通过Live/Dead和CCK-8实验证实与单纯的低强度超声处理相比,长时间的低强度超声结合微泡处理不仅促进PTC1细胞的死亡,更可以抑制细胞活力的下降。
自噬与甲状腺癌的治疗密切相关,一系列研究发现自噬与放射性碘吸收和治疗的敏感性相关。Lin等[9]发现自噬的抑制可以促进PTC1细胞对放疗和阿霉素治疗的耐受,但是促进自噬却可以提高PTC1细胞的化疗和放疗敏感性[3, 10]。通过ATG7 siRNA抑制自噬可以促使PTC1细胞对凋亡诱导的耐受[10]。因此治疗甲状腺癌患者,尤其是那些对传统治疗方法耐受的患者,激活自噬引起自噬性死亡或许是一种潜在的有效方法。
本文通过Western blot发现低强度超声结合微泡作用下PTC1细胞中ATG5、SQSTM1/P62和LC3-Ⅱ 蛋白水平升高,证实自噬相关标志蛋白的改变;进一步通过MDC染色、GFPL-LC3转染和TEM等方法观察到细胞中自噬泡数量的显著增加。LC3-Ⅱ是位于自噬体膜上的经典标志物;P62与自噬特异性降解蛋白结合而作为自噬降解过程的 “运输者”,P62蛋白水平与自噬水平相反,反映自噬流水平和细胞中蛋白聚体的积聚程度[11];ATG5是自噬形成过程中的关键蛋白,是 RNAi沉默抑制自噬激活的常用靶点[12]。本文使用ATG5 siRNA抑制低强度超声结合微泡作用后自噬激活,却发现PTC1细胞的死亡反而减少而细胞活力却上升,这证实了自噬性死亡在低强度超声结合微泡促进PTC1细胞死亡和抑制细胞活力中的作用,这与其它治疗甲状腺癌的研究结果相似[4]。
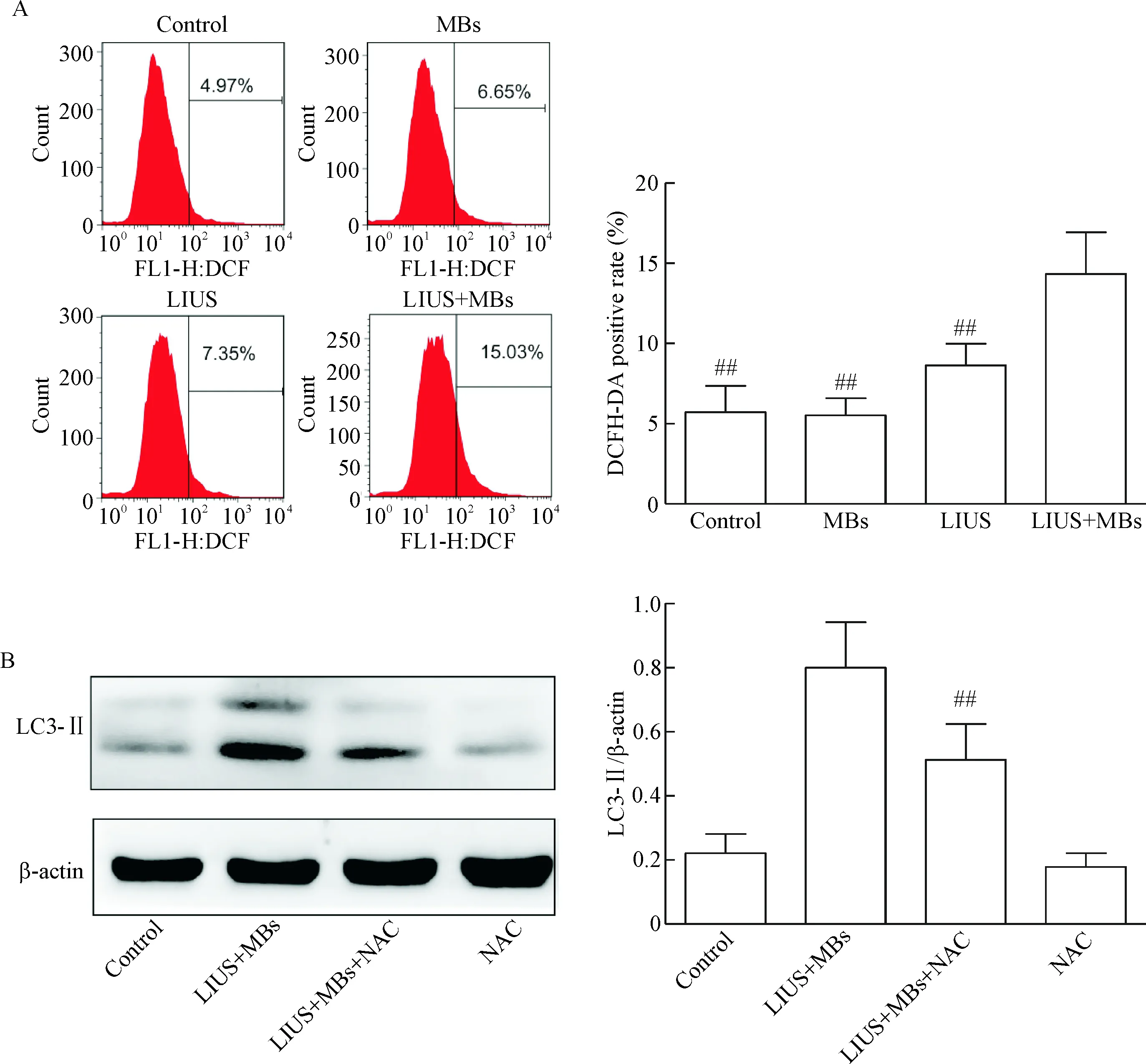
Figure 4. The involvement of ROS production in autophagy activation induced by low-intensity ultrasound (LIUS) combined with microbubbles (MBs) in PTC1 cells. A: DCFDA staining for the ROS production in the PTC1 cells; B: Western blot for determining LC3-Ⅱ level in the cells treated with LIUS combined with MBs andN-acetyl-L-cysteine (NAC). Mean±SD.n=6.##P<0.01vsLIUS+MBs group.
图4PTC1细胞内ROS水平在低强度超声联合微泡激活自噬中的作用
单纯低强度超声与细胞内ROS生成的关系具有一定的争议。研究发现1 MHz的单纯低强度超声可以抑制H2O2细胞内ROS的生成[13];Feril等[14]发现1 MHz的低强度超声对人白血病细胞的ROS生成没有影响;但是低强度超声也可以促进金丝桃素引起巨噬细胞内ROS的合成[15]。本文发现虽然单纯低强度超声对PTC1细胞内ROS水平没有影响,但是微泡结合低强度超声却可以显著促进细胞内ROS水平升高。更重要的是,ROS被认为是激活自噬的重要机制之一。芹黄素通过提高细胞内ROS水平激活甲状腺癌细胞的自噬性死亡[16]。ROS促进自噬的具体机制分为转录和转录后调节两方面,涉及大量的分子机制,包括ROS-FOXO3-LC3/BNIP3-autophagy信号通路、ROS-NRF2-P62-autophagy信号通路和ROS-TIGAR-autophagy信号通路等[17],而低强度超声结合微泡促进的ROS如何激活自噬性死亡需要进一步的研究。
综上所述,低强度超声结合微泡导致PTC1细胞死亡并抑制细胞增殖,促进细胞自噬性死亡和细胞内ROS合成增加。通过ROS抑制剂NAC证实ROS在自噬激活中的作用;通过ATG5沉默抑制自噬证实自噬性死亡在PTC1细胞死亡和细胞活力下降中的作用。因此低强度超声结合微泡可能通过促进ROS合成增加来激活自噬性死亡,从而导致细胞死亡。
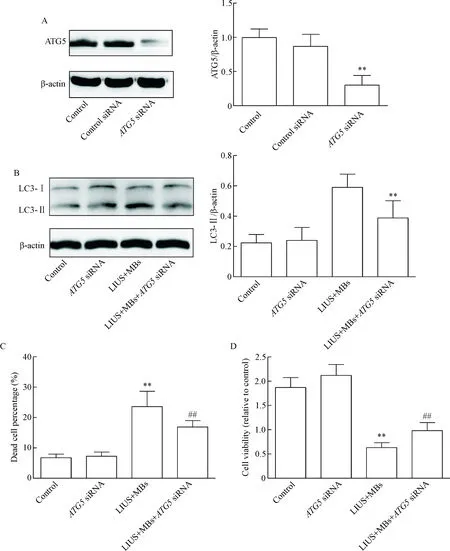
Figure 5. The involvement of autophagic cell death induced by low-intensity ultrasound (LIUS) combined with microbubbles (MBs) in the death and viability of the PTC1 cells. A: Western blot for determining ATG5 level in the PTC1 cells afterATG5 siRNA transfection; B: Western blot for determining LC3-Ⅱ level in the PTC1 cells afterATG5 siRNA transfection; C: the result of Live/Dead assay for the PTC1 cells after autophagic inhibition; D: the result of CCK-8 assay for detecting the cell viability after autophagic inhibition. Mean±SD.n=6.**P<0.01vscontrol group;##P<0.01vsLIUS+MBs group.
图5低强度超声联合微泡引起的自噬性死亡对人甲状腺癌PTC1细胞死亡和细胞活力的影响
[1] Chen W, Zheng R, Zhang S, et al. Report of incidence and mortality in China cancer registries, 2009[J]. Chin J Cancer Res, 2013, 32(3):106-112.
[2] Handkiewicz-Junak D, Czarniecka A, Jarzab B. Molecular prognostic markers in papillary and follicular thyroid can-cer: current status and future directions[J]. Mol Cell Endocrinol, 2010, 322(1-2):8-28.
[3] Mizushima N, Levine B, Cuervo AM, et al. Autophagy fights disease through cellular self-digestion[J]. Nature, 2008, 451(7182):1069-1075.
[4] Yu T, Wang Z, Mason TJ. A review of research into the uses of low level ultrasound in cancer therapy[J]. Ultrason Sonochem, 2004, 11(2):95-103.
[5] 杜海磊, 邱伟华, 杨卫平. 细胞自噬与肿瘤[J]. 中国病理生理杂志, 2010, 26(2):401-404.
[6] Li Y, Wang P, Chen X, et al. Activation of microbubbles by low-intensity pulsed ultrasound enhances the cytotoxicity of curcumin involving apoptosis induction and cell motility inhibition in human breast cancer MDA-MB-231 cells[J]. Ultrason Sonochem, 2016, 33:26-36.
[7] Qiu Y, Zhang C, Tu J, et al. Microbubble-induced sonoporation involved in ultrasound-mediated DNA transfection in vitro at low acoustic pressures[J]. J Biomech, 2012, 45(8):1339-1345.
[8] Gong Y, Wang Z, Dong G, et al. Low-intensity focused ultrasound mediated localized drug delivery for liver tumors in rabbits[J]. Drug Deliv, 2016, 23(7):2280-2289.
[9] Lin CI, Whang EE, Abramson MA, et al. Autophagy: a new target for advanced papillary thyroid cancer therapy[J]. Surgery, 2009, 146(6):1208-1214.
[10] Lin CI, Whang EE, Donner DB, et al. Autophagy induction with RAD001 enhances chemosensitivity and radiosensitivity through Met inhibition in papillary thyroid cancer[J]. Mol Cancer Res, 2010, 8(9):1217-1226.
[11] Yoshida GJ. Therapeutic strategies of drug repositioning targeting autophagy to induce cancer cell death: from pathophysiology to treatment [J]. J Hematol Oncol, 2017, 10(1):67.
[12] Jiang LB, Cao L, Yin XF, et al. Activation of autophagy via Ca2+-dependent AMPK/mTOR pathway in rat notochordal cells is a cellular adaptation under hyperosmotic stress[J]. Cell Cycle, 2015, 14(6):867-879.
[13] Kim NK, Kim CY, Choi MJ, et al. Effects of low-intensity ultrasound on oxidative damage in retinal pigment epithelial cellsinvitro[J]. Ultrasound Med Biol, 2015, 41(5):1363-1371.
[14] Feril LB Jr, Kondo T, Cui ZG, et al. Apoptosis induced by the sonomechanical effects of low intensity pulsed ultrasound in a human leukemia cell line[J]. Cancer Lett, 2005, 221(2):145-152.
[15] Li X, Gao L, Zheng L, et al. The efficacy and mechanism of apoptosis induction by hypericin-mediated sonodynamic therapy in THP-1 macrophages[J]. Int J Nanomed, 2015, 10:821-838.
[16] Zhang L, Cheng X, Gao Y, et al. Apigenin induces autophagic cell death in human papillary thyroid carcinoma BCPAP cells[J]. Food Funct, 2015, 6(11):3464-3472.
[17] Li L, Tan J, Miao Y, et al. ROS and autophagy: interactions and molecular regulatory mechanisms[J]. Cell Mol Neurobiol, 2015, 35(5):615-621.
(责任编辑: 林白霜, 罗 森)
Low-intensity ultrasound combined with microbubbles activates auto-phagic death of thyroid cancer cells by promoting ROS production
LIU Mei-kuai, YUAN Zhe-ying, HUANG Kai-xi, LI Hui, JIANG Hai-dan, CHEN Bin
(DepartmentofUltrasound,TheFirstAffiliatedHospitalofWenzhouMedicalUniversity,Wenzhou325000,China.E-mail:doctorchbe@126.com)
AIM: To investigate the effect of low-intensity ultrasound combined with microbubble contrast agent on autophagic death of thyroid cancer cells, and to analyze the mechanism of autophagy activation and its effect on cell viability.METHODSHuman thyroid cancer cell line TPC1 was treated with low-intensity ultrasound at 20 kHz frequency and 80 mW intensity combined with microbubbles. The cell death and viability were analyzed by Live/Dead assay and CCK-8 assay 60, 120 and 240 s after the treatment. The protein levels of microtubule-associated protein 1 light chain 3-Ⅱ (LC3-Ⅱ), autophagy-related protein 5 (ATG5) and SQSTM1/P62 were determined by Western blot. The number of intracellular autophagosomes was measured by the methods of monodansylcadaverine (MDC) staining, green fluorescent protein (GFP)-LC3 transfection and transmission electron microscopy. The level of reactive oxygen species (ROS) was mea-sured and the effect of ROS on autophagy activation was evaluated byN-acetyl-L-cysteine (NAC) treatment. The effect ofATG5 siRNA transfection on autophagy was analyzed for determining the role of autophagic death.RESULTSLow-intensity ultrasound combined with microbubbles significantly promoted TPC1 cell death and inhibited TPC1 cell viability (P<0.05) in a time-dependent manner. Compared with low-intensity ultrasound group and microbubble group, ultrasound combined with microbubbles significantly increased the protein levels of LC3-Ⅱ and ATG5, but inhibited the protein level of P62 (P<0.05). The results of MDC staining, GFP-LC3 transfection and transmission electron microscopy showed that ultrasound combined with microbubbles significantly increased the number of autophagosomes in the TPC1 cells. Compared with low-intensity ultrasound group and microbubble group, ultrasound combined with microbubbles increased the level of ROS, while NAC significantly reduced the protein level of LC3-Ⅱ (P<0.05). Thansfection withATG5 siRNA inhibited the autophagy, significantly decreased the percentage of cell death and increased cell viability (P<0.05).CONCLUSIONLow-intensity ultrasound combined with microbubbles promotes the autophagic cell death by increasing the level of ROS in thyroid cancer cells, leading to death of thyroid cancer cells.
Thyroid cancer; Low-intensity ultrasound; Microbubbles; Autophagy; Reactive oxygen species
1000- 4718(2017)11- 2000- 09
2017- 05- 12
2017- 09- 01
温州市科技计划(No. Y20170217)
△通讯作者 Tel: 0577-88069567; E-mail: doctorchbe@126.com
R736.1; R363
A
10.3969/j.issn.1000- 4718.2017.11.013

