大网膜包埋移植肝脏去细胞生物支架血管化过程观察
黄俊杰,王志斌,陈纳,张建色,王志翊,黎婷,戴开宇,梅劲,楼新法
(1.温州医科大学 生物支架移植与免疫研究所,浙江 温州 325035;2.温州医科大学 第二临床医学院,浙江 温州 325035;3.浙江大学附属第一医院 普外科,浙江 杭州 310058)
.论 著.
大网膜包埋移植肝脏去细胞生物支架血管化过程观察
黄俊杰1,3,王志斌1,陈纳2,张建色1,王志翊1,黎婷1,戴开宇1,梅劲1,楼新法1
(1.温州医科大学 生物支架移植与免疫研究所,浙江 温州 325035;2.温州医科大学 第二临床医学院,浙江 温州 325035;3.浙江大学附属第一医院 普外科,浙江 杭州 310058)
目的:观察肝脏去细胞生物支架(AHS)大网膜包埋移植后的血管新生过程.方法:采用TritonX-100灌注法制备大鼠肝脏AHS,HE染色、扫描电镜、铸型、DNA含量检测、免疫荧光染色等方法鉴定去细胞效果;通过大网膜包埋移植肝脏AHS,分别于术后1、3、7、14、28 d处死大鼠,病理切片HE染色观察移植肝脏AHS血管新生过程.结果:灌注法制备的肝脏AHS空间结构与细胞外基质成分保留完整,细胞成分基本被去除,AHS组DNA含量与正常对照组比差异有统计学意义(P<0.01);大网膜包埋移植肝脏AHS术后3 d,靠近网膜移植区的支架内出现血窦,术后7 d出现新生血管,并逐渐向移植支架中心区域延伸,血管逐步分化成熟,14 d以后形成血管化网状组织,28 d以后血管化网状组织仍存在.结论:大网膜包埋移植促使肝脏AHS再细胞化,最终可形成血管化的网状结构.
肝脏;去细胞;血管;组织工程;大鼠
再造一个可供移植的肝脏组织或类器官是肝脏组织工程学的最终目标,除种子细胞外,支架材料是诱导种子细胞黏附、增殖、分化并维持功能的重要载体,也是构建组织工程肝脏的基础.肝脏去细胞生物支架(acellular hepatic scaffolds,AHS)制备技术改变了传统天然细胞外基质(extracellular matrixc,ECM)和人工合成高分子聚合物等支架材料结构成分单一、生物相容性差等缺点,正常肝脏ECM的主要成分及其组成的三维空间结构如肝动静脉、门静脉和胆道等管道均得到完整保留[1],还能够诱导各类干细胞向类肝细胞分化[2-3],是理想的可用于生物人工肝、器官重构等研究的生物支架材料.支架材料血管化是实现组织工程肝脏的体外培养构建与体内移植的重要途径,目前肝细胞体外培养系统的氧和营养供给主要来自与培养液的渗透交换,这不但限制了肝细胞培养的数量与质量,也使得体外构建的组织工程肝脏无法通过血管缝合方式直接进行体内移植.为此本研究通过体内大网膜包埋移植AHS,动态观察移植支架血管化过程,为后续深入研究移植支架中的血管再生机制以及体外AHS血管化组织构建提供实验基础.
1 材料和方法
1.1 实验动物 健康10周龄雄性SD大鼠50只,体质量(200±20)g,由温州医科大学实验动物中心提供,动物生产许可证号:SCXK(浙)2010-0044.采用完全随机法将SD大鼠分为AHS制备组(n=10)、正常对照组(n=10)和ASH大网膜包埋移植组(n=30,分移植术后1、3、7、14、28 d组,每组6只),正常对照组用于获取正常肝脏和大网膜组织标本.动物实验严格按照科学技术部发布的《关于善待实验动物的指导性意见》执行.
1.2 主要试剂与仪器 TritonX-100(美国Sigma公司);肝素钠(美国Sigma公司);PBS(美国Gibco公司);丙烯腈-丁二烯-苯乙烯共聚物(ABS,上海奔流化工技术有限公司);DNA检测试剂盒(美国Omega公司);I型胶原(COL1)、IV型胶原(COL4)、纤维连接蛋白(FN)、层黏连蛋白(LN)抗体(美国Invitrogen公司);青霉素、链霉素(上海薄蕴生物有限公司);Long pump蠕动泵(YX1515X-A,保定兰格恒流泵有限公司);超级洁净工作台(DL-CJ-1N,北京东联哈尔仪器制造有限公司);恒温循环水槽(HX-105,北京长流科学仪器公司);荧光显微镜(美国Olympus公司).
1.3 肝脏AHS的制备及鉴定
1.3.1 肝脏AHS的制备:SD大鼠经5%水合氯醛(6 μL/g)行腹腔注射麻醉后,碘伏消毒,打开腹腔,门静脉插管,50 mL肝素PBS冲洗去除肝内残余血液后游离肝脏,放置无菌培养皿中,在无菌超净台上,37 ℃下调整门静脉灌注液流速为0.9 mL/min,灌注压调至40 mmHg,依次灌注300 mL肝素PBS,1 000 mL溶解于PBS(pH=12.0~12.5)的1% Triton X-100,500 mL乙醇与0.3%过氧乙酸溶液,2 000 mL添加青霉素和链霉素的PBS溶液.灌注后的肝脏去细胞支架于4 ℃的含有青霉素和链霉素的PBS溶液中无菌密封保存,用于大网膜包埋移植.
1.3.2 肝脏AHS铸型制备:将ABS、丙酮、油画颜料相混,充分搅匀.ABS浓度为5%,分别配成红、蓝、黄3种颜色.从AHS的肝总动脉插管灌入红色填充剂,门静脉插管灌入蓝色填充剂,下腔静脉插管灌入黄色填充剂,灌注压力为20~45 mmHg.分别隔2、6、12 h后再补灌,补灌压力为40~60 mmHg,直至肝表面出现细小均匀的红、蓝、黄点.灌注完毕后于4 ℃冰箱中放置24 h使填充剂凝固成型,再置于36.5%盐酸溶液中腐蚀1周后,将标本用流水缓慢冲洗干净.
1.3.3 HE染色观察:正常对照组的大鼠肝脏与肝脏AHS经4%多聚甲醛固定,酒精梯度脱水、二甲苯透明、浸蜡、包埋后切片,HE染色后光镜下观察.
1.3.4 免疫荧光染色:石蜡切片厚度5 μm,常规脱蜡至水,并进行抗原修复,然后用PBS漂洗每5 min 3次;2% BSA在37 ℃湿盒内封闭30 min;分别加入兔抗大鼠COL1、COL4、FN、LN抗体(通常1:100稀释,用0.01 mol/L pH值7.4的PBS稀释),4 ℃过夜;PBS漂洗5 min,共3次;加荧光标记的二抗抗体,37 ℃湿盒避光孵育30 min;避光PBS漂洗5 min,共3次;室温4'6-二脒基-2-苯基吲哚(4'6-diamidino-2-phenylindole,DAPI)复染10 min,PBS冲洗5 min,共1次; 甘油缓冲液封片;荧光显微镜下观察,胞核呈蓝色荧光,COL1、COL4、FN、LN的表达为绿色荧光.
1.3.5 扫描电镜观察:将正常肝脏和肝脏AHS组织标本切成小于1.0 mm3大小的组织块,0.9%氯化钠溶液漂洗,2%戊二醛溶液固定,经PBS漂洗,用1%锇酸固定液固定后,乙醇梯度脱水,干燥、镀膜,置于电镜下观察.
1.3.6 正常肝脏与肝脏AHS组织DNA含量测定:取正常肝脏和肝脏AHS组织标本100 mg,经蛋白酶K酶解后,提取基因组DNA(按照DNA试剂盒说明操作),微量紫外分光光度计测定其浓度.
1.4 大网膜包埋移植肝脏AHS及其血管化过程观察
用75%乙醇擦洗无菌超净台3遍,将密封保存的肝脏AHS切成约8 mmX8 mmX8 mm大小的立方体,用大网膜对支架进行包裹并缝合后,将移植物置入腹腔,分别于术后1、3、7、14、28 d处死大鼠,获取大网膜包埋AHS移植物,HE染色动态观察支架内血管新生过程.
1.5 统计学处理方法 采用SPSS18.0统计软件分析处理.计量资料用表示,组间比较采用两独立样本t检验.P<0.05为差异有统计学意义.
2 结果
2.1 肝脏AHS的鉴定
2.1.1 肝脏AHS组织形态与结构:肝脏在灌注过程中颜色逐渐变浅,最后成为半透明状,肉眼可见清晰完整的白色分支状脉管结构.HE染色显示正常肝脏组织结构清楚、肝细胞条索状排列、细胞核清晰;在汇管区可见肝动脉、门静脉、胆管的分支,见图1A;扫描电镜可见正常肝脏为大量的肝细胞整齐排列,见图1B;肝脏AHS呈透明"蜂窝状",仅可见细胞外基质成分,肝小叶、血管和胆管内均无细胞残留,无细胞核结构,但肝脏特有的小叶状结构依旧清晰可见,中央静脉和汇管区管道也保留完整,见图1C.肝脏AHS细胞外基质呈连续"渔网状"结构,管腔完整、中空而无细胞残留,见图1D.肝脏AHS铸型标本显示肝动脉(红色)、肝静脉(蓝色)和门静脉(黄色)主干及其分支管道结构基本完整,走形清晰,见图1E-F.
2.1.2 2组DNA含量分析:与正常肝脏比,肝脏AHS的DNA含量显著降低(P<0.01),见表1.
2.1.3 肝脏AHS免疫荧光染色:正常对照组的肝脏COL1、COL4、FN及LN免疫荧光阳性结果呈绿色,细胞密集,DAPI荧光显示蓝色胞核清晰(阳性),见图2A-D.肝脏AHS相应区域可见绿色荧光表达的COL1、COL4、FN及LN,DAPI荧光显示绿色胞核清晰(阴性),见图2E-H.
2.2 大网膜包埋移植肝脏AHS后血管化过程 实验过程未出现大鼠死亡.大网膜包埋移植肝脏AHS术后1、3、7、14、28 d,肝脏去细胞支架移植物随着植入时间的延长逐渐缩小,并失去其原有的形状.HE染色显示支架植入1 d后,支架与大网膜边界清楚,两者交界处有许多深染的炎症细胞浸润,见图3C-D;植入3 d后炎症细胞浸润范围由交界处逐渐向支架中心蔓延,交界处已有少许血窦,见图3E-F;植入7 d后支架全部被炎症细胞浸润,支架内形成较多的新生血管,血管密度由移植支架边缘区向中心区递减,见图3G-H;植入14 d后新生血管仍然较多,炎症细胞密度较移植第7天时明显增加,但支架结构整体呈现萎缩趋势,见图3I-J;植入28 d后移植的支架区域范围缩小,但依然能够看到大量新生血管与细胞,见图3K-M.

图1 肝脏AHS组织形态和结构图
表1 正常肝脏与肝脏AHS的DNA含量比较(n=10,)

表1 正常肝脏与肝脏AHS的DNA含量比较(n=10,)
与正常对照组比:aP<0.01
组别 核酸(μg/μL) 260 nm吸光度值 280 nm吸光度值 260/280正常对照组 4 350.0±378.0 86.992±12.894 46.692±7.564 1.86±0.32 AHS制备组 211.6± 25.3a 3.890± 0.873 2.251±0.683 5.19±1.67
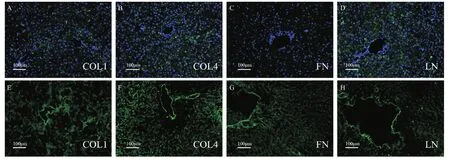
图2 正常肝脏与肝脏AHS COL1、COL4、FN和LN免疫荧光染色图(X200)
3 讨论
肝脏是一个由多管道构成的复杂器官,制备具有营养物质和代谢产物输送管道的支架材料是构建组织工程肝脏的关键,目前可用于肝脏组织工程的支架材料主要有天然ECM和人工合成支架等,一般为多孔隙结构支架材料,虽然可以为肝细胞提供黏附生长空间,但由于没有完整的血流灌注通道,加上肝细胞对氧需求量旺盛,很难在此基础上构建结构和功能完整的组织工程肝脏.AHS制备技术的出现突破了传统支架材料的局限性,在心脏[4]、肺脏[5-6]、肾脏[7]等器官的AHS制备以及再生与重构研究领域均取得了显著进展.本研究通过灌注法制备的大鼠AHS,肝内ECM成分及其组成的脉管管道结构如肝动脉、肝静脉、门静脉、胆道等均得到完整保留,HE染色显示ECM结构连续完整,未发现细胞核残留,DNA含量测定仅为(211.6±25.3)ng/µL,为后续通过循环灌注培养等方式体外构建血管化的组织工程肝脏提供了理想的支架材料.此外深入研究AHS的成分与结构,可为通过3D打印等先进技术实现肝脏支架材料的规模研发提供基础.
支架材料的血管化是实现体外组织工程肝脏构建和移植的重要基础,虽然可将血管内皮细胞接种于支架材料,构建血管内皮细胞化支架材料,方便人工组织的体内移植,但是血管内皮细胞在支架材料上存活率低、易凋亡,不能形成功能性血管来维持移植物中细胞的氧和营养供给[8].简单的支架血管内皮细胞化很难与具备完整结构与功能血管的支架材料相比,深入研究体内移植支架材料的血管化过程,是实现体外支架材料血管化的重要研究途径.大网膜含有丰富的毛细血管,具备较强的再生能力,易于和移植支架材料建立广泛的侧枝循环,是研究支架材料血管化过程及机制的重要自体生物反应器,在脊髓[9]、骨骼[10]等组织的体内移植血管化过程中均取得了良好的效果.大网膜包埋移植AHS证明移植的支架能在7 d左右形成新生血管,移植支架在14 d左右虽然有部分降解,但形成了结构完整的新生动静脉和微血管网,这种血管化的网状组织结构为体外构建血管化AHS提供全新研究平台.
大网膜包埋移植AHS血管化从动态观察来看,是一个机体对外来支架材料的再加工过程.首先是炎症细胞的浸润,在对移植支架再加工的基础上,成纤维细胞参与了移植支架的重塑,在此基础上发生血管新生,并逐步分化成熟.血管生成(angiogenesis)和血管发生(vasculogenesis)可能参与了这一过程,在支架近网膜移植侧,大网膜通过血管生成,向移植支架内新生血管、炎症细胞和成纤维细胞通过血管进入到支架内,对支架进行结构重塑,这一过程发生在支架移植早期;在支架重塑基础上,移植支架内逐渐出现新生血管,这些血管早期管腔闭合,内无红细胞,并逐步发育成熟,与体内循环联通后形成成熟的动静脉和网状血管.通过大网膜包埋移植AHS,大网膜脂肪细胞和微血管内皮细胞能够合成具有强烈血管生成作用的血管内皮生长因子和碱性成纤维细胞生长因子[11],可快速诱导移植支架材料内血管再生,另一方面AHS虽然去除了大部分细胞成分,但仍保留了大量具有生物学活性的血管内皮生长因子等[12],能够促进移植支架材料再细胞化过程中的血管生成,但具体机制仍值得进一步研究,并且血管化的网状组织结构是否能够应用于种子细胞的移植也值得深入观察.
[1] REN H, SHI X, TAO L, et al. Evaluation of two decellularization methods in the development of a whole-organ decellularized rat liver scaffold[J]. Liver Int, 2013, 33(3): 448-458.
[2] BAHARVAND H, HASHEMI S M, SHAHSAVANI M, et al.Differentiation of human embryonic stem cells into functional hepatocyte-like cells in a serum-free adherent culture condition[J]. Differentiation, 2008, 76(5): 465-477.
[3] JI R, ZHANG N, YOU N, et al. The differentiation of MSCs into functional hepatocyte-like cells in a liver biomatrix scaffold and their transplantation into liver-fibrotic mice[J].Biomaterials, 2012, 33(35): 8995-9008.
[4] OTT H C, MATTHIESEN T S, GOH S K, et al. Perfusiondecellularized matrix: using nature's platform to engineer a bioartificial heart[J]. Nat Med, 2008, 14(2): 213-221.
[5] PRICE A P, ENGLAND K A, MATSON A M, et al. Development of a decellularized lung bioreactor system for bioengineering the lung: the matrix reloaded[J]. Tissue Eng Part A, 2010, 16(8): 2581-2591.
[6] 陈婵, 王志斌, 翁杰, 等. 全肺AHS的制备与鉴定[J]. 温州医科大学学报, 2016, 46(2): 88-91.
[7] YU Y L, SHAO Y K, DING Y Q, et al. Decellularized kidney scaffold-mediated renal regeneration[J]. Biomaterials,2014, 35(25): 6822-6828.
[8] BADYLAK SF, TAYLOR D, UYGUN K. Whole-organ tissue engineering: decellularization and recellularization of three-dimensional matrix scaffolds[J]. Annu Rev Biomed Eng, 2011, 13: 27-53.
[9] CHOORAMANI G S, SINGH G K, SRIVASTAVA R N, et al.Chooramani technique: A novel method of omental transposition in traumatic spinal cord injury[J]. Asian J Eurosurg,2013, 8(4): 179-182.
[10] BIGHAM-SADEGH A, ORYAN A, MIRSHOKRAEI P,et al. Bone tissue engineering with periosteal-free graft and pedicle omentum[J]. ANZ J Surg, 2013, 83(4): 255-261.
[11] SAKO A, KITAYAMA J, YAMAGUCHI H, et al. Vascular endothelial growth factor synthesis by human omental mesothelial cells is augmented by fibroblast growth factor-2:possible role of mesothelial cell on the development of peritoneal metastasis[J]. J Surg Res, 2003, 115(1): 113-120.
[12] CARALT M, VELASCO E, LANAS A, et al. Liver bioengineering: from the stage of liver decellularized matrix to the multiple cellular actors and bioreactor special effects[J]. Organogenesis, 2014, 10(2): 250-259.
(本文编辑:吴彬)
Observation on the process of vascular reconstruction in acellular hepatic scaffolds of rat after transplantation into the greater omentum
HUANG Junjie1,3, WANG Zhibin1, CHEN Na2, ZHANG Jianse1, WANG Zhiyi1, LI Ting1,DAI Kaiyu1, MEI Jin1, LOU Xinfa1.
1.Institute of Bioscaffold Transplantation and Immunology, Wenzhou Medical University, Wenzhou, 325035; 2.School of the Second Clinical Medical Sciences, Wenzhou Medical University,Wenzhou, 325035; 3.Department of General Surgery, the First Affiliated Hospital of Zhejiang University, Hangzhou,310058
Objective: To observe the process of vascular reconstruction in acellular hepatic scaffolds of rat after transplantation into the greater omentum. Methods: Acellular hepatic scaffolds were harvested from adult SD rats by perfusing with TritonX-100. The scaffolds and native livers were observed through genomic DNA content analysis, scanning electron microscopy, HE stain, immunofluorescence and vascular cast. Then the acellular hepatic scaffolds were transplanted into the greater omentum in rats to investigate the vascular reconstruction. Rats were sacrificed respectively at 1, 3, 7, 14 or 28 days post-implantation and sections from the explanted grafts were analyzed by HE stain for morphology and microstructures. Results: Scanning electron microscope, HE stain and immunofluorescence showed most collagen fibers but no visible cell nuclei remained after decellularization in the scaffolds compared with the native livers. Vascular cast showed the pipeline structures of acellular hepatic scaffolds were intact and clear. Quantitative analysis of DNA content within the scaffolds showed only (211.6 ± 25.3) ng/µL. Then the blood sinus were observed on border of grafts at 3 days after transplantation into greater omentum. Afterwards the neovessels appeared, got into the internal of scaffolds, and formed microvascular network gradually in hepatic scaffolds after 14 days. The de novo microvascular network were still existed in hepatic scaffolds on 28 days. Conclusion: The implantation of greater omentum can promote the recellularization and eventually formation of vascularized reticular structures in the decellularized hepatic scaffolds.
hepar; decellular; vessel; tissue engineering; rats
R329.3
A
10.3969/j.issn.2095-9400.2017.10.001
2017-03-11
浙江省自然科学基金资助项目(LY13H030010,LY14H180008);浙江省医药卫生科技计划项目(2013KYA121,2016KYA061,2016KYA135);温州市科技局公益类项目(Y20140664);浙江省大学生科技创新活动计划项目(2014R 413024,2015R413031).
黄俊杰(1991-),男,浙江温州人,硕士生.
楼新法,教授,Email:wzb326@126.com.

