紫薯色素的变色范围及吸收光谱特性研究
高向阳, 高遒竹, 张 娜
(1.郑州科技学院食品科学与工程学院,河南 郑州 450064;2.河南农业大学食品科学技术学院, 河南 郑州 450002;3.江南大学食品科学与工程学院,江苏 无锡 214122)
紫薯色素的变色范围及吸收光谱特性研究
高向阳1,2, 高遒竹3, 张 娜1
(1.郑州科技学院食品科学与工程学院,河南 郑州 450064;2.河南农业大学食品科学技术学院, 河南 郑州 450002;3.江南大学食品科学与工程学院,江苏 无锡 214122)
为研究紫薯色素的变色范围和吸收光谱特性,以郑州市市售紫薯为样品,在优选的条件下提取其色素,以电位滴定法和吸光光度法进行测定。结果表明,紫薯色素在酸性溶液中,吸收光谱的波峰在530 nm左右,在碱性溶液中,波峰为600~620 nm;在强碱性溶液中波峰消失。紫薯色素的变色范围为7.3~7.8,只有0.5个pH单位,变色极其敏锐,可作为一种天然的酸碱指示剂和安全的食品着色剂,在食品工业中加以应用。
紫薯色素;变色范围;吸收光谱特性;pH电位滴定法
紫薯(IpomoeabatatasL.)属旋花科一年生草本植物,呈紫色至深紫色。紫薯色素中花青素可与糖发生糖苷化反应生成花色苷,这是一种天然水溶性花色苷类色素,其理化性质比其他同类花色苷如甘蓝花色苷、紫苏花色苷、葡萄花色苷和黑米花色苷稳定[1]。紫薯色素无异味,可溶于水、乙醇、碳酸钠、乙酸等溶液中[2],具有色泽自然鲜艳、无毒、无异味和抗突变、抗氧化、抗肿瘤、抗高血糖、缓解肝功能障碍等保健功能[3],以及良好的耐热性,能够经受食品工业所用的巴氏法消毒,因而广泛应用于食品工业中[4]。紫薯色素的纯化提取方法及稳定性的研究较多[5-8],但色素变色范围、应用和光谱特性鲜有文献报道。本研究通过正交试验优化最佳提取工艺,研究了色素在水溶液、柠檬酸溶液和酸化乙醇溶液中颜色的突变范围,对比了紫薯色素溶液在不同pH值时吸收光谱特性,为紫薯色素的进一步开发和科学利用提供参考。
1 材料与方法
1.1主要材料
渝紫263紫薯,购于郑州市马寨镇蔬菜市场。品种色素含量高,食用品质好。
1.2仪器与试剂
DZF-6050A型真空干燥箱(北京中兴伟业仪器有限公司);KQ5200DE型数控超声波清洗器(昆山市超声仪器有限公司);PXSJ-216型离子计(上海仪电科学仪器股份有限公司);DZKW-S-4型电热恒温水浴锅(北京市永光明医疗仪器有限公司);UV-4802H型紫外可见分光光度计(尤尼柯(上海)仪器有限公司)。
碳酸钠、盐酸、乙醇、乙酸、柠檬酸、氢氧化钠均为分析纯;水为二次蒸馏水。
1.3试验方法
将紫薯样品用蒸馏水洗净,切成薄片,于60 ℃干燥箱内烘干后,用研钵研至过60目尼龙筛,储存于广口瓶中备用。紫薯色素的提取工艺参考文献[3,9-11],称取10.0 g紫薯样品5份,分别按表1方法提取。待提取液中淀粉沉淀后,取上清液过滤,所得滤液用于吸收光谱的扫描、吸光度测量等试验。

表1 5种工艺的提取方法Table 1 Extraction method of five processes
1.4正交试验的设计
利用超声波提取植物有效成分,功率超过100 W时效果较好[12],所以,选用混合水平正交表L9(21×33)进行试验[13]。准确称取鲜紫薯10.0 g共9份,以质量分数为5.0%的柠檬酸为提取溶剂,料液比为1∶10,其他步骤依次按表4正交试验方案进行操作,测定各试验结果的吸光度,比较提取效果。
1.5紫薯色素溶液变色范围的确定
本研究用新鲜研碎紫薯,研究紫薯色素在柠檬酸溶液、蒸馏水和酸化乙醇溶液中颜色的变化。①以质量分数为5.0%柠檬酸为提取溶剂,料液比为1∶10,超声波功率为150 W,提取温度为55 ℃,时间为30 min;②用蒸馏水提取,料液比为1∶10,超声波提取条件同①;③以酸化乙醇(0.1%的盐酸与乙醇按体积比为2∶3混合)提取,料液比为 1∶30,超声波功率为120 W,温度为60 ℃,时间为30 min。试验表明,该色素颜色随pH值的改变而变化。
分别用柠檬酸溶液、蒸馏水和酸化乙醇提取紫薯色素制备紫薯色素溶液,用浓度为0.01 mol·L-1盐酸或0.01mol·L-1氢氧化钠溶液调节和测定紫薯色素溶液的pH值,观察、记录紫薯色素颜色的变化,在pH值6.5~8.0时要逐滴滴加标准溶液,观察颜色突变和记录pH值的突变范围。
2 结果与分析
2.1最佳提取工艺的研究
按1.3试验方法测定,结果如图1所示。由图1可知,提取液在510~550 nm有较高吸光度。将过滤后的紫薯残渣再用相同的提取剂进行2次提取,并对2次提取液在最大吸收波长530 nm测定,吸光度A越小表明第1次提取效果越好。结果表明,工艺2第1次提取效果最好,其次是工艺3和工艺5。
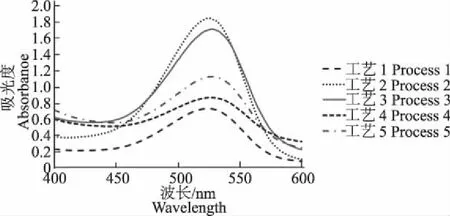
图1 紫薯色素提取液的吸收光谱Fig.1 The absorption spectrum of pigment from purplesweet potatoes under different extract methods
2.2正交试验结果
以质量分数为5.0%的柠檬酸为提取溶剂,料液比为1∶10,按照1.4正交试验设计选取试验因素和水平(表2),结果如表3所示。

表2 试验因素和水平编码表Table 2 The coding table of experiment factors and level
注:A. 紫薯的预处理方法(1.新鲜紫薯研成小颗粒,2.紫薯烘干后粉碎);B.提取温度;C.提取时间;D.超声波功率。下同。
Note:A. pretreatment methods of purple sweet potato (1. Purple sweet potatoes were only crushed, 2. Purple sweet potatoes were crushed after drying);B. extraction temperature;C. extraction time;D. ultrasound power. The same as below.
由表2和表3可知:按表2设计的因素和水平试验,得到表3中的极差R,R越大对结果的影响也越大[13],影响因素依次为:A>C>B>D,即原料预处理方法>提取时间>提取温度>超声波功率。
最佳提取工艺水平为A1B2C2D2,即新鲜紫薯研磨成小颗粒,提取液温度控制为55 ℃,超声提取时间为30 min,超声功率为150 W为最佳的工艺条件。
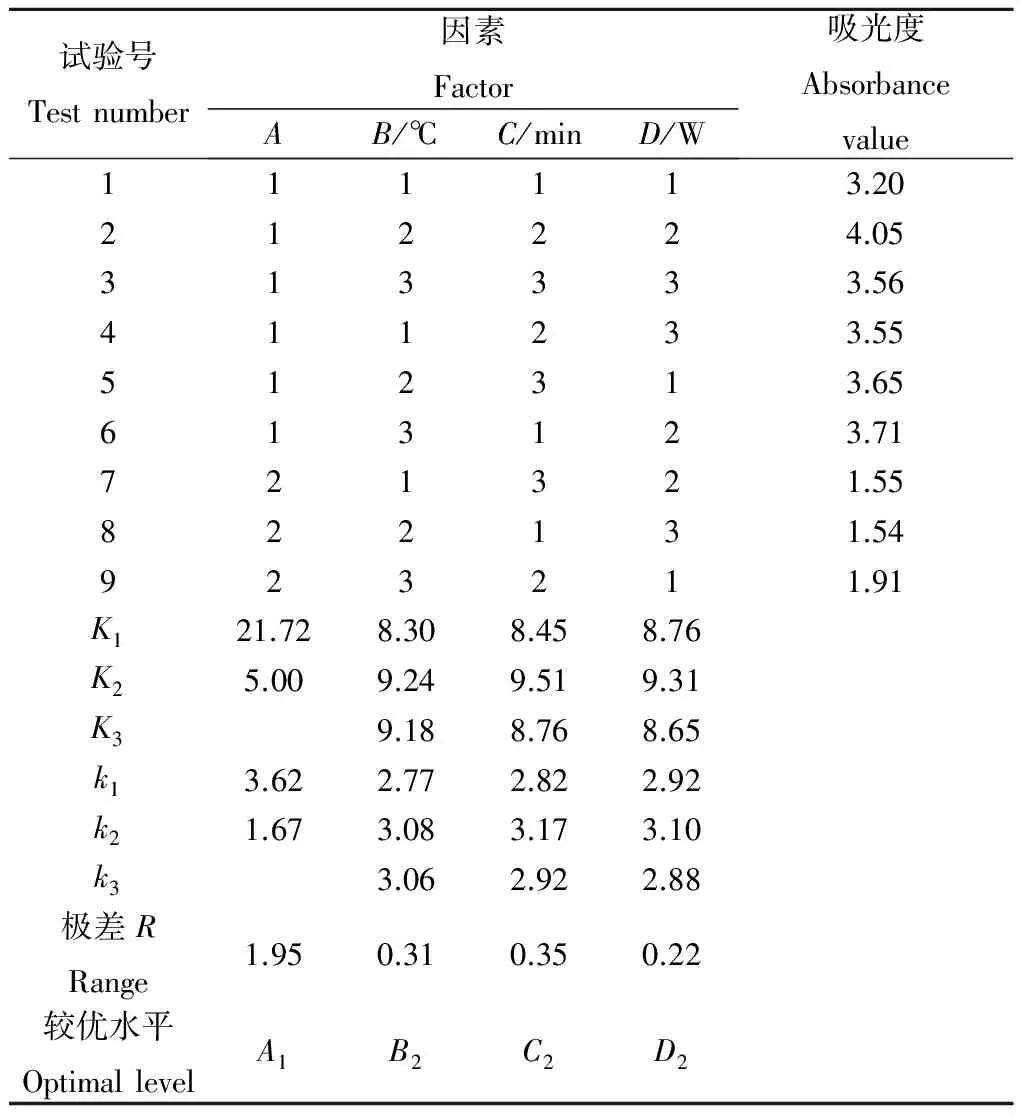
表3 正交试验结果Table 3 Results of orthogonal test
2.3紫薯色素的颜色变化和光谱特性
按1.5方法,对不同pH值的紫薯色素水溶液、紫薯色素柠檬酸溶液和紫薯色素酸化乙醇溶液的颜色变化和光谱特性进行研究,用紫外可见分光光度计扫描光谱,为便于比较,在530 nm处测量各自吸光度。紫薯色素水溶液的结果如表4和图2;紫薯色素柠檬酸溶液结果如表5;紫薯色素酸化乙醇溶液的结果如表6。

表4 pH值对紫薯色素水溶液的影响Table 4 Effect of pH value on pigment from purple sweet potato in water solution
由表4可知,紫薯色素水溶液在酸性溶液中呈现不同的红色,碱性溶液中呈现绿色至黄色。由图2可知,酸性条件下扫描的吸收光谱波峰在530 nm左右,pH值越小,吸收光谱波峰处的吸光度越大。在600~610 nm,随着pH值的升高,波峰发生红移,但pH值大于12时无明显波峰。
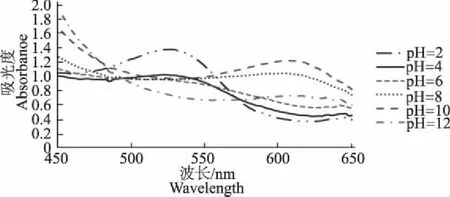
图2 紫薯色素水溶液的吸收光谱特性Fig 2 The absorption spectral characteristics of pigmentfrom purple sweet potato in water solution
由表5可知,紫薯色素5%柠檬酸溶液在酸性溶液中呈现各种红色,在碱性溶液中随pH值的升高,呈现从蓝、绿到黄色。按图2的方法对各溶液进行吸收光谱扫描可知:酸性条件下吸收光谱的波峰在515~542 nm,pH值越小,吸收光谱波峰处的吸光度越大,波峰随pH值的升高,发生红移和淡色效应。碱性条件下,600~610 nm间有一波峰,但pH值大于10时,该波峰基本消失。
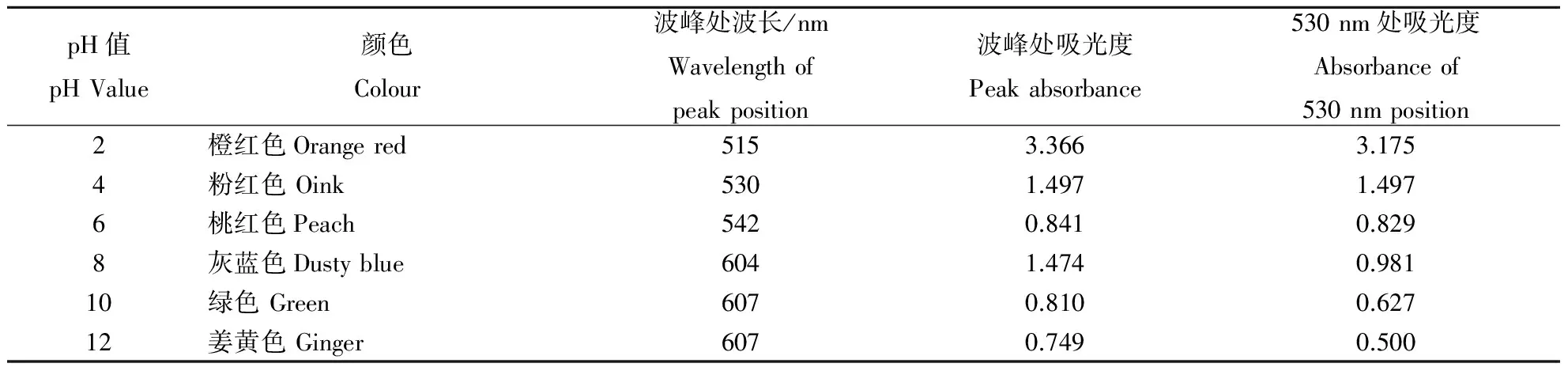
表5 pH值对柠檬酸溶液中的紫薯色素的影响Table 5 Effect of pH value on pigment from purple sweet potatoes in citric acid solution

表6 pH值对酸化乙醇溶液中的紫薯色素的影响Table 6 Effect of pH value on pigment from purple sweet potatoes in ethanol acidified solution
由表6可知,紫薯色素酸化乙醇溶液在酸性溶液中呈各种红色,碱性溶液中随pH值的升高,呈现由蓝、绿到青色。按图2的方法对各溶液进行吸收光谱扫描可知:pH值为2和4时,吸收光谱波峰在530 nm左右,pH值为2的吸光度大于pH值为4的,pH值为6时基本无明显波峰。随着pH值的升高,波峰发生红移,pH值大于8时,在600~620 nm有峰值,pH值为10时的吸光度大于pH值8和pH值12的。
2.4紫薯色素的变色范围
按照1.5步骤操作,逐滴滴加标准溶液,观察溶液的颜色变化并测定、记录相应的pH值,每个溶液平行测定5次,用格鲁布斯法[14]检验无可疑值后,取平均值报告变色范围。紫薯色素的变色范围如表7。由表7知:紫薯色素的pH值变色范围为7.3~7.8,只有0.5个pH单位,明显小于常用的酸碱指示剂。对于一些弱酸、弱碱的滴定,化学计量点附近pH值的突跃范围很小,可使用紫薯色素酸碱指示剂,颜色变化明显,易于灵敏观察和判断,建议优先选择在水溶液或酸性乙醇溶液中滴定,滴定结果会更准确。
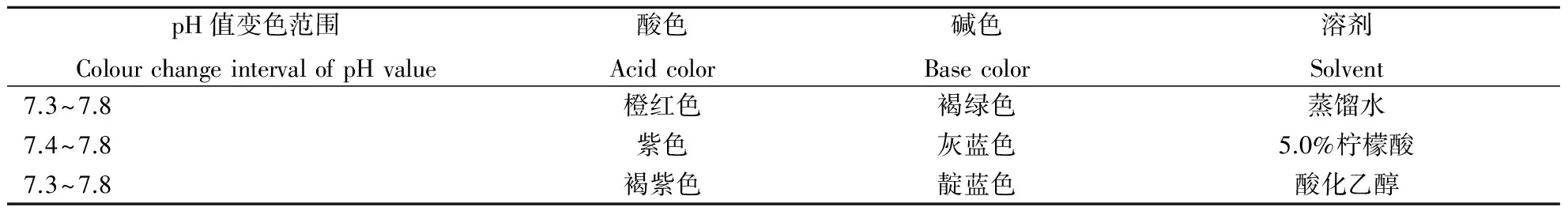
表7 紫薯色素的变色范围Table 7 The color range of pigment from purple sweet potatoes
3 结论
紫薯色素原料丰富,价格低廉,提取成本较低,广泛应用于食品行业中,而其副产品仍可作为食品、饲料的加工原料,具有很大的开发利用潜力[15]。紫薯色素能溶于水和醇类,耐热性好,经巴氏法消毒后无明显降解,可作为食品多种颜色的着色剂添加到水基食品如冷饮、果汁、配制酒、奶饮料、奶酪、果冻等食品中[2]。紫薯色素具有抗氧化、抗肿瘤等生理作用,因而能作为功能性配料用在保健食品中。对特殊人群尤其是儿童用食品,在注重食品安全的同时,为满足消费者的需求,利用紫薯色素变色范围窄的特性,生产多种天然颜色的安全营养食品,在满足儿童的好奇心和意愿的同时,可大幅度增加产品的销售量,提高企业经济收益。
本研究表明,紫薯色素在酸性溶液中,吸收光谱的波峰在530 nm左右,在碱性溶液中,波峰为600~620 nm,在强碱性溶液中波峰消失。紫薯色素的变色范围很窄,只有0.5个pH单位,变色极其敏感,且颜色变化明显,易于观察,可作为一种天然理想的新型酸碱指示剂加以利用。本研究拓展了紫薯色素应用范围,为新产品的开发奠定了必要的理论基础,有一定的科学参考价值。
[1] MITSUYOSHI K,TOMOMI T,KATSUHISA H, et a1.Antioxidative activity of anthocyanins from purple sweet potato, ipomoea batatas cultivar ayamurasaki [J]. Biosci Biotechnol Biochem,2005,69(5):979-988.
[2] 孙金辉,王微,董楠.紫薯花色苷的研究进展[J].粮食与饲料工业, 2011(11):38-40.
[3] 朱美娟,姚勇芳,韩雪钗,等.紫薯色素的提取及其稳定性的研究[J].安徽农业科学, 2009,37(36):17885-17887.
[4] 毛建霏,付成平,郭灵安,等.可见分光光度法测定紫甘薯总花青素含量[J].食品与发酵科技,2010,46(36):101-103.
[5] 余凡,杨恒拓,葛亚龙,等.紫薯色素的微波提取及其稳定性和抗氧化活性的研究[J]. 食品工业科技,2013,34(4):322-326.
[6] 胡梦琳,杨甲甲,代涛,等.紫薯色素两种提取方法的比对研究[J]. 食品科学, 2011, 32(6):247-249.
[7] 李治华,谢江,黄驰,等.紫甘薯花青素提取纯化技术研究进展[J].食品与发酵科技,2013,29(27):192-194.
[8] 肖海峻,施鹏飞,杨新建,等.甘薯紫色素提取技术研究进展[J].食品研究与开发,2014,35(19):137-140.
[9] 朱珠,柳中梅,刘云派.紫薯中提取色素的工艺研究[J]. 江西理工大学学报,2013,34(3):11-15.
[10] 王春利,东玉武,段春利,等. 紫薯红色素的提取与研究[J].辽宁化学,2012, 41(9):885-886.
[11] 李新华,林琳,鄂巍.紫甘薯红色素提取技术的研究 [J].沈阳农业大学学报,2007, 3(4):12-14.
[12] 胡爱军,郑捷.食品超声技术[M] .北京:化学工业出版社,2013:73-75.
[13] 张仲欣,杜双奎.食品试验设计与数据处理[M] .郑州: 郑州大学出版社,2011:217-228.
[14] 武汉大学.分析化学:上册[M].第5版. 北京:高等教育出版社,2013:67-68.
[15] 魏传斌,张萍.紫甘薯不同的初加工方式对花青素含量的影响[J].安徽农业科学,2014,42(14):4430-4431.
(责任编辑:朱秀英)
Studyoncolourchangeintervalandabsorptionspectralcharacteristicsofpigmentfrompurplesweetpotatoes
GAO Xiangyang1,2, GAO Qiuzhu3, ZHANG Na1
(1.School of Food Science and Engineering, Zhengzhou Institute of Science and Technology, Zhengzhou 450064, China; 2.College of Food Science and Technology, Henan Agricultural University, Zhengzhou 450002, China; 3.Food Science and Technology School, Jiangnan University, Wuxi 214122, China)
Purple potato pigment color range and absorption spectra properties were studied. With purple potatoes on sale from zhengzhou as samples, determination of pigment was conducted by the potential titration and absorption spectrophotometry after the pigment had been extracted under the condition of optimization. The results showed that the absorption spectrum peaks at about 530 nm in acidic solution, peak between 600 nm to 620 nm in alkaline solution and the peaks disappear in strong alkaline solution. The purple potato pigment color ranges from 7.3 to 7.8, within 0.5 pH unit only, indicating that the color change is very sharp. It can be used as a natural pH indicator and safe food colorants for use in the food industry.
pigment from purple sweet potato; colour change interval; potentiometric titration method of pH
2017-02-23
郑州市科技局新兴产业研究与开发基金项目(153PXXCY186)
高向阳(1949-),男,河南唐河人,教授,主要从事天然资源研究与开发、食品安全快速分析等方面的教学和研究工作。
1000-2340(2017)05-0725-05
S 531;TS 202.1
A

