介孔纳米羟基磷灰石/聚乳酸复合物支架与成骨细胞的生物相容性研究*
罗新乐黄术宋锦旗朱伟民欧阳侃
(1.深圳市龙华区人民医院关节外科,广东深圳518109;2.深圳市龙华区中心医院关节外科,广东深圳518110;3.深圳市第二人民医院运动医学科,广东深圳518100)
∙基础研究∙
介孔纳米羟基磷灰石/聚乳酸复合物支架与成骨细胞的生物相容性研究*
罗新乐1**黄术2宋锦旗2朱伟民3欧阳侃3
(1.深圳市龙华区人民医院关节外科,广东深圳518109;2.深圳市龙华区中心医院关节外科,广东深圳518110;3.深圳市第二人民医院运动医学科,广东深圳518100)
背景:目前骨组织工程中,支架材料的生物相容性和生物力学性能都不尽满意,后续的材料降解也是亟待解决的问题。新材料、方法、技术以及医学研究相结合,可以使骨组织工程中支架的外形与结构、生物相容性、降解速率都有很好的改进。目的:通过介孔纳米羟基磷灰石/聚乳酸(nano-hydroxyapatite/poly lactic acid,nHA/PLLA)复合物的支架构建以及与成骨细胞的相容性研究,旨在开发由2种材料复合而成具有更好的生物相容性的骨组织工程支架。方法:采取冷冻快速成型法制备nHA/PLLA复合物,BET法测定孔隙率,扫描电镜(scanning electron miscroscopy,SEM)观察材料内部结构等进行物理性能表征,X线衍射(X-ray diffraction,XRD)表征材料物理学特性。SEM观察成骨细胞在nHA/PLLA内生长、黏附、增殖情况;荧光倒置显微镜观察并计算细胞在该支架材料内的存活情况;MTT实验测定nHA/PLLA复合物对成骨细胞的活性影响。结果:制备的nHA/PLLA复合物,通道孔径为(164±52)μm,介孔率为89.3%±1.4%;干性和湿性nHA/PLLA复合支架的压缩模量分别为(1354.6±53.7)kPa和(1012.8±61.3)kPa。MTT实验结果表明,nHA/PLLA复合物对成骨细胞活性无显著影响,随着孵育时间的延长,黏附在复合物表面及介孔中的细胞数量逐渐增加。结论:nHA-PLLA复合物是一种性能良好的骨组织工程支架材料,具有制备简单、外形及内部结构符合组织工程支架要求、与成骨细胞的生物相容性好等优点。
纳米羟基磷灰石/聚乳酸复合物;生物相容性;组织工程;成骨细胞
骨与软骨的缺失在骨科临床中比较常见,自体骨的移植必定造成新的创伤,异体骨的移植存在排异问题[1-3]。骨组织工程的发展,首先必须有可靠的支架作为构建的基础,接种骨组织的种子细胞,培养后成功植入人体,成活后支架材料逐渐降解,完全形成新骨组织,达到修复的目的[4,5]。
骨组织工程中,支架材料选择非常重要,首先要具有良好的生物相容性,保证氧气、营养成分传输,有利于植入的种子细胞的新陈代谢,使其可以生长发育。常用支架材料主要包括天然材料,如壳聚糖、纤维素、透明质酸,与人工合成材料,如海藻酸盐、聚乳酸(polylactic acid,PLLA)、聚乙烯醇,两大类。但是,大多数传统支架材料无法满足生物相容性、良好机械性能等要求,这也限制了组织工程骨在临床中的应用[6-9]。
研究骨组织工程所需的支架材料中,外形与内部结构的孔径必须适合种子生长发育需要的条件,并且和人体的组织具有良好的生物相容性不被排异,植入人体后可以逐步的被自身组织替代。因此,在本研究中,选择纳米羟基磷灰石与聚乳酸2种材料进行复合形成支架材料,采用快速成形技术与冷冻技术结合构建支架,达到了可以实现对外形的优化,又可以利用冰晶升华形成的空隙控制孔径大多在介孔范围内,同时也保证了与人体组织的相容性。
1 材料与方法
1.1 实验材料
PLLA(山东岱罡生物材料有限公司),达尔伯克改良伊格尔培养基(dulbecco's modified eagle's medium,DMEM)培养液;噻唑蓝(methyl thiazolyl tetrazolium,MTT)、细胞增殖及细胞毒性检测试剂盒(美国Sigma公司);流式细胞检测试剂盒(美国Sigma公司);倒置显微镜(日本Olympus公司),X-650型扫描电子显微镜(scanning electron microscope,SEM;荷兰飞利浦公司)。
1.2 nHA/PLLA制备与表征
采用与冷冻技术结合的构建支架方法,制备纳米羟基磷灰石/聚乳酸复合物,随机抽取样本[10]。以BET法测定复合物材料的孔隙率。材料制成薄片状,扫描电镜对表面结构检测。以X射线光电子能谱表征nHA在PLLA材料中的分布。材料的力学强度通过津岛生物力学测试仪器测定。
1.3 成骨细胞接种于支架材料
将nHA/PLLA复合物置于24孔细胞培养板内。取4代以内处于对数生长期的成骨细胞,以胰蛋白酶消化、1000 rpm离心收集细胞,将细胞重悬于培养基中,调整浓度至5×104个/ml,取1.0ml接种于nHA/PLLA复合物材料中。首次换液时间为24 h,随后每2 d换液1次,于1、3、5 d通过扫描电镜观察细胞在材料上的生长情况。
1.4 细胞活性测定
将nHA/PLLA复合物与成骨细胞混合培养于24孔板内,用活/死细胞双染试剂在24 h、48 h对细胞染色,以倒置荧光显微镜观察细胞活力。活细胞中钙绿黄素染色后在494 nm下呈现绿光荧光,通过观察该荧光强度,定性研究细胞活性。
1.5 细胞增殖研究
将nHA/PLLA复合物与成骨细胞混合培养于24孔板内,每孔细胞数量均约为5×104个/ml。实验组分别取细胞与支架材料共培养后第1、3、5天后(对照组为无材料细胞悬液;空白对照组为只加培养液),弃培养液,以聚丁二酸丁二醇酯(poly butylene succinate,PBS)洗涤2次。加入预先配制的MTT 80µl,同时加入400µl无血清培养液继续培养4 h后,弃上清并加入700 µl二甲基亚砜(dimethyl sulfoxide,DMSO),振荡15 min,取溶液150µl至96孔板中。以酶标仪在490 nm处测定吸光光度值(optical density,OD)。
1.6 统计学方法
采用SPSS 19.0软件进行统计学分析,计量资料以均数±标准差表示,采用t检验,计数资料以百分比表示,采用χ2检验,以p<0.05为有统计学差异。
2 结果
2.1 nHA/PLLA复合物的形态表征
制作的nHA/PLLA复合物,在扫描电镜50倍镜下观察,呈三维网状立体结构,复合支架材料孔径约为(164±52)μm,各孔之间具有较好的连通性,空隙率为89.3%±1.4%。孔径大小不均、且各孔间交错联通。该结构是细胞接种与正常生长、黏附、增殖的基础,保证了细胞的营养供应及代谢物的消除(图1A)。通过扫描电镜的背散射电子模式观察nHA在PLLA材料中的分布情况。从图可知,大量白色纳米nHA均匀的分布于PLLA材料中,且该结构通过X射线光电子能谱对磷元素的分析,进行了进一步的验证(图1B)。
2.2 相结构和压缩特性表征
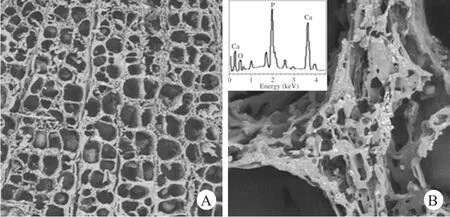
图1 nHA/PLLA复合物电镜扫描下的形态特征
以X射线衍射(XRD)表征材料的晶型结构特点为,单纯PLLA材料具有两个XRD窄峰,分别为2θ=16.6°与22.3°,说明了PLLA的半结晶特性(图2A,黑色曲线)。形成nHA/PLLA复合物结构后,上述两个峰消失,说明nHA的结合减少PLLA的结晶度(图2A,红色曲线)。同时出现了典型nHA的XRD峰,说明nHA已成功复合与PLLA材料中。
通过应力—应变曲线表征nHA/PLLA复合材料的压缩特性(图2B)。由图可知,在0%~45%范围内,材料应力随着应变的增加呈线性增强;当应变大于45%时,随着应变的增加,应力迅速增强。在相同的应变下,nHA/PLLA复合材料的应力均高于单纯的PLLA材料。湿性nHA/PLLA复合支架的应力略低于干性支架,因为其可发生微孔的水合作用。干性和湿性nHA/PLLA复合支架的压缩模量分别为(1354.6±53.7)kPa和(1012.8±61.3)kPa,而单纯PLLA材料仅为(539.3±36.2)kPa,说明nHA的复合显著改善了PLLA的机械性能。
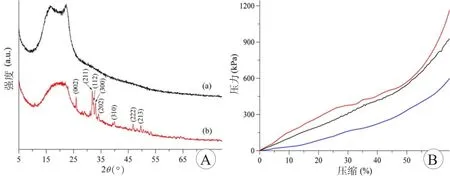
图2 nHA/PLLA复合物晶型结构曲线及应力应变曲线
2.3 成骨细胞在nHA/PLLA复合物中的生长
以扫描电镜观察成骨细胞在nHA/PLLA复合物中的生长,刚接种于材料后,细胞均匀分布于材料表面,且呈规则圆形,随培养时间的延长,细胞逐渐沉降至材料孔隙内部,轮廓完整黏附在材料壁上,并在支架材料孔隙内生长、增殖、分化等。在培养过程中,nHA/PLLA复合物能保持其完整性,体外培养5 d后未发现nHA/PLLA明显降解,能保持孔板内部孔隙并维持细胞的正常生长(图3)。
2.4 细胞活性检测
体外培养24 h、48 h后,细胞正常生长,活细胞被染色成亮绿色。在培养24 h后,材料中心细胞正常生长(图4A);随着培养时间延长至48 h,绿色荧光亮度进一步增加,表明细胞发生了进一步生长与分化(图4B)。以MTT实验法分析细胞活性,发现随着培养时间的增加各组细胞OD值逐渐增强,骨细胞在实验组和对照组中增殖均呈上升趋势,有统计学差异(p<0.05,图4C)。
3 讨论
本研究中组织工程修复骨缺损的研发中所需要的支架构成,尽量仿照人体骨的解剖结构与组成,纳米羟基磷灰石从成份上接近骨组织,采用快速成形技术与冷冻技术相结合,达到介孔的排列形式,孔径比较均匀的分布在一定范围之内,尽管介孔呈现多种形态,孔壁的性质好组成可以较好控制。在扫描电镜下观察,支架结构呈三维网状立体结构,各孔之间具有较好的连通性,且各孔间交错连通,该结构是细胞接种与正常生长、黏附、增殖的基础,保证了细胞的营养供应及代谢物的消除。通过应力—应变测试达到支架结构的强度要求,与成骨细胞的体外培养具有良好的相容性,随着培养时间的增长,成骨细胞的活性明显增加。因此,本研究中制备nHA/PLLA复合生物支架材料,可以调节共聚物,具有良好的生物相容性,可以作为有良好前景的骨组织工程中很好的支架材料,再进一步研发,力争适用于临床实际中。
骨组织工程中,支架材料的研发中羟基磷灰石材料,已经被公认的骨骼矿物质晶体的其中一种成分,其结构为六角柱体,晶体为六方晶系,磷酸根离子四面体网络使得羟基磷灰结构具备很好的稳定性[11,12]。羟基磷灰石材料具有很好的生物相容性,羟基磷灰石植入到人体组织中均可以与周围组织密切结合,国内外基础与临床研究均已证实。但是,羟基磷灰石材料脆性大、柔韧性差,因此,具体应用受到限制。纳米羟基磷灰石的粒径分布在1~100 nm,表面积更大,吸附效果更好,医学研究[13-15]发现,其具有比普通的羟基磷灰石更强的生物活性。纳米级的羟基磷灰石结晶主要分散在人体骨胶原骨架中,由于骨骼需要承受力的载荷,因此,需要一种有较高韧性的材料与之复合,既有一定的强度,又具有一定的柔韧度[16-18]。

图3 电镜扫描下成骨细胞在nHA/PLLA复合物中生长情况(1000×)A.成骨细胞在nHA/PLLA复合物第1天的生长情况;B.成骨细胞在nHA/PLLA复合物第3天的生长情况;C.成骨细胞在nHA/PLLA复合物第5天的生长情况
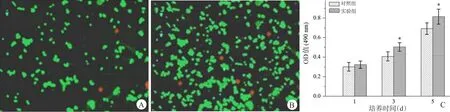
图4 成骨细胞活性的检测A.成骨细胞与nHA/PLLA复合物混合24 h后的细胞活力;B.成骨细胞与nHA/PLLA复合物混合48 h后的细胞活力;C.MTT法定量研究培养细胞活性统计图(与对照组比较,*p<0.05)
nHA/PLLA复合支架材料克服了普通羟基磷灰石强度低、脆性大,易折断和碎裂的缺点。通过扫描电镜、XRD和X射线衍射仪对nHA/PLLA复合支架材料进行表征。其具有较好孔隙率,其结构呈三维立体网状的固态多聚体。该结构是细胞在其上生长、分化、增殖以及营养物质交换的基础,为后期应用于骨组织工程提供基础,并且增加了细胞与材料的接触面积避免了接触性抑制,具备优良的力学性能满足机体负重部位骨缺损的修复。进一步研究该材料的生物相容性,观察该材料与细胞混合后对细胞活力的影响。结果表明,该支架材料生物相容性好、未发现免疫排斥反应,且该支架材料能促进成骨细胞黏附、增殖作用,促进成骨细胞矿化成骨作用。
综上所述,nHA/PLLA复合支架材料是一种性能较好的骨组织工程支架材料。
[1]James DR,Webster N,White JD,et al.Comparison of bone healing,as assessed by computed tomography,following tibial tuberosity advancement in dogs with and without autogenous cancellous bone grafts.N Z Vet J,2017,5:1-7.
[2]Naito K,Sugiyama Y,Obata H,et al.Screw fixation and autogenous bone graft for an irreducible distal ulna fracture associated with distal radius fracture.J Hand Surg Asian Pac Vol,2017,22(2):236-239.
[3]Cha SM,Shin HD,Kim KC,et al.Non-union of isolated radial neck fracture using a bone graft and temporary K-wire fixation:a case report.Hand Surg,2013,18(3):389-392.
[4]扈延龄,王向阳,王开,等.自体富血小板血浆凝胶双相接种法构建组织工程骨.中华骨与关节外科杂志,2016,9(2):165-169.
[5]Gassling V,Hedderich J,Açil Y,et al.Comparison of platelet rich fibrin and collagen as osteoblast-seeded scaffolds for bone tissue engineering applications.Clin Oral Implants Res,2013,24(3):320-328.
[6]Yang Y,Lin S,Wang B,et al.Stem cell therapy for enhancement of bone consolidation in distraction osteogenesis:A contemporary review of experimental studies.Bone Joint Res,2017,6(6):385-390.
[7]Scarfì S.Use of bone morphogenetic proteins in mesenchymal stem cell stimulation of cartilage and bone repair.World J Stem Cells,2016,8(1):1-12.
[8]Shao RX,Quan RF,Huang XL,et al.Evaluation of porous gradient hydroxyapatite/zirconia composites for repair of lumbar vertebra defect in dogs.J Biomater Appl,2016,30(9):1312-1321.
[9]Kimelman NB,Kallai I,Sheyn D,et al.Real-time bioluminescence functional imaging for monitoring tissue formation andregeneration.Methods MolBiol,2013,1048:181-193.
[10]曾飞煌,徐远志,房莉,等.应用数字化技术和快速成型技术制作牙颌模型的准确性评价.上海口腔医学,2012,21(1):53-56.
[11]García AJ,Ducheyne P,Boettiger D.Effect of surface reaction stage on fibronectin-mediated adhesion of osteoblastlike cells to bioactive glass.J Biomed Mater Res,1998,40(1):48-56.
[12]Lee S,Shen J,Pan HC,et al.Calvarial defect healing induced by small molecule smoothened agonist.Tissue Eng PartA,2016,22(23-24):1357-1366.
[13]Montufar EB,Vojtova L,Celko L,et al.Calcium phosphate foams:Potential scaffolds for bone tissue modeling in three dimensions.Methods Mol Biol,2017,1612:79-94.
[14]Oonishi H,Ohashi H,Kawahara I.Total hip arthroplasty around the inception of the interface bioactive bone cement technique.Clin Orthop Surg,2016,8(3):237-242.
[15]Vo TN,Tatara AM,Santoro M,et al.Acellular mineral deposition within injectable,dual-gelling hydrogels for bone tissue engineering.J Biomed Mater Res A,2017,105(1):110-117.
[16]Deng Y,Sun Y,Bai Y,et al.In vitro biocompability/osteogenesis and in vivo bone formation evalution of peptidedecorated apatite nanocomposites assisted via polydopamine.J Biomed Nanotechnol,2016,12(4):602-618.
[17]Qin J,Zhong Z,Ma J.Biomimetic synthesis of hybrid hydroxyapatite nanoparticles using nanogel template for controlled release of bovine serum albumin.Mater Sci Eng C Mater BiolAppl,2016,62:377-383.
[18]Tetteh G,Khan AS,Delaine-Smith RM,et al.Electrospun polyurethane/hydroxyapatite bioactive scaffolds for bone tissue engineering:the role of solvent and hydroxyapatite particles.J Mech Behav Biomed Mater,2014,39:95-110.
In vitro biocompatibility of mesoporous nano hydroxyapatite/poly lactic acid composite scaffolds with osteoblast in bone tissue engineering*
LUO Xinle1**,HUANG Shu2,SONG Jinqi2,ZHU Weimin3,OUYANG Kan3
(1.Department of Joint Surgery,People's Hospital of Longhua District,Shenzhen 518109;2.Department of Joint Surgery,Central Hospital of Longhua District,Shenzhen 518110;3.Department of Sport Medicine,Second People's Hospital of Shenzhen,Shenzhen 518100,Guangdong,China)
Background:At present,the biocompatibility and biomechanical properties of scaffold materials are not satisfactory in bone tissue engineering,and the subsequent degradation of materials is also a problem to be solved.The combination of new materials,methods,techniques and medical research could improve the shape and structure,biocompatibility and degradation rate of scaffolds in bone tissue engineering.Objective:To develop a compound of two materials with better biocompatibility in bone tissue engineering through the construction of scaffolds by mesoporous nano hydroxyapatite/poly lactic acid(nHA/PLLA)composite and the compatibility study of it with osteoblast.Methods:nHA/PLLA composite was prepared by freezing rapid prototyping method;porosity was determined by BET;internal structure was observed by SEM to show physical properties;physical characteristics were presented through X-ray diffraction.The growth,adhesion and proliferation of osteoblasts in nHA/PLLA in vitro were shown by SEM;the amount of osteoblasts in nHA/PLLA were observed and calculated by inverted fluorescence microscope;the influence of nHA/PLLA composite on osteoblasts activity was determined by MTT.Results:nHA/PLLA composite was prepared with the pore size of(164±52)μm and the porosity of 89.3%±1.4%;the modulus of compression of dry and wet nHA/PLLA composite scaffolds were(1354.6±53.7)kPa and(1012.8±61.3)kPa,respectively;MTT results showed that nHA/PLLA composite had no significant influence on osteoblasts activity and with the prolongation of incubation,the amount of osteoblasts adhering to the composite surface and in the mesoporous increased gradually.Conclusions:The nHA/PLLA composite is a kind of scaffold material with high performance in bone tissue engineering,and its advantages include easy preparation,shape and internal structure meeting the requirements of tissue engineering scaffold and good biocompatibility with osteoblasts.
Nano-Hydroxyapatite/Poly LacticAcid Composite;Biocompatibility;Tissue Engineering;Osteoblast
2095-9958(2017)08-0 336-05
10.3969/j.issn.2095-9958.2017.04-14
2015年湖南省科技厅社会发展支撑计划项目资助课题(编号:2015SK20471);深圳市龙华新区科技创新资金“社会公益科研”项目资助课题(编号:20151020A1030115)
**通信作者:罗新乐,E-mail:luoxinlesz@163.com

