苹果树根际高效解钾菌的筛选及鉴定∗
姜霁航,彭霞薇,颜振鑫,何不为,朱昌雄,国 辉**,耿 兵**
(1.北京林业大学生物科学与技术学院,北京 100083;2.中国农业科学院农业环境与可持续发展研究所,北京 100081)
苹果树根际高效解钾菌的筛选及鉴定∗
姜霁航1,彭霞薇1,颜振鑫1,何不为1,朱昌雄2,国 辉1**,耿 兵2**
(1.北京林业大学生物科学与技术学院,北京 100083;2.中国农业科学院农业环境与可持续发展研究所,北京 100081)
为探明苹果树根际解钾菌的种群特征和解钾性能,从苹果树根际土壤中分离获得解钾能力较强的高效解钾菌。本研究以钾长石为唯一钾源,分离获得118株具有解钾活性的菌株,重复片段 PCR基因指纹分析(Repetitive-element PCR, rep-PCR)聚为29个类群。利用火焰分光光度法测定菌株解钾能力,获得5株高效解钾菌,平均解钾活性达到41.47mg·L-1,其中K105的解钾能力最强,有效态钾增长23.09%。采用H2O2消煮后测得的 K+浓度升高,有效态钾增长最高达 31.22%。采用形态特征观察、生理生化特性检测和基于 16S rRNA基因序列的系统发育分析对高效解钾菌株进行鉴定。结果表明:K1为不动杆菌属(Acinetobacter sp.)、K98、K105和K115为假单胞菌属(Pseudomonas sp.)、K168为芽孢杆菌属(Bacillus sp.)。研究结果可为开辟新型高效解钾菌,为连作土壤的改良和苹果专用微生物菌肥的开发提供依据。
解钾菌;重复片段PCR基因指纹分析;筛选;鉴定
钾是植物的三大元素之一,对植物的生长起着十分重要的作用。钾元素在植物体内主要以K+的状态存在于细胞液中,是很多酶的催化剂。在植物生长的过程中有近60种酶需要钾加以活化,钾元素间接决定了植物的生长速度。土壤中钾元素一般可分为水溶性钾、交换性钾、非交换性钾和矿物质钾,能直接被植物吸收利用的有效钾约占总量的2%,有95%的钾以缓效态形式存在于钾长石或云母等硅酸盐矿物中,不能被植物直接吸收利用[1]。因此,研究如何将这些土壤矿物中的钾释放出来,成为作物能吸收利用的可给态钾,具有理论和实践意义。
中国土壤中可溶性钾资源匮乏,但是以钾长石为主的难溶性硅铝酸钾资源存储丰富,分布广泛,南方储存尤为丰富[2]。土壤中的钾矿物主要以稳定的硅酸盐形式存在,而解钾菌是从土壤中分离出的一种能利用铝硅酸盐和磷灰石类矿物的细菌,可作为微生物肥料,分解钾长石、磷灰石等不溶性的硅铝酸盐无机矿物质,促进难溶性的钾、磷、硅、镁等养分元素转化成可溶性养分,增加土壤速效养分的含量,促进作物生长发育,提高产量[3]。研究表明,生物有机质可改良土壤质量,减少土壤中氮磷钾等养分淋失[4]。目前利用土壤中的解钾微生物,有效开发钾长石资源,从中提取钾,制造钾肥是解决中国可溶性钾资源紧缺现状的重要途径[5]。而根际解钾微生物比普通解钾菌具有更显著的优势,不但能转化土壤中难溶性钾,改造土壤结晶构造,还能分泌促生物质,活化根际土壤微生物态环境,促进植物生长[6]。由于不同植物根际的解钾细菌的种类和数量存在差异,不同种类的解钾菌或不同菌株之间的解钾能力存在较大差异,所以从特定植物根际筛选高效解钾细菌的工作显得尤为重要。
近年来,随着苹果品种更新换代和密植的发展,新老果园的重茬,常常导致苹果再植病的发生,表现为植株矮小,生长衰弱,果实品质低下等症状[6]。许多高产果园苹果种植模式均为多年连作,这种种植模式下土壤钾素输出量大,有效钾亏缺严重[7]。在连作模式下,土壤中根际有益菌的种类和数量降低,有害真菌逐渐富集。微生物的“解钾”作用,是由于微生物代谢过程中所产生的无机酸和有机酸的作用结果,它能明显提高连作土壤中速效钾的含量,有效降低土壤中苹果连作病原菌镰刀菌的发生率[8]。研究表明,根际促生菌在改善苹果树连作中扮演着重要的角色[9]。解钾菌是常用的促生根际菌(PGPR)之一,通过在植物根际定殖,可促进植物生长,提高产量和营养利用率[1-2,10-12]。国内外研究表明,目前研究较为广泛的解钾菌多为胶质芽孢杆菌(Bacillus mucilaginosus)和克霍尔德菌(Burkholderia sp.)[13-15],解钾微生物多样性还有待开发,目前国内有关解钾细菌的研究与应用主要集中在农作物上,从多年生作物上筛选应用解钾细菌的报道鲜见,国内外鲜有苹果树根际解钾菌的相关研究报道。本研究通过苹果树根际高效解钾微生物的筛选,对促进解钾微生物多样性,利用生物途径改善缺钾现状,缓解土壤连作障碍具有十分重要的现实意义。
本研究以钾长石为唯一钾源,从苹果树根际土壤中分离出解钾分离株,rep-PCR基因指纹分析聚类,通过发酵培养,对发酵液中速效钾含量进行测定,获得高效解钾菌,并对解钾菌进行解钾能力测定和菌种鉴定,重点探讨连作苹果树根际解钾菌的解钾能力,并试图比较合理评估解钾菌的解钾作用。旨在开辟新型高效解钾菌,充分利用土壤钾素资源,为连作土壤的改良和苹果专用微生物菌肥的开发提供依据。
1 材料与方法
1.1 材料
1.1.1 土壤样品
土壤样品取自山东省泰安市多年生苹果园,分别采集多年生果树和栽植后表现出连作障碍的幼苗根际土,土壤理化性质如表1,每个区随机抽取6个点采样,共12份样品,取5-10cm土层,把根际土壤连同树根一起装入无菌袋,贴上标签编号。抖掉根际附着的土壤,将同一苹果园区的6个样品混合,用于解钾菌的分离。带回实验室放置于冰箱4℃保存。
1.1.2 培养基及溶液
LB液体培养基:胰蛋白胨10g,酵母提取物5g,NaCl 10g,H2O 1000mL。

表1 苹果树根际土壤理化性质Table 1 Soil properties of the apple rhizosphere region
LB固体培养基:琼脂粉 15g,其它成分同 LB液体培养基。
解钾菌分离液体培养基:蔗糖 5g,MgSO4·7H2O0.5g,Na2HPO42g,CaCO30.1g,FeCl30.005g,钾长石(K2O·Al2O3·6SiO2)粉(150 目)1.0g,H2O 1000mL。
解钾菌分离固体培养基:琼脂粉15g,其它成分同解钾菌分离液体培养基。
K标准系列溶液:KCl 0.19g(110℃烘2h)溶于蒸馏水中,定容至1000mL,即为100mg·L-1的K标准溶液,分别吸取0、2、5、10、20、30、40mL至容量瓶中,用蒸馏水定容至100mL,配置成0、2、5、10、20、30、40mg·L-1的 K 标准溶液[16]。
1.2 方法
1.2.1 解钾菌分离筛选
称取10g新鲜土样置于装90mL无菌水的250mL锥形瓶中,利用28℃、180rpm全温振荡培养箱振荡,充分混匀制成土壤悬浮液,按梯度稀释为10-3、10-4、10-5浓度,各取0.1mL稀释液涂布于以钾长石为唯一钾源的解钾菌分离培养基中,每个浓度 3个重复,放入 28℃培养箱中培养 3~4d。从中筛选较大的、圆形透明、表面粗糙黏稠的单菌落[2]进行四分体划线纯化,反复进行3次,同时用显微镜观察菌落纯度,直至获得纯培养。
1.2.2 rep-PCR分析及聚类图构建
采用天根生化试剂盒,按照说明书操作步骤进行样品DNA的提取。对各解钾菌分离株的基因组进行基因外重复回文序列(repetitive-element PCR,rep-PCR)DNA指纹分析,用软件CORSS CHECKER进行凝胶分析、SAS9.0进行聚类分析,构建苹果树根际解钾细菌的rep-PCR聚类分析图。
rep-PCR 采用引物为 BOX-AIR(5′-CTACGGC AAGGCGACGCTGACG-3′)[16]。rep-PCR 反应体系为:10×PCR Buffer 2.5μL,10mmol·L-1dNTP 2μL,25mmol·L-1MgCI21.5μL,10μmol·L-1引物 2μL,模板1μL,Taq酶0.15μL,补加双蒸水至30μL。rep-PCR反应条件为:95℃、7min—94℃、1min— 53℃、1min—65℃、8min,共 35个循环,再 65℃、16min—4℃、Pause。PCR产物进行 1%的琼脂糖凝胶电泳,电解液为1×TAE,Marker选用Trans 2KTMPlusⅡDNA Marker。
1.2.3 解钾能力测定
(1)钾标准曲线的绘制
将配制好的钾标准系列溶液,用含 K+0mg·L-1的钾标准液将火焰光度计上检流计读数调整为0,用40mg·L-1质量浓度的钾标准液将火焰光度计上检流计调为满度(100),然后按钾的质量浓度从稀到浓依次测定不同质量浓度下的钾离子含量(mg·L-1),记录检流计读数。以检流计读数为纵坐标,钾的质量浓度为横坐标,绘制标准曲线[16]。
(2)细菌的培养
将筛选获得的解钾菌在解钾菌分离培养基平板上培养48h,挑取单菌落接种于解钾菌分离液体培养基中,28℃、180rpm全温振荡培养箱培养 72h,获得处理组(接菌)发酵液。在250mL三角瓶中装入50mL培养液,高压灭菌锅121℃高温灭菌20min,冷却至室温。处理组(接菌)按 4% 的接种量接种发酵液,28℃、180rpm全温振荡培养箱培养72h测定速效钾含量。以对照组(不接菌)中速效钾含量为基准计算获得菌株的解钾能力。
(3)钾离子的测定
取步骤(2)中培养 72h后的培养液 20mL,6000r·min-1离心20min,取上清液用火焰分光光度计(棱光FP6410式)测定其中K+含量;另取20mL培养液,加4%H2O2,高压灭菌锅121℃高温灭菌处理20min,6000r·min-1离心 20min,测上清液中 K+的含量[17]。
(4)解钾活性的测定
将步骤(3)中得到的上清液与钾标准系列溶液一起在火焰分光光度计上进行测定,根据标准曲线读出待测上清液相对应的K+含量。
1.2.4 菌株鉴定
(1)菌种形态与生理生化分析
采用革兰氏染色法对菌株的形态进行显微镜观察,并结合生理生化性质实验初步确定菌株种属。参照Shirking等[18]的方法对菌株进行生理生化鉴定。
分别在25℃、28℃、30℃、37℃、45℃共5个温度梯度下,180r·min-1条件下振荡培养 48h,不同温度的处理各设3个重复,测定各发酵液600nm下0D值。
用 HCl和 NaOH调节培养基的 pH值分别为5.0、6.0、7.0、8.0、9.0,在5个pH梯度下,30℃、180r·min-1条件下振荡培养48h,不同pH的处理各设3个重复,测定各发酵液600nm下0D值。
(2)16Sr RNA基因序列分析
根据解钾能力测定和聚类结果,选取具有高效解钾能力的解钾菌进行菌株鉴定。
TaqDNA聚合酶、2×GC Buffer1、dNTPs试剂由北京某公司提供;采用扩增细菌16SrDNA的一对保守通用引物,由北京某生物技术有限公司提供。正向引物27F(5'-AGA GTT TGA TCC TGG CTC AG-3');反向引物 1492R(5'-AAG GAG GTG ATC CAG CCG CA-3')。PCR 体系为 2×GC Buffer one25μL,dNTPs1.25μL,10pmol 引物各 2.5μL,5U·μL-1Taq 酶 0.5μL,无菌水 17.25μL[19]。反应程序[12]如表 2。
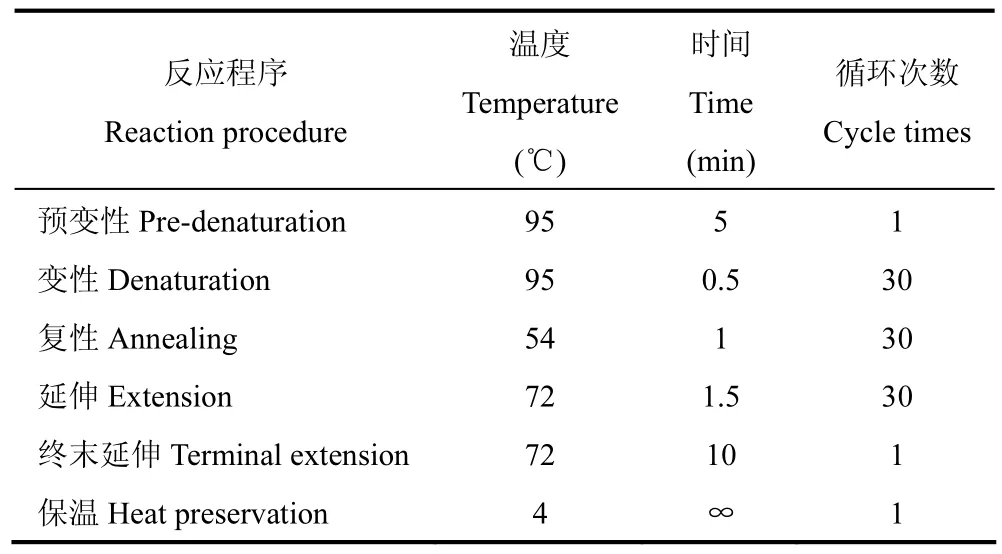
表2 16S rRNA聚合酶链式反应体系Table 2 16S rRNA polymerase chain reaction system
将测得的菌株序列上传至 NCBI数据库中进行BLAST分析比对,从比对结果中挑选相似性较高菌株的16S rRNA基因序列,通过Clustal X进行多重序列比对,并用MEGA5. 0软件,以Neighborjoining法构建系统发育树[19]。
2 结果与分析
2.1 土壤中解钾菌的分离与筛选
从苹果树根际中共分离得到 118株具有解钾能力的细菌分离株,菌株编号为“K”和“分离顺序”。菌落形态呈近圆形或椭圆形、白色或灰白色、半透明或不透明、大部分边缘规则、生长速度中等。
将分离获得的 118个解钾分离株进行 rep-PCR基因指纹分析,构建其DNA指纹聚类图,如图1。将118个解钾菌聚为29个类群,其中K1、K10、K13、K17、K22、K24、K28、K32、K48、K49、K50、K55等分离株具有完全一致的电泳 DNA指纹图谱(图2),被聚为同一类群,其余的28种分离株相异百分数为0.4水平上,都有各自独立的特征谱带,说明各分离株的基因组之间存在显著异质性,表现出丰富的基因型多态性。
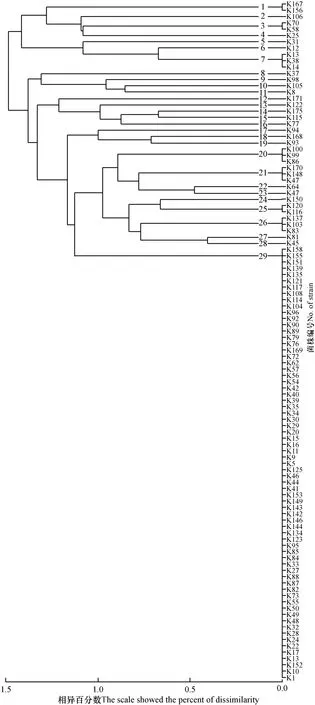
图1 苹果树根际解钾菌的rep-PCR DNA指纹聚类图Fig. 1 Cluster analysis of apple rhizospheric potassiumsolubilizing bacteria based on the rep-PCR DNA fingerprints
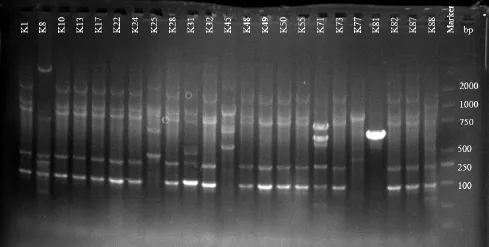
图2 部分解钾分离株的rep-PCR凝胶电泳结果Fig. 2 The result of rep-PCR gel electrophoresis of part potassium-solubilizing bacterial isolates
2.2 土壤中解钾菌菌株解钾能力的测定
对照组(CK)钾离子含量为31.73mg·L-1,以此为基准计算得到所有菌株的解钾能力,结果见图3。由图可见,29个菌株培养液其K+含量与CK差异均达极显著水平(P<0.01)。与 CK相比,培养 72h后未加 H2O2灭菌的处理中,各株菌的钾增加4.71%~23.09%,不同菌株解钾能力存在显著差异,其中K1、K98、K105、K115、K168的解钾能力最强,有效态钾分别增加18.43%、15.62%、23.09%、20.79%、21.79%。培养液中 K+含量<35mg·L-1的有 4株,占13.79%,35~40mg·L-1的有 6株,占 20.69%,>40mg·L-1的有19株,占65.51%,培养液中K+含量越高说明菌株的解钾能力越强。
研究发现,大部分菌株培养液加4%H2O2消化后溶液中的钾离子浓度高于未加的处理,与未经处理组得到的结果差异显著,钾含量增加量最高可达12.26倍。这可能是因为,H2O2的消化对钾长石有一定的溶解作用;也可能是解钾细菌在分解钾长石粉时,一部分溶解后存在于发酵液中,还有一部分钾在菌体中积累起来,供细菌自身生长繁殖需要,某些解钾菌具有荚膜结构,例如芽单胞菌属和不动杆菌属,荚膜的黏附作用可以吸附矿物释放的钾离子,培养液经4%H2O2溶液高温消煮后,细菌荚膜被氧化分解,荚膜吸附的钾离子被释放出来。
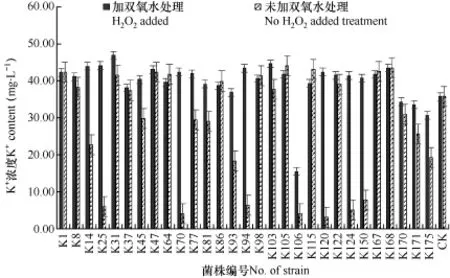
图3 29个解钾类群培养液中钾离子含量的比较Fig. 3 Comparision of K+ content in culture medium of 29 potassium-solubilizing groups
2.3 5株解钾能力较强的苹果树根际解钾菌的分类鉴定
2.3.1 形态鉴定
选取 5株高效解钾菌的菌落,其形态和菌落特征见表3。由表可见,其中K1、K115、K105、K98菌株均为革兰氏阴性菌,为无芽孢的杆菌,K168菌株为革兰氏阳性菌;菌落颜色有乳白色、淡黄色;除 K115、K105外其它菌落表型均呈湿润黏稠状。
2.3.2 生理生化性质
由表4可知,5株菌落在温度为28℃、pH为7.0~8.0的条件下生长最适宜;筛选获得的5株解钾菌生理生化性质如表5所示,5株细菌均可利用葡萄糖,可水解明胶,除K98外均不能分解吲哚。
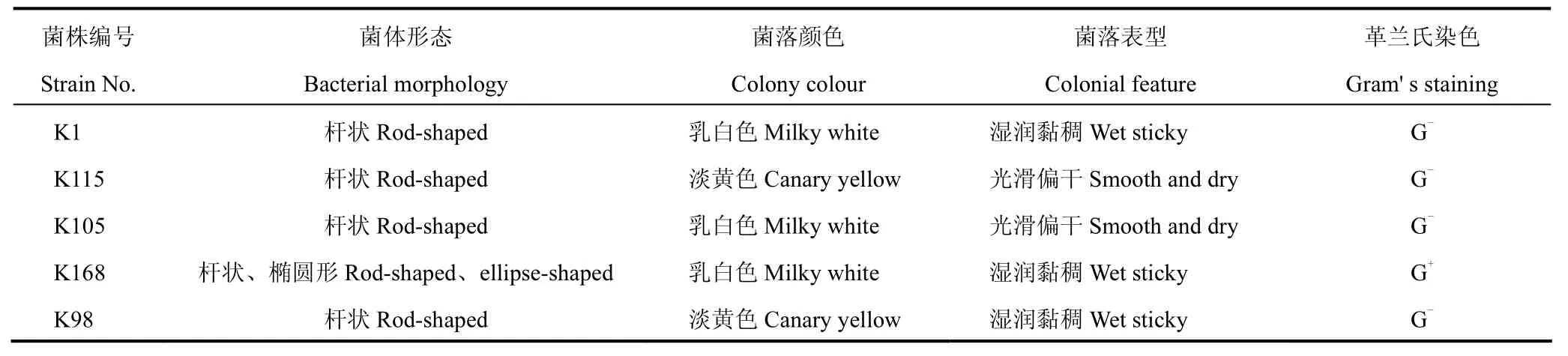
表3 形态鉴定结果Table 3 The morphology colony and basic characteristics of morphological
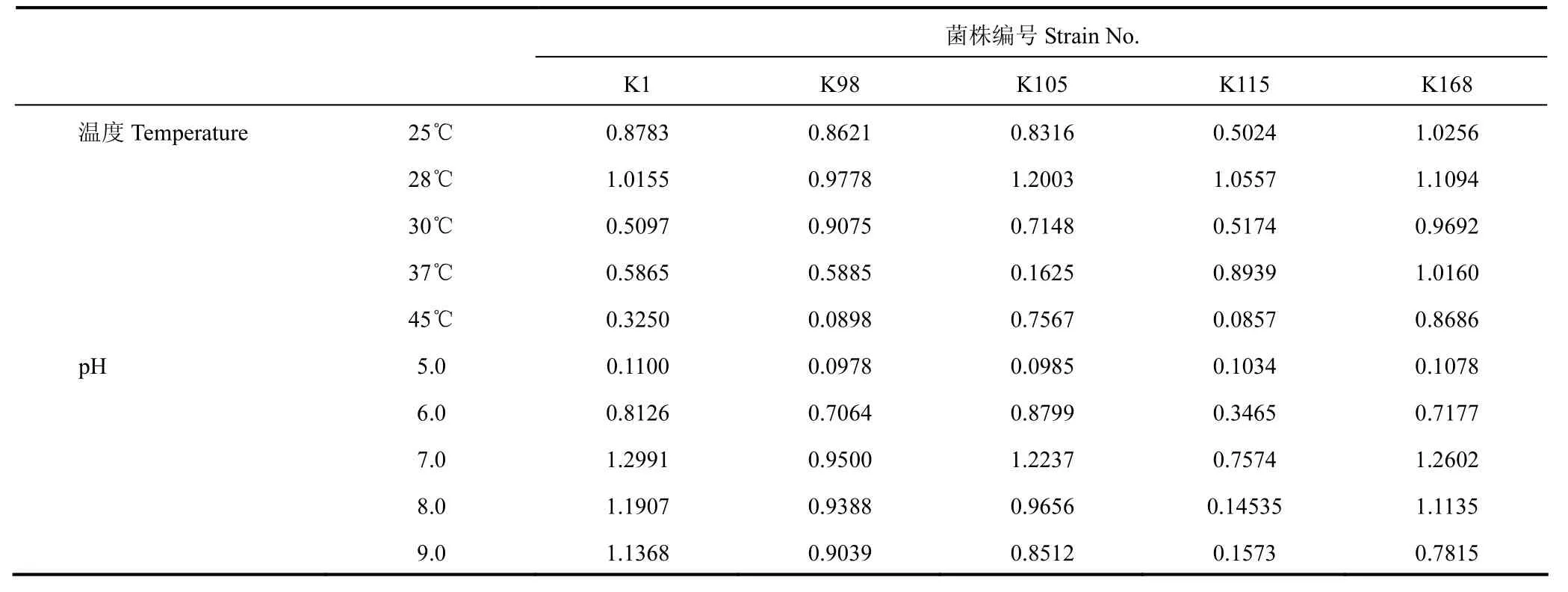
表4 5株解钾菌在不同温度梯度和pH梯度下的OD600值Table 4 OD600 value of 5 potassium-solubilizing bacteria under different temperature and pH gradient
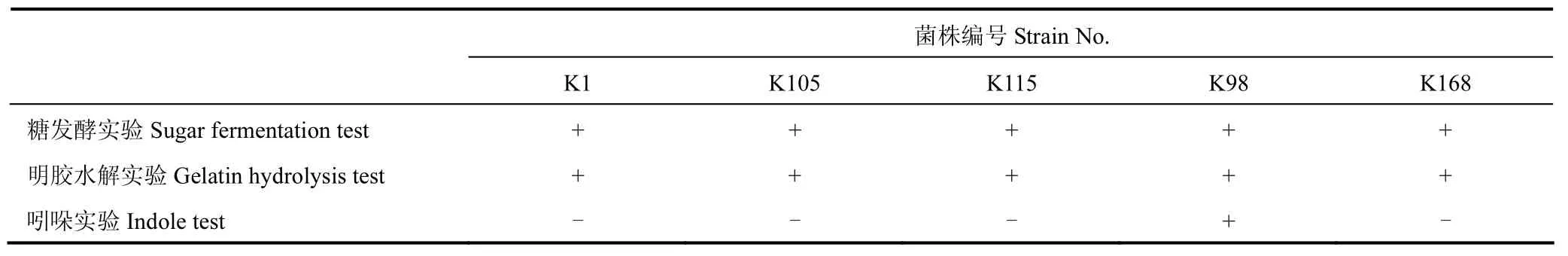
表5 生理生化性质Table 5 Physiological and biochemical characteristics
2.4 土壤中解钾菌菌株鉴定
2.4.1 GenBank数据库数据比对
测序所得的5株功能菌株16SrRNA基因序列长度均在1500bp左右,将5株菌株序列在NCBI中进行BLAST同源性比较,同时与GenBank中的核酸数据进行对比分析,获取同源性较高的相邻种、属的16SrRNA序列,比对结果如表6所示,其中假单胞菌属在整个样品中属于优势属。

表6 5株高效解钾菌的16S rRNA基因序列比对Table 6 16S rRNA gene sequence blast of 5 potassium-solubilizing bacteria
2.4.2 系统发育及同源性分析
对解钾能力最强的5株菌株进行PCR扩增,将获得的16SrRNA基因序列提交到NCBI数据库进行序列比对,选取同源性较高的菌株,利用MEGA5.0软件的Alignment Explorer程序进行多序列同源性分析,并通过该软件的 Neighbor-Joining法构建根际促生细菌的系统进化树如图4、图5、图6。由图可见,K1菌株与不动杆菌属(Acinetobacter sp.)的遗传进化距离最近,与已知菌株Acinetobacter sp.(GQ369439.1)的16S rRNA的基因序列同源性达到99%。菌株K98、K105、K115均属假单胞菌属(Pseudomonas sp.),其中菌株 K98与已知菌株Pseudomonas sp.48XA(DQ103513.1)的16S rRNA的基因序列同源性最大,高达到99%;菌株K105与已知菌株荧光假单胞菌Pseudomonas rhodesiae strain(KF147019.1)的16S rRNA的基因序列同源性最大,达到99%;菌株K115与已知菌株Pseudomonas sp.(GU784937.1)的16S rRNA的基因序列相似性达到99%。菌株K168与芽孢杆菌属(Bacillus sp.)的遗传进化距离最近,与已知菌株解淀粉芽孢杆菌Bacillus amyloliquefaciens(KP261025.1)的16S rRNA的基因序列相似性达到 99%。结合各菌株的菌体形态、菌落特征和生理生化性质,初步确定菌株K1为不动杆菌属(Acinetobacter sp.),菌株K98、K105、K115均为假单胞杆菌属(Pseudomonas sp.),菌株K168为芽孢杆菌属(Bacillus sp.)。因此,可在这3个属内挖掘高效解钾微生物,开发高效解钾微生物资源。
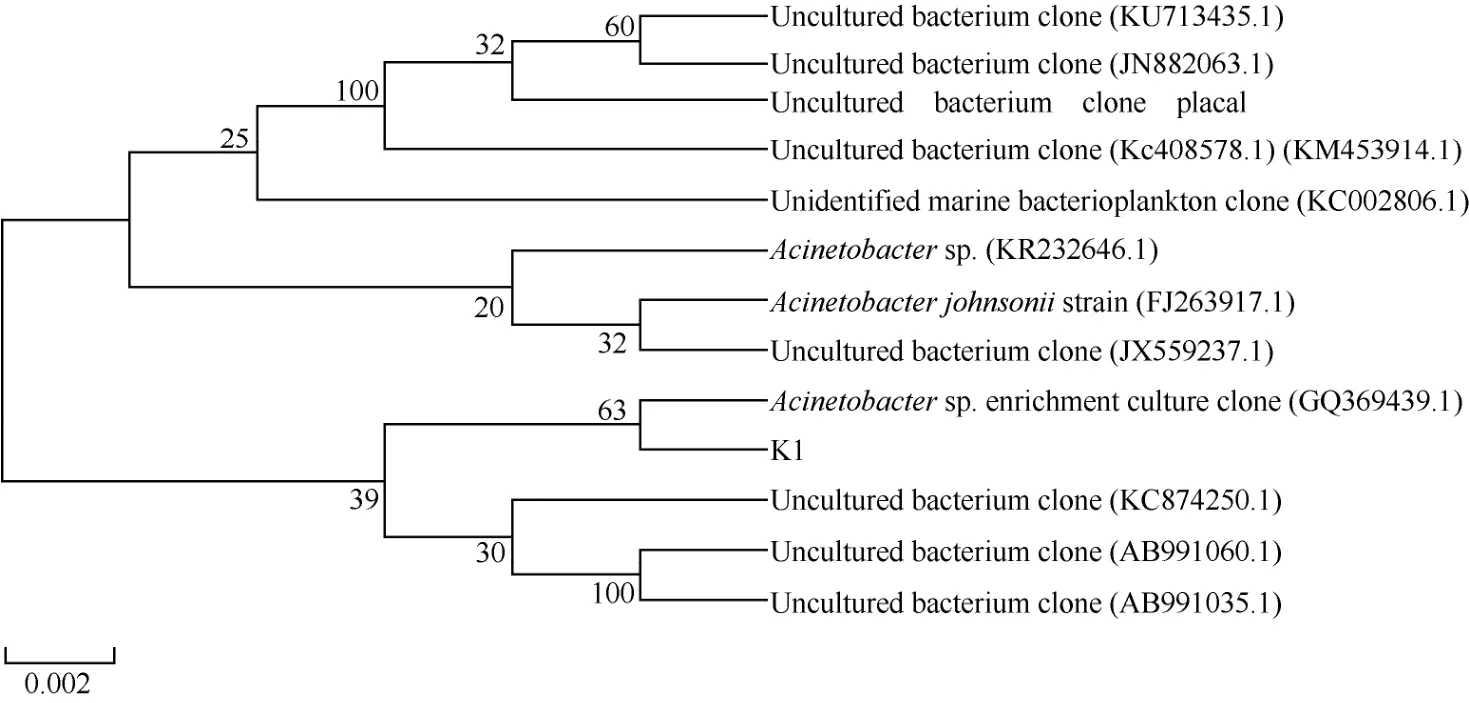
图4 基于16S rRNA基因序列的解钾菌K1的系统发育树Fig. 4 Phylogenetic tree of the strain K1 based on 16S rRNA gene sequence
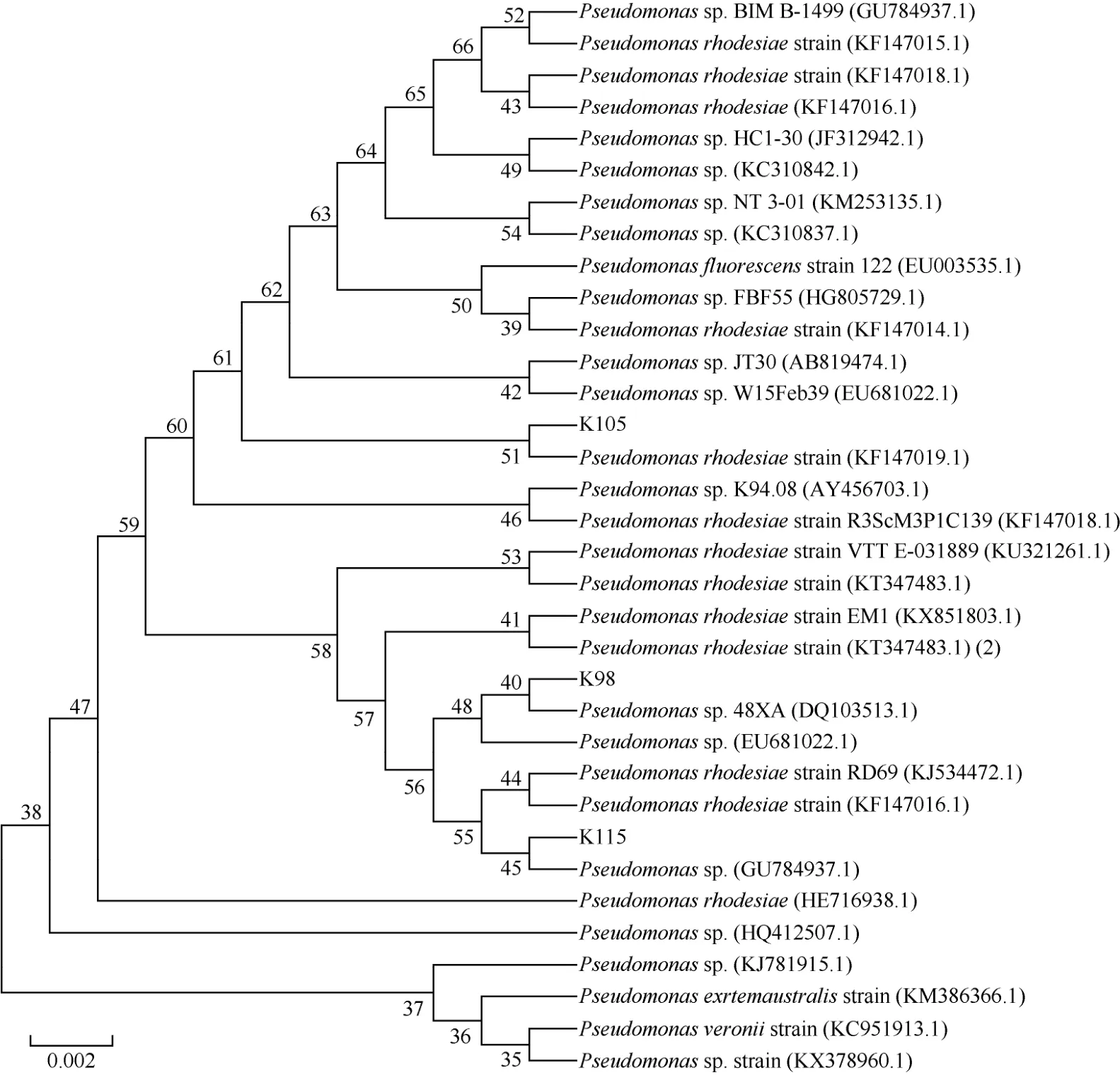
图5 基于16S rRNA基因序列的解钾菌K98、K105、K115的系统发育树Fig. 5 Phylogenetic tree of the strains K98, K105, K115 based on 16S rRNA gene sequence
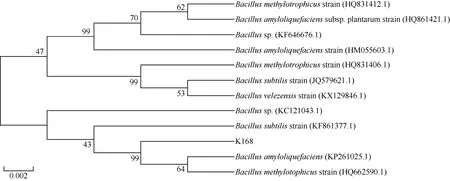
图6 基于16S rRNA基因序列的解钾菌K168的系统发育树Fig. 6 Phylogenetic tree of the strain K168 based on 16S rRNA gene sequence
3 讨论与结论
3.1 讨论
解钾菌又称硅酸盐细菌(Silicate bacteria),是一类能够分解钾长石、云母等硅酸盐类矿物,把土壤中难溶性钾分解、转化成为可以被作物直接吸收的有效钾并能分泌促进植物生长的活性物质的微生物[17,20]。大多数解钾菌都是从土壤中分离得到的,而根际土壤中更容易分离得到高效解钾菌[21]。根际解钾菌不仅可以改良土壤结构、降解有毒物质,还可以促进植物生长,防治植物病害[1]。近年来有研究表明,包括根际解钾菌在内的根际土壤功能菌可诱导植物产生生长激素,增强植物对环境的忍耐力及对病原菌的抗性,从而起到促生作用[22]。国内外研究表明,目前发现的钾矿物分解菌主要有硅酸盐细菌,包括环状芽孢杆菌(Bacillus circulans)、胶质芽孢杆菌(Bacillus nutcilaginosus)和土壤芽孢杆菌(Bacillus edaphicus)3个种[13-15]。但本研究中获得的5株高效解钾菌中,K1为不动杆菌属,K168为解淀粉芽孢杆菌,K105为荧光假单胞菌,K98和 K115为假单胞菌属。不同的土壤或作物其根际引起硅酸盐细菌种群的分布存在一定差异,针对苹果树相关根际解钾菌的报道很少。本研究从山东泰安苹果园获得土壤样品,得到118株具有解钾能力的细菌,占分离总细菌数(3.15×107个·mL-1)的 37.46%,说明采集的土壤样品中解钾菌的数量占较高比例。118株解钾菌株通过rep-PCR聚类分析聚为29个类群,测定解钾活性后获得5株高效解钾菌,经16Sr RNA基因测序分析,结合其菌体形态和菌落特征、生理生化特征,将K1鉴定为不动杆菌属(Acinetobacter sp.),K98、K105、K115鉴定为假单胞菌属(Pseudomonas sp.),K168 鉴定为芽孢杆菌属(Bacillus sp.)。
研究表明,钾长石与菌体相互作用的第一步是吸附,绝大多数微生物包括微生物细胞或酶,以及微生物在生长代谢或残体分解过程中释放出的小分子有机酸和大分子物质,以吸附态的形式与土壤矿物作用,形成细菌-矿物复合体[23]。本研究中,与对照组相比,有些菌株培养 72h后培养液中钾含量反而降低,这可能是由于菌体与钾长石形成复合体,对培养液中本来存在的钾元素有一定的吸附作用。
关于假单胞菌属(Pseudomonas sp.)和芽孢杆菌属(Bacillus sp.)的解钾活性已有报道[22,24-26],Bhattacharya在盐田中发现1株具有解钾活性的不动杆菌属(Acinetobacter sp.)[27],是一类稀有解钾菌,杨绍周等[28]曾发现一株不动杆菌(Acinetobacter calcoaceticus)属具有解磷活性,而目前对该类菌解钾活性的研究报道较少, 对其进一步研究有助于缓解钾肥短缺的现状和开发新一代稳定的功能菌种。
本研究发现,4%H2O2消煮处理的发酵液中的钾离子浓度明显高于未消煮处理的发酵液,这可能是由于解钾细菌在分解钾长石粉时,一部分钾溶解在发酵液中,还有一部分钾在菌体中积累起来,供细菌自身生长繁殖需求;有些细菌具有荚膜结构,细菌荚膜也可吸附钾离子,经H2O2消煮处理,荚膜多糖被氧化分解,使吸附的钾离子释放出来。经过H2O2处理后所检测到的钾离子包括溶液中游离态的钾、菌体吸附的钾和部分细胞内的钾,这样计算得到的解钾效率是最贴近真实情况的[29]。而培养基中钾长石中的钾仅包括溶液中游离态的钾和菌体所吸附的钾两部分,研究表明被菌体所吸附的钾只占一小部分[29],Eisenstadt[30]利用高特异性42K的泄漏间接检测枯草芽孢杆菌(Bacillus subtilis)生长、产芽胞过程中钾含量的变化,在细菌生长对数期钾元素含量仅占细胞干重的2.5%~3%,大部分通过解钾菌的分解作用变成游离态钾离子。从土壤中筛选的菌株具有一定解钾能力,但未经处理的菌株解钾能力并不高,通过加长对菌的浸出时间和对菌细胞膜的破坏可以提高培养液钾离子浓度,这可为高效解钾菌的筛选提供理论基础和技术指导。
解钾细菌的生长和解钾性能受光照、水分、温度等外界环境条件的影响,因此,解钾菌在田间的施用效果有待进一步研究。近年来植物根际促生菌中研究较多的细菌类群是固氮细菌、解磷细菌[9],对解钾菌的研究相对较少,本实验在探讨根际高效解钾菌的筛选及解钾活性的同时,获得一些具有研究价值和应用潜力的根际促生细菌,以期为改善苹果树根际微生态环境,研制开发苹果树微生物菌肥提供科学依据。
3.2 结论
解钾菌解钾能力的强弱是作为评价其性能的重要指标。本研究从苹果树根际分离出118个解钾分离株,rep-PCR聚为29个解钾类群,通过解钾活性的测定获得 5株高效解钾菌,具有明显解钾优势,钾离子含量最高达41.47mg·L-1,菌株K105的解钾能力最强,有效态钾增长 23.09%。5株高效解钾菌最适生长pH范围为7.0~8.0,最适生长温度为28℃。经生理生化和分子生物学鉴定,筛选获得的解钾菌分别属于不动杆菌属 Acinetobacter sp.,假单胞菌属Pseudomonas sp.,芽孢杆菌属Bacillus sp.,其中假单胞菌属Pseudomonas sp.为优势菌属。4%H2O2处理后的培养液中可溶性钾浓度明显高于未经 4%H2O2处理的培养液,经处理得到的钾离子含量更接近培养液中钾离子的实际含量。
References
[1]陈宇丰,柯春亮,周登博,等.香蕉根际土壤解钾放线菌的筛选鉴定及解钾特性研究[J].生物技术通报,2015, 31(6): 129-137.Chen Y F,Ke C L,Zhou D B,et al.Screening, identification and potassium-dissolving characteristics of potassium-dissolving actinomycete in banana rhizosphere soil[J].Biotechnology Bulletin,2015,31(6):129-137.(in Chinese)
[2]Han H S, Lee K D. Phosphate and potassium solubilizing bacteria effect on mineral uptake, soil availability and growth of eggplant[J].Research Journal of Agriculture and Biological Sciences,2005,1(2):176-180.
[3]罗华元,常寿荣,王绍坤,等.云烟高端品牌植烟区根际土壤高效解钾菌的筛选[J].西南农业学报,2011, 24(5): 1813- 1817.Luo H Y,Chang S R,Wang S K,et al.Screening of highly effective potassium bacteria in rhizosphere soil of high-end brand tobacco in Yunnan[J].Southwest China Journal of Agricultural Sciences,2011,24(5): 1813-1817.(in Chinese)
[4]惠锦卓,张爱平,刘汝亮,等.添加生物炭对灌淤土土壤养分含量和氮素淋失的影响[J].中国农业气象, 2014, 35(2): 156-161.Hui J Z,Zhang A P,Liu R L,et al.Effects of biochar on soil nutrients and nitrogen leaching in anthropogenic-alluvial soil[J].Chinese Journal of Agrometeorology,2014,35(2):156-161.(in Chinese)
[5]易浪波,彭清忠,何齐庄,等.高效钾长石分解菌株的筛选、鉴定及解钾活性研究[J].中国微生态学杂志,2012, 24(9):773-776.Yi L B,Peng Q Z,He Q Z,et al.Isolation and identification of potash feldspar-solubilizing bacteria and their potassiumreleasing activities[J].Chinese Journal of Microecology,2012,24(9):773-776.(in Chinese)
[6]罗娜,周德明,徐睿,等.降香黄檀、檀香根际解钾菌的筛选与活性研究[J].热带作物学报,2016, 37(5):964-970.Luo N,Zhou D M,Xu R,et al.Screening and identification of potassium bacteria in the rhizosphere of dalbergi odorifera,santalum album land the activity assay[J].Chinese Journal of Tropical Crops,2016, 37(5):964-970.(in Chinese)
[7]路永莉,杨宪龙,李茹,等.不同施钾时期对红富士苹果产量和品质的影响[J].应用生态学报,2015,26(4): 1179-1185.Lu Y L,Yang X L,Li R,et al.Effects of different potassium fertilizer application periods on the yield and quality of Fuji apple[J].Chinese Journal of Applied Ecology,2015,26(4):1179-1185.(in Chinese)
[8]陈长宝.人参化感作用及其忌连作机制研究[D].吉林:吉林农业大学,2006.Chen C B.Study on ginseng allelopathy and the elements of unable sueeessive cultivation[D].Jilin: Jilin Agricultural University,2006.
[9]Guo H,Mao Z,Jiang H,et al.Community analysis of plant growth promoting rhizobacteria for apple trees[J].Crop Protection,2014,62(4):1-9.
[10]Sheng X F.Growth promotion and increased potassium uptake of cotton and rape by a potassium releasing strain of Bacillus edaphicus[J].Soil Biology & Biochemistry,2005,37(10): 1918-1922.
[11]Mehta P,Walia A,Kulshrestha S,et al.Efficiency of plant growth-promoting P-solubilizing Bacillus circulans CB7 for enhancement of tomato growth under net house conditions[J].J Basic Microbiol, 2015,55(1):33-44.
[12]吴作为,吴颖运,李欣,等.胶质芽胞杆菌(Bacillus mucilaginosus)D4B菌株生理特性研究[J].中国土壤与肥料,2004,(2):40-43.Wu Z W,Wu Y Y,Li X,et al.Studies on physiology of Bacillus mucilaginosus D4B 1 strain[J].Soils and Fertilizers,2004,(2):40-43.(in Chinese)
[13]Sugumaran P,Janarthanam B.Solubilization of potassium containing minerals by bacteria and their effect of plant growth[J].World Journal of Agricultural Sciences,2007,3(3):350-355.
[14]Gopal M,Gupta A,Nair R V.Variations in hosting beneficial plant-associated microorganisms by root (wilt)-diseased and field-tolerant coconut palms of West Coast Tall variety[J].Current Science,2005, 89(11):1922-1927.
[15]Calvaruso C,Turpault M P,Freyklett P.Root-associated bacteria contribute to mineral weathering and to mineral nutrition in trees:a budgeting analysis[J].Appl Environ Microbiol, 2006, 72(2):1258-66.
[16]刘训理,王超,吴凡,等.烟草根际微生物研究[J].生态学报,2006,26(2):552-557.Liu X L,Wang C,Wu F,et al.Studies on tobacco rhizosphere microbes[J].Acta Ecologica Sinica, 2006,26(2):552-557.(in Chinese)
[17]杨剑芳,黄明勇,李杨,等.盐碱土硅酸盐细菌多样性初步研究[J].中国农学通报,2010,26(20):193- 199.Yang J F,Huang M Y,Li Y,et al.Preliminary study on diversity of silicate bacteria from saline-alkali soil[J].Chinese Agricultural Science Bulletin,2010,26(20):193-199.(in Chinese)
[18]Shirling E B,Gottlieb D.Methods for characterization of streptomyces species[J].International Journal of Systematic Bacteriology,1966,16(3):313-340.
[19]冯红梅,秦永胜,李筱帆,等.高温纤维素降解菌群筛选及产酶特性[J].环境科学,2016,37(4): 1546-1552.Feng H M,Qin Y S,Li X F,et al.Screening and enzyme production characteristics of thermophilic cellulaseproducing strains [J].Environmental Science,2016,37(4):1546-1552.(in Chinese)
[20]刘霞,刘社兰,解奕瑞,等.基于 16S rRNA 基因和细菌基因组间重复序列的DNA指纹图谱技术对肝硬化大鼠肝移植后肠道菌群多样性的研究[J].中国微生态学杂志,2010,22(3):193-198.Liu X,Liu S L,Xie Y R,et al.Dynamics of intestinal bacterial diversity in liver transplant rat with hepatic cirrhosis by PCR-DGGE and rep-PCR[J]. Chinese Journal of Microecology,2010,22(3): 193-198.(in Chinese)
[21]刘佳妍,金莉莉,王秋雨.细菌基因组重复序列 PCR 技术及其应用[J].微生物学杂志,2006,26(3):90-93.Liu J Y,Jin L L,Wang Q Y.Repetitive-Element PCR of bacteria and its application[J].Journal of Microbiology,2006,26(3):90-93.(in Chinese)
[22]Gupta C,Dubey R,Maheshwari D.Plant growth enhancement and suppression of Macrophomina phaseolina causing charcoal rot of peanut by fluorescent Pseudomonas[J].Biology and Fertility of Soils,2002,35(6):399-405.
[23]闫小娟,李振轮,谢德体,等.钾细菌对钾长石胶体吸附特性的影响研究[J].西南大学学报:自然科学版,2017, (2):1-7.Yan X J,Li Z L,Xie D T,et al.Effect of potassium bacteria on the adsorption of potassium feldspar colloid[J].Journal of Southwest University (Natural Science Edition),2017,(2):1-7.(in Chinese)
[24]王淋,乌云塔娜,刘慧敏,等.杜仲 MVA 途径相关基因全长cDNA序列特征研究[J].中南林业科技大学学报(自然科学版),2014,34(1):94-102.Wang L,Wuyuntana,Liu H M,et al.Study on full length cDNA of MVA pathway related genes in Eucommia ulmoides[J]. Journal of Central South University of Forestry& Technology,2014,34(1):94-102.(in Chinese)
[25]Johansen J E,Binnerup S J.Contribution of Cytophaga-Like bacteria to the potential of turnover of carbon, nitrogen, and phosphorus by bacteria in the rhizosphere of barley (Hordeum vulgare L.)[J].Microbial Ecology, 2002,43(3):298-306.
[26]Mondal K K,Dureja P,Verma J P.Management of Xanthomonas camprestris pv. malvacearum-induced blight of cotton through phenolics of cotton rhizobacterium[J].Current Microbiology,2001,43(5):336.
[27]Bhattacharya S,Bachani P,Jain D,et al.Extraction of potassium from K-feldspar through potassium solubilization in the halophilic Acinetobacter soli (MTCC 5918) isolated from the experimental salt farm[J].International Journal of Mineral Processing,2016,152:53-57.
[28]杨绍周,吴毅歆,邵德林,等.鼓槌石斛内生细菌分离、鉴定及功能分析[J].中国农学通报,2014,30(25):171-176.Yang S Z,Wu Y X,Shao D L,et al.Isolation,identification and functional analyses of endophytic bacteria from Dendrobium chrysotoxum[J].Chinese Agricultural Science Bulletin,2014,30(25):171-176.(in Chinese)
[29]王珣珏,黄巧云,蔡鹏,等.解钾菌解钾效率检测方法的比较[J].华中农业大学学报,2016,35(1):81-85.Wang X Y,Huang Q Y,Cai P,et al.Comparing different methods of detecting potassium solubilizing efficiency with potassium solubilizing bacteria[J].Journal of Huazhong Agricultural University,2016,35(1):81-85.(in Chinese)
[30]Eisenstadt E.Potassium content during growth and sporulation in Bacillus subtilis[J].Journal of Bacteriology,1972,112(112):264-267.
Isolation and Identification of Potassium-Solubilizing Bacteria from Rhizosphere Soil of Apple Tree
JIANG Ji-hang1, PENG Xia-wei1, YAN Zhen-xin1, HE Bu-wei1, ZHU Chang-xiong2, GUO Hui1, GENG Bing2
(1.College of Biological Sciences and Biotechnology, Beijing Forestry University, Beijing 100083, China; 2.Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Science, Beijing 100081)
In order to detect the population properties and potassium-dissolving characteristics of potassium-dissolving bacteria existing in apple rhizosphere soil, the highly efficient potassium-dissolving bacterial isolates were gained from the rhizosphere soil of apple trees. 118 strains with the ability of potassium-dissolving were isolated with potassium feldspar as the sole potassium source, then the strains were clustered into 29 populations by analysis of repetitive-element PCR (rep-PCR) genomic DNA fingerprinting. Flame spectrophotometer was used to determine the potassium-dissolving capacity, and 5 highly efficient potassium-dissolving bacteria was obtained, whose average soluble potassium content of culture medium reached to 41.47mg·L-1. K105 performed the highest potassiumdissolving ability, and the available potassium increased by 23.09%. The available potassium increased after being digested by H2O2solution, the maximum was up to 31.22%. After identifying the isolated 5 strains of efficient potassium-dissolving bacteria by bacterial morphology, physiology and biochemical characteristics, and phylogenetic analysis based on 16S rRNA gene sequences, 5 strains were classified into 4 bacterial genera. K1 belongs to Acinetobacter sp., K98, K105 and K115 belong to Pseudomonas sp., and K168 belongs to Bacillus sp.. It provided basis for exploration of new efficient potassium-solubilizing bacteria, contributing to improve apple replanted soil and develop microbial fertilizer special for apple trees.
Potassium-solubilizing bacteria; Rep-PCR DNA fingerprinting; Isolation; Identification
10.3969/j.issn.1000-6362.2017.11.006
姜霁航,彭霞薇,颜振鑫,等.苹果树根际高效解钾菌的筛选及鉴定[J].中国农业气象,2017,38(11):738-748
2017-03-07**
。E-mail:guohuiya@126.com; gengbing@caas.cn
北京林业大学青年科技启动基金(BLX2014-25);流域农业面源污染防控整装技术与农业清洁流域示范(2015ZX07103-007)
姜霁航(1992-),硕士生,主要研究资源与环境微生物。E-mail:13121201177@163.com

