ELISA检测抗-HCV灰区、弱反应标本与FQ-PCR检测结果对比分析
邹宵萌
ELISA检测抗-HCV灰区、弱反应标本与FQ-PCR检测结果对比分析
邹宵萌
目的 探讨丙型肝炎病毒抗体(抗-HCV)酶联免疫吸附试验(ELISA)检测呈灰区、弱阳性样本采用荧光定量PCR(FQ-PCR)的复检情况。方法 选取2012年4月~2016年3月于本院手术和输血治疗的1 348例患者为研究对象,根据ELISA法抗-HCV检测结果将患者标本分为:A组:阴性(S/CO<0.3)240例;B组:灰区(0.7≤S/CO<1)902例;C组:弱反应性(1≤S/CO<3.8)206例,所有研究对象均采用FQ-PCR复检,比较两种方法检测结果。结果 B组灰区和C组弱反应性标本中,FQ-PCR复检分别有41例(4.54%)和172例(83.49%)HCV RNA浓度>1 000 IU/ml;ELISA检测抗-HCV双试剂灰区HCV RNA FQ-PCR阳性率高于单试剂灰区,差异有统计学意义(P<0.05);ELISA检测抗-HCV双试剂弱反应性HCV RNA FQ-PCR阳性率与单试剂弱反应性比较,差异无统计学意义(P>0.05)。结论 ELISA法检测抗-HCV为灰区、弱反应性标本存在一定的HCV RNA阳性标本漏检和误诊,采用FQ-PCR检测对于HCV感染早期诊断和治疗尤为重要。
ELISA 弱反应性 抗-HCV FQ-PCR
丙型肝炎是一种主要通过血液或血液制品、静脉吸毒等途径传播的感染性疾病,具有发病隐匿、症状不典型等特点,患者若诊断、治疗不及时,可引起肝脏慢性炎性坏死、肝硬化,部分感染者甚至会发展为肝细胞癌[1],严重威胁人们的健康。抗-HCV是目前临床诊断丙型肝炎的常用指标,主要采用酶联免疫吸附试验(ELISA),虽然ELISA法具有操作简便、快速、成本低廉、灵敏度和特异性较高等优势,但对于部分病毒变异、“窗口期”感染及免疫静默期感染,常造成漏检或误诊[2],并由此延误患者的治疗和医疗纠纷的发生。本文采用荧光定量PCR(FQ-PCR)对部分ELISA检测抗-HCV呈阴性、灰区、弱反应标本进行复检,并对比分析两种方法的检测结果,现报道如下。
对象与方法
1 对象 选取2012年4月~2016年3月于本院手术和输血治疗的1 348例患者为研究对象,依据ELISA检测抗-HCV结果将患者标本分为:A组:阴性(S/CO<0.3)240例;B组:灰区(0.7≤S/CO<1)902例,其中单试剂灰区710例,双试剂灰区192例;C组:弱反应性(1≤S/CO<3.8)标本206例,其中单试剂弱反应性72例,双试剂弱反应性134例。分离所有标本血清置–20℃以下冰箱冷冻保存备用。
2 方法 采用ELISA法对1 348例研究对象进行抗-HCV检测,对S/CO检测值介于0.7~3.8的标本进行同种试剂双孔复试,若结果为灰区或弱反应性,则进行FQ-PCR检测。ELISA检测试剂、质控物由北京万泰生物技术有限公司提供,抗-HCV质控物含量为2 NCU/ml,HCV RNA FQ-PCR检测试剂盒(检测限 1 000 IU/ml)由中山大学达安基因股份有限公司提供。检测试剂和质控物均在有效期内使用,严格按照试剂盒说明书及设备进行操作和判读结果。检测设备:TL988型实时荧光定量PCR仪(西安天隆科技有限公司提供),PHOTO全自动酶标仪(郑州安图生物工程有限公司提供)和ADA CLIA 400全自动洗板机(长沙普源医疗器械有限公司提供),检测设备均经过校准,且运行状态良好。
3 统计学处理 将所得数据应用SPSS17.0软件进行分析处理,计数资料以率(%)表示,组间比较采用χ2检验,P<0.05表示差异有统计学意义。
结 果
1 ELISA检测抗-HCV与FQ-PCR结果比较 A组240例标本中,HCV RNA FQ-PCR复检结果均呈阴性;B组和C组灰区和弱反应性标本中,FQ-PCR复检分别有41例(4.54%)和172例(83.49%)HCV RNA浓度>1 000 IU/ml,见表1。
2 ELISA检测抗-HCV不同灰区和弱反应性标本FQ-PCR检测结果 ELISA检测抗-HCV双试剂灰区标本的HCV RNA FQ-PCR阳性率高于单试剂灰区,差异有统计学意义(P<0.05);ELISA检测抗-HCV双试剂弱反应性标本的HCV RNA FQ-PCR阳性率与单试剂弱反应性比较,差异无统计学意义(P>0.05),见表2、3。

表1 ELISA呈灰区、弱反应性及阴性标本与FQ-PCR检测结果比较

表2 不同灰区标本HCV RNA FQ-PCR复检结果比较
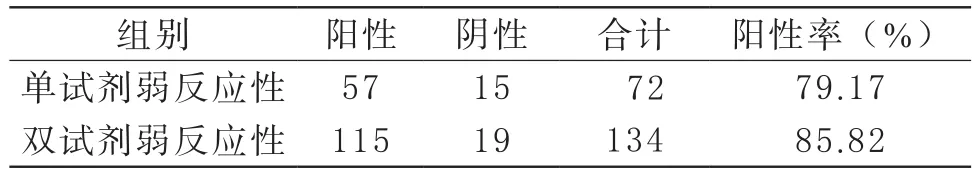
表3 不同弱反应性标本HCV RNA FQ-PCR检测结果比较
讨 论
丙型肝炎是一种严重威胁人类健康的感染性疾病,流行病学调查显示我国属丙型肝炎低流行区,人群抗-HCV阳性率为0.33%~0.53%,而河南地区1~75岁自然人群抗-HCV阳性率为0.64%,略高于全国平均水平[3]。目前抗-HCV检测是临床免疫初筛实验室诊断HCV感染的重要标志物,现今已广泛应用于采供血机构血液筛查和临床丙型肝炎患者诊断。ELISA法检测抗-HCV结果以S/CO<1判为无反应性,S/CO≥1判定为反应性,但由于ELISA检测方法的局限性及不同厂家试剂灵敏度、特异性差异,使得检测过程中一些处于临界值附近的标本常不能做出准确诊断[4],因此,如何快速、准确诊断HCV感染对患者治疗、预后及避免医疗纠纷尤为重要。
FQ-PCR是一种核酸定量检测技术,具有较高的灵敏度,可检出体内低水平HCV感染,且病毒突变株也可检测出,其结果可直接反映病毒传染性的强弱及复制水平。本文研究结果显示,在902例抗-HCV检测呈灰区标本中共检出41例(4.54%)HCV RNA浓度>1 000 IU/ml,表明ELISA法抗-HCV检测结果S/CO<1时,并不意味着可以完全排除HCV感染。陈显[5]等随机对部分HBsAg、抗-HCV、梅毒灰区标本进行核酸检测,均检出一定比例的阳性。目前研究认为,患者处于HCV感染窗口期或试剂盒灵敏度不够、HCV变异株感染及机体免疫功能低下时,不能产生相应的免疫应答或产生低水平的免疫应答等均可造成抗-HCV漏检[6]。理论上FQ-PCR可检出1拷贝HCV RNA,但受到实验室条件、人员技术、试剂质量、标本及核酸提取方法等因素的影响,往往很难做到这一点。近年来,因输血引起的丙型肝炎、艾滋病等感染性疾病的传播和由此导致的医疗纠纷时有发生并屡见报端[7],严重威胁患者的健康安全,因此对这部分处于灰区的标本进行核酸检测显得尤为重要。
在本文ELISA检测抗-HCV呈弱反应性的(1≤S/CO<3.8)206例标本中,有172例检出HCV RNA,34例未检出HCV RNA。抗-HCV呈反应性提示患者可能存在HCV感染,但往往不能区分是现症感染或既往感染,而检出HCV RNA是确定患者现症感染的特异性指标。ELISA法检测抗-HCV的基本原理为抗原抗体的特异性反应,研究显示,类风湿因子、高浓度非特异性免疫球蛋白、补体,某些自身抗体、异嗜性抗体、交叉反应物质等内源性感染因素,以及标本溶血、标本储存时间较长、细菌污染等外源性因素均可干扰酶免疫测定而导致假阳性结果[8、9]。而这部分原本HCV感染呈阴性患者的误诊,常带来很大的负面负担,并给患者的升学、招工等带来很大的影响,且给医疗纠纷留下隐患。
综上所述,对临床酶联免疫初筛实验室ELISA法检测抗-HCV结果处于灰区、弱反应样本,尤其当检测结果对患者的招工、升学等产生直接影响时,应进行HCV RNA PCR检测,以确定其是否真正感染HCV和降低漏诊、误诊率,同时也有利于患者的早期诊断、治疗和避免医疗纠纷的发生。
1 杨平,毕永春,胡伟,等.丙型肝炎病毒抗体联合核酸定量检测对丙型肝炎患者的早期诊断价值研究[J].检验医学与临床,2014,11(8):1020-1023.
2 方建华,王艺芳,李建斌.一例抗-HCV阴性、HCV RNA阳性献血者的追踪随访[J].中国输血杂志,2015,28(1):83-85.
3 孙国清,刘春华,樊盼英,等.河南省丙型肝炎流行病学分析[J].中国公共卫生,2016,32(1):25-27.
4 卢香云,程江,包建玲,等.ELISA法检测丙型肝炎病毒抗体最佳临界值及其可疑区间[J].现代预防医学,2015,42(10):1841-1844.
5 陈显,胡文佳,黄成垠,等.献血者ELISA检测为灰区标本的确认试验与核酸检测情况分析[J].中国输血杂志,2015,28(2):198-199.
6 周学勇,程卫芳,张浩,等.不同试剂对献血者HCV感染性标志物的检测情况比较[J].临床输血与检验,2015,17(4):317-319.
7 徐光勇,时培荣,鹿文静.典型经输血感染HIV1例[J].中国艾滋病性病,2014,20(8):608.
8 彭吉芳.丙型肝炎病毒检测假阳性1例[J].临床输血与检验,2014,16(2):217-218.
9 李金明.感染性疾病血清学检验中应重视对弱反应性标本的确认[J].中华检验医学杂志,2006,29(7):577-580.
Objective To Use the fluorescence quantitative PCR (FQ-PCR) for confirming antibodies against hepatitis C surface antigen(anti-HCV)that had been tested by enzyme linked immunoassay(ELISA). Methods 1 348 patients who had experienced blood transfusion and operation were collected from April 2012 to March 2016.The patients were divided into three groups,group A included 240 samples with negative anti-HCV detected by ELISA (S/CO<0.3);group B covered 902 samples with anti-HCV on cutoff value (0.7≤S/CO<1); and group C included 206 samples with weak reaction of anti-HCV detected by ELISA. Results Among groups B and C,41(4.54%)and 172(83.49%) samples were found to have HCV RNA level>1 000 IU/ml rechecked by FQ-PCR. FQ-PCR demonstrated a high positive rate in the samples on the cutoff value tested by ELISA double reagents(P<0.05); while no difference was noted between the samples with weak reaction of HCV RNA when tested with ELISA and FQ-PCR(P>0.05). Conclusion The false negative and misdiagnosis rate of ELISA is high in the samples near HCV cutoff value and in weak reaction,suggestingthat FQ-PCR is useful for early diagnose of HCV patients.
ELISA Weak reactive Anti-HCV FQ-PCR
R446.11 R512.6+3
A
1671-2587(2017)05-0505-03
A Compararison of ELI SA w ith FQ-PCR for Detection of A nti-HCV Antibodies in th e Samples Near Critical
Value ZOU Xiao-meng.Department of Blood Transfusion,Nanyang Nanshi Hospital,Nanyang,473000
10.3969/j.issn.1671-2587.2017.05.029
473000 河南省南阳市南石医院输血科
邹宵萌(1971–),女,河南南阳人,主管技师,主要从事临床输血和检验工作,(Tel)13838619609(E-mail)3266628713@qq.com。
2017-02-18)
(本文编辑:王敏)

