小分子有机物对自养型氧化硫硫杆菌与异养型胶红酵母菌共培养的影响
杨期勇,杨文锋,朱琼,张庆芳,刘艺奇,唐梅,谭婵娟
1. 九江学院鄱阳湖生态经济研究中心,江西 九江 332005;2. 兰州理工大学石油化工学院,甘肃 兰州 730050;3. 九江学院化学与环境工程学院,江西 九江 332005;4. 九江市流域管理与生态保护重点实验室(九江学院),江西 九江 332005
小分子有机物对自养型氧化硫硫杆菌与异养型胶红酵母菌共培养的影响
杨期勇1,3,4*,杨文锋2,3,朱琼3,张庆芳2,刘艺奇3,唐梅3,谭婵娟3
1. 九江学院鄱阳湖生态经济研究中心,江西 九江 332005;2. 兰州理工大学石油化工学院,甘肃 兰州 730050;3. 九江学院化学与环境工程学院,江西 九江 332005;4. 九江市流域管理与生态保护重点实验室(九江学院),江西 九江 332005
在污泥生物淋滤过程中起主要作用的微生物是嗜酸性氧化硫硫杆菌(Acidithiobacillus thiooxidans),污泥中大量的可溶性小分子有机物对氧化硫硫杆菌的生长有抑制作用,而异养型胶红酵母菌(Rhodotorula mucilaginosa)对这些小分子有机物具有吸收和降解作用。通过研究小分子有机物对自养型氧化硫硫杆菌与异养型胶红酵母共培养的影响,探寻能加快生物淋滤进程,缩短生物淋滤周期的方法。采用复合菌体系(氧化硫硫杆菌和胶红酵母菌)和单菌体系(氧化硫硫杆菌)的比较实验,探讨了乙酸、丙酸、柠檬酸、草酸和腐殖酸5种小分子有机物对自养型氧化硫硫杆菌和异养型胶红酵母菌共培养的影响。结果表明:乙酸、丙酸、柠檬酸、草酸和腐殖酸5种小分子有机物对氧化硫硫杆菌的生长及氧化产酸能力均有一定的抑制作用,其抑制作用大小顺序为乙酸>丙酸>腐殖酸>草酸>柠檬酸,但实验后期抑制作用都有所消减;在实验前期复合菌体系的氧化硫硫杆菌氧化产酸能力均好于单菌体系,而在实验后期,复合菌体系与单菌体系变化差距逐渐缩小;有机物的分子量越小,对氧化硫硫杆菌的影响越大,胶红酵母菌消除有机物对氧化硫硫杆菌的抑制作用越明显。因此,胶红酵母菌与氧化硫硫杆菌的共培养在一定程度上能有效加快生物淋滤进程,缩短淋滤周期,提高淋滤效率,在污泥生物淋滤技术中有着良好的应用前景。
生物淋滤;氧化硫硫杆菌;胶红酵母菌;小分子有机物;共培养
污泥中含有大量的重金属和未分解的有机物等污染物质,是阻碍污泥资源化利用的重要因素。起源于微生物湿法冶金的生物淋滤技术,逐渐被众多的学者应用于污泥中重金属的溶出与回收,成为污泥重金属污染控制技术的研究热点(Bosecker,1997;Renoux et al.,2001;Pathak et al.,2009;Fontmorin et al.,2015;Chen et al.,2016)。在污泥生物淋滤过程中起产酸作用的优势微生物是嗜酸性硫杆菌,而污泥中含有大量的可溶性小分子有机物、未分解的大分子有机物以及细菌的代谢产物,其中水溶性小分子有机物对嗜酸性硫杆菌生长具有抑制作用(初立恩等,1981;Flournier et al.,1998;Gu et al.,2004;Ren et al.,2009),这种抑制作用对生物淋滤法在污泥处理中的应用产生了一定的影响(华玉妹等,2006;鲁顺保等,2012)。为消除这一不利影响,优化硫杆菌的生长条件,众多的学者进行了大量的研究。早在20世纪80年代,颜望明等(1980)就开展了氧化硫硫杆菌(Acidithiobacillus thiooxidans)与真菌(红酵母、青霉、曲霉)混合培养的研究,发现混合培养可以促进氧化硫硫杆菌的生长,缩短了停滞期,加速了硫的氧化。Harrison(1984)从煤矿酸性废水中分离的Acidiphilum cryptum与无机化能菌共同培养时,可以利用无机化能菌分泌的有机物,消除其抑制作用。王世梅等(2006)研究发现硫杆菌与耐酸性红酵母菌混合培养后进行生物淋滤,可以有效缩短淋滤时间,提高重金属去除率。Zhou et al.(2013)将嗜酸性硫杆菌与真菌(Galactomyces sp. Z3)混合培养,发现Galactomyces sp. Z3可以有效降解乙酸、丙酸等小分子有机酸,淋滤时间比单独用嗜酸性硫杆菌进行淋滤缩短了4.5 d。谭险夷等(2014)在生物淋滤处理底泥重金属的过程中利用丝状菌消除低分子有机酸的有害影响,简化了处理工艺,节约了处理成本。
综上所述,耐酸性异养菌可以与嗜酸性硫杆菌共培养,能加快硫杆菌对重金属的浸出率,为提高污泥的生物淋滤效率提供了新思路。基于此,我们在前期筛选分离出嗜酸性氧化硫硫杆菌JJU-1菌株的基础上(杨期勇等,2015),进一步分离出一株耐酸性胶红酵母菌(Rhodotorula mucilaginosa)JJU-3菌株(邱秀文等,2017),将耐酸性胶红酵母菌与嗜酸性氧化硫硫杆菌混合培养,观察氧化硫硫杆菌在小分子有机物和耐酸性胶红酵母存在条件下的生长情况和氧化产酸能力,从而为氧化硫硫杆菌与胶红酵母菌协同去除污泥中重金属的研究提供基础和工艺参考。
1 材料与方法
1.1 供试菌种
本实验所用的嗜酸性氧化硫硫杆菌、耐酸性胶红酵母菌均由本实验室从污水污泥中筛选、分离、鉴定得到。
1.2 培养基
Waksman液体培养基:(NH4)2SO4:0.20 g,K2HPO4∙3H2O:3.93 g,MgSO4∙7H2O:0.50 g,CaCl2:0.19 g,溶于1000 mL蒸馏水,用5 mol∙L-1H2SO4调节pH为3.5~4.0。
BS solution 基础培养基:(NH4)2SO42.5 g∙L-1、KCl 0.1 g∙L-1、K2HPO41 g∙L-1、Ca(NO3)20.2 g∙L-1、MgSO4∙7H2O 1 g∙L-1,用硫酸调 pH 值至 4.0。
1.3 分析测试
pH值和氧化还原电位(ORP):玻璃电极法,采用ORP-431型氧化还原电位测定仪测定。
化学需氧量(CODcr):微波消解法。菌液用0.22 μm滤膜过滤,滤液即为CODcr待测液,采用美国哈希(HACH)公司生产的CODcr消解-比色管封闭回流消解水样及 DR890比色计进行测定:HACH CODcr消解-比色管(10 mL),HACHDRB200 CODcr加热器;HACH DR1010便携式分光光度计。
SO42-:铬酸钡分光光度法。根据国家标准《HJ/T 342—2007》进行测定。
1.4 胶红酵母菌对小分子有机物的降解实验
实验药品:甲酸、乙酸、丙酸、甲醇、柠檬酸均为化学纯(上海国药集团化学试剂有限公司),腐殖酸为化学纯(天津市光复精细化工研究所)。
本实验所用腐殖酸溶液的配制:称取1 g腐殖质,用10 mL 0.1 mol·L-1的NaOH碱溶,搅拌混匀,再用定性滤纸过滤,收集滤液加入盐酸调至酸性,用0.22 μm针筒过滤,所得溶液即为腐殖酸溶液。
配制4.2 L BS solution基础培养基,分装至12个500 mL锥形瓶中,然后将12个锥形瓶分为两组(实验组和对照组),分别依次加入0.2 mL甲酸、0.2 mL乙酸、0.2 mL丙酸、0.5 mL甲醇、0.4 g柠檬酸和2 mL腐殖酸溶液,用无菌透气封口膜密封包扎好后在105 ℃下蒸汽灭菌30 min。实验组接种20 mL胶红酵母菌菌液,对照组不接种胶红酵母菌。然后置于恒温摇床中培养,摇床参数设置为 180 r∙min-1、30 ℃。每个样品做3个平行样,每天取1次样,取样时先用0.22 μm针筒过滤菌液,所得滤液进行各项目分析测定。
1.5 氧化硫硫杆菌与胶红酵母菌的共培养
配制3.5 L Waksman培养基,分装至10个500 mL锥形瓶中,并加入2 g硫粉,然后将10个锥形瓶分为两组(复合菌和单菌),分别依次加入0.2 mL乙酸、0.2 mL丙酸、0.2 g柠檬酸、0.2 g草酸和1 mL腐殖酸,调pH值至3左右,用无菌透气封口膜密封包扎好后在105 ℃下蒸汽灭菌30 min。冷却后,在复合菌组锥形瓶中接种 10 mL胶红酵母菌菌液(OD600为1.0)和30 mL氧化硫硫杆菌菌液(OD600为0.2),单菌组锥形瓶中只接种30 mL氧化硫硫杆菌菌液(OD600为0.2)。然后置于恒温摇床中培养,摇床参数设置为180 r∙min-1、30 ℃。每个样品做3个平行样,每天取1次样,取样时先用0.22 μm针筒过滤菌液,所得滤液进行各项目分析测定。
2 结果与讨论
2.1 胶红酵母对小分子有机物的降解
2.1.1 胶红酵母菌的生长曲线
本文用 OD600值来表征胶红酵母菌的浓度大小,OD600值越大表明菌液中胶红酵母菌数量越大,胶红酵母菌生长越好。由图1可知,乙酸、丙酸、柠檬酸环境下,胶红酵母菌生长情况良好,OD600值最高分别达到 0.8、0.9和 1.1;甲酸环境下,胶红酵母菌活性较差,OD600值最高达到0.2;腐殖酸环境下,胶红酵母菌生长缓慢,OD600值最高仅为0.4;甲醇环境下,胶红酵母菌生长完全受到抑制。对照组为不加胶红酵母菌,OD600值基本不变化。
2.1.2 胶红酵母菌培养液pH值和CODcr值的变化
由图2和图3可知,柠檬酸环境下pH值5 d内由最初的3.55升高至7.35,前2天上升速率最快;CODcr值 5 d内由最初的 975 mg∙L-1降至 316 mg∙L-1,胶红酵母菌对柠檬酸的去除率达到了 67%左右。乙酸环境下pH值5 d内由最初的4.53升高至7.14,前2 天上升速率最快;CODcr值5 d内由最初的 883 mg∙L-1下降至 252 mg∙L-1,胶红酵母菌对乙酸的去除率达到了 71%左右。丙酸环境下 pH值5 d内由最初的4.64升高至7.14,前2天上升速率最快;CODcr值5 d内由最初的1076 mg∙L-1下降至269 mg∙L-1,胶红酵母菌对丙酸的去除率达到了75%左右。甲酸与甲醇环境下,pH值、CODcr值均无明显变化。腐殖酸环境下pH值由最初的6.36升高至7.22,CODcr值由最初的275 mg∙L-1下降至220 mg∙L-1,CODcr值变化不大。
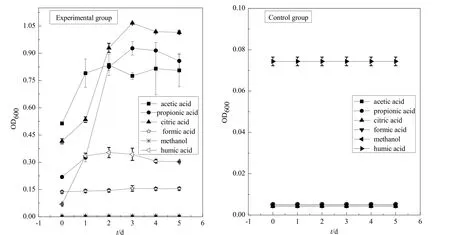
图1 胶红酵母菌的生长曲线Fig. 1 Growth curve of Rhodotorula mucilaginosa
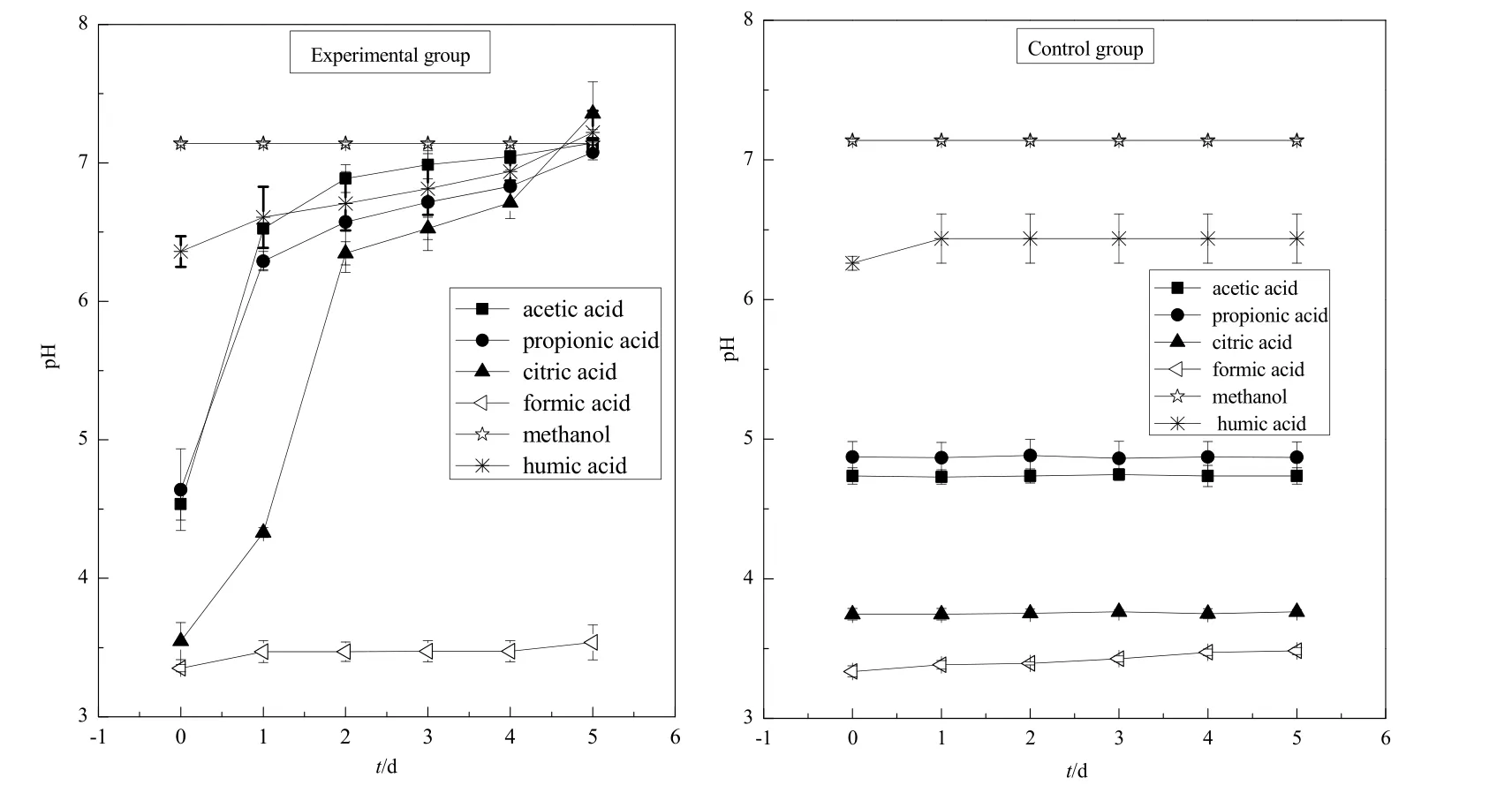
图2 胶红酵母菌培养液pH值变化Fig. 2 Variation of pH in the culture medium of Rhodotorula mucilaginosa
实验结果说明,胶红酵母菌对柠檬酸、乙酸和丙酸这 3种小分子有机酸有良好的吸收和降解能力;而碳链较短的甲酸对胶红酵母菌的生长具有明显的抑制作用;醇类有机物毒性较大,明显抑制了胶红酵母菌的生长;胶红酵母菌对腐殖酸有一定的吸收和降解效果,但效果不及柠檬酸、乙酸和丙酸。
2.2 小分子有机物对氧化硫硫杆菌和胶红酵母菌共培养的影响
2.2.1 共培养体系OD600值的变化
通过复合菌体系(氧化硫硫杆菌和胶红酵母菌)和单菌体系(氧化硫硫杆菌)的污泥生物淋滤比较实验,可以较好地了解胶红酵母菌和氧化硫硫杆菌的协同共生关系。由图4可知,复合菌在有机小分子有机物存在的环境下吸光值均呈先升高后下降的趋势。在复合菌体系中,乙酸、丙酸、柠檬酸环境下复合菌在第2天进入快速增长期;草酸与腐殖酸环境下复合菌在第1天即进入快速增长期,吸光值达到 0.7,随后逐渐降低。在单菌体系中,乙酸、丙酸环境下硫杆菌基本不生长,而柠檬酸、草酸和腐殖酸环境下硫杆菌生长缓慢。5种小分子有机物环境下的单菌体系中硫杆菌的生长情况说明了乙酸与丙酸对硫杆菌的抑制作用较为明显,柠檬酸、草酸和腐殖酸对硫杆菌的抑制作用较弱,这与鲁顺保等(2012)的研究结果一致。
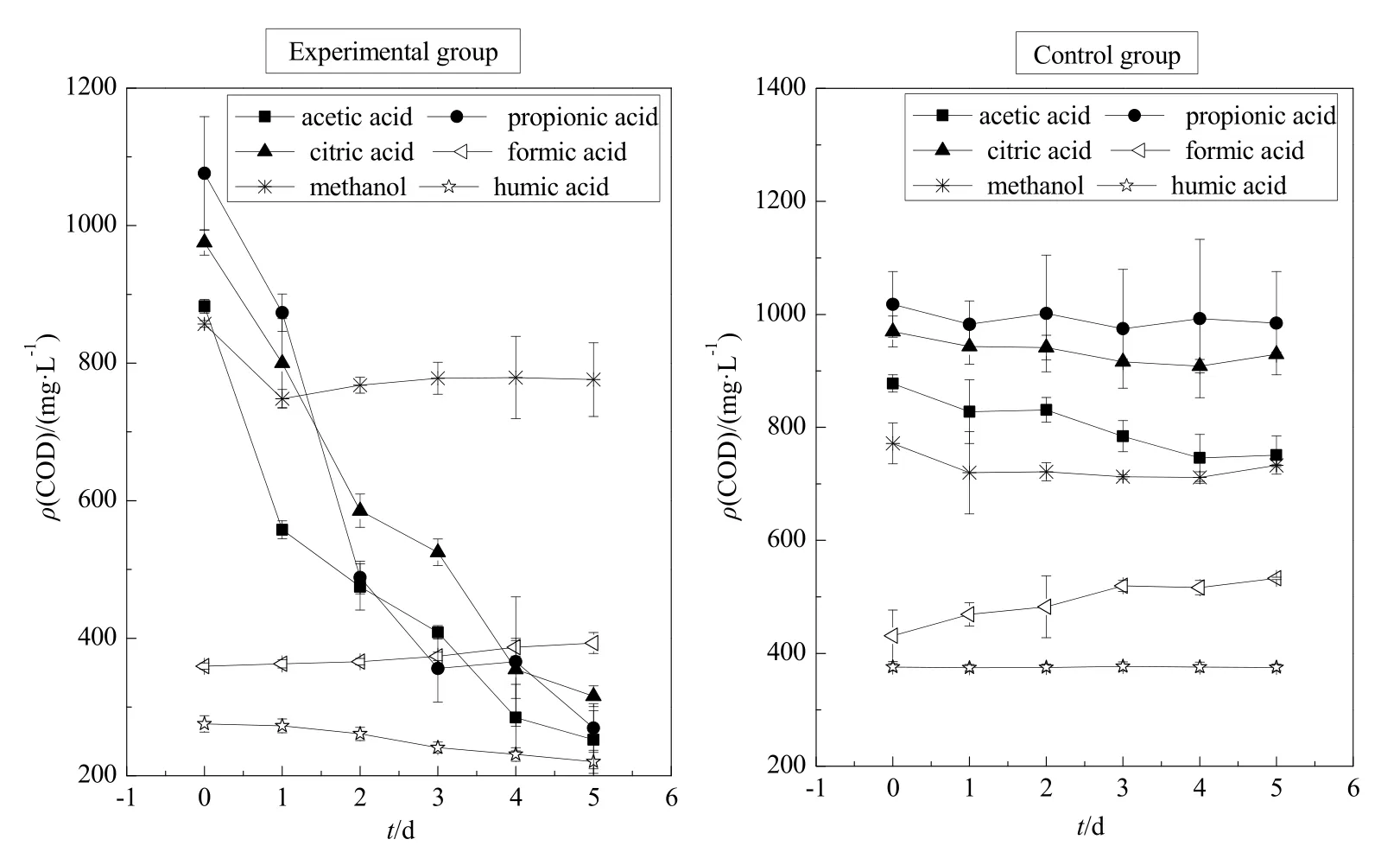
图3 胶红酵母菌培养液CODcr值变化Fig. 3 Variation of CODcr in the culture medium of Rhodotorula mucilaginosa
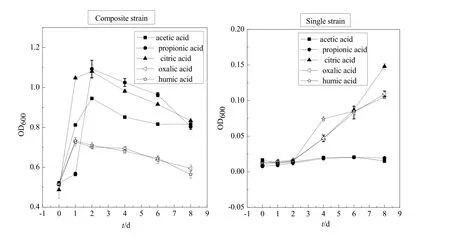
图4 共培养体系OD600值的变化Fig. 4 Variation of OD600 in the co-culture of Acidithiobacillus thiooxidans and Rhodotorula mucilaginosa
2.2.2 共培养体系pH和ORP的变化情况
由图5可知,体系pH值的动态变化可以反映硫杆菌的生长活性情况,ORP值上升是生物淋滤反应中硫杆菌大量繁殖的标志(Lazaroff et al.,1982)。本文比较了乙酸、丙酸、柠檬酸、草酸、腐殖酸对复合菌体系和单菌体系中pH和ORP的影响。
乙酸环境下,复合菌体系pH值8 d内从初始2.76~2.44;而单菌体系pH值变化不明显。复合菌体系ORP为上升趋势,8 d内从最初227 mV升高至 245 mV,而单菌体系基本不变。丙酸环境下,复合菌体系pH值4 d内由2.77迅速降至2.45,然后pH不再变化;而单菌体系pH值由2.70下降至2.62,单菌体系下降速率明显小于复合菌培养体系。复合菌体系ORP值4 d内从226 mV升高至244 mV,随后ORP值一直维持不变;而单菌体系ORP值由232 mV缓慢升高至237 mV。柠檬酸环境下,复合菌体系pH值4 d内由2.75降至2.13,而单菌体系pH值4 d内由2.7降至2.16,前4 天复合菌体系pH值下降速率略大于单菌体系;后4 天复合菌体系pH值降至2,单菌体系pH降至1.47,此阶段复合菌体系pH值下降速率小于单菌体系。两组体系ORP值变化规律与pH值基本相同。草酸环境下,复合菌体系和单菌体系pH值和ORP变化规律基本相同。腐殖酸环境下,复合菌体系前2 天pH值下降速度大于单菌体系,随后下降速率小于单菌体系,到第8天单菌体系pH下降到1.64,小于复合菌体系的1.91;而ORP前2天复合菌体系上升速率大于单菌体系,随后小于单菌体系。
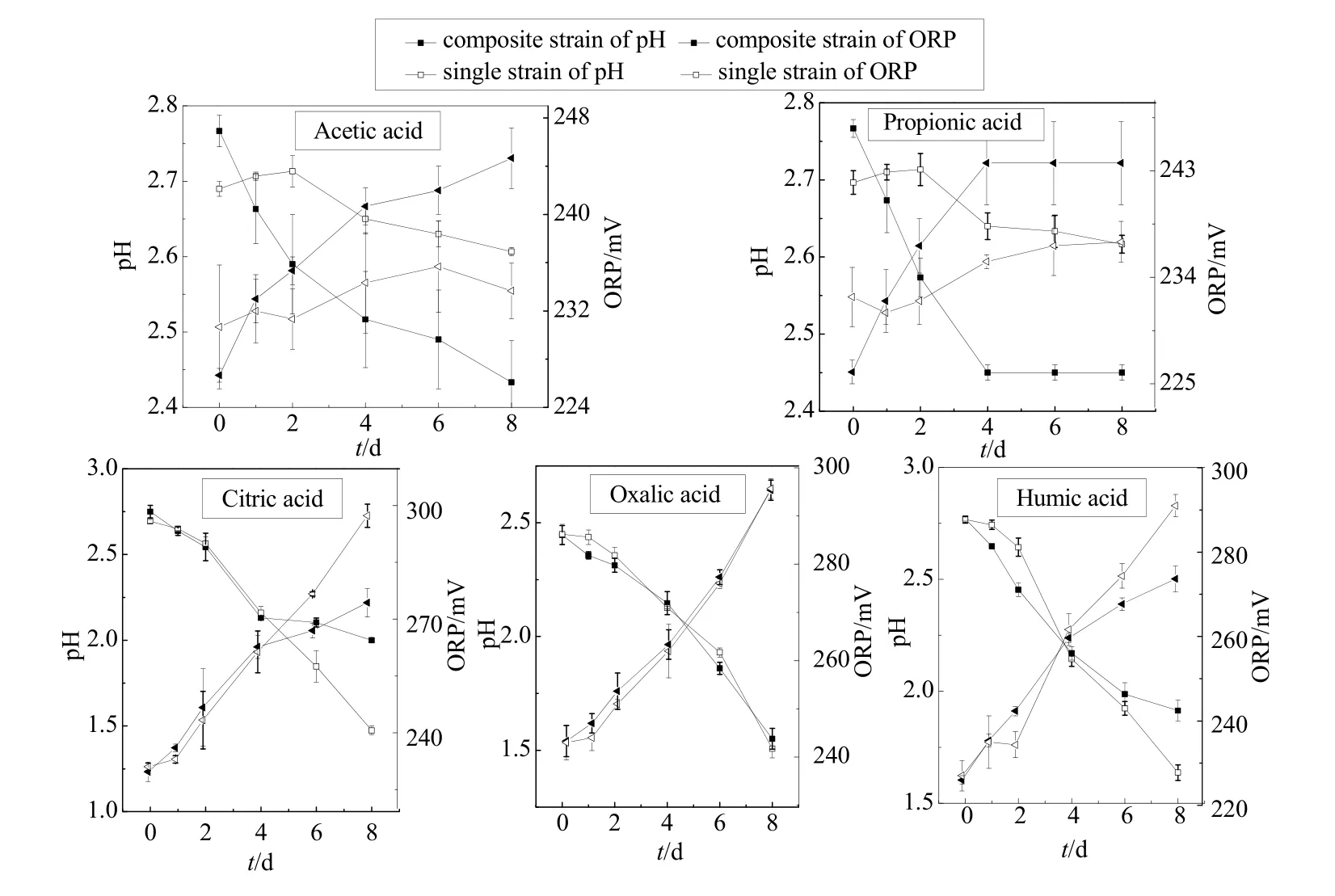
图5 共培养体系pH和ORP的变化情况Fig. 5 Variation of pH and ORP in the co-culture of Acidithiobacillus thiooxidans and Rhodotorula mucilaginosa
实验结果表明,在乙酸和丙酸环境下,复合菌体系的氧化产酸效率均高于单菌体系,乙酸和丙酸在实验前期对氧化硫硫杆菌的氧化产酸能力有一定的抑制作用,也说明了复合菌体系中胶红酵母菌在实验前期可以消除乙酸和丙酸对氧化硫硫杆菌的毒害作用,加快硫杆菌氧化及产酸能力,缩短生物淋滤周期。而柠檬酸、草酸和腐殖酸对氧化硫硫杆菌的氧化产酸能力抑制作用较小,在实验前期对氧化硫硫杆菌有一定的抑制作用,复合菌体系中的胶红酵母菌可以吸收降解掉一部分柠檬酸、草酸和腐殖酸,一定程度上消除其对硫杆菌的毒害作用;但在后期对氧化硫硫杆菌没有影响。
比较5种小分子对单菌与复合菌体系的影响,发现乙酸、丙酸对氧化硫硫杆菌的生长抑制作用最为明显,腐殖酸次之,柠檬酸与草酸抑制作用最小,有机物的分子量越小对氧化硫硫杆菌的影响越大,胶红酵母菌消除有机物对氧化硫硫杆菌的抑制作用越明显。因此,复合菌体系中柠檬酸与草酸环境下的硫杆菌氧化产酸能力强于乙酸、丙酸与腐殖酸体系,随着体系pH值不断降低,胶红酵母菌的生长活性受到影响,对小分子有机物的降解能力也受到限制,逐渐不及乙酸、丙酸与腐殖酸体系。
2.2.3 共培养体系的CODcr变化情况
化学需氧量可以直观地反映培养基中小分子有机物含量的变化情况,间接反映胶红酵母菌对小分子有机物的吸收、降解情况。由图6可知,在实验前期,复合菌体系CODcr值均有明显的下降,实验后期下降速率有所减缓;而对照组单菌体系CODcr值基本维持在某一水平波动。乙酸环境下的复合菌体系CODcr值在前2 天有明显的下降,由最初的1586 mg∙L-1迅速下降至618 mg∙L-1,2 d 后下降趋势变缓,8 d下降至526 mg∙L-1;丙酸环境下的复合菌体系CODcr值在前4 天有明显的下降,由最初的1621 mg∙L-1下降至519 mg∙L-1,后4天基本维持在500 mg∙L-1左右;柠檬酸环境下复合菌体系 CODcr值8 d 内由初始的1643 mg∙L-1下降至446 mg∙L-1,前4天下降速率最快,后4 天基本不再变化;草酸环境下复合菌体系 CODcr值前4天由初始的1420 mg∙L-1迅速下降至483 mg∙L-1,后4天基本维持在400~500 mg∙L-1之间;腐殖酸环境下复合菌体系CODcr值前4天由初始的1069 mg∙L-1迅速下降至444 mg∙L-1,后4天基本维持在400 mg∙L-1左右。
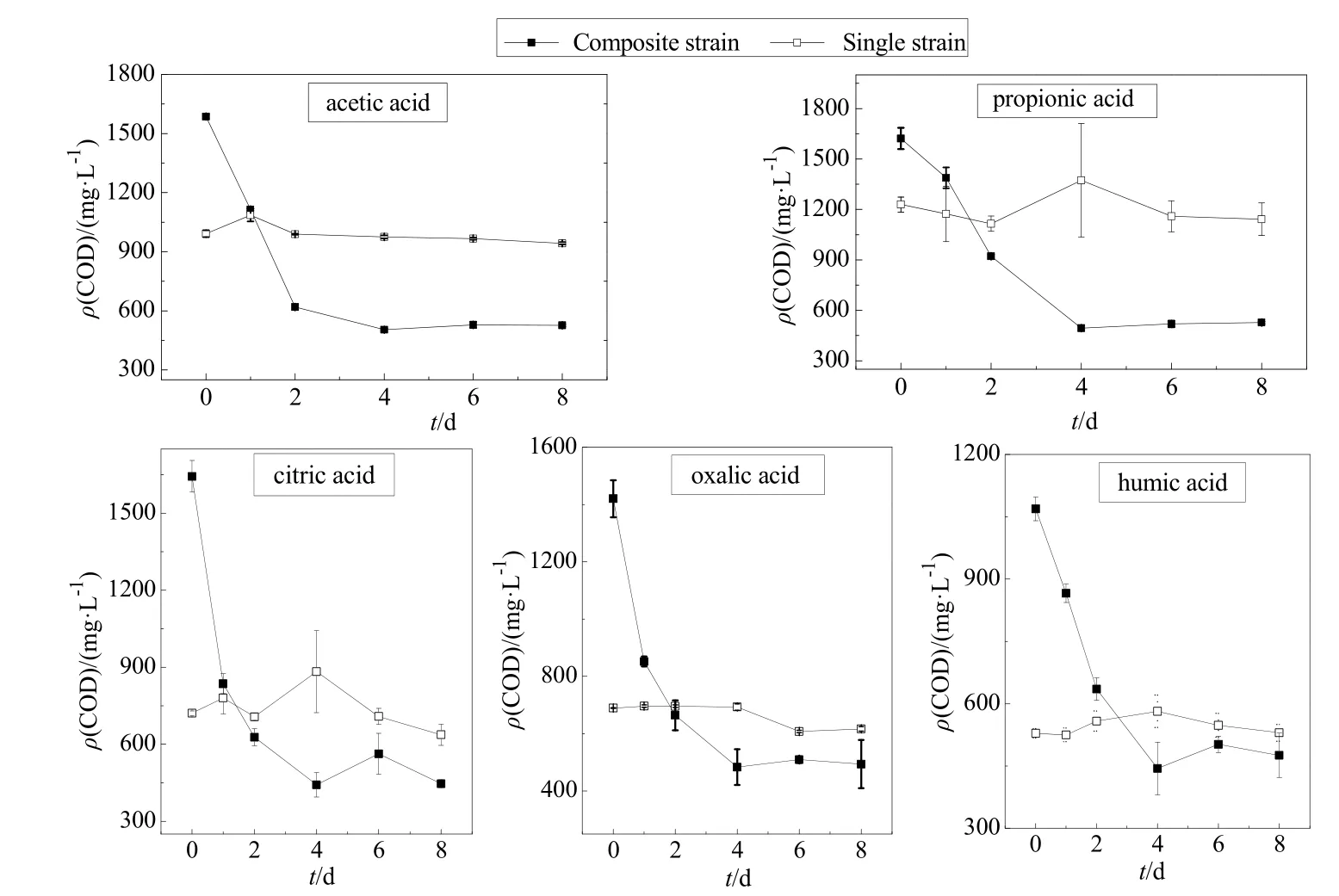
图6 共培养体系CODcr变化Fig. 6 Variation of CODcr in the co-culture of Acidithiobacillus thiooxidans and Rhodotorula mucilaginosa
在实验前期,复合菌体系CODcr值的下降说明胶红酵母菌对这5种小分子有机物都具有良好的吸收、降解能力;而到了实验后期,随着体系pH值的下降,胶红酵母菌的活性受到了一定程度的抑制,胶红酵母菌对小分子有机物的吸收、降解速率明显变缓。
2.2.4 共培养体系SO42-变化
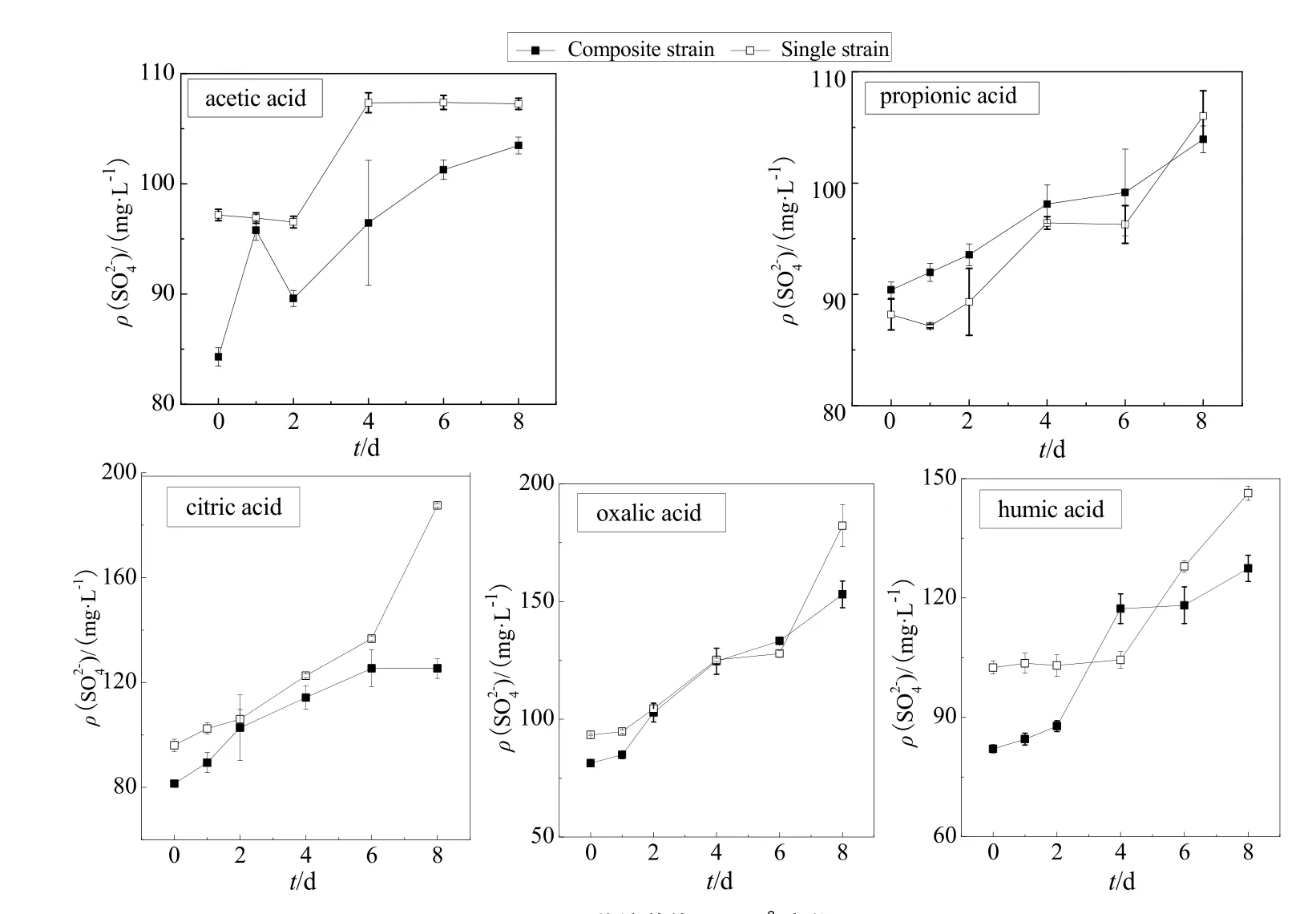
图7 共培养体系变化Fig. 7 Variation of SO42- in the co-culture of Acidithiobacillus thiooxidans and Rhodotorula mucilaginosa
SO42-浓度变化可直观地反映出氧化硫硫杆菌硫氧化速率。由图7可知,乙酸环境下,复合菌体系质量浓度由 84.30 mg∙L-1上升到 103.47 mg∙L-1;而单菌体系质量浓度由 97.17 mg∙L-1升高至107.25 mg∙L-1,复合菌体系总的硫氧化率大于单菌体系。丙酸环境下,前2 天复合菌体系硫氧化率大于单菌体系,复合菌体质量浓度2 d内由最初的 90.40 mg∙L-1升高至 93.55 mg∙L-1,单菌体系质量浓度一直维持在89 mg∙L-1左右;后6 天复合菌体系硫氧化速率基本与单菌体系相同。柠檬酸和草酸环境下,前6 天两个体系的硫氧化率基本一致,到第6天后,单菌体系质量浓度升高较快,硫氧化率大于复合菌体系。腐殖酸环境下,前4 天复合菌硫氧化率大于单菌培养体系,复合菌体系-质量浓度4 d内由最初的82.07 mg∙L-1上升到117.29 mg∙L-1,单菌培养体系质量浓度前4 天一直在102 mg∙L-1左右波动;后4 d复合菌体系质量浓度升高至 127.44 mg∙L-1,单菌体系质量浓度升高至146.32 mg∙L-1,复合菌体系硫氧化速率小于单菌体系。
在实验前期,复合菌体系中的胶红酵母菌可以迅速地吸收、降解一部分小分子有机物,促进硫杆菌的生长,加快了硫杆菌氧化硫粉的速率,所以复合菌体系硫氧化速率大于单菌体系;在实验后期,当酸性达到一定程度时,胶红酵母菌逐渐衰亡,未被降解的有机小分子对硫杆菌生长产生抑制作用,硫杆菌的氧化产酸速率减缓,复合菌体系与单菌体系变化差距逐渐缩小,部分单菌体系的硫氧化速率甚至高于复合菌体系。
3 结论
(1)乙酸、丙酸、柠檬酸、草酸和腐殖酸5种小分子有机物对氧化硫硫杆菌的生长及氧化产酸能力均有一定的抑制作用,抑制作用大小顺序为:乙酸>丙酸>腐殖酸>草酸>柠檬酸,但实验后期抑制作用都有所消减。
(2)在实验前期,胶红酵母菌可利用小分子有机物很好地生长,消除小分子有机物对自养型氧化硫硫杆菌的毒害作用,促进硫杆菌的生长及加快氧化产酸能力;在实验后期,当环境pH达到临界点时,耐酸性胶红酵母菌会逐渐衰亡,剩余未降解掉的小分子有机物对硫杆菌仍有一定的抑制作用,复合菌体系与单菌培养体系变化差距逐渐缩小。
(3)由于草酸与柠檬酸对硫杆菌的抑制作用不如乙酸、丙酸和腐殖酸,草酸与柠檬酸环境下的复合菌体系中硫杆菌的硫氧化产酸效率要高于乙酸、丙酸和腐殖酸,但胶红酵母菌对小分子有机物的降解效果不及乙酸、丙酸和腐殖酸。有机物的分子量越小,对氧化硫硫杆菌的影响越大,胶红酵母菌消除有机物对氧化硫硫杆菌的抑制作用越明显。
(4)氧化硫硫杆菌与胶红酵母菌的协同作用在一定范围内能加快污泥的生物淋滤进程,缩短淋滤时间。对于实验后期耐酸性胶红酵母菌的衰亡,可以定期在生物淋滤系统中投加一定量的耐酸性胶红酵母菌,以提高淋滤效率。
BOSECKER K. 1997. Biolaching: metal solubilization by microorganisms[J]. FEMS Microbiology Reviews, 20(3-4): 591-604.
CHEN Z H, HU M, CUI B H, et al. 2016. The effect of bioleaching on sewage sludge pyrolysis [J]. Waste Management, 48: 383-388.
FLOURNIER D, LEMIEUX R, COUILLARD D. 1998. Essential interactions between Thiobacillus Ferrooxidans and heterotrophic microorganisms during a wastewater sludge bioleaching process [J].Environmental Pollution, 101(2): 303-309.
FONTMORIN J M, SILLANPÄÄ M. 2015. Bioleaching and combined bioleaching Fenton-like processes for the treatment of urban anaerobically digested sludge Removal of heavy metals and improvement of the sludge dewaterability [J]. Separation and Purification Technology, 156(Part 2): 655-664.
GU X Y, WONG J W C. 2004. Identification of inhibitory substances affecting bioleaching of heavy metals from anaerobically digested sewage sludge [J]. Environmental Science and Technology, 38(10):2934-2939.
HARRISON A P. 1984. The Acidophilic Thiobacilli and other acidophilic bacteria that share their habitat [J]. Annual Review of Microbiology,38: 265-292.
LAZAROFF N, SIGAL W, WASSERMAN A. 1982. Iron oxidation and precipitation of ferric hydroxyl sulfates by resting Thiobacillus Ferrooxidans cells [J]. Applied and Environmental Microbiology,43(4): 924-938.
PATHAK A, DASTIDAR M G, SREEKRISHNAN T R. 2009. Bioleaching of heavy metals from sewage sludge: A review [J]. Journal of Environmental Management, 90(8): 2343-2353.
REN W X, LI P J, ZHENG L, et al. 2009. Effects of dissolved low molecular weight organic acids on oxidation of ferrous iron by Acidithiobacillus Ferrooxidans [J]. Journal of Hazardous Materials,162(1): 17-22.
RENOUX A Y,TYAGI R D,SAMSON R. 2001. Assessment of toxicity reduction after metal removal in bioleached sewage sludge [J]. Water Research, 35(6): 1415-1424.
ZHOU J, ZHENG G Y, WONG J W C, et al. 2013. Degradation of inhibitory substances in sludge by Galactomyces sp. Z3 and the role of its extracellular polymeric substances in improving bioleaching [J].Bioresource Technology, 132: 217-223.
初立恩, 颜望明, 王祖农. 1981. 几种外源有机酸对于氧化硫硫杆菌的生长和氧化硫的影响[J]. 山东大学(自然科学版), (4): 110-117.
华玉妹, 陈英旭, 田光明, 等. 2006. 小分子有机物对污泥中重金属生物沥滤的影响[C]//中国环境科学学会2006年学术年会优秀论文集(下卷). 北京: 中国环境科学出版社: 3209-3212.
鲁顺保, 张艳杰, 彭桂群. 2012. 添加小分子有机物对污泥重金属生物淋滤的抑制作用[J]. 生态环境学报, 21(10): 1771-1774.
邱秀文, 周桂香, 杨期勇, 等. 2017. 一株嗜酸异养菌的分离鉴定及其重金属耐受性研究[J]. 环境科学与技术, 40(1): 64-69
谭险夷, 袁兴中, 曾光明, 等. 2014. 丝状菌对生物淋滤去除底泥中重金属的促进作用[J]. 环境工程学报, 4(12): 2853-2859.
王世梅, 周立祥, 黄峰源, 等. 2006. 酵母菌与两种硫杆菌复合对污泥中三价铬的去除[J]. 中国环境科学, 26(2): 197-200.
颜望明, 郑士民, 钱新民, 等. 1980. 混合培养中几株真菌对氧化硫硫杆菌生长和硫的氧化的影响[J]. 山东大学学报(自然科学版), (2):88-96.
杨期勇, 邱秀文, 程鹏飞, 等. 2015. 嗜酸性氧化硫硫杆菌的分离鉴定及其产酸特性[J]. 生态环境学报, 24(8): 1366-1374.
Effects of Low-molecular Organics on the Co-culture of Acidithiobacillus thiooxidans and Rhodotorula mucilaginosa
YANG Qiyong1,3,4*, YANG Wenfeng2,3, ZHU Qiong3, ZHANG Qingfang2, LIU Yiqi3,TANG Mei3, TAN Chanjuan3
1. Poyang Lake Eco-economy Research Center, Jiujiang University, Jiujiang 332005, China;
2. College of Petrochemical Engineering, Lanzhou University of Technology, Lanzhou 730050, China
3. College of Chemistry and Environmental Engineering, Jiujiang University, Jiujiang 332005, China
4. Jiujiang Key Laboratory of Basin Management and Ecological Protection, Jiujiang University, Jiujiang 332005, China
Acidithiobacillus thiooxidans is the major microorganism in sludge bioleaching. The low-molecular organics in activated sludge which can be absorbed and degraded by Rhodotorula mucilaginosa have negative effects on the growth of Acidithiobacillus thiooxidans. In order to find the new methods to accelerate bioleaching processes and shorten bioleaching period, the effects of low-molecular organics on co-cultivation of Acidithiobacillus thiooxidans and Rhodotorula mucilaginosa were studied. In this research, the effects of this co-cultivation formula were studied through the comparative experiments of composite system of Acidithiobacillus thiooxidans and Rhodotorula mucilaginosa as well as single system of Acidithiobacillus thiooxidans which cultivated in different circumstances of acetic acid, propionic acid, citric acid, oxalic acid and humic acid, respectively. The result indicated that all the low-molecular organics listed above had negative effects on sulfur-oxidation of Acidithiobacillus thiooxidans.Furthermore, the effect intensities of different treatments were ranked as follows: acetic acid>propionic acid>humic acid>oxalic acid>citric acid. However, the effect was gradually reduced in the later stage of bioleaching. In earlier stage of treatment,sulfur-oxidation of Acidithiobacillus thiooxidans of composite system was greater than that of single system. whereas, in later stage of treatment, the gap between composite system and single system decreased gradually. And, sulfur-oxidation of Acidithiobacillus thiooxidans of single system was much better than that of composite system, separately. Thus, to a certain extent the co-cultivation of Acidithiobacillus thiooxidans and Rhodotorula mucilaginosa could effectively accelerate the bioleaching process, shorten leaching period, improve leaching efficiency and be highly prospective in sewage sludge bioleaching practices.
bioleaching; Acidithiobacillus thiooxidans; Rhodotorula mucilaginosa; low-molecular organics; co-culture
10.16258/j.cnki.1674-5906.2017.10.017
X172
A
1674-5906(2017)10-1768-08
杨期勇, 杨文锋, 朱琼, 张庆芳, 刘艺奇, 唐梅, 谭婵娟. 2017. 小分子有机物对自养型氧化硫硫杆菌与异养型胶红酵母菌共培养的影响[J]. 生态环境学报, 26(10): 1768-1775.
YANG Qiyong, YANG Wenfeng, ZHU Qiong, ZHANG Qingfang, LIU Yiqi, TANG Mei, TAN Chanjuan. 2017. Effects of low-molecular organics on the co-culture of Acidithiobacillus thiooxidans and Rhodotorula mucilaginosa [J]. Ecology and Environmental Sciences, 26(10): 1768-1775.
国家自然科学基金项目(21367014);江西省自然科学基金项目(20151BAB203026);江西省教育厅科技项目(GJJ14732)
杨期勇(1972年生),男,教授,博士,主要从事水污染控制及废物资源化技术研究。E-mail: yqy46901@163.com
*通信作者
2017-08-24

