缺血性脑卒中患者外周血血管内皮祖细胞水平变化及意义
李友梅,冯晓丽,陈淑华,马艳婷,陈红艳
(上海市杨浦区中心医院,上海200090)
缺血性脑卒中患者外周血血管内皮祖细胞水平变化及意义
李友梅,冯晓丽,陈淑华,马艳婷,陈红艳
(上海市杨浦区中心医院,上海200090)
目的探讨缺血性脑卒中患者外周血血管内皮祖细胞(EPCs)水平的变化及意义。方法选择缺血性脑卒中患者63例作为健康观察组、体检健康者20例作为健康对照组。分别于患者发病第1、7、14、21天用流式细胞术检测外周血EPCs比例,用酶联免疫吸附法检测血清血管内皮生长因子(VEGF)、基质细胞衍生因子1(SDF-1)水平。结果发病第1、7、14天,观察组外周血EPCs比例较健康对照组高(P均<0.05),发病第21天两组外周血EPCs比例比较差异无统计学意义(P>0.05)。发病第1、7、14天,观察组血清VEGF、SDF-1水平与对照组比较差异有统计学意义(P均<0.05),发病第21天两组血清VEGF、SDF-1水平比较差异无统计学意义(P均>0.05)。结论缺血性脑卒中患者发病第1天外周血EPGs数量减少,随后逐渐增多,至第21天恢复正常;EPGs数量变化可反映缺血性脑卒中患者病情发展。
缺血性脑卒中;血管内皮祖细胞;旁分泌功能
动脉粥样硬化和血栓形成是缺血性脑卒中的主要病因[1]。缺血性脑卒中可引起栓塞部位末梢的脑血管内皮因缺氧发生坏死和脱落。近年研究显示,存在于体循环中的血管内皮祖细胞(EPCs)可以分化为内皮细胞,修复受损伤的脑血管内皮[2]。在健康人外周血中EPCs数量很少并在小范围内波动,当血管内皮完整性遭到破坏时,EPCs的数量会发生改变。当缺血缺氧引起脑血管内皮受损后,骨髓中的EPCs动员并释放到外周血中。目前对缺血性脑卒中患者外周血EPCs数量变化报道不一[3~5]。本研究对缺血性脑卒中患者在发病后不同时间EPCs数量的变化进行观察,并探讨其临床意义。
1 资料与方法
1.1 临床资料 选择2016年7月~2017年4月本院收治的缺血性脑卒中患者63例(观察组),均符合脑梗死的诊断标准[6],经头颅CT或MRI检查确诊。其中男41例、女22例,年龄(61.4±3.5)岁,发病至入院时间<24 h。入选标准:入院前均有不同程度的偏瘫和意识障碍等神经系统受损症状,排除入院后行溶栓治疗的患者。患者入院后给予阿托伐他汀、拜阿司匹林、血栓通进行治疗;治疗后参照《脑卒中患者临床神经功能缺损程度评分标准》,神经功能缺损评分减少18%~45%者纳入研究。同期选择体检健康者20例作为健康对照组,男13例、女7例,年龄(58.8±4.1)岁,无高血压、糖尿病、心肌梗死和冠心病等病史。本研究经本院伦理委员会批准,患者知情同意。
1.2 外周血EPCs检测 采用流式细胞术。分别于患者发病第1、7、14、21天取末梢血10 mL,加入等体积的Percoll分离液(购于美国GE公司),放入50 mL离心管,1 500 r/min离心20 min,吸取液面交界处的有核细胞,并将细胞转移至15 mL离心管中,使用PBS稀释后1 500 r/min离心5 min,弃上清液,再加入PBS 10 mL重复离心清洗1次。重悬细胞制备单细胞悬液并调整细胞为1×106个/mL,取细胞悬液200 μL,分别加入EPCs因子CD34-PE、VEGRF-2-APC流式抗体(购于美国BD公司)各5 μL,避光室温孵育20 min后于流式细胞仪(美国BD公司)上检测CD34和VEGRF-2的表达。采用Cell Quest软件分析结果,计算CD34、VEGRF-2表达均为阳性的细胞(EPCs)占有核细胞的比例。
1.3 血清血管内皮生长因子(VEGF)、基质细胞衍生因子1(SDF-1)检测 采用酶联免疫吸附法。分别于患者发病第1、7、14、21天取末梢血1 mL,放入1.5 mL离心管中,3 000 r/min离心10 min。抽取血清5 μL加入495 μL的样品稀释液中,标准品取500 μL(不需要使用稀释液)。取出反应板,在每一孔中加入稀释后的血清10 μL,设置5个复孔,对照组中加入标准品原液10 μL,设置5个复孔。加样结束后,每孔分别加入VEGF、SDF-1抗体100 μL,室温下混匀,置于30 ℃的干燥箱内静置30 min。取出后弃上清液,加入辣根过氧化物酶100 μL,避光保存10 min,加入终止液并用FACSCalibur 550酶标仪(美国Bio-Rad公司)测波长450 nm处检查各孔的光密度值,通过实验的标准品计算样本浓度。

2 结果
2.1 两组外周血EPCs水平比较 发病第1、7、14天观察组外周血EPCs比例较健康对照组高(P均<0.05),发病第21天两组外周血EPCs比例比较差异无统计学意义(P>0.05)。见表1。
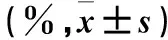
表1 两组外周血EPCs比例比较
2.2 两组血清VEGF、SDF-1水平比较 发病第1、7、14天观察组血清VEGF、SDF-1水平与对照组比较差异有统计学意义(P均<0.05),发病第21天两组血清VEGF、SDF-1水平比较差异无统计学意义(P均>0.05)。见表2。
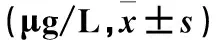
表2 两组血清VEGF、SDF-1水平比较
注:与对照组同时点比较,*P<0.05。
3 讨论
EPCs是一种具备分化潜能的前体细胞,在一定条件下可以分化为血管内皮细胞。在生理状态下,EPCs存在于末梢血循环中的量很少,其主要参与维持更新或修补受损伤的血管内皮细胞,使机体内的血管生成维持在一定的动态平衡[7]。但在病理状态下,EPCs可从骨髓动员到外周血中,归巢至损伤的组织,参与血管的形成,并可分化为成熟的血管内皮细胞,参与缺血组织的修复[8]。多种心血管疾病(冠心病、急性心肌梗死、高血压、高胆固醇血症、缺血性脑卒中等)患者EPCs在外周血中的数量均发生变化[9]。研究显示,缺血性脑卒中患者体内EPCs数量减少,且可将EPCs作为评价心血管风险的标志物之一[10];同时也有研究报道,缺血性脑卒中患者体内EPCs的数量增多,并认为EPCs数量与缺血性脑卒中患者的预后相关[11,12]。本研究中缺血性脑卒中患者发病第1天血清EPCs数量减少,但随着病情转归EPCs数量逐渐升高并在发病第21天恢复正常。
EPCs还可通过旁分泌作用释放各种细胞因子,包括VEGF、碱性成纤维细胞生长因子、粒细胞-巨噬细胞集落刺激因子、SDF-1和基质金属蛋白酶9等。以上细胞因子对促进EPCs的骨髓动员起重要作用[13],可动员EPCs从骨髓进入外周血,还可以促进EPCs增殖、分化、趋化和归巢。VEGF是目前已知的诱导EPCs向成熟的血管内皮细胞分化的最重要的细胞因子,促进EPCs的骨髓动员、成熟,在EPCs增殖、分化、趋化和归巢中起至关重要的作用;SDF-1是一种趋化因子,对EPCs的趋化作用是其他细胞因子的10倍。血液中SDF-1水平升高有利于EPCs归巢,诱发EPCs与受损内皮黏附和血小板聚集,并抑制EPCs凋亡,在诊断和治疗心肌缺血性疾病中有重要意义。因此,本研究选取VEGF、SDF-1两种因子进行分析。结果显示缺血性脑卒中发生的第1天,患者血清VEGF、SDF-1水平降低。由于EPCs可直接分泌VEGF和SDF-1,因此EPCs数量减少后血清VEGF、SDF-1水平下降。随着缺血性脑卒中患者病情康复,血清VEGF、SDF-1水平逐渐升高,到发病第21天恢复正常。
本研究未将药物治疗作为影响因素加以考虑。EPCs增殖主要受内皮损伤和肿瘤因素的影响,当机体内发生外源性的内皮损伤和血管生长旺盛需要有内皮细胞补充时,机体可通过骨髓动员的方式将EPCs动员到外周血中,而且数量极少。药物对EPCs骨髓动员效果较差,目前用以治疗缺血性脑卒中的药物无动员EPCs的相关报道。
综上所述,通过对发病不同时期缺血性脑卒中患者内体的EPCs水平的观察,发现EPCs在发病初期出现明显下降,此后EPCs比例随患者康复逐渐升高并最终恢复正常。与此同时,VEGF和SDF-1在缺血性脑卒中患者体内的变化也证实了其变化趋势与EPCs变化相同。可见,EPCs水平变化可反映缺血性脑卒中患者病情的变化。
[1] 张小雪,张京芬.国内急性期缺血性脑卒中的溶栓治疗现状分析[J].中华老年心脑血管病杂志,2015,17(2):222-224.
[2] 彭飞飞,黄岩.丁苯酞对急性缺血性脑卒中患者外周血EPCs的影响[J].实用药物与临床,2016,19(3):311-313.
[3] 任长虹,高明清,李宁,等.脑卒中生物标志物研究的重要性及研究现状[J].军事医学,2012,36(2):150-153.
[4] 岳丹丹,吴丹红.内皮祖细胞在缺血性脑卒中诊治中的研究进展[J].医学研究杂志,2015,44(11):173-175.
[5] 李欢欢,何旭,刘亢丁.内皮祖细胞与缺血性脑卒中[J].中国组织工程研究,2010,14(19):3569-3572.
[6] 许予明,谭颂,刘鸣,等.脑血管疾病诊断与治疗临床指南[J].内科急危重症杂志, 2005,11(5):243-245.
[7] Dragoni S, Guerra G, Fiorio PA, et al. A functional transient receptor potential vanilloid 4 (TRPV4) channel is expressed in human endothelial progenitor cells[J]. J Cell Physiol, 2015,230(1):95-104.
[8] Wang H, Cai KY, Li W, et al. Sphingosine-1-phosphate induces the migration and angiogenesis of EPCs through the Akt signaling pathway via sphingosine-1-phosphate receptor 3/platelet-derived growth factor receptor-β[J]. Cell Mol Biollett, 2015,20(4):597-611.
[9] 徐家行,殷桂林.内皮祖细胞治疗缺血性疾病的临床应用进展[J].山东医药,2010,50(18):111-112.
[10] 朱江,刘煜敏.内皮祖细胞与缺血性脑血管病研究进展[J].中华老年医学杂志,2010,29(5):436-438.
[11] 张道培,闫福岭,朱奕昕,等.急性重症脑卒中患者单核细胞免疫抑制与炎性标志物的相关性[J].中华神经医学杂志,2008,7(10):1067-1070.
[12] 李刚,韩雄,徐军,等.急性脑卒中的血液生化标志物诊断研究进展[J].中华医学杂志,2013,93(7):554-557.
[13] Szmitko PE, Fedak PW, Weisel RD, et al. Endothelial progenitor cells: new hope for a broken heart[J]. Circulation, 2003,107(24):3093.
10.3969/j.issn.1002-266X.2017.37.023
R743.33
B
1002-266X(2017)37-0068-03
上海市杨浦区卫生与计划生育委员会课题(201308)。
2017-05-31)

