自体细胞免疫治疗联合化疗对晚期非小细胞肺癌的近期疗效
刘淑娟,张海梅,宋海平,魏晓芳,孙伟红
(1青岛市肿瘤医院,山东青岛266042;2青岛市中心医院)
自体细胞免疫治疗联合化疗对晚期非小细胞肺癌的近期疗效
刘淑娟1,张海梅1,宋海平1,魏晓芳2,孙伟红2
(1青岛市肿瘤医院,山东青岛266042;2青岛市中心医院)
目的探讨自体树突状细胞(DC)、细胞因子活化杀伤细胞(CIK)免疫治疗联合化疗对晚期非小细胞肺癌(NSCLC)的近期临床疗效。方法选取晚期NSCLC患者185例,根据接受治疗方式的不同分为化疗组62例、DC/CIK组60例、联合组63例。化疗组采用培美曲塞或吉西他滨化疗6~8周期;DC/CIK组采集患者外周血单个核细胞,体外分离培养DC和CIK回输,2周内重复回输3~5次为1个免疫治疗周期,每3个月进行1次,共治疗2次。联合组先行培美曲塞或吉西他滨化疗,化疗结束后第2天进行DC、CIK免疫治疗,化疗及DC、CIK治疗方式、时间分别与化疗组、DC/CIK组相同。计算三组客观反应率(ORR)、疾病控制率(DCR),并观察治疗前后生活质量改善情况。结果治疗结束后第8周,联合组ORR高于DC/CIK组(P<0.05)、DCR高于化疗组、DC/CIK组(P均<0.05)。治疗结束后第12周,联合组生活质量评分高于化疗组、DC/CIK组,疲乏、恶心呕吐、气促、咳嗽及胸痛症状量表评分均低于化疗组,气促、咳嗽及胸痛症状量表评分均低于DC/CIK组(P均<0.05)。结论自体DC、CIK免疫治疗联合化疗对晚期NSCLC有良好的近期疗效,能显著提高患者生活质量。
非小细胞肺癌;树突状细胞;细胞因子活化杀伤细胞;免疫治疗;化学治疗
临床非小细胞肺癌(NSCLC)占全部肺癌的80%~85%[1],是我国肿瘤相关死亡的主要原因之一[2]。对于不能手术切除的晚期NSCLC,同步放化疗配合辅助化疗是最常见的治疗方式,但是目前治疗效果并不令人满意。同时,在化疗过程中由于基础肺功能差、化疗药不良反应强烈等原因部分患者不能耐受而放弃化疗。细胞免疫治疗是目前新兴的一种肿瘤治疗方式。树突状细胞(DC)、细胞因子活化杀伤细胞(CIK)等免疫细胞能高效杀伤肿瘤细胞[3],同时CIK也可增强化疗疗效。因此对于不能耐受化疗或化疗失败的患者,细胞免疫治疗是一种新的选择。免疫细胞联合化疗也成为治疗晚期肺癌的有效手段[4,5]。为此,本研究对DC、CIK联合化疗治疗晚期NSCLC的近期临床效果进行了观察。
1 资料与方法
1.1 临床资料 选取2011年1月~2015年11月在本院肿瘤科治疗的NSCLC患者185例。入选标准:①均经病理学诊断证实为肺鳞癌或腺癌,并具有客观可测量病灶者;②预计生存期>6个月者;③脏器功能正常者;④无化疗和DC、CIK治疗禁忌者;⑤有完整的病历资料者。排除标准:①有严重心脏病,包括近期内患心肌梗死、失代偿性心力衰竭、严重心律失常、顽固性不稳定型心绞痛等患者;②严重肝肾功能不全者;③近期内患有急性脑出血者;④严重哮喘或其他严重呼吸功能不全者。185例患者随机分为三组。化疗组62例,男34例、女28例,年龄(65.26±12.22)岁,Karnofsky评分(65.97±8.13)分;病理分型:鳞癌32例,腺癌30例;TNM分期:ⅢA期20例,ⅢB期18例,Ⅳ期24例。DC/CIK组60例,男32例、女28例,年龄(66.17±11.22)岁,Karnofsky评分(71.67±5.22)分;病理分型:鳞癌31例,腺癌29例;TNM分期:ⅢA期19例,ⅢB期18例,Ⅳ期23例。联合组63例,男34例、女29例,年龄(68.37±14.34)岁,Karnofsky评分(73.07±8.29)分;病理分型:鳞癌30例,腺癌33例;TNM分期:ⅢA期21例,ⅢB期20例,Ⅳ期22例。三组临床资料比较差异无统计学意义(P均>0.05)。三组均签署知情同意书,临床试验程序均经本院伦理委员会审查批准。
1.2 治疗方法 ①化疗组根据病理分型采用单纯化疗。肺腺癌化疗:培美曲塞500 mg/m2,静脉滴注1 h,第1天;顺铂75 mg/m2,静脉滴注1 h,第1~3天。肺鳞癌化疗:吉西他滨1 250 mg/m2,静脉滴注1 h,第1、8天;顺铂75 mg/m2,静脉滴注1 h,第1~3天。化疗21~28 d为1个周期,根据患者获益及耐受情况,化疗进行6~8个周期。②DC/CIK组采用DC、CIK免疫治疗。参照文献[6]化疗前1 d利用血细胞单采机采集患者外周血单个核细胞,体外分离培养,DC和CIK培养至第8天收集回输。制备好的DC分成两部分,一部分与CIK混合加入含有1 500 U/mL IL-2和1%白蛋白的生理盐水中,通过静脉回输入患者体内;另一部分用1.5 mL生理盐水悬浮,皮下注入肺癌转移途径的引流淋巴结。2周内重复回输3~5次为1个免疫治疗周期,DC、CIK治疗每3个月进行1次,共治疗2次。③联合组先行培美曲塞或吉西他滨化疗,化疗结束后第2天进行DC、CIK免疫治疗,化疗及DC、CIK治疗方式、时间分别与化疗组、DC/CIK组相同。
1.3 DC、CIK表型测定 为控制免疫细胞的质量,培养细胞在每次回输前进行DC、CIK表型测定。取培养细胞悬液0.5 mL,生理盐水洗涤后,加入鼠抗人单克隆抗体(DC标志:CD11、CD80、CD83、CD86、CD54和HLA-DR;CIK标志:CD3、CD4、CD8和CD56)20 μL,避光室温孵育30 min,之后加入PBS 2 mL洗涤2次,用PBS重悬上机进行检测。
1.4 疗效评价 治疗结束后第8周,观察三组近期疗效。肿瘤近期疗效按实体瘤疗效评价标准进行评价,以CT和PET-CT影像资料为主要依据。完全缓解(CR):所有目标病灶消失;部分缓解(PR):基线病灶长径缩小总和≥30%,维持4周;疾病进展(PD):基线病灶长径总和增加≥20%或出现新病灶;疾病稳定(SD):基线病灶长径总和有缩小但未达PR或有增加但未达PD。以CR+PR计算客观反应率(ORR),以CR+PR+SD计算疾病控制率(DCR)。
1.5 生活质量评估 生活质量通过中文版欧洲癌症研究与治疗组织的生活质量核心量表和肺癌特异性模块进行问卷评估。量表中总体健康状态和功能量表采取正向计分,症状量表或者单个项目采取负向计分。由患者本人填写调查表,由研究者再将每个量表的原始数据换算成0~100分,分别于治疗前1 d及治疗结束后12周进行评估。

2 结果
2.1 免疫细胞DC、CIK表型表达 免疫细胞回输前DC、CIK表型表达率见表1,显示回输细胞质量良好,符合回输要求。
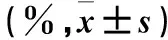
表1 免疫细胞DC、CIK表型表达率
2.2 三组近期临床疗效比较 治疗后,联合组ORR(39.7%)高于DC/CIK组(8.3%)(P<0.05),但联合组ORR与化疗组(30.6%)相比差异无统计学意义(P=0.55)。联合组DCR(82.5%)均高于化疗组(59.7%)和DC/CIK组(35.0%),比较差异有统计学意义(P均<0.05)。三组近期临床疗效见表2。
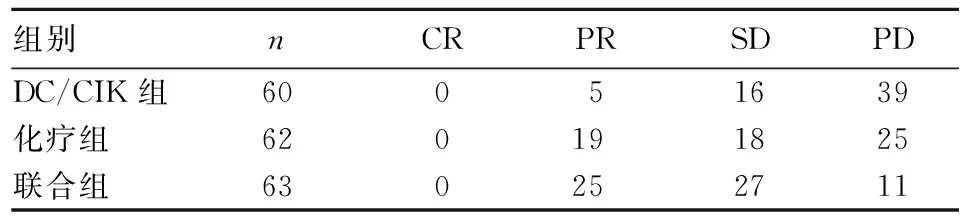
表2 三组近期临床疗效比较(例)
2.3 三组生活质量及症状评分比较 治疗前三组生活质量评分比较,P均>0.05;治疗后联合组生活质量评分高于化疗组和DC/CIK组(P均<0.05)。三组治疗前各种临床症状评分比较,P均>0.05;治疗后相同症状评分均低于治疗前(P均<0.05)。三组治疗前后症状评分比较见表3。
3 讨论
众所周知,肿瘤的发生发展与机体的免疫状态密切相关,肿瘤患者的免疫状态与预后的关系已成为肿瘤研究的焦点之一。化疗是肿瘤常规治疗方法之一,可减少肿瘤的复发和转移,提高总生存率[7]。但是,化疗对非靶向组织包括免疫系统有广泛的不良反应。Verma等[8]研究发现,化疗可短时间删除循环淋巴细胞的主要亚群,较长时间(>9个月)删除B细胞和CD4+淋巴细胞,导致获得性免疫系统改变。晚期癌症患者原本免疫功能低下,经过化疗后其免疫系统会进一步损伤,导致各种并发症和不适症状发生,患者生活质量明显下降。DC是人体内专职的功能最强的抗原呈递细胞,可诱导机体产生强烈的抗肿瘤免疫反应。CIK除能直接杀死肿瘤细胞外,还能调节机体细胞免疫反应。多项临床研究证实免疫细胞在控制肿瘤生长、降低肿瘤复发率方面有潜在的作用[9,10]。为此我们分析DC、CIK联合化疗治疗晚期NSCLC近期临床效果和对生活质量的影响,以期了解免疫细胞和化疗联合治疗晚期NSCLC是否产生协同抗肿瘤效果。
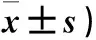
表3 三组治疗前后生活质量及临床症状评分比较(分,
注:与化疗组相同时间点比较,*P<0.05;与DC/CIK组相同时间点比较,#P<0.05。
DC和CIK的功能性活化是有效免疫治疗的必须条件。成熟的DC可产生潜在的肿瘤特异性细胞毒性T细胞应答。本研究显示,来自患者的DC经培养后,其成熟标志CD83和共刺激分子(HLA-DR、CD86和CD80)表达水平都达到90%。CIK是一种新的免疫效应细胞群,其主要效应细胞是具有NK细胞特性的活化T细胞,表型特征是CD3+CD56+,CIK的细胞毒性与CD3+CD56+表达呈正相关。已有文献证实,体外大量活化培养的DC回输体内后能有效激活初始T细胞,诱导机体产生抗肿瘤免疫反应[11]。体外细胞因子诱导产生的CIK经扩增后回输患者体内,促进体内融瘤细胞因子释放[12]。本研究发现,联合组DCR明显高于化疗组和DC/CIK组,联合组ORR明显高于DC/CIK组,此结果与Wu等[13]的报道一致。但联合组ORR与化疗组相比差异无统计学意义,可能与研究样本偏少或观察时间较短有关。生活质量影响癌症患者的生存,改善生活质量有助于延长生存期。本研究发现,治疗前三组整体生活质量评分以及单个症状评分比较均无统计学差异。治疗结束后12周,联合组整体生活质量评分高于化疗组和DC/CIK组,联合组疲乏、恶心呕吐、气促、咳嗽及胸痛症状量表评分均低于化疗组,气促、咳嗽及胸痛症状量表评分均低于DC/CIK组。联合组与化疗组和DC/CIK组相比,生活质量明显改善,提示DC、CIK联合化疗可产生协同作用,稳定病情,改善生活质量。
综上所述,DC、CIK联合化疗治疗晚期NSCLC近期效果良好。但由于本研究样本量较小,结果可能存在偏差,其客观真实性尚需要更大规模的临床试验进一步验证。
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. Cancer J Clin, 2013,63(1):11-30.
[2] Liu X, Yang Q, Xi Y, et al. Kanglaite injection combined with chemotherapy versus chemotherapy alone in the treatment of advanced non-small cell lung carcinoma[J]. J Cancer Res Ther, 2014,10(Suppl 1):46-51.
[3] Ohtani T, Yamada Y, Furuhashi A, et al. Activated cytotoxic T-lymphocyte immunotherapy is effective for advanced oral and maxillofacial cancers[J]. Inter J Oncol, 2014,45(5):2051-2057.
[4] 季加孚,陕飞.胃癌综合治疗的研究进展与评价[J]. 中华外科杂志,2011,49 (3): 193-197.
[5] 杜娟,刘宝瑞.胃癌免疫治疗新趋势:个体化肽疫苗[J].中国肿瘤生物治疗杂志,2015,22(4):514-518.
[6] 孙伟红,魏晓芳,赵鹏,等.胃癌患者DC-CIK治疗前后外周血Treg细胞及相关细胞因子的变化[J].中国肿瘤生物治疗杂志,2015,22(1):79-83.
[7] Roche H, Fumoleau P, Spielmann M, et al. Sequential adjuvant epirubicin-based and docetaxel chemotherapy for node-positive breast cancer patients: the FNCLCC PACS 01 Trial[J]. J Clin Oncol, 2006,24(36):5664-5671.
[8] Verma R, Foster RE, Horgan K, et al. Lymphocyte depletion and repopulation after chemotherapy for primary breast cancer[J]. Breast Cancer Res, 2016,18(1):10.
[9] Liu L, Zhang W, Qi X, et al. Randomized study of autologous cytokine-induced killer cell immunotherapy in metastatic renal carcinoma[J]. Clin Cancer Res, 2012,18(6):1751-1759.
[10] Wright SE, Rewers-Felkins KA, Quinlin IS, et al. Cytotoxic T-lymphocyte immunotherapy for ovarian cancer: a pilot study[J]. J Immunotherapy, 2012,35(2):196.
[11] 尹先哲,王苗,杜锋,等.CIK细胞与白介素-2回输联合同步化疗治疗晚期非小细胞肺癌临床研究[J].山东医药,2012,52(28):21-22,25.
[12] 刘卫国.免疫治疗对乳腺癌患者术后免疫功能和生存状况的影响[J].中国现代普通外科进展,2015,18(3):189-192.
[13] Wu C, Jiang J, Shi L, et al. Prospective study of chemotherapy in combination with cytokine-induced killer cells in patients suffering from advanced non-small cell lung cancer[J]. Anticancer Res, 2008,28(6B):3997-4002.
10.3969/j.issn.1002-266X.2017.37.015
R734.2
B
1002-266X(2017)37-0045-03
山东省医药卫生科技发展计划(2016WS0324)。
孙伟红(Email: qdswzx@126.com)
2017-06-28)

