三阴乳腺癌组织PTEN蛋白表达变化及与患者预后的关系
万珍玲,刘超
(1海南省妇幼保健院,海口570206;2天津市胸科医院)
·临床研究·
三阴乳腺癌组织PTEN蛋白表达变化及与患者预后的关系
万珍玲1,刘超2
(1海南省妇幼保健院,海口570206;2天津市胸科医院)
目的观察三阴乳腺癌组织同源性磷酸酶-张力蛋白(PTEN)的表达变化,并探讨其与患者预后的关系。方法选择三阴乳腺癌组织标本80例份、乳腺纤维腺瘤正常乳腺组织石蜡标本25例份,采用免疫组化法检测二者PTEN蛋白表达。对80例三阴乳腺癌患者进行随访,记录无病生存期及总生存期。用Cox多因素回归分析三阴乳腺癌患者预后的影响因素。结果乳腺癌组织PTEN阳性表达率低于正常乳腺组织(P<0.05)。临床分期为Ⅰ、Ⅱ期的三阴乳腺癌患者,其组织中PTEN蛋白阳性表达率高于临床分期Ⅲ、Ⅳ期患者(P<0.05);发生淋巴结转移的三阴乳腺癌患者,其组织中PTEN蛋白阳性表达率低于未发生淋巴结转移的患者(P<0.05)。PTEN蛋白表达阴性的三阴乳腺癌患者术后1、2、5年生存率均低于PTEN蛋白表达阳性患者(P均<0.05)。Cox多因素回归分析结果显示,肿瘤直径、淋巴结转移、临床分期及PTEN蛋白表达是三阴乳腺癌患者5年无瘤生存的独立影响因素(P均<0.05)。结论三阴乳腺癌组织中PTEN蛋白呈低表达;PTEN蛋白表达阴性的三阴乳腺癌患者预后差。
三阴乳腺癌;同源性磷酸酶-张力蛋白;预后
三阴乳腺癌是指孕激素受体、阴性人表皮生长因子受体2和雌激素受体均表现为阴性的乳腺癌[1]。三阴乳腺癌发病年龄早、恶性程度高、易发生早期局部复发及远处转移、侵袭性强,是乳腺癌分型中预后最差的一种[2]。15%~20%乳腺癌为三阴乳腺癌[3]。研究结果显示,27.3%~80.0%乳腺癌组织同源性磷酸酶-张力蛋白(PTEN)表达异常[4],即PTEN表达缺失或低表达会影响乳腺肿瘤细胞的增殖及患者预后。PTEN可作为诊断乳腺癌发展程度的潜在指标。PTEN基因启动子区异常甲基化的乳腺癌患者预后较差。本研究观察三阴乳腺癌组织中PTEN蛋白的表达变化,并探讨其与患者预后的关系。
1 资料与方法
1.1 临床资料 选择2013年5月~2015年4月本院收治的乳腺癌患者,均为女性,年龄42~65(51±8.56)岁;均行手术治疗,并根据情况进行放化疗,均未进行内分泌治疗;患者均初诊,以前未做过治疗。乳腺纤维腺瘤患者均为女性,年龄41~65(51±9.25岁)。二者年龄具有可比性。均排除肝炎病毒及人类免疫缺陷病毒感染者;合并自身免疫性疾病、恶性肿瘤、严重心脑血管疾病、精神疾患者。患者及家属均签署知情同意书。收集手术切除的三阴乳腺癌组织、乳腺纤维腺瘤正常乳腺组织石蜡标本。
1.2 乳腺癌组织与正常乳腺组织PTEN蛋白表达检测 采用免疫组化法。用10%甲醛固定组织标本,石蜡包埋,制成4 μm厚的组织切片,常规脱蜡、水化,抗原热修复采用枸橼酸盐缓冲液。PTEN抗体按照1∶100的比例进行稀释。采用PBS替代一抗体,阳性对照物为试剂盒自带已知阳性组织。由2名具有丰富经验的病理医师观察结果。PTEN蛋白表达于细胞膜及细胞质,阳性染色为深褐色。随机选择10个高倍镜视野(×400)计数1 000个乳腺癌细胞。参考张慧宇等[5]的计分方法,即深色计3分,中间色计2分,淡色计1分,无色计0分;阳性细胞百分比≥51%计3分,26%~50%计2分,6%~25%计1分,≤5%计0分。以上二者积分乘积≥3为阳性。
1.3 随访 通过门诊及电话对80例三阴乳腺癌患者的身体状况进行随访,包括患者无病生存期及总生存期。自手术切除肿瘤开始至发生复发或死亡的时间为无病生存期;自手术切除肿瘤开始至死亡或末次随诊的时间为总生存期。随访至术后24个月。
1.4 统计学方法 采用SPSS20.0统计软件。计数资料比较采用χ2检验;Cox多因素回归分析三阴乳腺癌患者5年无瘤生存的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌组织及正常乳腺组织中PTEN蛋白表达比较 PTEN蛋白在乳腺癌组织及正常乳腺组织中的阳性表达率分别为41.25%(33/80)、76.00%(19/25),二者比较差异有统计学意义(χ2=8.65,P<0.05)。
2.2 PTEN蛋白表达与三阴乳腺癌患者临床病理参数的关系 临床分期为Ⅰ、Ⅱ期的三阴乳腺癌患者,其组织中PTEN蛋白阳性表达率高于临床分期Ⅲ、Ⅳ期患者(P<0.05);发生淋巴结转移的三阴乳腺癌患者,其组织中PTEN蛋白阳性表达率低于未发生淋巴结转移的患者(P<0.05);不同年龄段及肿瘤直径大小不同的三阴乳腺癌患者其PTEN蛋白阳性表达率比较差异无统计学意义(P均>0.05)。见表1。
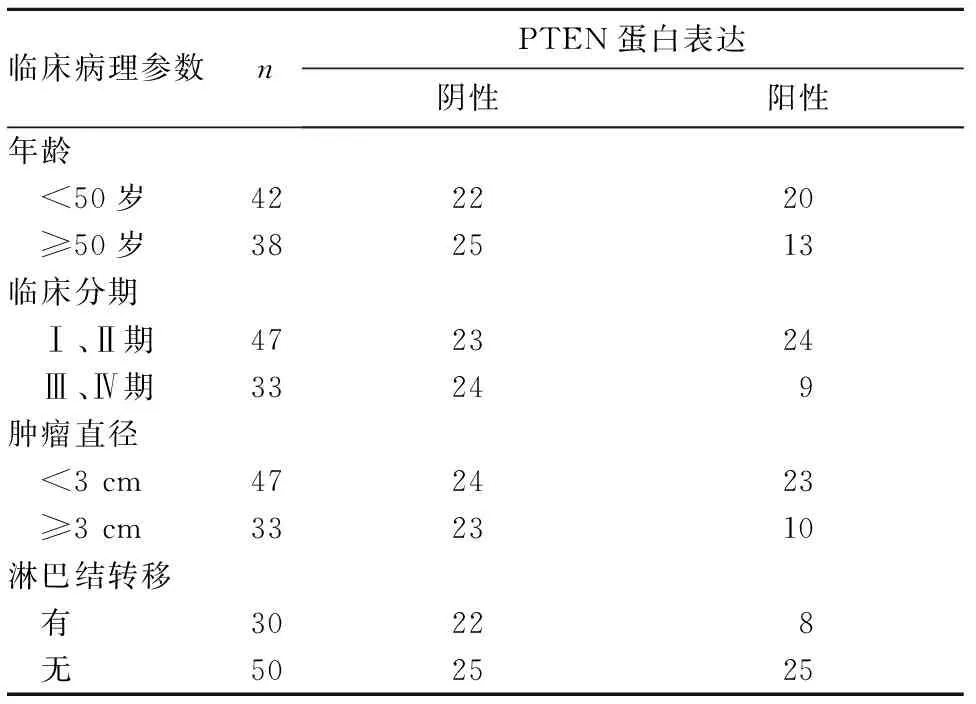
表1 PTEN蛋白表达与三阴乳腺癌患者临床病理参数的关系
2.3 PTEN蛋白表达与三阴乳腺癌患者预后的关系 PTEN蛋白表达阴性的三阴乳腺癌患者术后1年生存率为72.34%(34/47),2年生存率为59.57%(28/47),5年生存率为42.55%(20/47);PTEN蛋白表达阳性的三阴乳腺癌患者术后1年生存率为90.91%(30/33),2年生存率为75.76%(25/33),5年生存率为57.58%(19/33)。PTEN蛋白表达阴性的三阴乳腺癌患者术后1年、2年、5年生存率均低于PTEN蛋白表达阳性患者(P均<0.05)。Cox多因素回归分析结果显示,肿瘤直径、淋巴结转移、临床分期及PTEN蛋白是三阴乳腺癌患者5年无瘤生存的独立影响因素(P均<0.05)。见表2。
3 讨论
乳腺癌是女性发病率最高的恶性肿瘤,且其发病率在逐年上升。其中三阴乳腺癌是乳腺癌中治愈率最低的一种亚型[6]。临床上通常采取手术治疗及术后化疗控制疾病复发与转移,延长患者生命。早期诊断是提高患者无瘤生存率和生活品质的主要因素。相关报道表明,多数进行信号传导的蛋白通常为抑癌基因或癌基因的产物,而乳腺癌组织的PTEN-PI3K/AKT通路异常活跃,PTEN基因的突变缺失是引起乳腺癌的关键[7]。原发癌及转移性癌组织中都检测出大量的PTEN不断发生启动子甲基化,进而活性丧失。大概50%结直肠癌及大量其他肿瘤组织中都存在PTEN基因突变,并且突变后的PTEN基因功能缺失[8]。PTEN蛋白能够抑制细胞迁移、诱导细胞凋亡、抑制细胞周期进展和局部黏附等[9]。可见PTEN基因是肿瘤的抑制基因[10]。
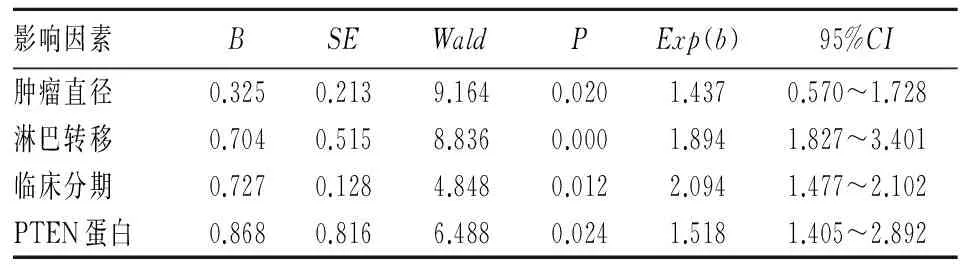
表2 三阴乳腺癌患者5年无瘤生存率Cox多因素回归分析
本研究结果显示,乳腺癌组织中PTEN蛋白阳性表达率低于正常乳腺组织,由此可以推断,PTEN蛋白与乳腺癌的发生发展密切相关。PTEN基因缺失及突变并不是PTEN蛋白表达下降的惟一原因,翻译后的异常调控能够引起PTEN蛋白降解,而启动子甲基化等基因外机制可以导致PTEN表达降低。本研究中,临床分期为Ⅰ、Ⅱ期的三阴乳腺癌患者,其组织中PTEN蛋白阳性表达率高于临床分期为Ⅲ、Ⅳ期的患者,未发生淋巴结转移的患者其组织中PTEN蛋白阳性表达率高于发生淋巴结转移的患者。即PTEN蛋白阳性表达率与乳腺癌组织病变严重程度有关,该结果与相关研究[11]结果相同。PTEN蛋白表达变化与乳腺癌发生发展有关。
PTEN蛋白表达为阴性的三阴乳腺癌患者其术后1、2、5年生存率均显著低于PTEN蛋白阳性患者。Cox多因素回归分析结果显示,肿瘤直径、淋巴结转移、临床分期及PTEN蛋白是三阴乳腺癌患者5年无瘤生存的独立影响因素。说明PTEN蛋白影响三阴乳腺癌患者预后。PTEN蛋白表达阴性的三阴乳腺癌患者预后差。
[1] Williams CB, Soloff AC, Ethier SP, et al. Perspectives on epidermal growth factor receptor regulation in triple-negative breast cancer: ligand-mediated mechanisms of receptor regulation and potential for clinical targeting[J]. Adv Cancer Res, 2015,127:253-281.
[2] Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China[J]. Lancet Oncol, 2014,15(7):e279-e289.
[3] Lehmann BD, Pietenpol JA. Identification and use of biomarkers in treatment strategies for triplenegative breast cancer subtypes[J]. J Pathol, 2014,232(2):142-150.
[4] Vitolo MI, Weiss MB, Szmacinski M, et al. Deletion of PTEN promotes tumorigenic signaling, resistance to anoikis, and altered response to chemotherapeutic agents in human mammary epithelial cells[J]. Cancer Res, 2009,69(21):8275-8283.
[5] 张慧宇,魏燕,高剑波,等.二脂酰甘油酰基转移酶在乳腺癌组织的表达及其临床意义[J].中华实验外科杂志,2016,33(4):936-938.
[6] 贾晓华,孙保存,张丹芳,等.127例三阴乳腺癌临床特点分析[J].山东医药,2011,51(47):27-29.
[7] Li X, Wang Q, Fu L, et al. Expression of PTEN, p53 and EGFR in the molecular subtypes of breast carcinoma and the correlation among them[J]. Zhong Nan Da Xue Xue Bao Yi Xue Ban, 2015,40(9):973-978.
[8] Santanam U, Banach-Petrosky W, Abate-Shen C, et al. Atg7 cooperates with Pten loss to drive prostate cancer tumor growth[J]. Genes Dev, 2016,30(4):399-407.
[9] Chen JH, Zhang P, Chen WD, et al. ATM-mediated PTEN phosphorylation promotes PTEN nuclear translocation and autophagy in response to DNA - damaging agents in cancer cells[J]. Autophagy, 2015,11(2):239 - 252.
[10] Leslie NR, Kriplani N, Hermida MA, et al. The PTEN protein: Cellular localization and post - translational regulation[J]. Biochem Soc Trans, 2016,44(1):273-278.
[11] Xu C, Fillmore CM, Koyama S, et al. Loss of Lkb1 and Pten leads to lung squamous cell carcinoma with elevated PD-L1 expression[J]. Cancer Cell, 2014,25(5):590-604.
10.3969/j.issn.1002-266X.2017.37.013
R737.9
A
1002-266X(2017)37-0040-03
中国博士后科学基金资助项目(2015M581308)。
刘超(E-mail:896221780@qq.com)
2017-06-09)

