左卡尼汀对脓毒症线粒体靶向治疗作用研究
李力 汪峰


【摘要】 目的:观察左卡尼汀能否作为代谢复苏药物改善脓毒症患者线粒体功能,并观察其治疗效果。方法:选取2014年2月-2017年2月本院就诊的脓毒症患者86例,采用随机数字表法分为常规治疗组(对照组)和左卡尼汀组(治疗组),每组43例,观察两组治疗前后血小板线粒体功能、乳酸清除率、SOFA评分、呼吸机辅助时间、ICU住院时间及短期(28 d)病死率。结果:治疗组治疗后血小板粒体跨膜电位和线粒体内ATP含量均优于治疗前且优于对照组,差异均有统计学意义(P<0.05);两组治疗后SOFA评分均下降,治疗组乳酸清除率高于对照组,SOFA评分低于对照组,呼吸机辅助时间、ICU住院时间明显缩短,短期病死率均低于对照组,差异均有统计学意义(P<0.05)。结论:左卡尼汀通过改善线粒体功能,可以增加脓毒症患者乳酸清除率,提高组织器官能量供应,阻止器官衰竭,缩短呼吸机辅助时间及ICU住院时间,降低患者短期(28 d)死亡率。
【关键词】 脓毒症; 线粒体; 左卡尼汀; 代谢复苏
Effect Study of L-carnitine for Sepsis Mitochondrial Targeting Therapeutic/LI Li,WANG Feng.//Medical Innovation of China,2017,14(26):021-024
【Abstract】 Objective:To observe whether L-carnitine can improve the mitochondrial function of sepsis as a metabolic resuscitation drug and its therapeutic effect.Method:From February 2014 to February 2017,86 patients with sepsis treated in our hospital were selected and divided into routine treatment group(the control group) and L-carnitine group(the treatment group) according to the random number table method,43 patients in each group.The platelet mitochondrial function,lactate clearance and SOFA scores before and after treatment,ventilator-assisted time,ICU hospitalization time and short-term(28 d) mortality of two groups were observed.Result:The levels of mitochondrial transmembrane potential and mitochondrial ATP content of the treatment group were improved compared with those before treatment and the control group,the differences were statistically significant(P<0.05).SOFA levels of two groups were decreased,and SOFA levels of the treatment group were lower than that of the control group,the duration of ventilator assisted,ICU hospitalization time and short-term mortality of the treatment group were were lower than those of the control group,the differences were statistically significant(P<0.05).Conclusion:L-carnitine can increase the lactic acid clearance rate for sepsis patients by improving the mitochondrial function,which can increase energy supply of tissues and organs,also can prevent organ failure,shorten the ventilator-assist time and ICU hospitalization time,reduce the short-term (28 d) mortality.
【Key words】 Sepsis; Mitochondrial; L-carnitine; Metabolic recovery
First-authors address:Jiujiang University Affiliated Hospital,Jiujiang 332000,China
doi:10.3969/j.issn.1674-4985.2017.26.006
膿毒症导致器官功能衰竭的发病机制尚不明确。有研究认为,感染所引起的全身炎症反应可抑制线粒体功能,以至于组织器官没有足够的能量来维持正常的功能,机体处于低代谢状态甚至器官衰竭。在最近的临床和实验研究,对脓毒症线粒体靶向治疗已明显降低多器官功能障碍(Multiple organ dysfunction syndrome,MODS)的严重程度和死亡率,这种干预被命名为“代谢复苏”[1]。左卡尼汀对稳定线粒体结构形态、膜的通透性及维持正常的线粒体功能有重要作用[2-3]。从人体脏器获取线粒体很难实现,但是循环血液中的血小板线粒体含量丰富,甚至在危重患者中很容易获得,并且血小板线粒体功能可以用不同技术方法进行检测,也可作为线粒体靶向治疗药物效果的评估[4]。本研究观察左卡尼汀能否作为代谢复苏药物改善脓毒症患者的预后,现报道如下。endprint
1 资料与方法
1.1 一般资料 选择2014年2月-2017年2月本院ICU住院的脓毒症患者86例,其中男47例,女39例,年龄27~76岁。纳入标准:所有患者均符合2014年《中国严重脓毒症/脓毒性休克治疗指南》关于脓毒症诊断标准,ICU住院时间>7 d[5]。排除标准:(1)既往有器官功能严重不足或免疫力低下患者(参照APACHEII评分中的慢性健康评分);(2)用药剂量不足或疗程不足7 d、检测指标不全者;(3)对治疗药物明确过敏者;(4)近2周用过影响血小板的药物,如阿司匹林、血宁片等。将其按照随机数字表法分为治疗组和对照组,每组43例,两组患者一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经医院伦理委员会批准,所有患者及家属签署知情同意书。
1.2 方法 对照组参考《中国严重脓毒症/脓毒性休克治疗指南》采取常规集束化治疗方案[6](即6 h复苏集束化治疗,是指在疑诊或确诊严重感染后立即开始并在6 h内完成的治疗措施。包括血乳酸水平测定,使用抗生素前留取病原学标本,急诊在接诊3 h内、ICU在收治1 h内开始使用广谱抗生素。如有低血压或血乳酸水平>4 mmol/L,应立即给予液体复苏(20~40 mL/kg);适当的液体复苏后低血压仍不能纠正者,应加用血管活性药物,以维持平均动脉压≥65 mm Hg,CVP≥8 mm Hg,ScvO2≥70%)。治疗组在常规集束化治疗方案基础上,加用左卡尼汀注射液(常州兰陵制药有限公司生产)4 g静滴,1次/d,持續7 d。
1.3 样本处理 为减少血小板线粒体激活,本研究采用Percoll密度梯度离心法分离纯化血小板。将两组患者分别于入院时及入院3、7 d用真空采血管绿头管(肝素钠)2支抽取新鲜静脉血8 mL。将9份Percoll原液加入1份2.5M蔗糖溶液混匀配置等渗Percoll溶液,再用0.25 M蔗糖溶液稀释等渗Percoll溶液至浓度1.06 g/mL,然后取肝素抗凝静脉血与等量Percoll溶液充分混合,(常温,1000次/min×20 min)取F1白色云雾层,PBS缓冲液洗涤3遍即得到分离纯化的血小板备用。
1.4 观察指标 (1)血小板线粒体跨膜电位检测:JC-1是一种广泛用于检测线粒体膜电位(mitochondrial transmembrane potential,ΔΨm)的理想荧光探针。通过JC-1从红色荧光到绿色荧光的转变检测细胞膜电位的下降。以JC-1孵育血小板15 min后,PBS缓冲液洗涤,采用流式细胞仪(BD FACS CotoⅡTM)进行定量检测,线粒体去极化的比例由绿荧光的百分比来衡量。(2)血小板线粒体内三磷酸腺苷(ATP)含量检测:以荧光素-荧光素酶法检测血小板线粒体ATP水平,原理:荧光素在荧光素酶、ATP等物质参与下,进行反应发出荧光;用分光光度计可测定发光强度;当荧光素和荧光素酶都足量时,在一定范围内,ATP的含量与发光强度成正比。血小板悬液与检测试剂等比混合,室温孵育15 min,采用宝特800酶标仪检测荧光强度。(3)乳酸清除率:所有患者检测入院时及入院6、12、24 h动脉血气记录乳酸值,并计算6、12、24 h乳酸清除率。(4)SOFA评分:所有患者在入院时及入院3、7 d抽取静脉血检测血常规、生化检查、记录24 h尿量及动脉血气计算PaO2/FiO2值、GCS评分等计算SOFA评分。(5)临床观察指标:观察两组左卡尼汀治疗对呼吸机辅助时间、ICU住院时间及短期(28 d)病死率。
1.5 统计学处理 采用SPSS 22.0软件进行统计学分析,计量资料用(x±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用 字2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组血小板线粒体膜电位变化 两组治疗前低ΔΨm细胞百分比比较,差异无统计学意义(P>0.05),入院7 d两组患者低ΔΨm细胞百分比均低于治疗前,入院3、7 d治疗组患者低ΔΨm细胞百分比均低于对照组,差异均有统计学意义(P<0.05),见表2。
2.2 两组血小板线粒体内ATP水平的变化 两组治疗前血小板内ATP相对含量比较,差异无统计学意义(P>0.05),入院3、7 d治疗组患者血小板内ATP水平均高于治疗前且高于对照组同期,差异均有统计学意义(P<0.05),见表3。
2.3 两组乳酸清除率比较 两组患者在入院时乳酸值比较,差异无统计学意义(P>0.05)。治疗组入院6、12、24 h的乳酸值均低于对照组,治疗组乳酸清除率高于对照组,差异均有统计学意义(P<0.05)。见表4。
2.4 两组SOFA评分比较 两组患者入院时SOFA评分比较,差异无统计学意义(P>0.05),治疗组入院3、7 d SOFA评分均低于对照组,差异均有统计学意义(P<0.05),见表5。
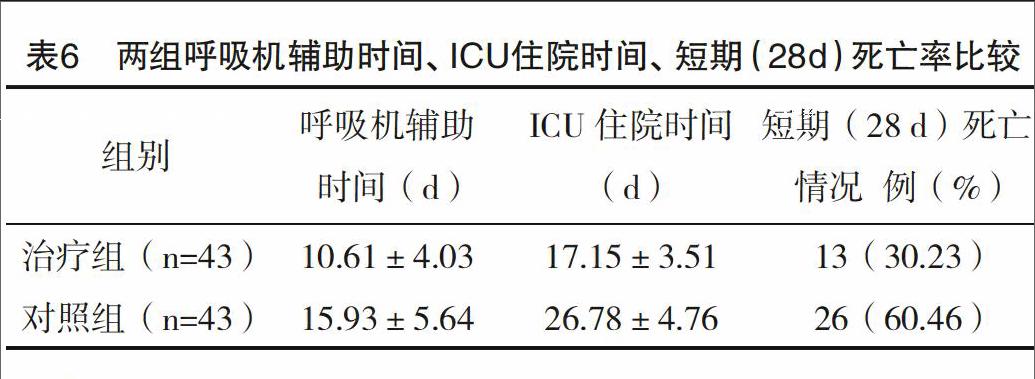
2.5 两组呼吸机辅助时间、ICU住院时间、短期(28 d)病死率比较 治疗组呼吸机辅助时间、ICU住院时间、短期病死率均低于对照组,差异均有统计学意义(P<0.05),见表6。
3 讨论
脓毒症是宿主对感染的反应失控导致危及生命的器官功能衰竭[7]。其主要特征是线粒体功能障碍[8],而线粒体功能降低在器官功能障碍的发生、发展及功能恢复中起关键性作用[9-10]。在脓毒症早期在脂多糖作用下细胞内脂酰基转移酶去乙酰化增加,线粒体功能及完整性遭到破坏,并且出现线粒体自噬现象[11-12]。随着脓毒症病情的进展,线粒体功能及数量均下降,组织器官为了适应线粒体能量供应,只能降低或关闭细胞功能来减少能量需求,从而达到能量供需平衡即MODS[13]。如果脓毒症不能得到有效控制,病情持续时间过长,线粒体结构和功能将呈现不可逆性的改变,最终导致线粒体功能衰竭,细胞能量枯竭,引起多器官功能衰竭而死亡[14]。endprint
左卡尼汀即左旋肉碱是脂肪代谢过程中的一种关键物质,能作为载体把脂肪酸从线粒体外运入线粒体内,使其氧化分解。左卡尼汀用于感染性休克患者是安全有效的,能明显降低短期(28 d)死亡率,并能提高低酮体类脓毒症患者远期(1年)生存率[15-16]。其机制可能是左卡尼汀通过乙酰肉碱转移酶的活动,参与在脂酰肉碱和脂酰-CoA酯之间平衡的建立,能有效维持线粒体功能[17];并且能改善受损线粒体超微结构、维持线粒体长度、减少线粒体损伤的数量,从而阻止细胞凋亡[2];左卡尼汀对于线粒体功能损伤的保护也有抗氧化和抗炎的机制参与[18-19]。在代谢应激时,线粒体积累脂酰-CoA,是为了保持机体卡尼汀稳态[20]。足够量的游离卡尼汀可促使堆积的脂酰-CoA进入线粒体内,使氧化磷酸化得以顺利进行,从而提高组织细胞能量供应,阻止器官功能衰竭[21]。
笔者通过对在医院ICU住院的86例脓毒血症患者研究显示,加用左卡尼汀治疗3 d即出现细胞内ATP水平较对照组高,且高于入院时水平,差异均有统计学意义(P<0.05);而低ΔΨm细胞百分比及SOFA评分均低于对照组,差异均有统计学意义(P<0.05)。说明早期加用左卡尼汀能减少线粒体氧化应激损害、维持线粒体功能作用。从乳酸清除率也提示早期加用左卡尼汀对预后有积极作用。加用左卡尼汀治疗7 d细胞内ATP水平高于对照组,且高于入院时,低ΔΨm细胞百分比及SOFA评分低于对照组,且低于入院时,差异均有统计学意义(P<0.05)。说明左卡尼汀改善受损线粒体结构和功能,提高组织器官能量供应,阻止器官衰竭,对脓毒症患者的治疗有积极作用。
本研究结果显示,加用左卡尼汀治疗后患者呼吸机辅助时间明显缩短、在ICU住院时间也明显减少,并且降低短期(28 d)病死率差异均有统计学意义(P<0.05)。这不仅提高了脓毒症患者的生存率,还大大节省了医疗费用支出。
综上所述,左卡尼汀注射液可能是通过改善线粒体膜电位,恢复线粒体氧化磷酸化功能,提高组织细胞能量供应,有效增加脓毒症患者乳酸清除率,提高组织器官能量供应,阻止器官衰竭,缩短呼吸机辅助时间及ICU住院时间,降低患者短期(28 d)死亡率。左卡尼汀对脓毒症治疗效果明显,可作为代谢复苏药物用于集束化治疗。
参考文献
[1] Leite H P,de Lima L F.Metabolic resuscitation in sepsis: a necessary step beyond the hemodynamic[J].J Thorac Dis,2016,8(7):552-557.
[2] Li X,Zhang C,Zhang X,et al.An acetyl-L-carnitine switch on mitochondrial dysfunction and rescue in the metabolomics study on aluminum oxide nanoparticles[J].Part Fibre Toxicol,2015,13(1):4-23.
[3] Zhang Z Y,Fan Z K,Cao Y,et al.Acetyl-L-carnitine ameliorates mitochondrial damage and apoptosis following spinal cord injury in rats[J].Neurosci Lett,2015,604(14):18-23.
[4] Protti A,Fortunato F,Artoni A,et al.Platelet mitochondrial dysfunction in critically ill patients:comparison between sepsis and cardiogenic shock[J].Crit Care,2015,19(1):39.
[5]中華医学会重症医学分会.中国严重脓毒症/脓毒性休克治疗指南(2014)[J].Chin Crit Care Med,2015,6(27):401-426.
[6]王海彦,廖品琥.脓毒症集束化治疗的临床研究进展[J].天津医药,2013,4(41):392-395.
[7] Singer M,Deutschman C S,Seymour C W,et al.The Third International Consensus Defi-nitions for Sepsis and Septic Shock (Sepsis-3)[J].JAMA,2016,315(8):801-810.
[8] Fink M P.Cytopathic hypoxia and sepsis:is mitochondrial dysfunction pathophysiologically important or just an epiphenomenon[J].Pediatr Crit Care Med,2015,16(1):89-91.
[9] Arulkumaran N,Deutschman C S,Pinsky M R,et al.Mitochondrial function in sepsis[J].Shock,2016,45(3):271-281.
[10] Singer M.The role of mitochondrial dysfunction in sepsis-induced multi-organ failure[J].Virulence,2014,5(1):66-72.
[11] Zhao P,Gao J,Jiang J,et al.Myocardial cells and mitochondrial autophagy in sepsis mice induced by lipopolysaccharide[J].Chinese Journal of Cellular and Molecular Immunology,2016,32(2):177-181.endprint
[12] Zou C,Synan M J,Li J,et al.LPS impairs oxygen utilization in epithelia by triggering degradation of the mitochondrial enzyme Alcatl[J].J Cell Sci,2016,129(1):51-64.
[13] Duran-Bedolla J,Montes de Oca-Sandoval M A,Salda?a-Navor V,et al.Sepsis,mitochondrial failure and multiple organ dysfunction[J].Clin Invest Med,2014,37(2):58-69.
[14] Lee I,Hüttemann M.Energy crisis:the role of oxidative phosphorylation in acute inflammation and sepsis[J].Biochim Biophys Acta,2014,1842(9):1579-1586.
[15] Puskarich M A,Kline J A,Krabill V,et al.Preliminary safety and efficacy of L-carnitine infusion for the treatment of vasopressor-dependent septic shock: a randomized control trial[J].JPEN J Parenter Enteral Nutr,2014,38(6):736-743.
[16] Puskarich M A,Finkel M A,Karnovsky A,et al.
Pharmacometabolomics of l-Carnitine Treatment Response Phenotypes in Patients with Septic Shock[J].Ann Am Thorac Soc,2015,12(1):46-56.
[17] Tonazzi A,Giangregorio N,Console L,et al.Mitochondrial carnitine/acy-lcarnitine transloase:insights in structure/function relationship[J].Mini Reviews in Medicinal Chemistry,2015,15(5):396-405.
[18] Le Borgne F,Ravaut G,Bernard A,et al.L-carnitine protects C2C12 cells against mitochondrial superoxide overproduction and cell death[J].World Journal of Biological Chemistry,2017,8(1):86-94.
[19] Khalatbari-Soltani S,Tabibi H.Inflammation and L-carnitine therapy in hemodialysis patients:a review[J].Clinical and Experimental Nephrology,2015,19(3):331-335.
[20] Marcovina S M,Sirtori C,Peracino A,et al.Translating the basic knowledge of mitochondrial functions to metabolic therapy:role of L-carnitine[J].Transl Res,2013,161(2):73-84.
[21] Longo N,Frigeni M,Pasquali M.Carnitine transport and fatty acid oxidation[J].Biochimica Et Biophysica Acta,2016,1863(10):2422-2435.
(收稿日期:2017-05-22) (本文編辑:康玥)endprint

