嗜卷书虱羧酸酯酶CarE基因克隆及表达分析
唐培安 李非凡 王进军 沈 飞 宋 伟
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心1,南京 210023)(西南大学;重庆市昆虫学及害虫控制工程重点实验室2,重庆 400716)
嗜卷书虱羧酸酯酶CarE基因克隆及表达分析
唐培安1李非凡1王进军2沈 飞1宋 伟1
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心1,南京 210023)(西南大学;重庆市昆虫学及害虫控制工程重点实验室2,重庆 400716)
为探明羧酸酯酶CarE在嗜卷书虱抗药性中的作用,本研究采用RT-PCR和RACE方法,从嗜卷书虱体内克隆获得了2条CarE基因全长序列,命名为Lbest1与Lbest2(GenBank登录号分别为EU854151与EU854152),2条基因全长为2 049和2 525 bp,编码570和617个氨基酸组成的蛋白质,理论等电点分别为6.85和4.74。2条基因均具有昆虫羧酸酯酶的催化活性位点和保守序列,并具有多个磷酸化位点。聚类分析结果表明,2条CarE基因均属于羧酸酯酶的F簇。定量分析结果表明,Lbest2在敌敌畏和磷化氢抗性品系中的表达水平均显著高于敏感品系(P<0.05),而Lbest1在不同品系中的表达水平没有显著差异;敌敌畏和磷化氢处理均可诱导2条基因表达水平的提高;Lbest1在发育过程中表达水平逐渐降低,而Lbest2在若虫期表达水平维持不变。结果表明,Lbest1主要参与调节昆虫的生长发育,Lbest2具有降解外源性物质和代谢解毒的功能。
嗜卷书虱 羧酸酯酶 抗性机理 基因克隆
羧酸酯酶(CarE)属于丝氨酸水解酶家族,广泛存在于生物体的组织与器官内,其活性中心含一个Ser残基,能有效催化含羧基酯键、酰胺键和硫酯键的内源性与外源性多种化合物的水解[1]。在昆虫体内CarE是最重要的解毒酶之一,它能与有机磷酸酯、氨基甲酸酯、拟除虫菊酯类杀虫剂产生特异性亲和,使杀虫药剂降解,从而保护昆虫免受杀虫药剂毒害[2-4]。大量研究表明,CarE解毒代谢活性的增强是昆虫对杀虫剂产生抗性的重要机理之一[5-8]。棉铃虫对有机磷杀虫剂的抗性以及玉米象对β-细辛醚的抗性均与CarE解毒代谢活性的增强直接关联[9-10]。进一步研究CarE与昆虫抗药性的关系发现,许多昆虫,如飞蝗L.migratoria、稻纵卷叶螟C.medinalis以及大豆蚜A.glycines等,其对有机磷杀虫剂产生抗性是由于CarE基因的过量表达导致其活性增强所致[11-13]。
嗜卷书虱(Liposcelisbostrychophila)隶属于啮目(Psocoptera)、书虱科(Liposcelididae),是一种重要的储藏物害虫,我国大部分地区都有嗜卷书虱的分布,近年来随着储粮熏蒸剂和保护剂的大量应用,嗜卷书虱抗性问题日益突出,而关于嗜卷书虱抗性机理的研究大部分都集中在乙酰胆碱酯酶(AChE)、多功能氧化酶(MFO)和谷胱甘肽S-转移酶(GST)等方面,关于CarE分子特性及其在抗性形成中的作用报道较少。据此,本试验通过RT-PCR和RACE技术克隆了嗜卷书虱体内2条CarE基因的全长序列,进而应用实时荧光定量PCR研究其在不同品系、不同发育阶段以及药剂诱导前后基因的表达水平,旨在为揭示CarE在嗜卷书虱抗性形成过程中的作用,制定抗性治理策略提供借鉴。
1 材料与方法
1.1 试验材料
1.1.1 供试书虱
嗜卷书虱敏感品系(Susceptible strain,SS):源于1990年建立的嗜卷书虱种群,该种群采自西南大学昆虫学及害虫控制工程重点实验室(原西南农业大学应用昆虫与螨类生态研究室)模拟粮仓中。饲养方法如下:在实验室(27±1) ℃、(75 ± 5)% RH、不予光照、不接受任何药剂的条件下以全麦粉、酵母粉和脱脂奶粉(10∶1∶1)混合而成的饲料饲养,该品系也被用于基因克隆试验。
敌敌畏抗性品系(DDVP-R):饲养方法相同,每一个月间隔用适当浓度的敌敌畏丙酮溶液熏蒸处理一次,保持成虫的死亡率在75%左右,所获得的品系抗性倍数达22.36,作为敌敌畏抗性品系。
磷化氢抗性品系(PH3-R):饲养方法相同,每一个月间隔用一定量的PH3气体熏蒸处理一次,保持成虫的死亡率在75%左右,所获得的品系抗性倍数达4.51,作为磷化氢的抗性品系。
1.1.2 主要试剂
DEPC:Amersco公司;DNA凝胶回收试剂盒:上海华舜公司;TRIzol Isolation Reagent:Invitrogen公司;M-MLV反转录酶、载体pMD 18-T Vector、DH5α感受态细胞competent cell、3’-Full RACE 试剂盒:TaKaRa公司;5’-Full RACE试剂盒:Clontech和Invitrogen公司。
1.2 试验方法
1.2.1 RNA提取
称取20 mg嗜卷书虱羽化后3~5 d的雌成虫(约1 000头),放于灭菌的研钵中,液氮速冻后迅速研碎,后续步骤参照TRIzol Isolation Reagent试剂盒说明书进行。使用SmartSpecTM 3000核酸浓度分析仪(美国BIO-RAD公司)检测RNA纯度与浓度提取的RNA样品置于-80 ℃冰箱保存备用。
1.2.2 第一链cDNA的合成及PCR扩增
合成第一链cDNA的反应体系分别参照3’-Full RACE 试剂盒(TaKaRa)与5’-Full RACE试剂盒(Clontech)的说明书进行。利用简并引物进行PCR扩增,反应条件:94 ℃预变性3 min,然后94 ℃变性30 s、50 ℃退火30 s、72 ℃延伸1 min,共25个循环,在72 ℃延伸10 min,4 ℃保存;第二轮半套式PCR反应,将第一轮的PCR产物作为模板,退火温度为53 ℃,扩增30个循环,其他与第一轮相同。使用特异性引物扩增3’或5’端时,退火温度参照试剂盒的要求以及基因特异性引物的退火温度设定,扩增循环数参照试剂盒说明,其他条件相同。PCR扩增产物以1.5%的琼脂糖胶进行电泳检测。
1.2.3 PCR产物克隆与测序
经琼脂糖凝胶电泳检测后,用DNA凝胶回收试剂盒对目的电泳条带进行纯化,纯化产物用pGEM®-T Easy vector连接,转化到感受态大肠杆菌(E.coliDH5α)。挑选阳性克隆经菌液检测后送Invitrogen公司测序。
1.2.4 基因表达模式研究
采用实时荧光定量PCR(quantitative real time PCR)方法,测定嗜卷书虱不同品系(SS、DDVP-R、PH3-R)、不同发育时期(1龄、2龄、3龄、4龄若虫和成虫)和药剂诱导前后2条CarE基因mRNA表达水平。
不同品系:包括敏感品系(SS)、敌敌畏抗性品系(DDVP-R)和磷化氢抗性品系(PH3-R)等3个品系,RNA提取等方法相同,每处理设3个重复。
不同发育时期:参考Wang等[14]的方法挑取嗜卷书虱敏感品系1龄、2龄、3龄、4龄若虫和成虫进行RNA提取。
药剂诱导:挑取嗜卷书虱敏感品系雌成虫30 mg,放入直径2 cm的塑料小盒中,用160目尼龙丝网作盒盖,将装有书虱的小盒放入广口瓶中,加入5 mg/L的敌敌畏丙酮溶液4 μL或磷化氢气体6 μL,并设无药剂处理的对照,密闭后放置在(27±1) ℃、全黑暗条件下熏蒸处理18 h(死亡率在30%左右);挑取熏蒸后仍存活的书虱20 mg提取总RNA。
实时荧光定量PCR(quantitative real time PCR)方法:使用β-actin作为内参基因,20 μL Real time PCR反应体系中包括:2× MasterMix 10 μL、上下游引物(10 μmol/L)各1 μL、cDNA 模板2 μL以及ddH2O 6 μL。循环条件为:95 ℃预变性10 min;随后进行40个95 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s的循环,每个循环退火结束后进行荧光信号采集。循环结束后以0.5 ℃/10 s的速度从60 ℃缓慢递增到95 ℃,连续测定样品的荧光强度以获取熔解曲线,以确定无引物二聚体或非特异性扩增发生。每个样品至少重复3次。
1.2.5 生物信息学分析
多重序列比对和氨基酸序列的推导使用DNAMAN软件完成;BLAST搜索、开放阅读框(ORF)的查找以及酶的催化三联体的预测在美国国家生物技术信息中心(NCBI) 站点完成;采用 ExPASy 在线软件预测酶的分子质量(MM)和等电点(pI);使用Mega 5.1 软件针对氨基酸序列进行Neighbor-Joining聚类分析,信号肽的预测使用在线软件SignalP 3.0完成(http://www.cbs.dtu.dk/services/SignalP)。使用NetNGlyc1.0 Server 软件对编码蛋白糖基化位点(N-glycosylation site)进行预测;Scanprosite(http://www.expasy.org/prosite/)用于预测氨基酸序列的磷酸化位点等。
1.2.6 引物设计与数据分析
使用Primer Premier5.0软件设计克隆试验所用引物;使用在线引物设计软件Primer 3.0 (http://frodo.wi.mit.edu/)设计用于实时荧光定量PCR的引物,引物序列与扩增效率见表1;进行实时荧光定量PCR并获得相应Ct值后,采用2-ΔΔCt法比较目的基因在各个检测试验中表达水平的差异;采用SPSS13.0软件中ANOVA单因素分析方法对数据进行差异显著性分析(P<0.05)。
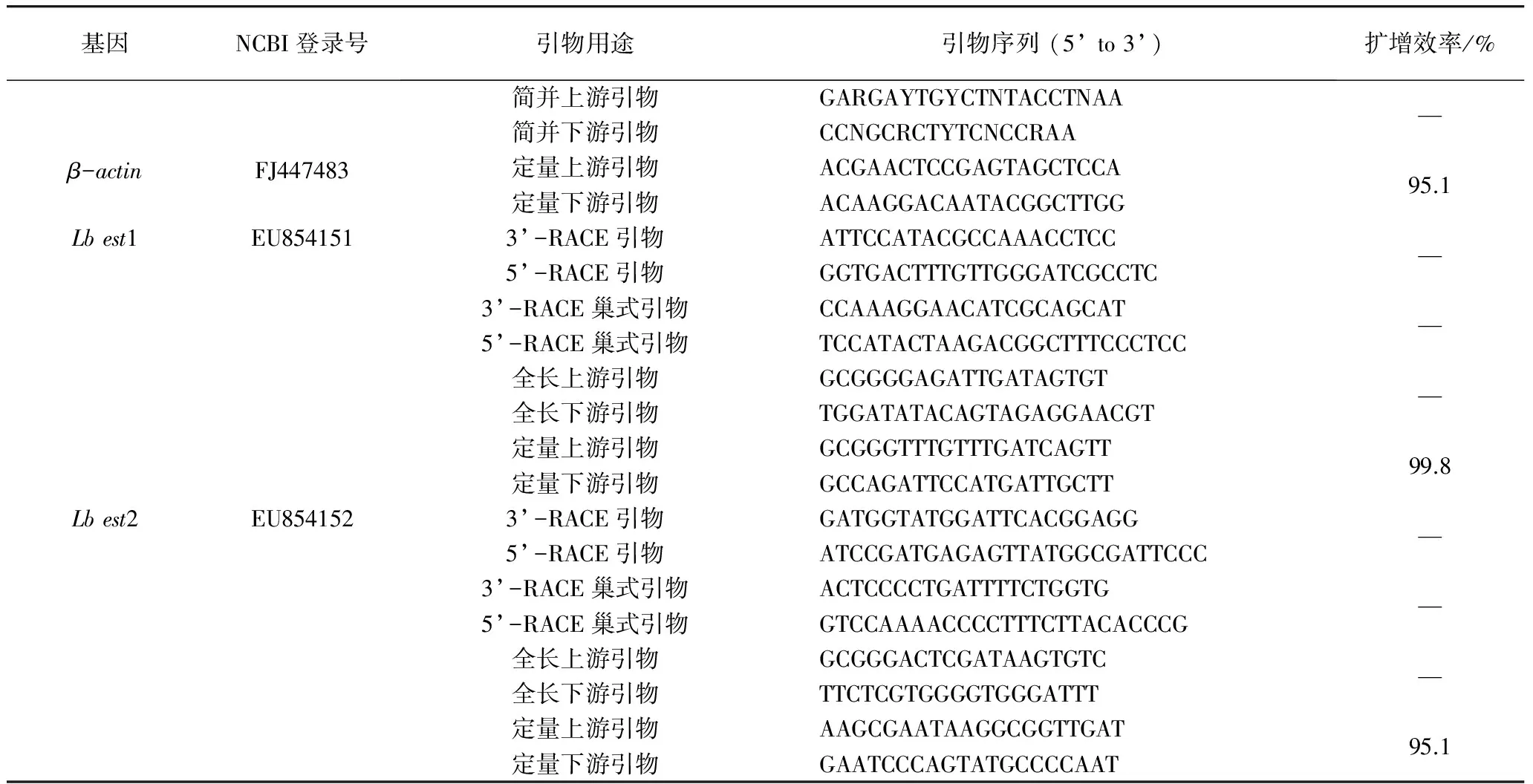
表1 引物序列与扩增效率
2 结果与分析
2.1 嗜卷书虱CarE基因全长序列的克隆及分析
利用羧酸酯酶简并引物扩增,结果显示有1条与预测长度相符的条带,经克隆测序后得到2个不同的基因片段,2个片段长度均为344 bp,编码114个氨基酸,是完整的编码序列。将2个片段所推导的氨基酸序列进行BLASTP搜索,结果表明,这2个基因片段与其他昆虫CarE基因具有很高的同源性。
根据克隆获得的2个CarE基因片段,分别使用扩增3’端和5’端的基因特异引物,利用RACE技术成功地克隆获得了嗜卷书虱2个CarE基因的全长序列,分别命名为Lbest1(GenBank登录号:EU854151)和Lbest2(GenBank登录号:EU854152)。核苷酸及其推导的氨基酸序列见图1、图2。
2.2 嗜卷书虱CarE氨基酸序列分析
由表2可知,Lbest1基因全长为2 049 bp,其中开放阅读框1 713 bp,编码一个570个氨基酸组成的前体蛋白,N端无信号肽;成熟蛋白的分子质量为61.4 kDa,理论等电点为6.85;Lbest1含有cAMP和cGMP依赖的蛋白激酶磷酸化位点2个,分别对应推导的氨基酸编号为:102~105、283~286;蛋白激酶C磷酸化位点9个,分别对应推导的氨基酸编号为:24~26、281~283、286~288、302~304、390~392、403~405、431~433、462~464和567~569;酪蛋白激酶Ⅱ磷酸化位点7个,分别对应推导的氨基酸编号为:46~49、93~96、177~180、302~305、358~361、411~414、519~522。
Lbest2基因全长为2 525 bp,包括由76个核苷酸组成的5’非编码区序列、由1 854个核苷酸组成的ORF和由595个核苷酸组成的3’非编码区序列。ORF编码617个氨基酸组成的前体蛋白,其中包括了由17个氨基酸组成的信号肽;成熟蛋白的分子质量为67.3 kDa,理论等电点为4.74。Lbest2含有cAMP和cGMP依赖的蛋白激酶磷酸化位点1个,对应推导的氨基酸编号为:89~92;蛋白激酶C磷酸化位点5个,分别对应推导的氨基酸编号为:87~89、88~90、353~355、592~594和603~605;酪蛋白激酶Ⅱ磷酸化位点10个,分别对应推导的氨基酸编号为:136~139、142~145、292~295、322~325、341~344、347~350、363~366、538~541、543~546以及575~578。另外,通过预测Lbest2还含有2个N-糖基化位点(161和184)。

表2 嗜卷书虱2个全长羧酸酯酶的氨基酸序列特征
将嗜卷书虱和其他昆虫CarE的氨基酸序列进行多重序列比对。由图3可见,不同昆虫CarE之间在活性位点附近的氨基端序列保守性较高,如保守的催化三联体(GESAG-E-H)、6个保守的半胱氨酸残基形成三对二硫键及FGESAG序列等。
根据在线软件ScanProsite的算法原理,CarE有2个保守结构域,1个是丝氨酸活性中心:F-[GR]-G-x (4)-[LIVM]-x-[LIV]-x-G-x-S-[STAG]-G,另1个是二硫键形成的位点:[ED]-D-C-L-[YT]-[LIV]-[DNS]-[LIV]-[LIV-FYW]-x-[PQR](其中“[ ]”表示不同物种在该位点是其中的1个氨基酸)。本试验克隆获得的嗜卷书虱2条CarE经该软件分析均发现了CarE的保守结构域,Lbest1的丝氨酸活性中心为“FGGDPNKVTIFGESAG”,二硫键形成的位点为“EDCLFLNVFTP”;Lbest2的丝氨酸活性中心为“FGGDPNRITLFGESAG”,二硫键形成的位点为“EDCLYLNIYSP”。

图2 嗜卷书虱Lb est2的核苷酸序列及推导的氨基酸序列
2.3 嗜卷书虱CarE氨基酸序列聚类分析
选取双翅目、鞘翅目、直翅目等共9个代表性昆虫的CarE氨基酸序列以及本试验获得的嗜卷书虱Lbest1、Lbest2序列,参考Oakeshott等[15]对羧酸酯酶的研究方法,使用Mega 5.1 软件进行Neighbor-Joining聚类分析;结果由图4可知,Lbest1与Lbest2均被划分在F簇中,该簇主要由非鳞翅目昆虫的保幼激素酯酶(juvenile hormone esterase,JHE)组成;F簇属于第二功能组(Secreted catalytic class),组内主要包括与激素降解相关的酶类。嗜卷书虱的Lbest1先与黄星天牛、黑腹果蝇、黄粉虫、蟋蟀的JHE聚类在一起,然后与本试验获得的另一个Lbest2汇成一大类。

注:保守的氨基酸残基用黑色表示,﹡代表活性中心的催化三联体位点;Md_CarE: 家蝇CarE Musca domestica (AAD29685); Cp_CarE: 库蚊CarE Culex pipiens quinquefasciatus (EDS26821); Hd_CarE: 棉铃虫CarE Helicoverpa armigera (ABQ42338); Lb_est1: 嗜卷书虱CarE1 Liposcelis bostrychophila (EU854151); Lb_est2: 嗜卷书虱 CarE2 Liposcelis bostrychophila (EU854152)。图3 嗜卷书虱CarE与其他昆虫酯酶序列的多重比对
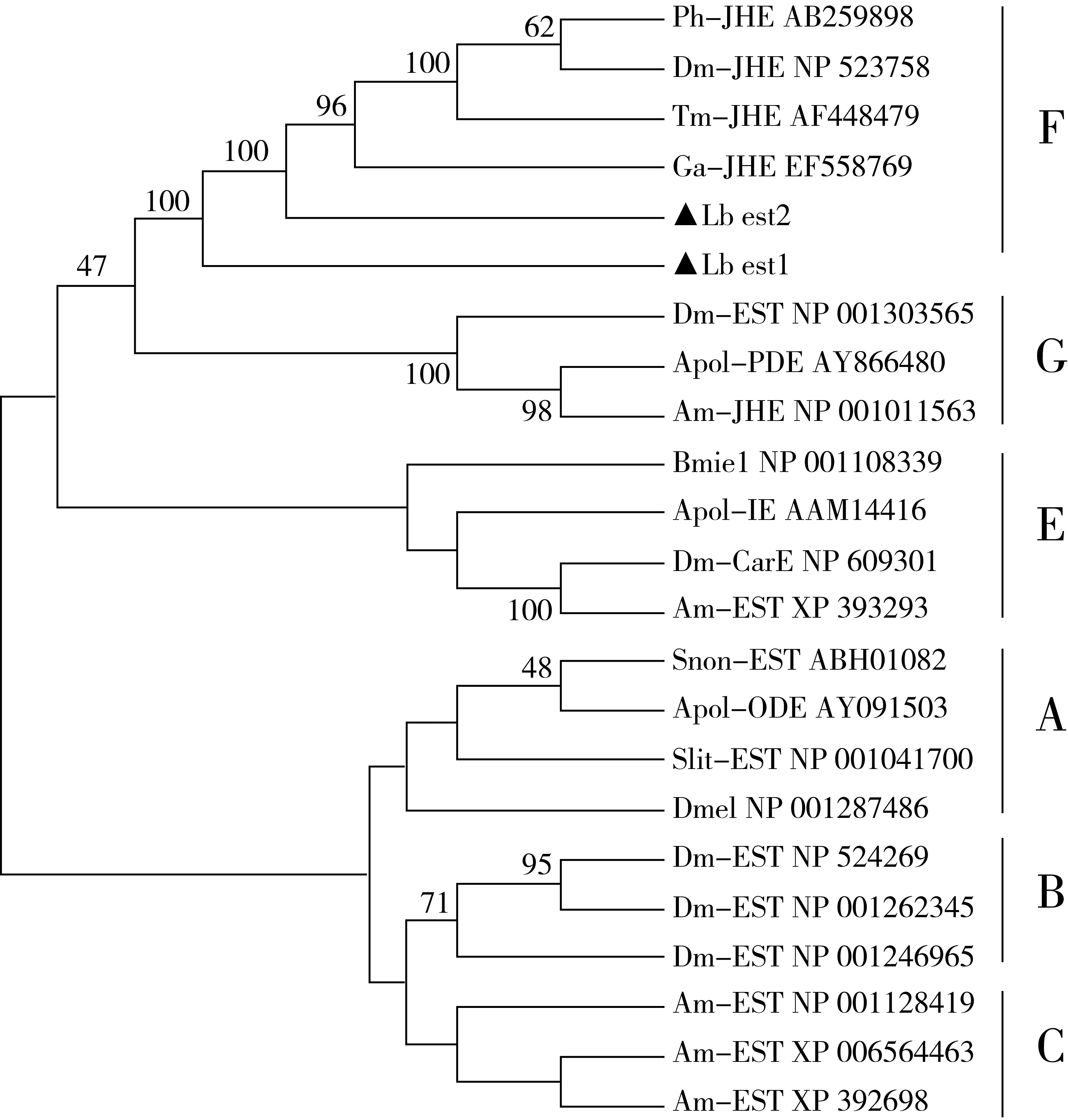
注: Ph为黄星天牛; Dm为黑腹果蝇; Tm为黄粉虫; Ga为蟋蟀; Apol为蚕蛾; AM为蜜蜂; Bm为家蚕; Snon为地中海玉米螟; Slit为斑马鱼图4 昆虫CarE和酯酶氨基酸序列的聚类分析
2.4 2条CarE基因在不同品系中的表达水平研究
嗜卷书虱2个CarE基因(Lbest1和Lbest2)在不同品系中的相对表达水平见图5。在嗜卷书虱体内Lbest2的表达水平显著高于Lbest1,在敌敌畏抗性品系、磷化氢抗性品系以及敏感品系中的比值分别达到2.22、1.85和1.65倍(P<0.05)。其中Lbest1在抗性品系中的表达水平高于敏感品系,但差异未达显著水平(P>0.05)。Lbest2在两抗性品系中的表达水平均显著高于敏感品系(P<0.05),其中在敌敌畏抗性品系中的表达水平最高,达到敏感品系的1.9倍,在磷化氢抗性品系中的表达水平是敏感品系的1.4倍。
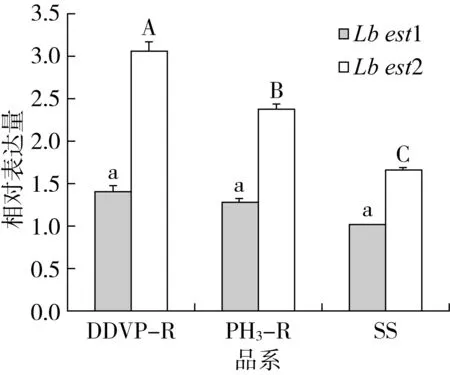
注:同一颜色柱上不同字母表示差异显著 (P<0.05),余同。图5 嗜卷书虱2个CarE基因在不同品系中表达水平的比较
2.5 药剂处理对CarE基因mRNA表达水平的影响
从图6中可以看出,敌敌畏和磷化氢均可诱导嗜卷书虱体内2个CarE基因的过量表达。Lbest1经敌敌畏和磷化氢处理后表达量分别是对照的1.76和1.47倍,三者之间差异达显著水平(P< 0.05)。同样,Lbest2经敌敌畏和磷化氢处理后表达量分别是对照的1.65和1.84倍。

图6 嗜卷书虱2个CarE基因在药剂处理前后表达水平的比较
2.6不同发育阶段CarE基因mRNA表达水平的研究
嗜卷书虱CarE基因在不同发育阶段的相对表达水平见图7。Lbest1在低龄若虫期的表达水平较高,但随着昆虫的生长发育表达水平逐渐降低,成虫期表达水平最低。Lbest2在若虫期的表达水平较低,且在4个若虫龄期间的表达水平差异不显著,但都显著低于成虫期的表达水平(P<0.05)。

图7 嗜卷书虱2个CarE基因在不同发育阶段表达水平的比较
3 讨论
本研究从嗜卷书虱体内克隆得到2个CarE基因的全长序列,通过软件预测到2条基因均存在多个磷酸化位点,Lbest1无信号肽,所以也无糖基化位点,为非糖基化蛋白,这与Vaughan等[16]对蚊虫羧酸酯酶的结果类似,由此推测其并非胞内蛋白。而Lbest2预测到2个糖基化位点,糖基化修饰是生物体内最为重要的蛋白质翻译后修饰形式之一,有研究表明,糖基化修饰可以增强羧酸酯酶的稳定性[17-18],使用SignalP 3.0预测结果显示5’端有17个氨基酸组成的信号肽序列,因此该蛋白为分泌型蛋白。
聚类分析结果显示,Lbest1与Lbest2均被划分在F簇中,该簇主要由非鳞翅目昆虫的保幼激素酯酶组成[15]。保幼激素是昆虫发育和繁殖过程中的关键激素,会由于保幼激素酯酶的水解作用而影响其浓度高低,从而调节昆虫的生长发育[19-21]。有研究发现,具有水解保幼激素功能的氨基酸其催化三联体为S-E-H[22],这与本研究发现的Lbest1与Lbest2催化三联体序列一致。因此推测Lbest1与Lbest2在嗜卷书虱变态发育过程中起重要的调节作用。
基因定量分析结果显示,Lbest1在不同品系中的表达水平差异不显著;而不同发育时期的定量结果表明,该基因随着昆虫的生长发育表达水平逐渐降低,成虫期表达水平最低;结合聚类分析结果,认为Lbest1主要在调节昆虫的生长发育过程中起到重要作用。Lbest2在敌敌畏抗性品系中的表达水平最高,达到敏感品系的1.9倍,在磷化氢抗性品系中的表达水平是敏感品系的1.4倍,且2种药剂均可诱导该基因表达上调,说明Lbest2与敌敌畏和磷化氢的抗性有关。前人研究表明,羧酸酯酶介导害虫抗药性主要是通过提高对杀虫剂的水解活性,增强对杀虫剂的阻隔或者改变酶与底物的亲和力来发挥作用[23-24],而羧酸酯酶基因mRNA表达量的增加常常导致昆虫抗药性的增强[25-26]。嗜卷书虱Lbest2在抗性品系中的表达水平显著高于敏感品系而且在受到药剂处理时过量表达,由此推测Lbest2主要参与外源性物质的降解,具有代谢解毒的功能。
4 结论
本研究成功扩增了2条嗜卷书虱CarE基因,通过软件预测、同源性比对、qRT-PCR技术以及聚类分析等研究方法,比较并分析了2条嗜卷书虱CarE可能具有的功能,从而为解析嗜卷书虱生长发育过程及抗药性形成的机理以及嗜卷书虱抗药性治理提供了参考。
[1]Zhang Y, Wang L, Guo H, et al. A transcriptome-based screen of carboxylesterase-like genes that are involved in chlorpyrifos resistance inLaodelphaxstriatellus(Fallén)[J]. Pesticide Biochemistry and Physiology, 2012, 104(3): 224-228
[2]He P, Zhang Y N, Yang K, et al. An antenna-biased carboxylesterase is specifically active to plant volatiles inSpodopteraexigua[J]. Pesticide Biochemistry and Physiology, 2015, 123: 93-100
[3]Lü F G, Fu K Y, Li Q, et al. Identification of carboxylesterase genes and their expression profiles in the Colorado potato beetleLeptinotarsadecemlineatatreated with fipronil and cyhalothrin[J]. Pesticide Biochemistry and Physiology, 2015, 122: 86-95
[4]Wei P, Shi L, Shen G, et al. Characteristics of carboxylesterase genes and their expression-level between acaricide-susceptible and resistantTetranychuscinnabarinus(Boisduval)[J]. Pesticide Biochemistry and Physiology, 2016, 131: 87-95
[5]Dou W, Xiao L S, Niu J Z, et al. Characterization of the purified glutathione S-transferases from two psocidsLiposcelisbostrychophilaandL.entomophila[J]. Agricultural Sciences in China, 2010, 9(7): 1008-1016
[6]Grigoraki L, Balabanidou V, Meristoudis C, et al. Functional and immunohistochemical characterization of CCEae3a, a carboxylesterase associated with temephos resistance in the major arbovirus vectorsAedesaegyptiandAe.albopictus[J]. Insect Biochemistry and Molecular Biology, 2016, 74: 61-67
[7]Vontas J G, Hejazi M J, Hawkes N J, et al. Resistance—associated point mutations of organophosphate insensitive acetylcholinesterase, in the olive fruit flyBactroceraoleae[J]. Insect Molecular Biology, 2002, 11(4): 329-336
[8]Yang X Q. Gene expression analysis and enzyme assay reveal a potential role of the carboxylesterase gene CpCE-1 fromCydiapomonellain detoxification of insecticides[J]. Pesticide Biochemistry and Physiology, 2016, 129: 56-62
[9]许雄山, 韩召军, 王荫长. 羧酸酯酶与棉铃虫对有机磷杀虫剂抗性的关系[J]. 南京农业大学学报, 1999, 22(4): 41-44
Xu X S, Han S J, Wang Y C. Relationship between carboxylesterase and organophosphate resistance in Helicoverp aarmigera (Hübner) [J]. Journal of Nanjing Agricultural University, 1999, 22(4): 41-44
[10]邱艳, 宋旭红, 黄衍章. 玉米象成虫对 β-细辛醚中毒的行为反应及杀虫机理研究[J]. 中国粮油学报, 2014, 29(7): 80-85
Qiu Y, Song X H, Huang Y Z.Research on behavior response and insecticidal mechanism of β-asarone against Sitophilus zeamais adult[J].Journal of the Chinese Cereals and Oils Association, 2014, 29(7): 80-85
[11]张建琴, 葛娉婷, 李大琪, 等. 飞蝗羧酸酯酶基因 LmCesF1 的时空表达及与杀虫剂耐受性的关系[J]. 中国农业科学, 2014, 47(8): 1522-1530
Zhang J Q, Ge P T, Li D Q, et al. Spatio-Temporal Expression and insecticide tolerance analysis of carboxylesterase gene LmCesF1 from locusta migratoria[J]. Scientia Agricultura Sinica, 2014, 47(8): 1522-1530
[12]刘苏, 冯明峰, 何梦竹. 稻纵卷叶螟羧酸酯酶基因的鉴定与表达谱分析[J]. 应用昆虫学报, 2015, 52(3): 662-670
Liu S, Feng M F, He M Z. Identification and expression profiles of Cnaphalocrocis medinalis carboxylesterase genes[J]. Chinese Journal of Applied Entomology, 2015, 52(3): 662-670
[13]杨帅, 王玲, 赵奎军, 等. 大豆蚜羧酸酯酶基因 AgCarE 的克隆, 表达及活性分析[J]. 中国农业科学, 2012, 45(18): 3755-3763
Yang S, Wang L, Zhao K J, et al. Cloning, expression and activity analysis of Carboxylesterase gene from Aphis glycines (Hemiptera: Aphididae) [J]. Scientia Agricultura Sinica, 2012, 45(18): 3755-3763
[14]Wang J J, Tsai J H, Zhao Z M, et al. Development and reproduction of the psocidLiposcelisbostrychophila(Psocoptera: Liposcelididae) as a function of temperature[J]. Annals of the Entomological Society of America, 2000, 93(2): 261-270
[15]Yu Q Y, Lu C, Li W L, et al. Annotation and expression of carboxylesterases in the silkworm,Bombyxmori[J]. BMC Genomics, 2009, 10(1): 553
[16]Vaughan A, Hemingway J. Mosquito carboxylesterase Estα21 (A2). Cloning and sequence of the full-length cDNA for a major insecticide resistance gene worldwide in the mosquitoCulexquinquefasciatus[J]. Journal of Biological Chemistry, 1995, 270(28): 17044-17049
[17]周蕾, 顾建新. N-糖基化位点鉴定方法和非经典 N-糖基化序列[J]. 生命科学, 2011, 23(6): 605-611
Zhou L, Gu J X. N-glycosylation sites analysis and nonconsensus N-glycosylated sequences[J].Chinese Bulletin of Life Sciences, 2011, 23(6):605-611
[18]Kroetz D L, McBride O W, Gonzalez F J. Glycosylation-dependent activity of baculovirus-expressed human liver carboxylesterases: cDNA cloning and characterization of two highly similar enzyme forms[J]. Biochemistry, 1993, 32(43): 11606-11617
[19]Kamita S G, Hammock B D. Juvenile hormone esterase: biochemistry and structure[J]. Journal of Pesticide Science, 2010, 35(3): 265
[20]Zhang Y, Li S, Xu L, et al. Overexpression of carboxylesterase-1 and mutation (F439H) of acetylcholinesterase-1 are associated with chlorpyrifos resistance inLaodelphaxstriatellus[J]. Pesticide Biochemistry and Physiology, 2013, 106(1): 8-13
[21]Zhang J, Ge P, Li D, et al. Two homologous carboxylesterase genes fromLocustamigratoriawith different tissue expression patterns and roles in insecticide detoxification[J]. Journal of Insect Physiology, 2015, 77: 1-8
[22]Oakeshott J, Claudianos C, Campbell P M, et al. Biochemical genetics and genomics of insect esterases[J]. Comprehensive Molecular Insect Science, 2005, 5: 309-381
[23]Li X, Schuler M A, Berenbaum M R. Molecular mechanisms of metabolic resistance to synthetic and natural xenobiotics[J]. Annual Review of Entomology, 2007, 52: 231-253
[24]Li F, Han Z. Mutations in acetylcholinesterase associated with insecticide resistance in the cotton aphid,AphisgossypiiGlover[J]. Insect Biochemistry and Molecular Biology, 2004, 34(4): 397-405
[25]Feng Q L, Ladd T R, Tomkins B L, et al. Spruce budworm (Choristoneurafumiferana) juvenile hormone esterase: hormonal regulation, developmental expression and cDNA cloning[J]. Molecular and Cellular Endocrinology, 1999, 148(1): 95-108
[26]Huang S J, Qin W J, Chen Q. Cloning, sequence analysis and expression levels of a carboxylesterase gene fromSpodopteralitura(Fab.)(Lepidoptera: Noctuidae)[J]. Acta Entomologica Sinica, 2010, 53(1): 29-37.
Gene Cloning of Carboxylesterases and mRNA Expression Level inLiposcelisBostrychophila
Tang Peian1Li Feifan1Wang Jinjun2Shen Fei1Song Wei1
(College of Food Science and Engineering; Collaborative Innovation Center for Modern Grain Circulation and Safety. Nanjing University of Finance and Economics1, Nanjing 210023) (Key Laboratory of Entomology and Pest Control Engineering, Southwest University2, Chongqing 400716)
The objective of this study was to explore the function of carboxylesterase gene in pesticide detoxification. TheLbest1 andLbest2 encoding CarE (GenBank Accession No are EU854151 and EU854152) were cloned fromL.bostrychophilain the way of reverse transcriptase PCR (RT-PCR) and rapid amplification of cDNA ends (RACE). Full-length of these two genes were 2 049 and 2 525 bp, encoded 570 and 617 amino acids, the isoelectric point were 6.85 and 4.74 respectively. Phosphorylation sites were predicted and gene sequences were analyzed, both two genes contained the catalytic activity sites and conserved sequences of the insect carboxylesterase gene as a result. Cluster analysis showed that these two genes were clustered in clade F catalytic activity sites. qRT-PCR (quantitative real time PCR) was used to test the mRNA expression level of these two carboxylesterase gene among different strains, different developmental stages, and after treatment by DDVP or PH3were also studied. Based on the results, it was concluded thatLbest1 could regulate the growth and development of insects,Lbest2 might play an important role in metabolic detoxification and degradation of exogenous substances.
liposcelisbostrychophila, carboxylesterases, resistance mechanism, gene clone
S482.6
A
1003-0174(2017)10-0130-10
国家重点研发专项(2016YFD0401004、2017YFD040 1003),粮食公益性行业科研专项(201413007-2、201513002-5),江苏高校优势学科建设工程资助(JSYXK201403)
2017-04-30
唐培安,男,1981年出生,副教授,粮食储藏
王进军,男,1970年出生,教授,昆虫学

