从木榄叶片超微结构所受的影响评估外来种拉关木的化感作用
王秀丽, 周亮,, 卢昌义,,*
1.厦门大学环境与生态学院, 厦门 361102 2.河口生态安全与环境健康福建省高校重点实验室(厦门大学嘉庚学院), 漳州 363105
从木榄叶片超微结构所受的影响评估外来种拉关木的化感作用
王秀丽1, 周亮1,2, 卢昌义1,2,*
1.厦门大学环境与生态学院, 厦门 361102 2.河口生态安全与环境健康福建省高校重点实验室(厦门大学嘉庚学院), 漳州 363105
探讨外来速生红树植物拉关木(Laguncularia racemosa)扩张过程中潜在的化感作用,为其入侵风险评估提供参考。通过室内栽培试验测定拉关木根、枝、叶、果的水浸液不同质量浓度(0.1 g·mL–1、0.5 g·mL–1)对我国乡土红树植物木榄(Bruguiera gymnorhiza)幼苗叶片超微结构的影响。结果表明,在拉关木根、叶、果的水浸液低浓度(0.1 g·mL–1)处理下,木榄幼苗的叶肉细胞内的叶绿体紧密排列在细胞壁周围,线粒体结构保持完好; 而在拉关木枝的水浸液低浓度(0.1 g·mL–1)处理下,木榄幼苗叶肉细胞内的液泡轻微皱缩,出现轻微的质壁分离现象。拉关木枝、果水浸液高浓度(0.5 g·mL–1)处理下,木榄幼苗叶片叶肉细胞的叶绿体内的淀粉粒变多,变大,线粒体内部结构出现降解;拉关木根的水浸液高浓度(0.5 g·mL–1)处理下,部分叶绿体结构受到破坏,但线粒体结构基本保持较好;而在拉关木叶的水浸液高浓度(0.5 g·mL–1)处理下,木榄叶片叶肉细胞的超微结构基本保持完好,表明拉关木叶水浸液对木榄幼苗的化感抑制作用弱。本研究中拉关木各器官高浓度(0.5 g·mL–1)水浸液对木榄幼苗叶片超微结构的化感作用强弱顺序为:枝>果>根>叶。
外来种;拉关木;木榄;超微结构;化感作用
1 前言
外来植物入侵被视为 21世纪全球三大最棘手的环境问题之一[1–3]。在外来植物入侵机制中,化感作用被认为外来入侵植物成功入侵新自然生境的“新奇武器”Novel weapons hypthesis[4–5],近年越来越受到重视[6–7]。化感作用是植物通过释放化学物质促进或抑制邻近植物生长的相互作用机制[8–9]。化感物质可通过植物的不同组织(根、枝、叶、果)释放到环境中[10–12]。由于缺乏共同的进化史,入侵植物的化感作用等拮抗特征,其在与本土植物进行资源竞争时占据优势[13]。此外,外来植物所分泌的化感物质可在土壤中持久保留,这将对该区域的植物种类多样性及整个生态系统造成潜在影响[14–15]。
前人对外来植物化感作用方面的研究主要从宏观的层面,集中在化感物质对受体植物或本地植物种子的萌发率、幼苗生长、生理生化及根系形态等方面的影响[16–20],而从微观层面对叶片细胞超微结构的研究较少[21–22]。叶绿体是叶绿素的存在位点,也是植物进行光合作用的场所,化感作用对叶绿体、线粒体等超微结构的影响直接关系到植物的生长。位于潮间带的红树林湿地同样遭受外来植物的入侵[23–25],国内外关于红树林湿地入侵植物的研究也有报道[26–27]。拉关木Laguncularia racemoseL.Gaertn.F.,属于使君子科(Combretaceae),是真红树植物的一种,广泛分布于南美、西印度群岛、百慕大群岛、西非、以及佛罗里达沿岸[28],1999年从墨西哥拉巴斯市引入海南东寨港红树林区[29]。拉关木具有生长速度快、树高茎粗、适应能力强等特性,广泛用作我国河口海岸带红树林造林的先锋树种。由于拉关木的速生快长特性,其引进是否会造成入侵值得关注。那么,拉关木是否会对其它乡土红树植物产生化感作用?木榄是我国的乡土红树植物种之一,在我国分布广泛,并和外来红树植物拉关木生境条件相似,因此,了解木榄受拉关木化感作用的影响将有助于评估外来红树植物拉关木对本土红树植物可能的影响,为今后合理引进该树种以及红树林生态系统的保护管理提供参考。
2 材料与方法
2.1 拉关木水浸液的制备
水浸液的制备参照李玫等[30]的无瓣海桑水浸液的制备方法。2015年9月从福建省龙海市浮宫镇溪山村的九龙江支流(117°53'E, 24°20'N)的6年生的拉关木人工林(基本概况:平均树高为7.03 m,平均胸径为14.03 cm,林分密度为2958株·hm–2)的根、枝、叶、果鲜样品,将采回的样品带回室内洗净、称重量,将各器官剪碎(<2 cm),分别放入塑料桶中,按比例加蒸馏水配置成质量浓度为0.5 g·mL–1的溶液,浸泡期间,每隔12 h搅拌10 min,三天后用双层纱布过滤两次制成母液,置于带盖的塑料瓶中4 ℃冰箱保存备用。
待处理实验苗时,从冰箱取出拉关木的根、枝、叶、果的母液,分别按比例加入蒸馏水配置成质量浓度为0.1 g·mL–1的水浸液。使用前取出放置一段时间,避免骤冷对受体幼苗的影响[31]。
2.2 试验设计
2015年7月从福建龙海浮宫镇草埔头村的九龙江入海口(107°53'E,24°20'N)处的木榄红树林区采成熟的木榄胚轴,用于受体植物木榄幼苗的培育。木榄幼苗培育:所用的试验花盆为高 17 cm,直径为21 cm,盆内基质为漳州龙海红树林区采集的海沙,每盆种植8支胚轴,共27盆,每3 天浇适量水,待苗生长15 天时,对每盆幼苗浇500 mL的红树林营养液,营养液的配置参照李春强等[32]的“红树林营养液”配方,略加改动〔(配方:1000 mL蒸馏水中加入以下成分:Ca(NO3)2: 1.0 g, NaH2PO4: 0.25 g,FeCl3: 0.005 g, MgSO4: 0.25 g, KCl: 0.12 g)〕。本实验中木榄幼苗的培育主要在实验室走廊的空间,温度、光照均较稳定,条件接近自然,雨水不会淋到培育的苗。待木榄胚轴萌芽长根,幼苗定植1个月后,对其进行化感处理。
受体植物化感处理参照李玫等[24]对受体植物白骨壤的处理方法,略加改动。将供体拉关木的根、枝、叶、果的水浸液分别设置 2个不同质量浓度处理组(0.1 g·mL–1和 0.5 g·mL–1)和 1 个对照组。每组3盆,每隔 10 天每盆加入相应质量浓度的水浸液50 mL,对照组加入清水,试验时间持续2个月。
2.3 透射电镜观察
化感处理2个月后,从各处理组3个重复处理盆中分别随机选择一株木榄幼苗成熟叶片(从植株顶部往下第2对叶片)中部主脉两侧用刀片迅速切取约1 mm×1 mm的条形叶样,将同一浓度处理3个重复的条形叶样混合,用 2.5%的戊二醛固定(0.1 g·mL–1,pH 7.4的磷酸盐缓冲液固定),抽气使材料沉底,在4℃冰箱里固定24 h,用0.1 mol·L–1PBS漂洗,用1% OsO4在4 ℃避光固定2—3 h,蒸馏水浸洗,经系列浓度乙醇脱水后,用618树脂包埋,用EM UC7RT型超薄切片机进行切片60—80 nm,切片用 3%醋酸铀-枸橼酸铅双染色,在 JEOL JEM—2100型透射电子显微镜下进行观察及拍片。
3 结果与分析
对照组中的木榄幼苗叶片叶肉细胞的低倍和高倍放大倍数下的超微结构图(图1A):细胞膜结构完整,叶绿体整齐的紧贴细胞壁,呈规则的长梭形,基粒片层和类囊体片层结构清晰,叶绿体膜结构清晰,排列整齐,部分叶绿体含有一个淀粉颗粒,淀粉颗粒呈椭圆形。线粒体呈圆球形或椭圆形,双层膜结构完整,内嵴清晰可见。
3.1 拉关木根水浸液的影响作用

图1 对照与拉关木根的水浸液(0.1 g·mL–1、0.5 g·mL–1)处理下的木榄幼苗叶片超微结构图Fig.1 TEM micrographs of B.gymnorhiza samples after culturing in aqueous extracts free and in different concentrations(0.1 g·mL–1, 0.5 g·mL–1) of aqueous extract of L.racemosa root
拉关木根的水浸液低浓度(0.1 g·mL–1)处理下,木榄幼苗叶片的叶肉细胞中的细胞膜清晰,叶绿体数量变多且形态变圆,紧密沿着细胞壁排列,液泡大,线粒体紧挨叶绿体排列,部分叶绿体含一个淀粉颗粒,呈圆形(图1B);叶绿体出现轻微膨胀,靠近细胞壁一侧的叶绿体内颗粒变多,线粒体有圆形、椭圆形或哑铃形,线粒体外模结构清晰,内部嵴丰富(图1C)。拉关木根的水浸液高浓度(0.5 g·mL–1)处理下,木榄幼苗叶片的叶肉细胞的叶绿体仍沿着细胞壁周围分布,部分叶绿体形态结构基本保持完好,但部分叶绿体结构出现破坏现象,部分叶绿体含一个淀粉颗粒,呈椭圆形(图1D)。部分叶绿体膜出现破裂,内含的塑性球增多,类囊体片层膨胀(图1E),线粒体基本保持完好,双层膜模糊不清(图1 F)。
3.2 拉关木枝水浸液的影响作用
在拉关木枝的水浸液低浓度(0.1 g·mL–1)处理下,木榄幼苗叶片的叶肉细胞超微结构发生了变化,液泡出现皱缩,发生质壁分离现象,叶绿体为长梭形或椭圆形,大部分叶绿体仍紧贴细胞壁排列,个别叶绿体排列脱离细胞壁(图2A);线粒体为椭圆形,线粒体膜结构基本无变化,双层膜结构完好,内部嵴较丰富(图2B);叶绿体的类囊体片层排列整齐,一个叶绿体内出现2个淀粉颗粒(图2C)。在拉关木枝的水浸液高浓度(0.5 g·mL–1)处理下,木榄幼苗叶片的叶肉细胞呈现一定的受害现象,胞壁界限不清晰,出现多个叶绿体黏连在一起,部分叶绿体变形呈长条状,且排列脱离细胞壁(图2D);线粒体遭受破坏,多个线粒体聚集在一起,基质解体,出现空泡化(图2E);叶绿体的类囊体片层变模糊,淀粉颗粒变圆形且数量增加(图2F)。
3.3 拉关木叶水浸液的影响作用
在拉关木叶的水浸液低浓度(0.1 g·mL–1)处理下,木榄幼苗叶片的叶肉细胞的液泡出现轻微皱缩,发生质壁分离,叶绿体为椭圆形或圆形,紧贴细胞壁排列(图 3A和B),叶绿体被膜清晰,类囊体片层排列紧密,未出现扩张现象,线粒体膜结构基本完,内部嵴较丰富(图3C)。在拉关木叶的水浸液高浓度(0.5 g·mL–1)处理下,木榄幼苗叶片的叶肉细胞内的叶绿体为圆形或不规则形,沿细胞壁排列,叶绿体内的嗜锇颗粒数量增多,淀粉颗粒变大,圆形或不规则形(图3D),部分叶绿体出现肿胀,类囊体片层变模糊(图3E)。线粒体膜基本保持完好,内部嵴较丰富(图3F)。
3.4 拉关木果水浸液的影响作用
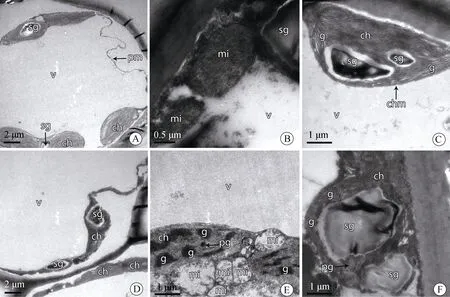
图2 拉关木枝的水浸液(0.1 g·mL–1、0.5 g·mL–1)处理下的木榄幼苗叶片超微结构图Fig.2 TEM micrographs of B.gymnorhiza samples after culturing in different concentrations (0.1 g·mL–1, 0.5 g·mL–1) of aqueous extract of L.racemosa stem
在拉关木果的水浸液低浓度(0.1 g·mL–1)处理下,木榄幼苗叶片的叶肉细胞超微结构与对照组比差异不大。木榄幼苗叶片的叶肉细胞中的细胞膜清晰,叶绿体为长梭形,规则的紧贴细胞壁排列,叶绿体内含有淀粉颗粒和嗜锇颗粒(图4A);叶绿体被膜清晰且连续不断,类囊体片层清晰且排列紧密(图4B和 C);线粒体呈圆球形或椭圆形,双层膜结构完整且连续不断,内嵴清晰可见(图4D)。在拉关木果的水浸液高浓度(0.5 g·mL–1)处理下,木榄幼苗叶片的叶肉细胞的大部分叶绿体结构受到破坏,多个叶绿体黏连成一团,内含的淀粉颗粒变大且数目增多(图 4E);线粒体处在细胞壁与叶绿体之间,外膜轮廓模糊不清,内部结构出现轻微降解线粒体基质部分解体,内嵴模糊(图4F)。

图3 拉关木叶的水浸液(0.1 g·mL–1、0.5 g·mL–1)处理下的木榄幼苗叶片超微结构图Fig.3 TEM micrographs of B.gymnorhiza samples after culturing in different concentrations (0.1 g·mL–1, 0.5 g·mL–1) of aqueous extract of L.racemosa leaf

图4 拉关木果的水浸液(0.1 g·mL–1、0.5 g·mL–1)处理下的木榄幼苗叶片超微结构图Fig.4 TEM micrographs of B.gymnorhiza samples after culturing in different concentrations (0.1 g·mL–1, 0.5 g·mL–1) of aqueous extract of L.racemosa fruit
3.5 拉关木各部位水浸液对木榄幼苗叶肉细胞超微结构的影响特征
由表1可知,我国乡土红树植物木榄幼苗对拉关木不同器官不同浓度水浸液的化感作用响应方面,有相似之处,拉关木根、果水浸液低浓度(0.1 g·mL–1)处理均使木榄幼苗叶片叶肉细胞的叶绿体数量增加,可促进木榄幼苗的生长;拉关木叶水浸液低浓度(0.1 g·mL–1)处理下,木榄幼苗叶片的超微结构基本保持完好;而拉关木枝水浸液低浓度(0.1 g·mL–1)处理均导致木榄幼苗叶片叶肉细胞出现质壁分离现象,一定程度上影响木榄幼苗的生长。在拉关木枝、果水浸液高浓度(0.5 g·mL–1)处理下,木榄叶片叶肉细胞的超微结构均受到不同程度的破坏,线粒体内部结构出现降解,叶片细胞超代谢功能受到影响,从而抑制乡土红树植物木榄幼苗的生长;拉关木根的水浸液高浓度(0.5 g·mL–1)处理下,部分叶绿体结构受到破坏,但线粒体结构保持较好。而在拉关木叶的水浸液高浓度(0.5 g·mL–1)处理下,木榄幼苗叶片叶肉细胞的超微结构基本保持完好,表明拉关木叶水浸液对木榄幼苗的化感抑制作用最弱。
4 讨论

表1 拉关木各部位水浸液对木榄幼苗叶片超微结构的影响特征Tab.1 Effects of leaf ultrastructure of B.gymnorhiza seedlings samples after culturing in different organs of aqueous extract of L.racemosa
本研究揭示了拉关木不同器官水浸液对受体植物木榄幼苗叶肉细胞超微结构的形态变化的化感影响。关于陆地或水生生态系统的化感抑制或化感促进作用现象的研究已有报道[22,33]。供体植物对受体植物生长的化感抑制作用通常与受体植物细胞器结构(如叶绿体,线粒体等)受到强烈破坏有关[34]。叶绿体是植物进行光合作用的场所,光合性能的好坏决定了植物能否正常生长,完整的叶绿体结构是保证植物进行正常光合的前提[35]。线粒体是氧化磷酸化、释放能量的场所,其数目与细胞的生理功能及需求密切相关,一般需要能量较多的细胞中线粒体数目也较多[36]。前人研究表明化感作用强度与化感物质浓度密切相关[37–38]。本研究中,在拉关木各器官水浸液浓度为0.1 g·mL–1处理下,木榄幼苗的叶肉细胞内的各细胞器结构基本保持完好。在拉关木不同器官浓度为0.5 g·mL–1水浸液处理下,木榄幼苗叶肉细胞内的细胞器出现不同程度的破坏。
前人研究表明,同一植物不同部位的水浸液对受体植物的生长具有不同的化感效应[39–40]。本研究结果也表明,拉关木不同器官水浸液对木榄幼苗叶肉细胞超微结构的影响也是不同的。在拉关木根、果的水浸液低浓度(0.1 g·mL–1)处理下,木榄幼苗的叶肉细胞内的叶绿体结构完好且数量变多,紧密排列在细胞壁周围,单位面积叶绿体数量的增加,使木榄幼苗叶片的叶绿素含量增加,有利于木榄幼苗叶片光合作用的增强,反而可促进木榄幼苗的生长;叶绿体结构与光合作用密切相关,叶绿体基粒数和基粒片层数越多,光合能力越强[41–42]。而在拉关木枝的水浸液低浓度(0.1 g·mL–1)处理下,木榄幼苗叶肉细胞内的液泡轻微皱缩,出现轻微的质壁分离现象,抑制木榄幼的生长;表明低浓度(0.1 g·mL–1)的拉关木枝水浸液对木榄幼苗的抑制作用强于拉关木根、叶、果低浓度(0.1 g·mL–1)水浸液对木榄幼苗的影响。本研究中,在拉关木根的水浸液高浓度(0.5 g·mL–1)处理下,木榄幼苗叶绿体内塑性球含量增加,这是细胞衰老的症状,因这些内含物来源于类囊体降解的脂滴所形成[43]。不同环境胁迫导致的塑性球数量的增加与更高水平的具有酶和结构功能的塑性球特异性蛋白相关[15]。塑性球蛋白作为叶绿体中的脂质储库,在环境胁迫下作为蛋白质合成和再循环的活性位点[44]。因此,木榄幼苗叶肉细胞内塑性球数量的增加,可能是木榄对拉关木根的水浸液的毒性的反应。此外,本研究结果表明,在拉关木根的水浸液浓度为0.5 g·mL–1时,木榄幼苗叶肉细胞内的叶绿体膜破裂及类囊体结构受到破坏。该结果与 Wang等[45]对镉胁迫下水稻幼苗叶肉细胞的类囊体膜系统松散或解体的研究结果相似。拉关木枝水浸液高浓度(0.5 g·mL–1)处理下,木榄叶片叶肉细胞的超微结构受到不同程度的破坏,线粒体内部结构出现降解,叶片细胞超代谢功能受到影响,从而抑制乡土红树植物木榄幼苗的生长。本研究中,在拉关木果的水浸液处理浓度为0.5 g·mL–1时,木榄幼苗叶肉细胞内的淀粉颗粒的数量明显增加。由于木榄幼苗叶肉细胞内线粒体结构的破坏,因此,淀粉颗粒作为呼吸底物的功能停止并在叶绿体内积累[46]。本研究中,在拉关木叶的水浸液处理浓度为0.5 g·mL–1时,木榄幼苗叶片的叶肉细胞结构基本保持完好,表明木榄幼苗对拉关木叶的水浸液有较强的耐受性。
5 结论
综上所述, 拉关木不同器官水浸液对木榄幼苗叶片超微结构的形态变化存在不同程度的化感影响;拉关木各器官低浓度(0.1 g·mL–1)水浸液处理下,木榄幼苗叶肉细胞的超微结构基本保持完好,但在拉关木各器官高浓度(0.5 g·mL–1)水浸液对木榄幼苗叶片超微结构的化感作用强弱顺序为:枝>果>根>叶。但本研究表明的拉关木对木榄幼苗具有潜在的化感作用仅是在实验室条件下以水浸液处理对木榄幼苗叶片超微结构的影响,不能完全反映其在自然条件下的化感作用规律。自然条件下,由于海洋潮汐流动的作用和巨大的水体稀释,植物体浸出液的浓度累积难于达到实验室里水浸液处理的高浓度。今后需对拉关木在野外自然条件下对乡土红树植物的化感作用的实际效果进行研究。此外, 今后的研究需比较外来红树植物拉关木和本土红树植物的化感作用强弱,因为外来种的化感作用必须比本土植物相互间的化感作用更强时,才可能导致入侵成功。因此,拉关木化感作用仍有待更深入研究,以进一步明确其化感物质和作用机理等,以期为引进红树植物种拉关木的风险评估提供参考。
[1]MATSUMOTO J, MURAOKA H, WASHITANI I.Whole plant carbon gain of an endangered herbaceous speciesAster kantoensisand the influence of shading by an alien grassEragrostis curvulain its gravelly floodplain habitat[J].Annals of Botany, 2000, 86(4): 787–797.
[2]BRUCKMAN D, CAMPBELL D R.Pollination of a native plant changes with distance and density of invasive plants in a simulated biological invasion[J].American Journal of Botany, 2016, 103(8): 1458–1465.
[3]CAPO E A, AGUILAR R, RENISON D.Livestock reduces juvenile tree growth of alien invasive species with a minimal effect on natives: a field experiment using exclosures[J].Biological Invasions, 2016, 18(10): 2943–2950.
[4]CALLAWAY R M, RIDENOUR W M.Novel Weapons:Invasive Success and the Evolution of Increased Competitive Ability[J].Frontiers in Ecology & the Environment,2004, 2(8): 436–443.
[5]陈圣宾, 李振基.外来植物入侵的化感作用机制探讨[J].生态科学, 2005, 24(1): 69–74.
[6]BAIS H P, VEPACHEDU R, GILROY S, et al.Allelopathy and exotic plant invasion: from molecules and genes to species interactions [J].Science, 2003, 301(5638): 1377–1380.
[7]李军, 王瑞龙.入侵植物肿柄菊叶片凋落物化感潜力的研究[J].生态科学, 2015, 34(6): 100–104.
[8]MAY F E, Ash J E.An assessment of the allelopathic potential of eucalyptus[J].Australian Journal of Botany,1990, 38(3): 245–254.
[9]WU H W, HAIG T, PRATLEY J, et al.Distribution and exudation of allelochemicals in wheatTriticum aestivum[J].Journal of Chemical Ecology, 2000, 26(9): 2141–2154.
[10]SODAEIZADEH H, RAFIEIOLHOSSAINI M, HAVLIK J,et al.Allelopathic activity of different plant parts ofPeganum harmalaL.and identification of their growth inhibitors substances[J].Plant Growth Regulation, 2009,59(3): 227–236.
[11]PARVEZ S S, PARVEZ M M, FUJII Y, et al.Differential allelopathic expression of bark and seed ofTamarindus indicaL[J].Plant Growth Regulation, 2004, 42(3): 245–252.
[12]WESTON L A, DUKE S O.Weed and crop allelopathy[J].Critical Reviews In Plant Sciences, 2003, 22(3-4): 367–389.
[13]CALLAWAY R M, RIDENOUR W M.Novel weapons:invasive success and the evolution of increased competitive ability[J].Frontiers in Ecology and the Environment, 2004,2(8): 436–443.
[14]PRATI D, BOSSDORF O.Allelopathic inhibition of germination byAlliaria petiolata(Brassicaceae)[J].American Journal of Botany, 2004, 91(2): 285–288.
[15]STINSON K A, CAMPBELL, SA, POWELL, J R, et al.Tocopherol cyclase (VTE1) localization and vitamin E accumulation in chloroplast plastoglobule lipoprotein particles[J].Journal of Biological Chemistry, 2006, 281(16):11225–11234.
[16]任艳萍, 江莎, 古松, 等.外来植物黄顶菊根、茎、叶的化感作用初探[J].植物保护, 2009, 35(3): 36–40.
[17]周文杰, 李建明, 芦站根.外来植物黄顶菊水浸提液对绿豆种子萌发及生长的影响[J].江苏农业科学, 2007(4):72–74.
[18]许桂芳, 周修任, 王鸿升, 等.外来植物土荆芥的化感作用潜力[J].江苏农业学报, 2011, 27(1):223–225.
[19]LORENZO P, PALOMERA-PEREZ, A, REIGOSA, M J, et al.Allelopathic interference of invasiveAcacia dealbataLink on the physiological parameters of native understory species[J].Plant Ecology, 2011, 212(3): 403–412.
[20]CHU C J, MORTIMER P E, WANG H C, et al.Allelopathic effects ofEucalyptuson native and introduced tree species[J].Forest Ecology and Management, 2014, 323,79–84.
[21]CHON S U, NELSON C J.Allelopathy in Compositae plants.A review[J].Agronomy for Sustainable Development, 2010, 30(2): 349–358.
[22]GRANA E, SOTELO T, DIAZ-TIELAS C., et al.Citral induces auxin and ethylene-mediated malformations and arrests cell division inArabidopsis thalianaroots[J].Journal of Chemical Ecology, 2013, 39(2): 271–282.
[23]BRIDGEWATER P B, CRESSWELL I D.Biogeography of mangrove and saltmarsh vegetation: implications for conservation and management in Australia[J].Mangroves and Salt Marshes, 1999, 3(2): 117–125.
[24]BISWAS S R, CHOUDHURY J K, NISHAT A, et al.Do invasive plants threaten the Sundarbans mangrove forest of Bangladesh?[J].Forest Ecology & Management, 2007,245(1): 1–9.
[25]REN H, GUO Q F, LIU H, et al.Patterns of alien plant invasion across coastal bay areas in southern China[J].Journal of Coastal Research, 2014, 30(3): 448–455.
[26]DONNELLY M J, GREEN D M, WALTERS L J.Allelopathic effects of fruits of the Brazilian pepper Schinus terebinthifolius, on growth, leaf production and biomass of seedlings of the red mangrove Rhizophora mangle, and the black mangrove Avicennia germinans[J].Journal of Experimental Marine Biology & Ecology, 2008,357(2): 149–156.
[27]WILLIS, MAJA, ZERBE S, et al.Distribution and Ecological Range of the Alien Plant Species Mikania micrantha Kunth (Asteraceae) in Taiwan[J].Journal of Ecology & Environment, 2008, 31(4): 277–290.
[28]JIMENEZ J A, ENCARNOCION L.Massive tree mortality in Puerto Rican mangroves forests[J].Caribbean Journal of Science, 1985, 21: 75–78.
[29]廖宝文, 郑松发, 陈玉军, 等.海南东寨港几种国外红树植物引种初报[J].中南林学院学报, 2006, 26(3): 63–67.
[30]李玫, 廖宝文, 郑松发, 等.无瓣海桑对乡土红树植物的化感作用[J].林业科学研究, 2004, 17(5):641–645.
[31]PISULA N L, MEINERS S J.Relative allelopathic potential of invasive plant species in a young disturbed woodland[J].Journal of the Torrey Botanical Society, 2010,137(1): 81–87.
[32]李春强, 刘志昕, 黎娟华, 等.红树植物化感作用对中肋骨条藻生长的影响[J].热带作物学报, 2009, 30 (6): 862–867.
[33]LI F M, HU H Y.Isolation and characterization of a novel antialgal allelochemical fromPhragmites communis[J].Applied and Environmental Microbiology, 2005, 71 (11):6545–6553.
[34]GNIAZDOWSKA A, BOGATEK R.Allelopathic interactions between plants.Multi site action of allelochemicals[J].Acta Physiologiae Plantarum, 2005, 27(3B): 395–407.
[35]孟凡娟, 庞洪影, 王建中, 等.NaCl和Na2SO4胁迫下两种刺槐叶肉细胞叶绿体超微结构[J].生态学报, 2011,31(3):734–741.
[36]汪堃仁, 薛绍白, 柳惠图.细胞生物学[M].北京: 北京师范大学出版社, 1998.
[37]SCHRADER K K, RIMANDO A M, TUCKER C S, et al.Evaluation of the natural productSeaKleenfor controlling the musty-odor-producing cyanobacteriumOscillatoria perornatain catfish ponds[J].North American Journal of Aquaculture, 2004, 66(1): 20–28.
[38]NAKAI S, YAMADA S, HOSOMI M.Anti-cyanobacterial fatty acids released fromMyriophyllum spicatum[J].Hydrobiologia, 2005, 543: 71–78.
[39]CHUNG I M, SEIGLER D, MILLER DA, et al.Autotoxic compounds from fresh alfalfa leaf extracts: Identification and biological activity[J].Journal of Chemical Ecology,2000, 26(1): 315–327.
[40]SCRIVANTI L R.Allelopathic potential ofBothriochloa laguroidesvar.laguroides(DC.)Herter(Poaceae: Andropogoneae)[J].Flora, 2010, 205(5): 302–305.
[41]BURGOS N R, TALBERT R E, KIM KS, et al.Growth inhibition and root ultrastructure of cucumber seedlings exposed to allelochemicals from rye (Secale cereale)[J].Journal of Chemical Ecology, 2004, 30(3): 671–689.
[42]CRUZ-ORTEGA R, ANAYA A L, HERNANDEZBAUTISTA B E, et al.Effects of allelochemical stress produced by Sicyos deppei on seedling root ultrastructure ofPhaseolus vulgarisandCucurbita ficifolia[J].Journal of Chemical Ecology, 1998, 24(12): 2039–2057.
[43]GHOSH S, MAHONEY S R, PENTERMAN J N, et al.Ultrastructural and biochemical changes in chloroplasts duringBrassica napussenescence[J].Plant Physiology and Biochemistry, 2001, 39(9): 777–784.
[44]ALVES L Q, DE JESUS R M, DE ALMEIDA A F, et al.Effects of lead on anatomy, ultrastructure and concentration of nutrients in plantsOxycaryum cubense(Poep.& Kunth)Palla: a species with phytoremediator potential in contaminated watersheds[J].Environmental Science and Pollution Research, 2014, 21(10): 6558–6570.
[45]WANG Y W, JIANG X H, LI K, et al.Photosynthetic responses ofOryza sativaL.seedlings to cadmium stress:physiological, biochemical and ultrastructural analyses[J].Biometals, 2014, 27(2): 389–401.
[46]SANTOS I, ALMEIDA J M, SALEMA R.Plants ofzea-maysL.developed under enhanced UV-B radiation.1.Some ultrastructural and biological aspects[J].Journal of Plant Physiology, 1993, 141(4): 450–456.
Allelopathic effects of exotic mangrove species Laguncularia racemosa on leaf ultrastructure of Bruguiera gymnorhiza seedlings
WANG Xiuli1, ZHOU Liang1,2, LU Changyi1,2,*
1.College of Environment and Ecology,Xiamen University,Xiamen361102,China2.Key Laboratory of Estuarine Ecological Security and Environmental Health of Fujian Province University,Tan Kah Kee College,Xiamen University,Zhangzhou363105,China
In order to provide a reference for the invasion risk assessment of fast-growing alien mangrove species ofLaguncularia racemosa, the aqueous extracts of different concentrations (0.1 mg·L–1, 0.5 mg·L–1) of roots, stems, leaves and fruits ofL.racemosawere used to determine the allelopathic effects on the leaf ultrastructure of seedlings ofBruguiera gymnorhizanative species in China by indoor cultivation experiment.The results of this study show that when subjected to the concentration of 0.1 mg·L–1aqueous extracts fromL.racemosaroots and fruits, the number of chloroplasts in the mesophyll cells ofB.gymnorhizaseedlings increased and mitochondria were delimited by a double mitochondria membrane,as well as showed clear cristae inside an electrondense stroma; when subjected to the concentration of 0.1 mg·L–1aqueous extracts ofL.racemosastems, the vacuoles of the mesophyll cells in the mesophyll cells ofB.gymnorhizawere slightly shrunk and a slight wall separation was observed.Whereas subjected to the concentration of 0.5 mg·L–1aqueous extracts fromL.racemosastems and fruits, the size and number of starch grains of chloroplast were increased, and the mitochondria were deformed and seriously degraded.When subjected to the concentration of 0.5 mg·L–1aqueous extracts fromL.racemosaroots, some parts of chloroplast were damaged, but the mitochondria structure basically remained intact; whereas subjected to the concentration of 0.5 mg·L–1aqueous extracts fromL.racemosaleaves, both the chloroplast and mitochondria in mesophyll cells ofB.gymnorhizaseedlings basically remained intact, which showed that the inhibitory effect of the aqueous extract ofL.racemosaleaves was weak.When subjected to the concentration of 0.5 mg·L–1aqueous extracts from different organs ofL.racemosa, the allelopathy intensity order on the ultrastructure of leaves ofB.gymnorrhizaseedlings was: stem>fruit>root>leaves.
exotic plant;Laguncularia racemosa;Bruguiera gymnorhiza; ultrastructure; allelopathy
10.14108/j.cnki.1008-8873.2017.05.023
Q247
A
1008-8873(2017)05-177-09
王秀丽, 周亮, 卢昌义.从木榄叶片超微结构所受的影响评估外来种拉关木的化感作用[J].生态科学, 2017, 36(5): 177-185.
WANG Xiuli, ZHOU Liang, LU Changyi.Allelopathic effects of exotic mangrove speciesLaguncularia racemosaon leaf ultrastructure ofBruguiera gymnorhizaseedlings[J].Ecological Science, 2017, 36(5): 177-185.
2017-02-23;
2017-06-05
国家自然科学基金(41376115)
王秀丽(1985—), 女, 福建漳州人,博士研究生, 主要从事红树林湿地生态研究, E-mail: wxiuli1988@163.com
*通信作者:卢昌义, 教授, 博士生导师, 主要从事红树林湿地海岸生态恢复工程方面研究, E-mail: lucy@xmu.edu.cn

