IL-1β下调Rho激酶活性介导脓毒症大鼠血管钙失敏的机制研究*
梁家林,刘良明,李 涛
(1.空军杭州航空医学鉴定训练中心医学疗养部,杭州 310013;2.第三军医大学大坪医院野战外科研究所二室/创伤、烧伤与复合伤国家重点实验室,重庆 400042)
IL-1β下调Rho激酶活性介导脓毒症大鼠血管钙失敏的机制研究*
梁家林1,刘良明2△,李 涛2
(1.空军杭州航空医学鉴定训练中心医学疗养部,杭州 310013;2.第三军医大学大坪医院野战外科研究所二室/创伤、烧伤与复合伤国家重点实验室,重庆 400042)
目的探讨白细胞介素(IL)-1β下调Rho激酶活性介导脓毒症大鼠血管钙失敏的机制。方法SD大鼠32只,按随机数字表完全随机分为假手术组、盲肠结扎穿孔(CLP) 3 h组、CLP 6 h组、CLP 12 h组,每组8只。经CLP复制脓毒症大鼠模型,检测不同时点血浆IL-1β浓度及肠系膜上动脉(SMAs)钙敏感性,分析二者之间的相关性。培养SMAs来源的血管平滑肌细胞(VSMCs)并与不同浓度重组人IL-1β孵育24 h,观察IL-1β对其肌球蛋白轻链(MLC20)磷酸化水平、Rho激酶活性、G蛋白表达水平及RhoGEFs活性的影响。结果经CLP 3 h后SMAs钙敏感性开始下降(P<0.05),而血浆IL-1β在CLP 6 h后开始上升(P<0.05),SMAs钙敏感性变化趋势与血浆IL-1β浓度变化呈明显负相关(P<0.05)。IL-1β可降低VSMCs MLC20磷酸化水平及Rho激酶活性(P<0.05),上调Gα11表达而下调Gα12表达(P<0.05),但对Gαq和Gα13表达无明显作用(P>0.05)。IL-1β可明显降低RhoGEF和PDZ-RhoGEF活性(P<0.05),升高p63 RhoGEF活性(P<0.05)。结论IL-1β通过下调Gα12表达,引起PDZ-RhoGEF和Rho激酶的活性下降,导致MLC20磷酸化水平下降从而介导脓毒症大鼠血管钙失敏的发生;另外也能通过上调Gα11表达,引起p63 RhoGEF活性增加而介导脓毒症大鼠血管钙敏感性增加,但总效应是使钙敏感性降低。
脓毒症;白细胞介素1β;钙失敏;G蛋白;RhoGEF
脓毒症、脓毒性休克是重症监护室最常见的并发症之一,尽管对其研究投入了大量的人力、物力,但其病死率始终居高不下[1]。血管低反应性(即血管对血管活性药物的反应性下降甚至不反应)是导致其高病死率的重要原因[2]。目前认为血管低反应性的发生机制主要有:(1)受体失敏,血管舒、缩相关受体如血管肾上腺素能受体[3]等表达下降和(或)亲和力下降;(2)膜超极化,钾通道的过度激活使得血管平滑肌细胞(VSMCs)膜的超极化[4];(3)钙失敏假说,即VSMCs肌肉收缩相关蛋白对钙的敏感性降低,引起力/钙比下降[5]。
脓毒症伴随着细胞因子如肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-1β、IL-6等的瀑布式释放,体内、外研究均证实IL-1β能够介导脓毒症血管收缩反应性降低,作用机制有NO依赖性和NO非依赖性机制[6],但是针对以上机制进行矫治却只能部分逆转IL-1β介导的血管低反应性,提示还存在着其他重要机制[7]。
基础研究显示,Rho激酶能磷酸化CPI-17和肌球蛋白轻链磷酸酯酶(myosin light chain phosphatase,MLCP),磷酸化的CPI-17和MLCP均能抑制MLCP的活性,使得肌球蛋白轻链激酶(myosin light chain kinase,MLCK)和MLCP的活性比值上升,使肌球蛋白轻链(MLC20)磷酸化水平增加,使VSMCs收缩增加[8]。Rho激酶的活性受RhoA调控,RhoA又主要受RhoGEFs调控,而RhoGEFs的活性受Gαq/11和Gα12/13两大家族调节[9]。VSMCs主要存在的RhoGEFs有PDZ-RhoGEF、p115 RhoGEF、p63 RhoGEF和LARG,Gαq/11调节LARG和p63 RhoGEF的活性,而Gα12/13调节PDZ-RhoGEF、LARG和p115 RhoGEF的活性[10]。IL-1β是否通过Rho激酶介导脓毒症大鼠血管的钙失敏发生?如果是,它又是通过调节哪种或哪几种G蛋白的活性进而引起下游相应的RhoGEF活性改变,进而引起Rho激酶活性下降而导致血管钙失敏。笔者前期研究显示,IL-1β通过下调PKC、Rho激酶活性引起血管钙失敏,从而介导内毒素休克家兔血管低反应性的发生,而且发现Rho激酶较PKC发挥更重要的作用[11]。本研究重点探索IL-1β是如何调节Rho激酶活性,但因为商品化的抗兔抗原一抗很难获得,难以开展分子机制研究,而抗大鼠抗原的一抗却很丰富,因此,本研究以脓毒症大鼠为动物模型研究IL-1β调节Rho激酶活性的作用机制。
1 材料与方法
1.1实验动物 实验动物使用通过第三军医大学伦理委员会批准并严格按规定执行。SPF级成年健康雌性SD大鼠,体质量(210±10)g,由第三军医大学大坪医院野战外科研究所实验动物中心提供。
1.2主要试剂与仪器 大鼠IL-1β ELISA试剂盒(NeoBioscience公司),重组大鼠IL-1β(PeproTech公司),兔抗大鼠p63 RhoGEF抗体(Proteintech公司),山羊抗大鼠PDZ-RhoGEF抗体(Santa Cruz公司),兔抗大鼠Gα12、Gα13、Gαq抗体及小鼠抗大鼠Gα11抗体(Santa Cruz公司),兔抗大鼠MYPT1抗体及磷酸化MYPT1抗体 (Thr850,Millipore公司),小鼠抗人β-actin抗体(Pierce公司),RhoGEF exchange assay biochem 试剂盒(Cytoskeleton公司),逆转录试剂盒及PCR反应混合试剂(Promega公司),DMEM/F12 1∶1及新西兰胎牛血清(Hyclone公司),配制Krebs-Henseleit重碳酸盐缓冲液(K-H液)的试剂均为国产分析纯。Power lab八道生理记录仪及压力传感器(AD Instrument公司),恒温离体器官灌流槽(Letica公司),垂直板状电泳仪(Bio-Rad公司),多功能读板机(Bio-TEDSynergy HT),CO2细胞培养箱(SHEL/JB)。
1.3方法
1.3.1脓毒症模型的复制及标本获取 SD大鼠32只,按随机数字表完全随机分为假手术组、盲肠结扎穿孔(CLP) 3 h组、CLP 6 h组、CLP 12 h组,每组8只。采用CLP复制脓毒症模型,参考文献[12],并适当调整:(1)1 mL/kg 3%戊巴比妥钠腹腔麻醉;(2)开腹(从腹白线处),切口长约3.0 cm,找到盲肠,清除肠系膜(注意避免损伤血管),用4号线在离盲端1.5 cm处结扎盲肠,再用三棱锥在结扎盲端中央处穿孔,使成前端大小约0.5 cm×0.5 cm×0.5 cm而后端大小约0.4 cm×0.4 cm×0.4 cm的三角形孔;(3)依次用4号线和1号线关腹。假手术组大鼠只进行麻醉和开、关腹操作。在CLP手术后3、6、12 h(补适量3%戊巴比妥钠麻醉大鼠),开腹经腹主动脉取1.5 mL动脉血,加1 U肝素抗凝,离心(3 000 g×10 min,4 ℃),取上清液,即为血浆,分装保存于-80 ℃冰箱用于IL-1β测定;小心游离出肠系膜上动脉(SMAs)主干,用角膜剪剪除周围结缔组织(一定要注意保护血管内皮完整),制成长2~3 mm的血管环,用于Ca2+反应性测定。另取各组SMAs分支,用RIPA裂解液提取各组总蛋白。
1.3.2IL-1β体外单因素处理及标本获取 按文献[13]所述培养SMAs来源的VSMCs。实验分为对照组、1 ng/mL IL-1β组、10 ng/mL IL-1β组和100 ng/mL IL-1β组,每组各6瓶细胞。待VSMCs传代细胞(第三代)生长100%融合后,磷酸盐缓冲液(PBS)洗2次,加入DMEM/F12每瓶2 mL饥饿细胞12 h后,加入等体积生理盐水(对照组)或使终浓度为上述浓度的IL-1β溶液孵育24 h。用RIPA裂解液提取各组细胞的总蛋白。
1.3.3脓毒症大鼠血管钙敏感性、血浆IL-1β水平变化及相关性分析 取1.3.1制备的血管环,分别测定各组血管环对Ca2+的敏感性,方法同文献[5]。以张力(收缩力/血管环重量)为量化标准,用最大张力(Emax)来评价血管钙敏感性。将1.3.1所得的血浆从-80 ℃冰箱中取出,按大鼠IL-1β ELISA试剂盒操作说明,测量各组在450 nm处吸光度(A)值。用CurveExpert 1.3软件进行曲线拟合,得出标准曲线和公式,求出各组血浆的IL-1β浓度。用各组的Emax值和IL-1β浓度进行相关性分析,得出二者之间是否存在相关性。
1.3.4IL-1β对大鼠VSMCs MLC20磷酸化水平及Rho激酶活性的影响 取 1.3.2处理好的总蛋白(每组n=3),用蛋白质印迹法(Western blot)检测,以磷酸化MLC20(MLC20-p)/非磷酸化MLC20(MLC20)表示MLC20磷酸化水平,以磷酸化MYPT1(Rho激酶底物,MYPT1-p)/非磷酸化MYPT1(MYPT1)表示Rho激酶活性。
1.3.5IL-1β对大鼠VSMCs的Gα11、Gαq、Gα12、Gα13的表达影响 取1.3.2处理好的总蛋白(每组n=3),用Western blot检测各组的Gα11、Gαq、Gα12、Gα13表达。
1.3.6IL-1β对大鼠VSMCs的RhoGEF、PDZ-RhoGEF和p63 RhoGEF活性的影响 取1.3.2处理好的总蛋白(每组n=3),应用RhoGEF exchange assaybiochem kit检测各组的RhoGEF、PDZ-RhoGEF和p63-RhoGEF活性。RhoGEF活性用总蛋白直接检测。p63 RhoGEF和PDZ-RhoGEF活性检测如下:(1)免疫沉淀,联合总蛋白、Protein A/G 20 μL、PDZ-RhoGEF或p63 RhoGEF一抗1 μg,在 4 ℃孵育24 h,离心(3 000 g×5 min,4 ℃),去上清液得沉淀,用1 mL RIPA裂解液洗沉淀,离心(3 000 g×5 min,4 ℃),去上清液,重复2次,得到的沉淀即为与磁珠结合的抗原抗体复合物;(2)洗脱,沉淀中加入30~50 μL洗脱缓冲液(0.2 mol/L甘氨酸,pH 2.5),轻轻地盖上盖子并混匀,立即离心(3 000 g×3 min,4 ℃),小心的转移上清液 (避免转移任何免疫介质),立即在每20 μL上清液中加入1 μL 1.5 mol/L Tris,pH 9.0 以中和洗脱液;(3)按照试剂盒操作步骤进行活性检测,以测得的荧光值-基底荧光值代表RhoGEF的活性。
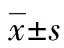
2 结 果
2.1脓毒症大鼠血管钙敏感性及血浆IL-1β浓度变化 在CLP后3、6和12 h,大鼠SMAs对Ca2+敏感性的量-效曲线均出现右移,Emax均降低(P<0.05),见图1A。血浆IL-1β水平在CLP后6 h和12 h均明显升高(P<0.05),见图1B。血浆IL-1β水平与同时期SMAs的钙敏感性呈明显负相关(r=-0.821,P<0.05)。
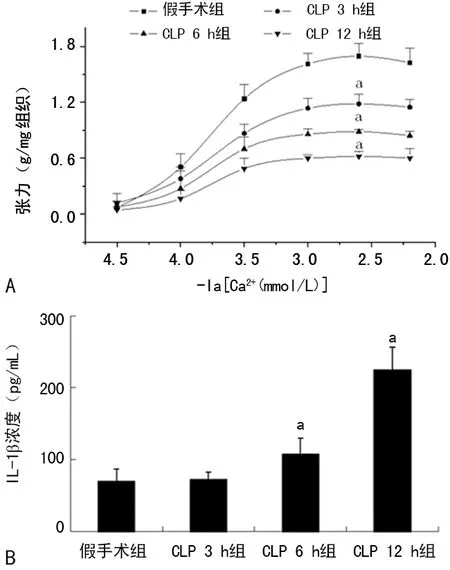
a:P<0.05,与假手术组比较
图1脓毒症大鼠血管钙敏感性及血浆IL-1β浓度变化
2.2IL-1β对大鼠VSMCs MLC20磷酸化水平及Rho激酶活性的影响 与对照组相比,IL-1β能明显降低大鼠VSMCs MLC20-p/MLC20及MYPT1-p/MYPT1 (P<0.05)。见图2。
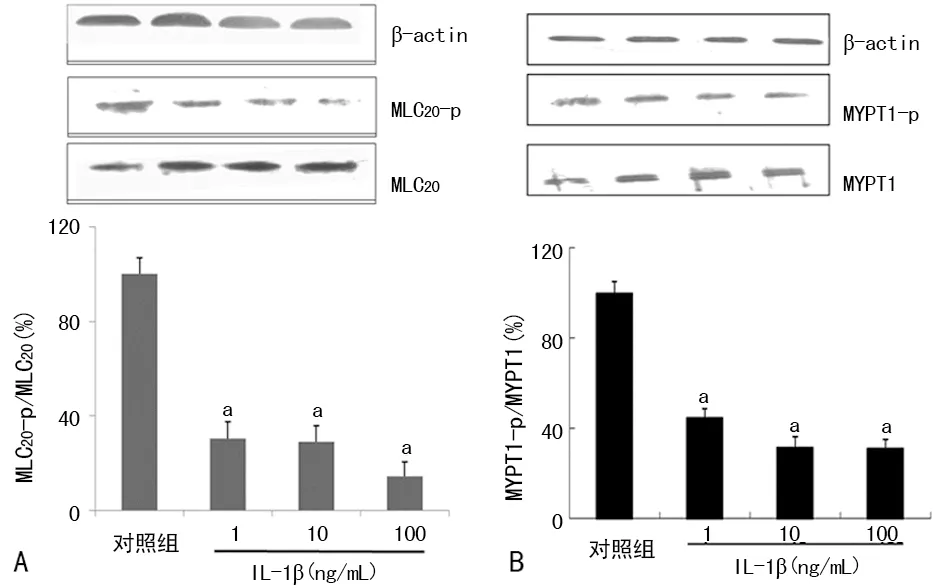
a:P<0.05,与对照组比较
图2 IL-1β对大鼠VSMCs MLC20磷酸化水平及Rho激酶活性的影响
2.3IL-1β对大鼠VSMCs的Gαq、Gα11、Gα12、Gα13表达水平的影响 以G蛋白/内参β-actin表示各G蛋白的表达水平。与对照组相比,VSMCs的Gα11表达水平在各浓度IL-1β孵育后明显升高(P<0.05),Gα12表达水平明显降低(P<0.05),Gα13和Gαq表达水平无明显改变(P>0.05)。见图3。
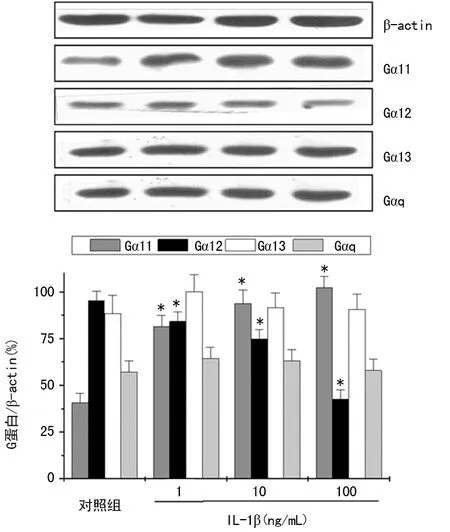
*:P<0.05,与对照组比较
图3 IL-1β对大鼠VSMCs的Gαq、Gα11、Gα12、Gα13表达水平的影响
2.4IL-1β对大鼠VSMCs的RhoGEF、p63 RhoGEF和PDZ-RhoGEF活性的影响 与对照组相比,VSMCs的RhoGEF和PDZ-RhoGEF活性在各浓度IL-1β组明显降低(P<0.05),p63 RhoGEF活性却明显升高(P<0.05)。见图4。

a:P<0.05,与对照组比较
图4 IL-1β对大鼠VSMCs的RhoGEF及p63 RhoGEF和PDZ-RhoGEF活性的影响
3 讨 论
研究显示,Rho激酶是调节血管钙敏感性的重要作用分子,Rho激酶是一种丝氨酸/苏氨酸激酶,其调节机制为:(1)直接磷酸化MLC20;(2)磷酸化CPI-17从而抑制MLCP进而抑制MLC20去磷酸化;(3)直接抑制MLCP,最终使MLC20的Ser-19位点磷酸化,增加肌球蛋白与肌动蛋白结合,使粗肌丝横桥上的ATP酶活性得到提高,启动横桥摆动,增强肌丝滑行能力使血管平滑肌收缩[14]。
笔者前期研究结果提示,IL-1β能通过下调Rho激酶活性介导内毒素休克家兔血管钙失敏的发生,为进一步探索其调节机制,结合实际,本研究利用脓毒症大鼠模型及大鼠SMAs来源的VSMCs重点研究了IL-1β是如何下调Rho激酶活性从而介导脓毒症血管钙失敏发生的。尽管前期实验提示IL-1β能通过下调Rho激酶活性介导内毒素休克家兔血管钙失敏发生,但首先还是要验证IL-1β是否通过下调Rho激酶活性介导脓毒症大鼠血管钙失敏的发生,结果得到了验证。值得注意的是,CLP 3 h后血管钙敏感性开始下降,而血浆IL-1β却在CLP 6 h后开始升高,这是因为脓毒症后血浆IL-1β升高晚于TNF-α等其他细胞因子升高,而TNF-α等其他细胞因子对血管钙敏感性也可能有调节作用。结果显示在血浆IL-1β水平升高后血管钙敏感性进一步降低,相关性分析显示二者呈明显负相关,在整体水平提示IL-1β可能介导脓毒症大鼠血管钙敏感性下降。为排除脓毒症时其他细胞因子的影响,进一步确认其介导作用,笔者在离体水平培养SMAs来源的VSMCs,并利用IL-1β单独作用于它们,结果显示IL-1β能明显降低VSMCs的MLC20磷酸化水平及Rho激酶活性,而MLC20磷酸化水平及Rho激酶活性是反映钙敏感性的重要指标,从而在离体水平验证了IL-1β能通过下调Rho激酶活性介导脓毒症大鼠血管钙失敏发生。
那么IL-1β是如何调节Rho激酶活性而介导脓毒症大鼠血管钙失敏发生的呢?本研究检测了VSMCs上调节RhoGEF活性的G蛋白的表达水平,并通过检测其下游的相应RhoGEF活性来反映其自身的活性水平。结果显示,IL-1β对G蛋白的表达调控存在差异性:下调Gα12的表达,上调Gα11的表达,对Gα13和Gαq表达却无明显作用。不难理解的是下调Gα12的表达,因为IL-1β能介导脓毒症血管钙失敏发生,而G蛋白表达水平与钙敏感性是正相关的。对于上调Gα11的表达就不好解释了,有报道TNF-α能上调VSMCs Gαq家族表达[15],Gα11是Gαq家族成员,TNF-α与IL-1β在功能上存在相似性,故IL-1β上调Gα11的表达是有可能的。检测了G蛋白表达水平,但不知其活性状态,目前对于G蛋白活性状态的检测较困难,为此笔者检测了其下游相应RhoGEF(PDZ-RhoGEF、p63 RhoGEF活性)和总RhoGEF活性以反映G蛋白活性状态,结果其活性水平与其相应的上游G蛋白表达变化方向一致,且总RhoGEF活性下降,提示IL-1β通过Gα12/PDZ-RhoGEF/RhoA/Rho激酶介导血管钙失敏的发生,另外通过Gα11/p63 RhoGEF/RhoA/Rho激酶上调血管钙敏感性。
综上所述,IL-1β可通过下调Rho激酶的活性介导脓毒症大鼠血管钙敏感性降低,进一步研究发现,IL-1β一方面通过下调Gα12表达,下调PDZ-RhoGEF活性而下调Rho激酶活性;另一方面通过上调Gα11表达,上调p63 RhoGEF活性而上调Rho激酶活性,但两方面途径的总效用使总RhoGEF活性下降,进而使Rho激酶活性下降而介导脓毒症血管钙失敏的发生。
[1]Simpson SQ,Gaines M,Hussein Y,et al.Early goal-directed therapy for severe sepsis and septic shock:a living systematic review[J].J Crit Care,2016,29(36):43-48.
[2]Kimmoun A,Ducrocq N,Levy B.Mechanisms of vascular hyporesponsiveness in septic shock[J].Curr Vasc Pharmacol,2013,11(2):139-149.
[3]Liang JL,Yang GM,Li T,et al.Interleukin 1β attenuates vascular α1 adrenergic receptors expression following lipopolysaccharide-induced endotoxemia in rabbits:involvement of JAK2-STAT3 pathway[J].J Trauma Acute Care Surg,2014,76(3):762-770.
[4]Gao Y,Yang Y,Guan Q,et al.IL-1β modulate the Ca2+-activated big-conductance K channels(BK)via reactive Oxygen species in cultured rat aorta smooth muscle cells[J].Mol Cell Biochem,2009,338(1/2):59-68.
[5]Xu J,Yang G,Li T,et al.Involvement of Cpi-17 and zipper-interacting protein kinase in the regulation of protein kinase C-alpha,protein kinase C-epsilon on vascular calcium sensitivity after hemorrhagic shock[J].Shock,2010,33(1):49-55.
[6]Takizawa S,Ozaki H,Karaki H.Interleukin-1beta-induced,nitric oxide-dependent and -independent inhibition of vascular smooth muscle contraction[J].Eur J Pharmacol,1997,330(2/3):143-150.
[7]Soler M,Camacho M,Vila L.Imidazolineoxyl N-Oxide preventsthe impairment of vascular contraction caused by interleukin-1beta through several mechanisms[J].J Infect Dis,2003,188(6):927-937.
[8]Hodge RG,Ridley AJ.Regulating Rho GTPases and their regulators[J].Nat Rev Mol Cell Biol,2016,17(8):496-510.
[9]Somlyo AP,Somlyo AV.Ca2+sensitivity of smooth muscle and nonmuscle myosin II:modulated by G proteins,kinases,and myosin phosphatase[J].Physiol Rev,2003,83(4):1325-1358.
[10]Kather JN,Kroll J.Rho guanine exchange factors in blood vessels:Fine-tuners of angiogenesis and vascular function[J].Exp Cell Res,2013,319(9):1289-1297.
[11]Liang JL,Yang GM,Li T,et al.Effects of interleukin-1β on vascular reactivity after lipopolysaccharide-induced endotoxic shock in rabbits and its relationship with PKC and Rho kinase[J].J Cardiovasc Pharmacol,2013,62(1):84-89.
[12]Rittirsch D,Huber-Lang MS,Flierl MA,et al.Immunodesign of experimental sepsis by cecal ligation and puncture[J].Nat Protoc,2009,4(1):31-36.
[13]Yang GM,Xu J,Li T,et al.Role of via receptor in AVP-Induced restoration of vascular hyporeactivity and its relationship to MLCP-MLC(20) phosphorylation pathway[J].J Surgical Res,2010,161(2):312-320.
[14]Puetz S,Lubomirov LT,Pfitzer G.Regulation of smooth muscle contraction by small GTPases[J].Physiology,2009,24(6):342-356.
[15]Hotta K,Emala CW,Hirshman CA.TNF-alpha upregulates G(i)alpha and G(q)alpha protein expression and function in human airway smooth muscle cells[J].Am J Physiol Lung Cell Mol Physiol,1999,276(3):L405-411.
StudyonmechanismofIL-1βmediatingvascularcalciumdesensitizationinsepticratsthroughdown-regulatingRhokinaseactivity*
LiangJialin1,LiuLiangming2△,LiTao2
(1.DepartmentofMedicalRehabilitation,HangzhouAeromedicalIdentificationandTrainingCenterofAirForce,Hangzhou,Zhejiang310013,China;2.SecondDepartment,InstituteofFieldSurgeryResearch/StateKeyLaboratoryofTrauma,BurnsandCombinedInjury,DapingHospital,ThirdMilitaryUniversity,Chongqing400042,China)
ObjectiveTo investigate the mechanism of interleukin-1β(IL-1β) mediating the vascular calcium desensitization of septic rats by down-regulating Rho kinase activity.MethodsThirty-two SD rats were randomly divided into the sham operation group,cecal ligation and puncture (CLP) 3 h group,CLP 6 h group and CLP 12 h group,8 cases in each group.The septic rat was duplicated by CLP.Then the plasma IL-1β level and calcium sensitivity of superior mesenteric arteries (SMAs) were detected at different time points.Their correlation was analyzed.VSMCc derived from SMAs were cultured and incubated with different concentrations of human recombinant IL-1β for 24 h.Then the influences of IL-1β on the MLC20phosphorylation level,Rho kinase activity,G protein expression level and RhoGEF activity were observed.ResultsThe calcium sensitivity of SMAs after CLP 3 h began to decrease(P<0.05),while plasma IL-1β level began to increase after CLP 6 h (P<0.05),the change trend of SMAs calcium sensitivity was negatively correlated with plasma IL-1β level change(P<0.05).IL-1β could decrease the phosphorylation level of VSMCs myosin light chain(MLC20) and Rho kinase activity(P<0.05),up-regulate Gα11 expression and down-regulate Gα12 expression,but had no obvious effect on Gαq and Gα13 expression(P>0.05).IL-1β could significantly reduce RhoGEF and PDZ-RhoGEF activity(P<0.05) but significantly increase p63 Rho GEF activity(P<0.05).ConclusionIL-1β induces the decrease of PDZ-RhoGEF and Rho kinase activity by down-regulating Gα12 expression,causes the decrease of MLC20phosphorylation level,thus mediates the occurrence of calcium desensitization in septic rat;in addition,IL-1β may cause the increase of p63 RhoGEF activity by up-regulating Gα11 expression,thus mediates the increase of vascular calcium sensitivity in septic rats,but the total effect is the decrease of calcium sensitivity.
sepsis;interleukin-1 beta;calcium desensitization;G protein;RhoGEF
10.3969/j.issn.1671-8348.2017.28.001
国家杰出青年科学基金资助项目(30625037)。
梁家林(1982-),主治医师,博士,主要从事脓毒症血管低反应性发生机制的研究。△
,E-mail:liangmingliu@yahoo.com。
R631+.2
A
1671-8348(2017)28-3889-04
2017-03-02
2017-04-28)

