去氢木香内酯对人肝星状细胞增殖及凋亡的影响研究
程 剑,林 彬,沈晓洁,刘 燕
(无锡卫生高等职业技术学校,江苏无锡 214028)
论著·基础研究doi:10.3969/j.issn.1671-8348.2017.28.006
去氢木香内酯对人肝星状细胞增殖及凋亡的影响研究
程 剑,林 彬△,沈晓洁,刘 燕
(无锡卫生高等职业技术学校,江苏无锡 214028)
目的探讨去氢木香内酯(Dehy)对人肝星状LX-2细胞增殖及凋亡的影响,分析其可能的作用机制。方法人肝星状LX-2细胞经不同浓度Dehy处理后,采用四甲基偶氮唑盐(MTT)法、流式细胞术检测LX-2细胞增殖和周期分布,Hoechst 33342染色法及AV-PI双染法检测LX-2细胞凋亡情况,蛋白质印迹法(Western blot)检测凋亡相关蛋白的表达。结果给予不同浓度的Dehy作用48 h后,能够明显抑制LX-2细胞的增殖,阻滞细胞周期于S、G2/M期,同时诱导LX-2细胞的凋亡,呈浓度依赖性;Western blot结果显示,Dehy可促进P27、Bax的表达上调,Bcl-2的表达下调。结论Dehy通过调节Bax、Bcl-2和P27的表达诱导人肝星状LX-2细胞的凋亡和周期的阻滞。
去氢木香内酯;肝星状细胞LX-2;细胞周期;细胞凋亡
肝纤维化是一个世界范围内的卫生难题[1],它是由各种致病因子所致慢性肝损伤后,肝内实质细胞、间质细胞异常增生导致细胞外基质(ECM)过度沉积的病理过程,随着病情的发展,将导致肝小叶及纤维结节的形成,最终发展成肝硬化[2-3]。所以,及时对肝纤维化进行有效地治疗显得尤为重要。目前对肝纤维化的治疗主要通过抗炎、抗病毒、减少ECM沉积等方式[4],然而这些治疗效果并不理想,寻找有效的抗纤维化的药物及治疗方法仍然是首要任务。
去氢木香内酯(dehydrocostuslactone,Dehy)是一种倍半萜内酯类化合物,主要从木香、木兰、月桂树等植物中提取出来的。我国传统中医药常使用含有木香的复方治疗肿瘤,而其中抗癌的主要活性成分就是Dehy[5-6]。国内外的众多文献报道了Dehy的抗癌作用[7-8],研究还发现Dehy具有抗炎、抗病毒、抗菌、抗氧化等多方面的药理活性[9-12]。Chen等[10]研究发现,Dehy在低剂量条件下对肝癌细胞Hep-3B、HepA2的乙型肝炎表面抗原(HBsAg)和乙型肝炎e抗原(HBeAg)的基因表达均具有明显的抑制作用,主要表现在mRNA表达量的降低,这说明Dehy具有很好的抗乙型肝炎病毒活性。而肝纤维化的一个主要的病因就是乙型肝炎病毒的感染,所以Dehy具备很好的抗肝纤维化的应用前景。目前,Dehy对肝纤维化的影响还未见报道,本文通过研究体外条件下Dehy对肝星状LX-2细胞的增殖、凋亡及相关蛋白表达的影响,进而探究Dehy在肝纤维化发展过程中的作用。
1 材料与方法
1.1材料
1.1.1细胞株 人肝星状LX-2细胞由上海生命科学院细胞库提供。LX-2细胞于37 ℃水浴锅中快速复苏,接种于含10%胎牛血清的DMEM培养基(含100 U/mL青霉素和链霉素)中,置于37 ℃、5%CO2恒温培养箱中培养。待细胞长满至80%左右即可用0.25%胰酶消化,根据需要的密度进行接种。
1.1.2药物 Dehy购于上海源叶生物科技有限公司,实验前配制10 mg/mL的Dehy备用原液,用二甲基亚砜(DMSO)溶解,置于4℃冰箱内储存,使用时再用DMEM培养基稀释成需要的浓度。
1.1.3主要试剂 DMEM干粉和胎牛血清购自美国Gibco公司,DMSO和胰蛋白酶购自上海博光生物技术有限公司,四甲基偶氮唑盐(MTT)粉购自美国Sigma公司,细胞周期检测试剂盒购自美国BD公司,Hoechst 33342染色剂和细胞凋亡检测试剂盒购自上海碧云天生物科技有限公司和上海翊圣生物科技有限公司,P27、Bax、Bcl-2抗体购自美国CST公司,抗GAPDH、兔二抗购自康成生物公司。
1.2方法
1.2.1细胞增殖实验 待LX-2细胞生长到80%融合度左右,用0.25%胰酶消化,800 r/min离心3 min,用10%胎牛血清重悬,于计数板上计数,根据细胞的密度用10%胎牛血清稀释至5 000个/100 μL,将细胞混悬液加入96孔板中,每孔100 μL,置于37 ℃、5%CO2恒温培养箱过夜培养。细胞贴壁后,每孔给予0、2、4、8、12、16、20 μg/mL的Dehy,每个浓度设置5个复孔。处理24 h或48 h后,加入20 μL的0.5 mg/mL MTT,避光条件孵育4 h,吸弃培养基,再加入150 μL DMSO溶解结晶,于摇床上摇15 min左右,在酶联免疫检测仪上检测光密度值(OD值),检测波长为490 nm。根据公式计算Dehy对LX-2细胞的增殖抑制能力,细胞抑制率=(1-空白对照组OD值/实验对照组OD值)×100%。
1.2.2细胞周期实验 实验分为空白对照组,Dehy低、中、高3个浓度实验组;将处于对数生长期的LX-2细胞消化,离心,用10%胎牛血清重悬,以45万/皿的密度接种细胞于6 cm培养皿中,细胞贴壁后,各组按照Dehy 0、2.5、5.0、10.0 μg/mL处理;48 h后,收集细胞,用磷酸盐缓冲液(PBS)洗3次,再用75%的冰乙醇(-20 ℃预冷)固定,置于4 ℃冰箱中过夜;用预冷PBS洗3次,离心,去除乙醇,加入200 μL的PI染液重悬细胞,避光条件下反应30 min,混匀,上机检测。
1.2.3Hoechst 33342染色法观察细胞核的形态变化 分组同1.2.2;先在6孔板底部固定盖玻片,再将处于对数生长期的LX-2细胞消化,离心,用10%胎牛血清重悬,以15万/孔的密度接种细胞,置于37 ℃、5%CO2恒温培养箱过夜培养,细胞贴壁后给予Dehy 0、2.5、5.0、10.0 μg/mL)处理;48 h后,加入4%甲醛固定15 min,PBS洗净,再加入Hoechst 33342 染料(1∶1 000)避光染色20 min,PBS洗净,于荧光显微镜下观察细胞核变化,并拍照。
1.2.4Annexin V-FITC细胞凋亡检测试剂盒检测细胞凋亡 分组同1.2.2;将处于对数生长期的LX-2细胞用不含EDTA的胰酶消化,离心,用10% 胎牛血清重悬,以45万/皿的密度接种细胞于6 cm培养皿中,培养过夜后,给予Dehy 0、2.5、5.0、10.0 μg/mL处理;48 h后,收集上清液,用不含EDTA的胰酶消化细胞,1 500 r/min离心3 min,用预冷的PBS洗3次,加入100 μL的Buffer重悬细胞,于避光条件下再分别加入5 μL Annexin V-FITC和5 μL PI Staining Solution,混匀,4 ℃条件下反应10 min;染色结束后在1 h内完成上机检测。
1.2.5Western blot检测凋亡相关蛋白的表达 实验分组及药物处理同上,处理48 h后,用PBS洗3次,吸净剩余的PBS,根据细胞的密度加入一定量预先配好的蛋白裂解液(蛋白酶抑制剂混合物∶磷酸酶抑制剂∶PMSF∶RIPA为1∶1∶1∶100)于冰上裂解30 min(每隔5分钟摇晃1次,使得细胞充分裂解),离心收集上清液,加入1/4体积的上样缓冲液,置于沸水中10 min,使其变性,最后放置于-20 ℃冰箱中保存备用。根据所测蛋白的分子量配制SDS-PAGE分离胶(8%、10%),浓缩胶均为5%,每组上样总蛋白均为30 μg,60 V电泳约30 min后,换成120 V电泳90 min;根据蛋白Mark,裁剪所需的胶带,将蛋白按0.25 A、120 min条件转至PVDF膜上,再用5%脱脂牛奶封闭1 h,一抗孵育P27(1∶800)、Bax(1∶1 000)、Bcl-2(1∶1 000)、GAPDH(1∶5 000)过夜,TBST洗涤3次,孵育兔二抗(GAPDH除外),TBST洗3次后用ECL发光试剂盒发光;以GAPDH作为内参,通过灰度分析软件进行分析。
2 结 果
2.1Dehy对LX-2细胞增殖的抑制作用 MTT结果显示,细胞的活性受到明显的抑制,且随着浓度的增加,抑制作用逐渐增强。Dehy作用48 h的抑制率明显高于24 h,所以后期实验均采用48 h检测时间。见图1。
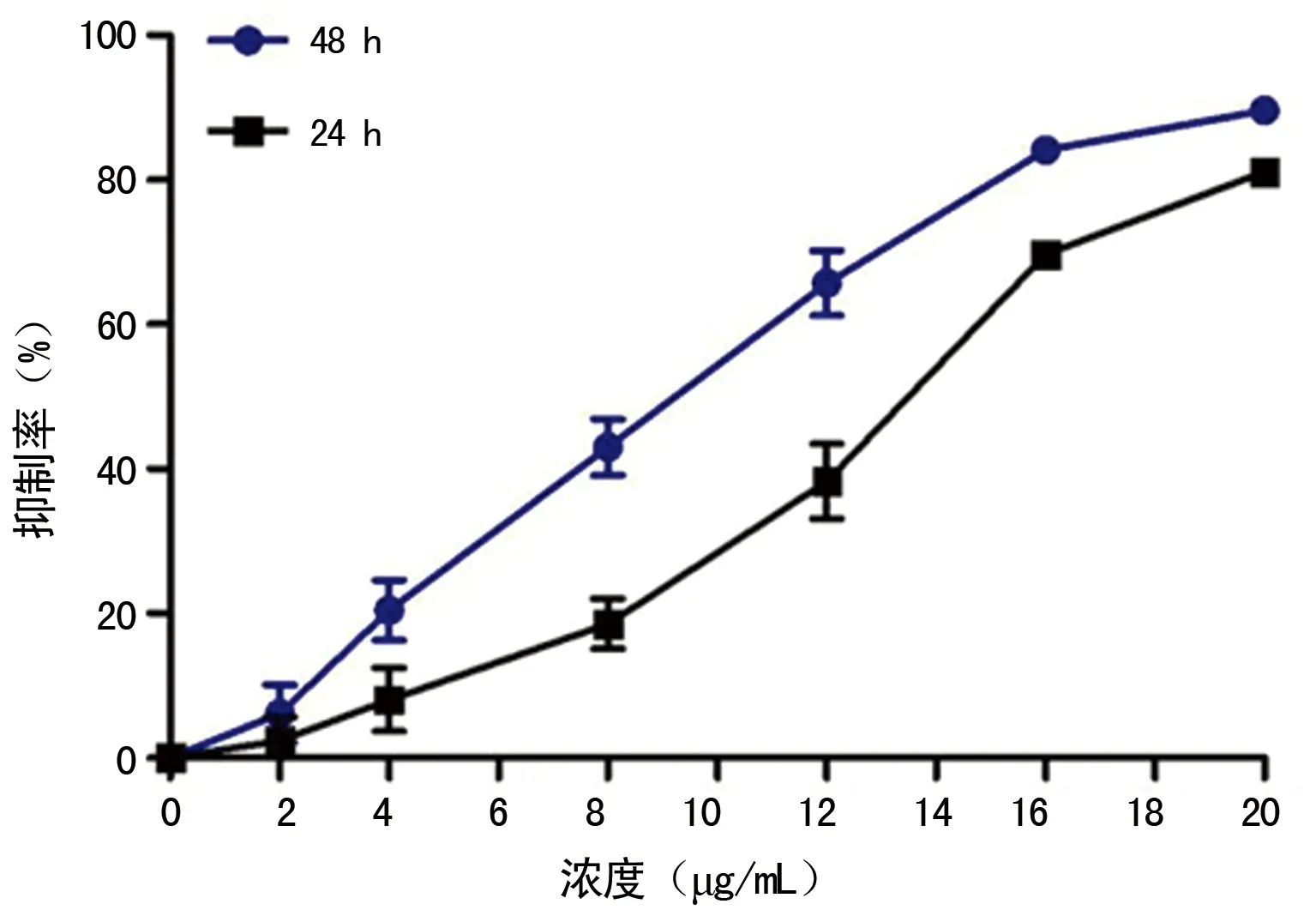
图1 Dehy对LX-2细胞增殖的抑制作用
2.2Dehy对LX-2细胞周期分布的影响 经过Dehy处理后,LX-2细胞周期分布发生明显的改变,随着Dehy浓度的升高,S和G2/M期细胞增加,G0/G1期减少。见表1、图2。
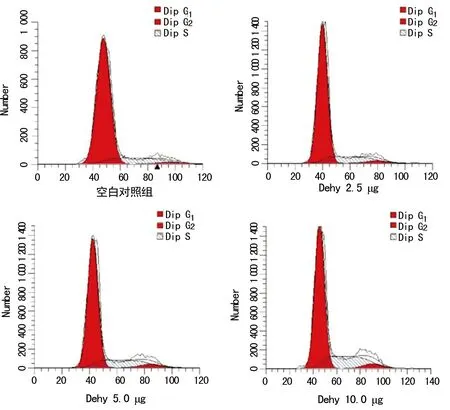
图2 Dehy对LX-2细胞周期分布的影响
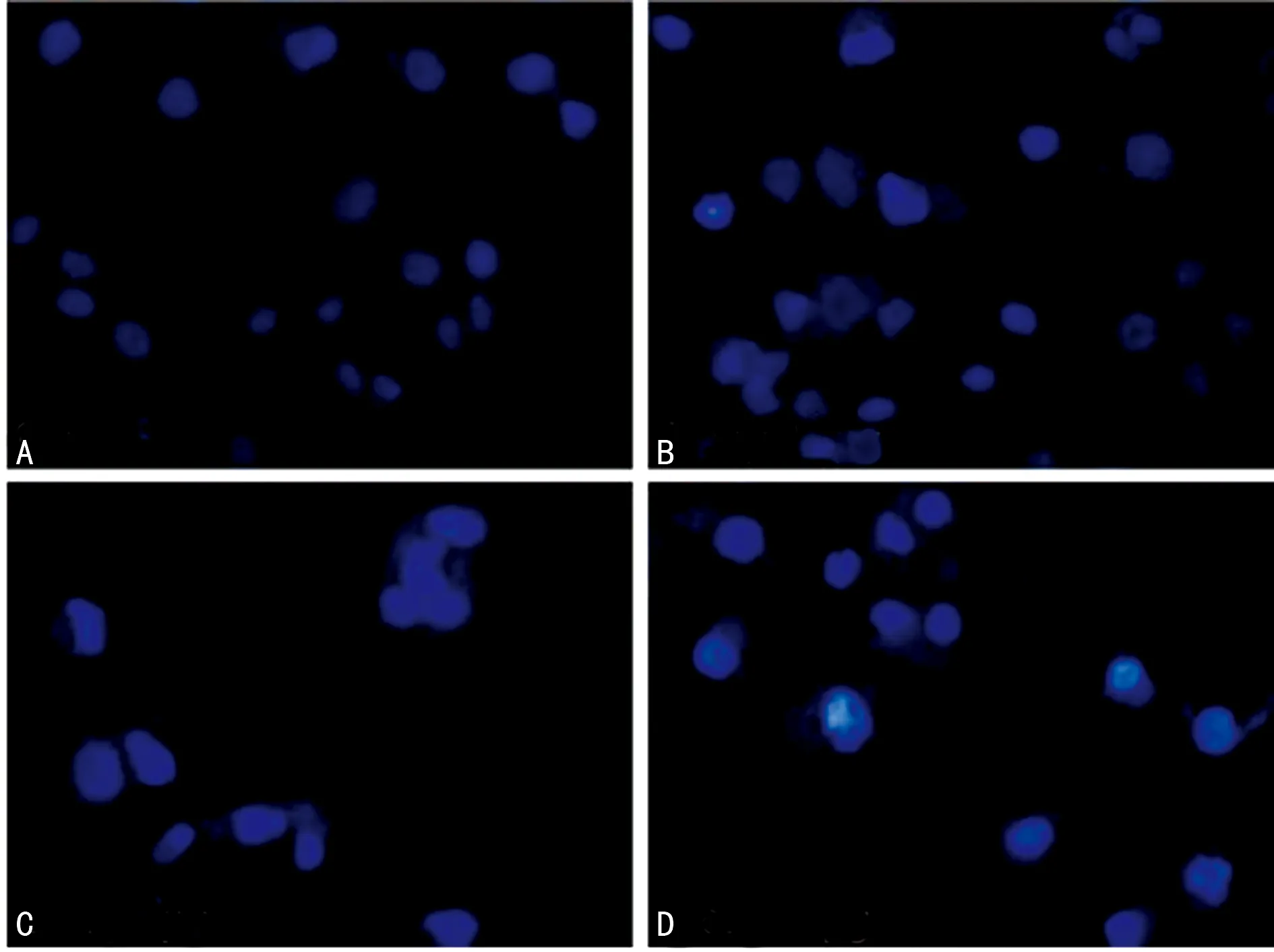
A:空白对照组;B:Dehy 2.5 μg/mL;C:Dehy 5.0 μg/mL;D:Dehy 10.0 μg/mL
图3 LX-2细胞的Hoechst 33342染色
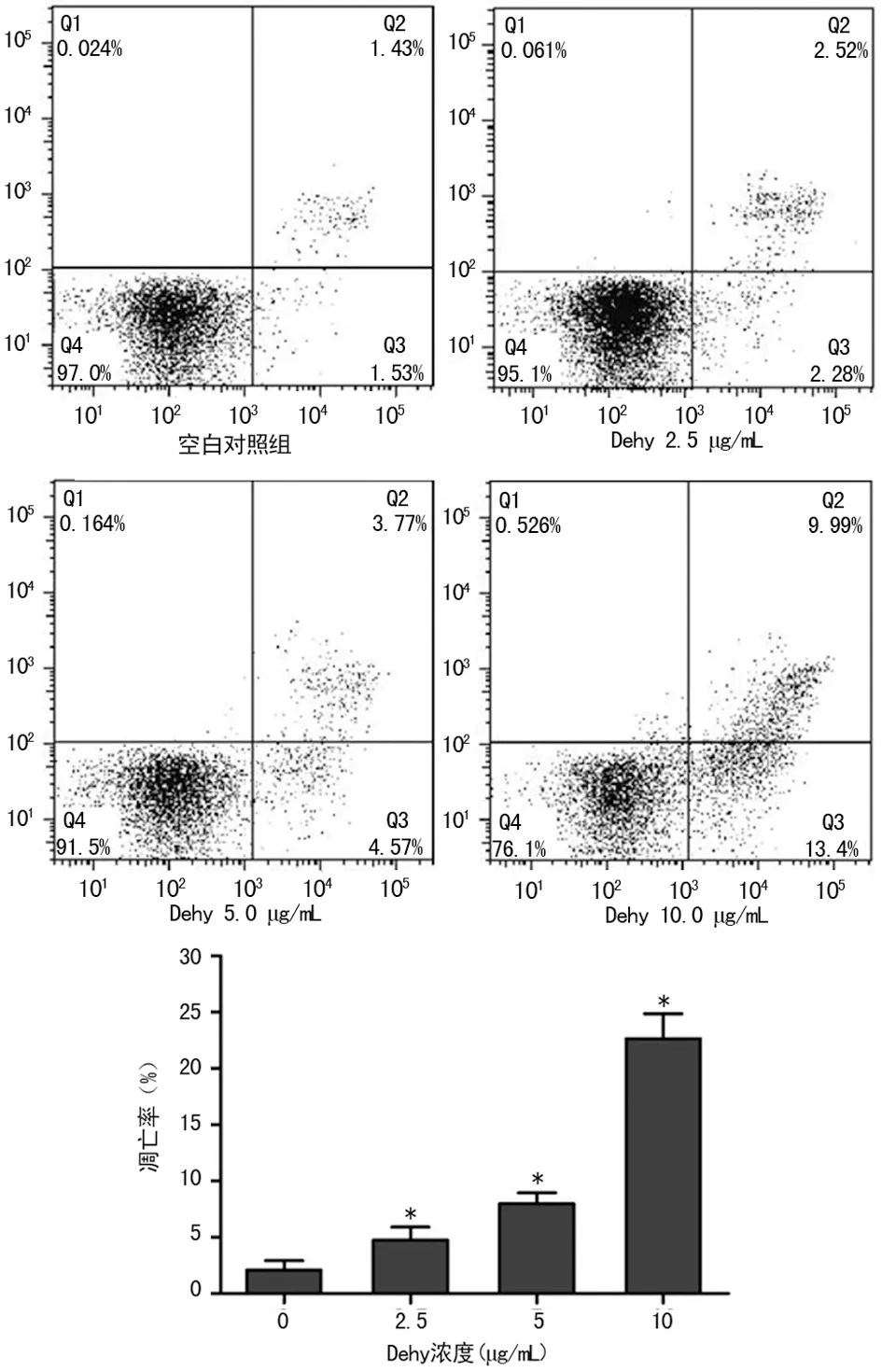
2.3Dehy对LX-2细胞凋亡的影响 给予不同剂量的Dehy处理LX-2细胞48 h后,通过Hoechst 33342染色发现,空白对照组细胞核染色均匀,荧光较弱且呈现弥散状态,没有表现出明显的凋亡现象;实验组中,随着给药剂量的增加,荧光强度越来越强,且可观察到细胞核呈现固缩状态,表现出明显的凋亡现象,见图3。Annexin V-FITC细胞凋亡检测显示,随着浓度的增加,凋亡率逐渐上升,见图4。
表1 Dehy对LX-2细胞周期分布的影响
*:P<0.05,与空白对照组比较
*:P<0.05,与空白对照组比较
图4 Dehy对LX-2细胞凋亡的影响
*:P<0.05,与空白对照组比较
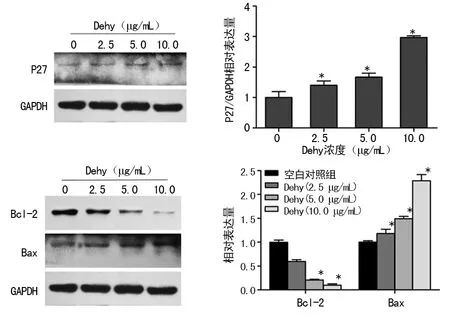
图5 Dehy对LX-2细胞的Bcl-2、P27及Bax表达的影响
2.4Western blot检测凋亡相关蛋白的表达 Western blot检测发现,周期相关蛋白P27、促凋亡蛋白Bax的表达上调,抑凋亡蛋白Bcl-2表达下调。见图 5。
3 讨 论
肝纤维化是酒精,非酒精性脂肪肝,乙型肝炎或丙型肝炎病毒感染等慢性肝损伤发展而来,最终导致肝硬化,影响肝脏的功能和代谢。在肝纤维化发展的过程中,肝星状细胞(hepatic stellate cell,HSC)的激活被认为是肝纤维化时过量ECM 的主要来源[13]。所以,抑制或者逆转HSC的激活是肝纤维化治疗的主要靶点,而增殖是HSC激活的主要标志,所以可通过抑制HSC的增殖或诱导其凋亡,阻止HSC的激活,从而减缓肝纤维化的发展进程。Dehy是菊科植物木香中分离所得的倍半萜内酯类化合物,本实验主要研究Dehy对人肝星状LX-2细胞的增殖及凋亡的作用,并探讨可能的分子机制。
笔者通过MTT检测发现,Dehy对人肝星状LX-2细胞的增殖具有明显的抑制作用,随着浓度的增加,抑制作用越明显,且作用48 h的抑制率明显高于24 h。肝纤维化的一个主要特征就是细胞异常增殖,而细胞的增殖与细胞周期调控密切相关。细胞周期是指持续分裂的细胞从一次有丝分裂结束到下一次有丝分裂完成所经历的整个过程。本研究发现,随着浓度的增加,S、G2/M期细胞逐渐增多,G0/G1期细胞明显减少,说明Dehy可以阻滞细胞周期于S、G2/M,从而抑制了LX-2细胞的增殖。抑制增殖的另一个主要原因是细胞凋亡,本研究结果表明,Dehy可以诱导LX-2细胞的凋亡,且呈剂量依赖性。
为了进一步研究Dehy诱导LX-2细胞凋亡及周期阻滞的分子机制,笔者检测了相关蛋白的表达。P27是细胞周期素依赖性激酶抑制因子家族中的一员,该蛋白能够结合并阻止细胞周期素E-CDK2或细胞周期素D-CDK4复合物的激活,因此能够抑制细胞周期进程,影响细胞生长,对细胞周期行使负调控作用,是一种抑癌基因[14]。结果显示,Dehy作用于LX-2细胞后P27蛋白的表达上调,并且呈剂量依赖性,说明P27参与了细胞周期阻滞作用,从而抑制了LX-2细胞的增殖。Bax和Bcl-2属于Bcl-2家族蛋白,是线粒体凋亡途径中最主要的调控因子,主要表现对线粒体膜通透性和膜电位的影响[15]。Western blot结果显示,经过Dehy处理后的细胞,其Bcl-2的表达明显减少,Bax的表达呈剂量依赖性增加,因此,推测Dehy可能是通过调节Bcl-2和Bax的表达影响细胞的凋亡。
本研究表明,Dehy可以通过调节P27、Bcl-2和Bax的表达,影响人肝星状LX-2细胞的周期阻滞和凋亡,从而抑制其增殖的作用,而其具体的分子调控机制还有待进一步的研究。
[1]Tsochatzis EA,Bosch J,Burroughs AK.Liver cirrhosis[J].Lancet,2014,383(9930):1749-1761.
[2]Kotaro S,Satoshi E,Seo L,et al.Neovessel formation promotes liver fibrosis via providing latent transforming growth factor-β[J].Biochem Biophys Res Commun,2014,443(3):950-956.
[3]张怡,平洁,汪晖.肝星状细胞凋亡信号途径及其药物治疗的研究进展[J].中国药理学通报,2009,25(1):16-18.
[4]Jonathan F,Peter H.Pathogenesis and treatment of hepatic fibrosis:is cirrhosis reversible?[J].Clin Med,2011,11(2):179-183.
[5]Mohan P,Subha R,Kumar R.Saussurea costus:botanical,chemical and pharmacological reviewof an ayurvedic medicinal plant[J].J Ethnopharmacol,2007,110(3):379-390.
[6]Ming S,Jr S,Jaw D,et al.Cytotoxic sesquiterpene lactones from the root of Saussurea lappa[J].J Nat Prod,2003,66(9):1175-1180.
[7]Choi J,Kim Hee.Evaluation of anticancer activity of dehydrocostuslactone in vitro[J].Mol Med Rep,2011,3(1):185-188.
[8]Ji K,Sung L,Young P,et al.Apoptosis of DU145 human prostate cancer cells induced by dehydrocostus lactone isolated from the root of Saussurea lappa[J].Food Chem Toxicol,2008,46(12):3651-3658.
[9]Elena B,Rosanna DP,Hisanori S,et al.Costunolide and dehydrocostuslactone,two natural sesquiterpene lactones,ameliorate the inflammatory process associated to experimental pleurisy in mice[J].Eur J Pharmacol,2014,730(1):107-115.
[10]Chen C,Chou K,Lee D,et al.Active compounds from Saussurea lappa Clarks that suppress hepatitis B virus surface antigen gene expression in human hepatoma cells[J].Antiviral Res,1995,27(1/2):99-109.
[11]Kyung L,Eun S,Byung L,et al.Growth inhibitory,bactericidal,and morphostructural effects of dehydrocostus lactone from Magnolia sieboldii Leaves on antibiotic-susceptible and-resistant strains of Helicobacter pylori[J].PLoS One,2014,9(4):e95530.
[12]Seo Su,Choi Mi.The effects of dehydrocostus lactone on osteoblastic MC3T3-E1 cells in redox changes and PI3K/Akt/CREB[J].Immunopharmacol Immunotoxicol,2012,34(5):810-814.
[13]Hu L,Peng Z,Tang P,et al.Synthesis of peptides of Carapax Trionycis and their inhibitory effects on TGF-β1-induced hepatic stellate cells[J].Drug Discov Ther,2013,7(6):248-253.
[14]Kevin S,Michael B.Strategies for the enhancement of recombinant protein production from mammalian cells by growth arrest[J].Biotechnol Adv,2010,28(3):385-394.
[15]Bagci Z,Vodovotz Y,Billiar R,et al.Bistability in apoptosis:roles of bax,bcl-2,and mitochondrial permeability transition pores[J].Biophys J,2006,90(5):1546-1559.
Effectofdehydrocostuslactoneonproliferationandapoptosisinhepaticstellatecells
ChengJian,LinBin△,ShenXiaojie,LiuYan
(WuxiSeniorHealthVocationalTechnologySchool,Wuxi,Jiangsu214028,China)
ObjectiveTo investigate the effects of dehydrocostuslactone(Dehy) on human hepatic stellate LX-2 cells proliferation,apoptosis and the possible related mechanisms.MethodsAfter treating the LX-2 cells by different concentrations of Dehy,the MTT assay and flow cytometry were used to assess the influence of Dehy on cell proliferation and cycle distribution of LX-2 cells.The Hoechst 33342 staining and AV-PI dual staining were used to detect the effect of Dehy on cell apoptosis in LX-2 cells.The apoptosis related proteins expression was detected by Western blot.ResultsAfter different concentrations of Dehy acting for 48 h could significantly inhibit the proliferation of LX-2 cells,blocked the cellular cycle at stage S and G2/M,meanwhile induced LX-2 cells apoptosis in the concentration dependent manner;Western blot results showed that Dehy could promote the up-regulation of P27 and bax expression and down-regulation of Bcl-2.ConclusionDehy induces human liver LX-2 cells apoptosis and cell cycle arrest by adjusting the expression of Bax,Bcl-2 and P27.
dehydrocostuslactone;hepatic stellate cells;cell cycle;apoptosis
程剑(1967-),教授,硕士,主要从事肿瘤与病理方向研究。△
,E-mail:529733809@qq.com。
R364.3
A
1671-8348(2017)28-3906-03
2017-05-22
2017-07-10)
10.3969/j.issn.1671-8348.2017.28.008

