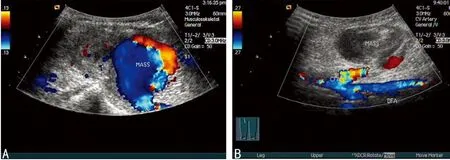
超声在治疗医源性股动脉假性动脉瘤中的临床价值*
张东竹,刘 学,杜 瑛,张梦菲,高红丽,黄丽红,姚延峰
(重庆医科大学附属永川医院超声医学科 402160)
·经验交流· doi:10.3969/j.issn.1671-8348.2017.28.025
超声在治疗医源性股动脉假性动脉瘤中的临床价值*
张东竹,刘 学,杜 瑛,张梦菲,高红丽,黄丽红,姚延峰△
(重庆医科大学附属永川医院超声医学科 402160)
目的评价超声引导下医源性股动脉假性动脉瘤(IFAP)瘤腔内注射凝血酶和超声引导加压在治疗IFAP中的应用价值。方法选取通过彩色多普勒确诊为IFAP患者56例,分为A、B两组。A组(28例)进行超声引导压迫下经皮瘤腔内注射凝血酶(UGTI)对股动脉假性动脉瘤(PSA)进行治疗,并于术后24 h,出院后1周、1个月、3个月随访复查。B组(28例)进行超声引导压迫修复法(UGCR)对PSA进行治疗,并于术后24 h及出院后1周、1个月、3个月随访复查。对两种方法治疗PSA的成功率、操作时间长短、复发率、并发症等方面进行评价。同时观察PSA瘤腔大小、瘤颈长度、瘤颈宽度及瘤口峰值血流速度等因素对两种治疗方法的影响。结果对PSA的治疗,UGTI成功率明显高于UGCR,UGTI操作时间明显短于UGCR,而复发率则显著低于UGCR。患者PSA瘤腔大小、瘤颈宽度对UGCR的影响都显著大于对UGTI的影响,而瘤口峰值血流速度对两种治疗方法均无明显影响。结论通过UGTI治疗PSA明显优于通过UGCR治疗PSA,UGTI可作为治疗经股动脉介入治疗术后形成PSA的首选方法。
医源性股动脉假性动脉瘤;超声引导压迫下经皮瘤腔内注射凝血酶;超声引导压迫修复法
随着现代医疗技术的不断发展,经股动脉血管内介入诊断及治疗技术也得到了广泛应用,伴随经股动脉介人手术的数量不断增加,各种较硬导管、较大口径鞘的运用、围术期抗血小板药物及高抗凝药物的使用、穿刺技术不熟练、穿刺点不当及拔鞘后未能正确压迫等综合因素的影响下,使得医源性股动脉假性动脉瘤(iatrogenic femoral artery pseud-oaneurysm,IFAP)的发生率明显增多,成为经股动脉介入术后较常见的并发症,有文献报道其发生率2%~6%,占到所有股动脉假性动脉瘤(pseudoaneurysms,PSA)的 近50%[1]。如果不对其进行及时而有效地诊断与治疗,会导致动脉瘤破裂、血栓栓塞、压迫周围正常神经、组织皮下组织或皮肤坏死等严重后果。血管吻合、局部动脉修补、手术切除是治疗PSA的主要手术处理方法,但这些方法存在创伤大、患者不耐受、并发症多及费用高等缺点,因此不易推广使用。近年来假性动脉瘤的治疗已由外科手术转向了压迫修复法(UGCR)、经皮瘤腔内注射凝血酶(UGTI)等[2-3]。现对本院 56例经股动脉介入治疗术后并发PSA行彩色多普勒引导压迫下瘤腔内注射凝血酶治疗法及彩色多普勒引导压迫治疗法的疗效和安全性进行分析,现报道如下。
1 资料与方法
1.1一般资料 收集2011年1月至2015年8月在本院经股动脉介入术后发生PSA患者56例,所有患者均经彩色多普勒(CDU)确诊,所有PSA均为单纯型。PSA的彩超诊断标准:(1)二维图像显示股动脉旁无回声或者混合性回声区;(2)瘤壁由周围纤维组织构成,缺乏动脉壁的三层结构;(3)瘤腔内血流缓慢,或呈涡流,或呈旋转的血流信号,表现为一半为红色而另一半为蓝色。若能清晰显示瘤颈部或破裂口,则可见收缩期血液从来源动脉进入瘤体内,舒张期瘤体内血液通过瘤颈部返回来源动脉,瘤颈长短不一;(4)在破裂口或瘤颈探及双期双向特征性频谱,其特点是:①双向为同一心动周期的正、反向血流;②双期是指正、反向血流分别持续于整个收缩期和舒张期;③收缩期流速明显高于舒张期流速;④压迫瘤体近侧来源动脉时,瘤体可缩小,瘤体的搏动性也明显减弱,瘤颈部和瘤腔内血液流速减低。将56例患者分为A、B两组,每组28例。A组:男16例,女12例,男女比例为1.00∶0.75;年龄39~82岁,平均(59.36±12.08)岁;瘤体大小为(7.8±4.2)cm2;瘤颈长度(5.1±1.4)mm,瘤颈宽度(2.7±0.6)mm,瘤口峰值流速(26.2±8.2)cm/s;发生假性动脉瘤的时间为术后1~4 d,平均(1.65±0.75) d。B组:男15例,女13例,男女比例为1.00∶0.87;年龄42~85岁,平均年龄(56.22±11.73)岁,瘤体大小为(8.3±3.0)cm2;瘤颈长度(5.9±1.2)mm,瘤颈宽度(2.6±0.7)mm;瘤口峰值流速(27.1±7.9)cm/s;发生假性动脉瘤的时间为术后1~3 d,平均(1.55±0.73) d。
1.2仪器与方法
1.2.1仪器与药物 仪器使用美国Philips IE33彩色多普勒超声诊断仪,频率5~10 MHz。穿刺架为PHILIPS_C5-1_翼控式超声穿刺架,20 G穿刺针、5 mL注射器。药物选用针剂凝血酶,将注射用凝血酶(冻干粉每支500 U)用 0.9% 生理盐水稀释成 200 U/mL备用,即5 mL注射器抽取 5 mL 生理盐水稀释凝血酶(冻干粉每支500 U)2支配成凝血酶液(200 U/mL),以1 mL注射器抽取1 mL凝血酶液,每0.1 mL凝血酶液中凝血酶的量是 20 U。
1.2.2治疗方法 A组采用UGTI法:(1)术前患者需要签署知情同意书,知情同意书告知患者及家属存在血栓、血管栓塞、出血、感染及过敏反应等并发症;(2)彩色多普勒血流成像(CDFI)明确PSA的部位、瘤体大小、瘤颈部位及瘤颈直径等,并明确瘘口处血流速度,同时做好体表标记,设计较好的进针路径;(3)患者取平卧位,患肢伸直,常规消毒后铺巾,为预防迷走神经反射,可皮下局部注射利多卡因进行浸润麻醉;(4)一名医生使用超声探头压迫封闭瘤颈并进行引导,另一医生在引导下将带有针芯的 20 G 穿刺针经皮穿刺入假性动脉瘤的瘤腔体部,使针尖远离瘤颈部,尽量靠近瘤腔体部的一侧边缘。拔出针芯,当有鲜红色血液流出后,则进一步确认穿刺针位于瘤体内。将装有凝血酶的注射器连接至穿刺针,在CDFI实时监视下将凝血酶小剂量缓慢注入瘤腔内,可见瘤腔内迅速形成絮状稍强回声团或低回声团,直至PSA瘤颈部及瘤腔内彩色血流信号消失,继续超声探头压迫瘤颈10 min; (5)少数病例一次注射凝血酶后以CDFI观察发现血栓周边至瘤腔壁仍有血流信号,则调整针尖位置至有血流信号处再次注射凝血酶,直至PSA瘤颈部及瘤腔内彩色血流信号消失;(6)注射凝血酶的同时注意患者反应及监测足背动脉搏动情况,预防远端动脉内形成血栓,造成远端动脉栓塞。手术完成后,以原体表标记的PSA瘤颈处为中心垫纱布,局部弹力绷带、沙袋加压压迫包扎,压迫治疗力量以能保持远端正常血流(足背动脉搏动可触及)及患者能耐受为宜,压迫时间为 24 h,患肢制动8 h、绝对卧床休息24 h。加压过程中,每间隔2 h观察远端肢体血供情况,防止远端动脉血栓形成造成肢体缺血。(7)在术后24 h予以超声复查,出院后1周、1个月及3个月门诊彩超CDFI随访,了解 PSA 是否完全闭合或复发,同时观察远端血管情况,了解有无相关并发症。B组采用UGCR法: CDFI明确 PSA 的部位、瘤体大小、瘤颈部位及瘤颈直径等,并明确瘘口处血流速度以后,在实时CDFI监控下,定位后在体表做好标记,调节加压力度,用探头选择性压迫PSA的瘘口近心端,以阻断进入瘤体的血液,促使瘤体内血栓形成。垂直加压20 min后缓慢减压,彩色多普勒超声显示瘤腔内是否出现絮状低回声,血流信号消失,如果瘤腔内出现絮状低回声、瘤腔血流信号消失,考虑首次压迫成功。操作时应适度加压,以能阻断血流进入瘤体的同时又保持远端正常血流(足背动脉搏动可触及)为宜。若压迫20 min后瘘口处或瘤体内血流依然存在,则再次加压20 min后再缓慢减压然后观察瘘口处或瘤体内有无血流信号存在,若重复上述方法4次,瘘口处或瘤体内血流依然存在则视为治疗失败,则选择其他方法进一步治疗。待瘤腔及瘤颈内血流信号消失后,所有病人均用弹力绷带进行加压包扎并患肢制动8 h、绝对卧床休息24 h。在压迫24 h后予以超声复查,出院后1周、1个月及3个月门诊彩超随访,了解 PSA 是否完全闭合或复发,同时观察远端血管情况,了解有无相关并发症。
1.2.3疗效标准[8]术后第2天、出院后1周、1个月、3个月彩超复查,瘤腔消失或瘤腔内血栓形成使瘤腔无彩色血流信号为治疗成功标准,而术后瘤腔内依然探及血流信号则为治疗失败。
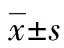
2 结 果
本研究发现A组21例患者注射一次凝血酶后瘤腔内迅速可见絮状稍强回声团或低回声团(图1、2),血栓形成时间均在 30 s内,平均10 s,瘤腔在2~4 min 内全部形成血栓并闭合,7例患者注射第二次凝血酶,瘤腔在7 min 内全部形成血栓并闭合,治疗总成功率100%;除1例术后1 d低热,观察1周后自行好转外,无其余并发症发生。B组 28例患者中,80 min内治疗成功24例,其中 20~40 min 7例,40~60 min 13例,60~80 min 4例,成功率为85.7%;术后 3 例患者复发,其中1例于术后第2天复发,1例于出院后第1天复发,另1例于出院后第3天复发,复发率为 12.5%;除1例患者术后持续疼痛2 d外(分析原因可能因其过于肥胖在加压过程中用力太重和用力时间太长有关),余无其他并发症。A组的操作时间明显小于B组,差异有统计学意义(P<0.05),A组患者的手术成功率明显高于B组患者,而术后复发率明显低于B组,差异有统计学意义(P<0.05)。两组患者均无明显并发症发生,差异无统计学意义(P>0.05),患者PSA瘤腔大小、瘤颈长度及瘤口大小均对UGCR法有较明显影响,而对UGTI法基本无影响,其差异有统计学意义(P<0.05),而瘤口峰值流速对两组患者均无明显影响,其差异无统计学意义(P>0.05),见表1、2。
A:治疗前假性动脉瘤内彩色血流信号;B治疗后假性动脉瘤内血栓形成
图1典型病例1
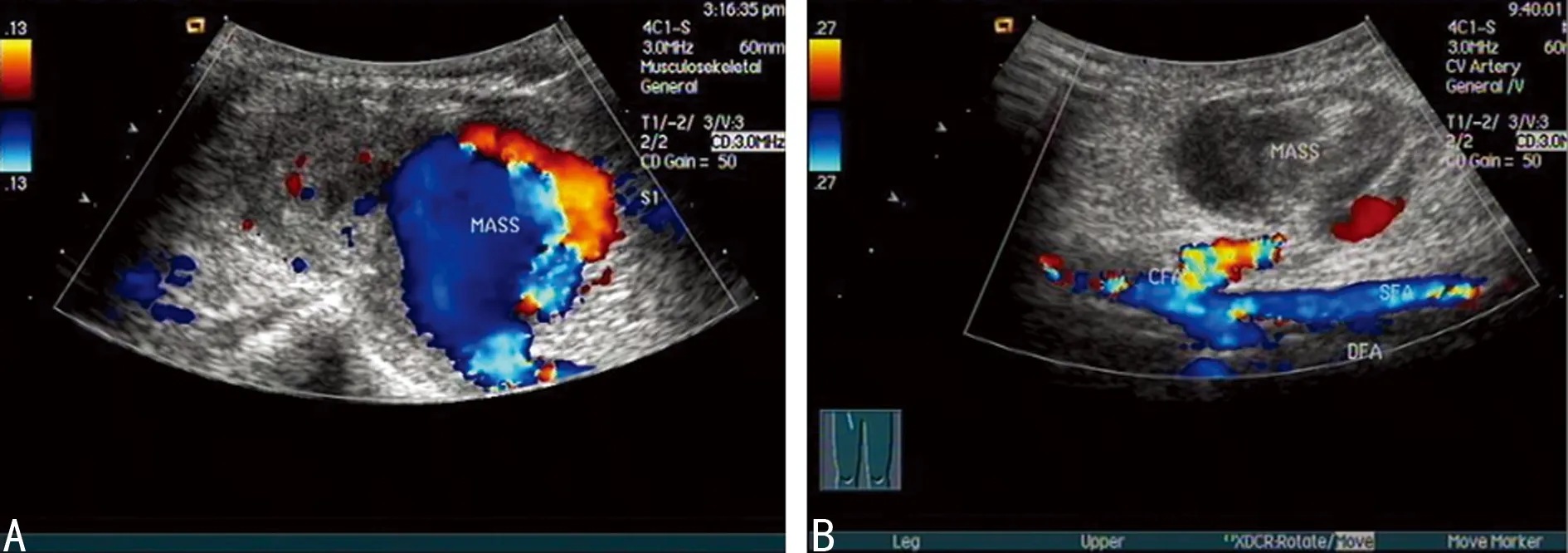
A:治疗后假性动脉瘤内血栓形成;B治疗后假性动脉瘤内未见血流信号
图2典型病例2
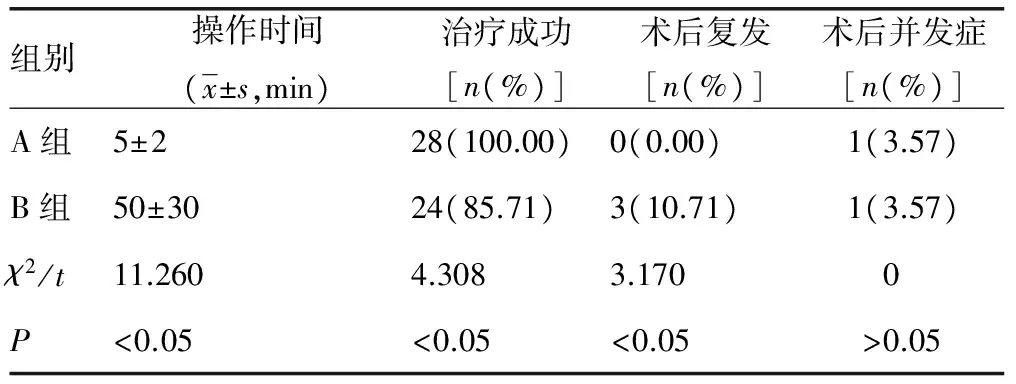
表1 两组患者治疗效果比较(n=28)
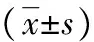
表2 动脉瘤特征对两组患者疗效的影响
3 讨 论
随着介入性诊断治疗技术及动脉穿刺的大量开展,各种大口径管、鞘的运用、穿刺技术不成熟,以及围术期抗凝药物和抗血小板药物的应用,使得IFAP的发生率明显升高。成为临床较常见的并发症,相关文献报道其发生率2%~6%[2]。绝大多数PSA不但不能自愈,而且可能不断增大,并伴发局部压迫症状加重甚至破裂出血。因此,一旦确诊PSA应进行积极有效治疗,PSA的处理时间与感染率、肢体缺血性挛缩发生率、截肢率及病死率等关系密切,故及时确诊并采取积极有效的治疗措施,可避免或减少相应的并发症和后遗症。目前常用治疗方法有加压包扎、UGTI、UGCR、载瘤动脉内置入带膜支架及外科手术行假性动脉瘤切除和动脉修补术等,但其中外科手术创伤大。带膜支架置入费用昂贵,不作为治疗股动脉假性动脉瘤的首选。UGTI及UGCR因为简单、安全,成功率较高,成了可供选择的较佳方案。
UGTI治疗法的治疗机制主要为压迫瘤颈的同时直接将凝血酶注入瘤腔内促使血栓迅速形成,从而达到堵塞瘤颈,阻止动脉血流进入瘤腔,从而起到封闭PSA瘤体的目的。在注射凝血酶时使用二维超声及CDFI观察瘤腔血栓形成过程,均以注射凝血酶针尖处为中心逐步形成血栓,数10 s内血栓即迅速扩充至整个瘤腔,多数病例仅需注射一次凝血酶,数分钟后整个瘤腔既能充满血栓,以CDFI观察未见血栓内及血栓与瘤腔壁间有彩色血流信号,这与注射的凝血酶能迅速激活凝血系统有关,在血栓形成同时,瘤腔内血液流速明显减缓,也进一步促进血栓形成并扩大,直至血栓充满整个瘤腔。少数病例以CDFI观察发现血栓周边至瘤腔壁仍有血流信号,则调整针尖位置至有血流信号处再次注射凝血酶,调整针尖位置后补充注射凝血酶依然效果显著。UGCR治疗法的机制主要在于通过超声探头加压压迫使PSA瘤颈和漏道闭塞,阻断进入瘤腔内的动脉血流,使其在局部形成血栓,然后再通过血栓机化,纤维组织形成,从而达到闭合瘤腔的目的。
本研究中,UGTI法治疗PSA与UGCR治疗PSA在操作时间、复发率存在统计学差异,同时PSA的瘤腔大小、瘤口大小及瘤颈长度对UGCR治疗法的影响也明显大于对UGTI治疗法。以上因素均与两种治疗方法的治疗机制息息相关。A组通过UGTI发治疗的 28例患者中21例均一次注射凝血酶治疗成功,另7例注射2次凝血酶治疗成功,总成功率100%;血栓形成时间均在30 s内,平均约12 s。与童国新等[4]报道超声引导下注射凝血酶治疗股动脉PSA治愈率达96%~100%基本相符。而UGCR法治疗PSA的治疗时间较UGTI治疗法治疗PSA的时间明显增加,平均治疗时间达50 min,最长达80 min。其原因为UGTI 法将凝血酶直接注入瘤腔内,其刺激凝血系统十分迅速,故形成血栓较快。而UGCR法是压迫瘤颈后、阻断血流,使瘤腔内自然形成血栓,这个过程较为缓慢,故而两种治疗方法的操作时间差异明显。同时通过UGTI治疗法形成的血栓性质稳定,PSA复发率极低,而通过UGCR法治疗形成的血栓较为松散,在压力消失后,随着瘤口高速血流的冲击及血栓再通等因素的影响下,少部分瘤腔较大和瘤口较大的PSA瘤腔再次开放,使治疗难以成功,或者治疗成功后一段时间内再次复发。Luedde等[5]报道的瘤颈较短、瘤体及瘤口较大患者单纯压迫往往难以成功与本研究所得出的结论相一致。
局部压迫修复法对操作医师的耐力和体力要求均较高,长时间用手加压,容易产生手部及全身疲劳;而且由于患者感觉疼痛明显且持续时间较长,部分患者不能耐受[6],反复多次压迫还容易造成皮肤破溃、坏死、感染等,加重患者痛苦;而且对于PSA瘤体较大的患者,单纯压迫治疗也不易成功,有报道其失败率可高达27%~34%,尤其对于肥胖患者。有研究显示,使用超声引导下瘤腔内凝血酶注射治疗假性动脉瘤治愈率高达99%[7],而童国新等[4]也报道超声引导下注射凝血酶治疗股动脉PSA治愈率达96%~100%。以上报道与本研究结果基本相符。
综上所述,均表明UGTI法治疗PSA成功率明显高于UGCR治疗法。故UGTI法和UGCR法比较,其方法治疗时间更短,成功率更高,同时减轻了治疗医生和患者的不适,值得临床推广应用。
[1]Corso R,Rampoldi A,Riolo F,et al.Occlusion of post catheterisation femoral pseudoaneurysms with percutaneous thrombin injection under ultrasound guidance[J].Radiol Med,2004,108(4):385-393.
[2]Vlachou PA,Karkos CD,Bains SA,et al.Percutaneous ultrasound-guided thrombin injection for the treatment of iatrogenic femoral artery pseudoaneurysms[J].Eur J Radiol,2011,77(1):172-174.
[3]Kuma S,Morisaki K,Kodama A,et al.Ultrasound-Guided percutaneous thrombin injection for Post-Catheterization pseudoaneurysm[J].Circulation J,2015,79(6):1277-1281.
[4]童国新,王宁夫,叶显华,等.凝血酶栓塞治疗冠脉介入术后股动脉假性动脉瘤疗效观察[J].心脑血管病防治,2008,8(6):372-374.
[5]Luedde M,Krumsdorf U,Zehelein J,et al.Treatment of iatrogenic femoral pseudoaneurysm by ultrasound-guided compression therapy and thrombin injection[J].Angiology,2007,58(4):435-439.
[6]崔国明,侯家声.股动脉假性动脉瘤彩色多普勒超声诊断及监测分析[J].医学影像学杂志,2009,19(12):1598-1600.
[7]Paulson EK,Sheafor DH,Kliewer MA,et al.Treatment of iatrogenic femoral arterial pseudoaneurysms:comparison of US-guided thrombin injection with compression repair [J].Radiol,2000,215(2):403-408.
重庆市卫生计生委医学科研基金资助项目(2015ZBXM069);重庆市永川区科委自然科学基金资助项目(Ycstc,2015nc5027);重庆医科大学附属永川医院院级基金资助项目(YJLCX201628)。
张东竹(1979-),主治医师,硕士,主要从事临床影像与核医学研究。△
,E-mail:yaoyanfeng111@163.com。
R543.16
B
1671-8348(2017)28-3965-03
2017-04-15
2017-06-25)

