基质金属蛋白酶-8对角膜基质胶原的作用研究*
金 鑫,刘素素,贺司宇,王丽娅,张芬芬,代闫芳,杨 柯,张晊瑞,张红敏△
(1.郑州大学人民医院眼科/河南省眼科研究所/河南省立眼科医院,郑州 450000;2.锦州医科大学眼科学硕士研究生,辽宁锦州 121000;3.新乡医学院眼科学硕士研究生,河南新乡 453000)
论著·基础研究doi:10.3969/j.issn.1671-8348.2017.30.004
基质金属蛋白酶-8对角膜基质胶原的作用研究*
金 鑫1,刘素素1,贺司宇1,王丽娅1,张芬芬2,代闫芳1,杨 柯1,张晊瑞3,张红敏1△
(1.郑州大学人民医院眼科/河南省眼科研究所/河南省立眼科医院,郑州 450000;2.锦州医科大学眼科学硕士研究生,辽宁锦州 121000;3.新乡医学院眼科学硕士研究生,河南新乡 453000)
目的探讨基质金属蛋白酶-8(MMP-8)对角膜的作用。方法选取健康C57BL/6J小鼠15只,右眼角膜基质内注射10 μL MMP-8作为实验组,左眼给予等量生理盐水作为对照组。于0、4、8 h使用双光子显微镜二次谐波成像技术对活体小鼠角膜逐层扫描,Imaris软件对所得图像三维重建,计算图像信号强度。4、8 h在裂隙灯下评价角膜混浊度。8 h角膜取材,测定各角膜羟脯氨酸水平。结果0 h实验组及对照组小鼠角膜基质纤维信号强度分别为89.7±11.2、85.3±7.0,4 h分别为14.5±3.4、46.6±14.0,8 h分别为11.0±4.6、34.6±12.5,4 h及8 h,实验组较对照组角膜基质信号强度明显降低(P<0.05);4 h及8 h,实验组较对照组角膜明显混浊(P<0.05);8 h测得实验组与对照组角膜羟脯氨酸水平分别为(0.433±0.090)、(0.590±0.133)μg/mg,实验组明显低于对照组(F=7.193,P=0.014)。结论MMP-8对小鼠角膜基质胶原有明显的降解破坏作用,导致角膜透明度下降。
角膜基质;基质金属蛋白酶-8;二次谐波成像
真菌性角膜炎(fungal keratitis,FK)是一种严重的致盲性眼病,近年来发病率逐渐升高[1]。国内外学者研究发现,基质金属蛋白酶(matrix metalloproteinases,MMP)-8在FK表达升高[2]。MMP-8属于MMPs中胶原酶的一种,可降解Ⅰ、Ⅱ、Ⅲ型胶原。目前研究认为MMP-2和MMP-9在角膜基质重塑及胶原降解中有重要作用[3],而MMP-8对角膜的作用及作用机制尚少见研究报道。二次谐波(second harmonic generation,SHG)成像是近年发展起来的一种层面扫描解析组织结构的光学成像技术,具有非线性光学成像特有的三维高分辨率和高成像深度,在生物医学领域先后应用于角膜、活细胞成像等研究方向[4]。本实验通过建立小鼠角膜MMP-8基质注射模型,使用SHG实时活体观察胶原纤维信号强度等,探讨MMP-8对小鼠角膜胶原的作用。
1 材料与方法
1.1材料
1.1.1实验动物 8~12周龄无特殊病原体(SPF)级雄性C57BL/6J小鼠15只,体质量20~25 g,购自南京大学模式动物研究所,经裂隙灯检查无眼科疾病。实验小鼠在温度为(25±1)℃、相对湿度为59%~61%、12 h光照/12 h黑暗的SPF级动物房内饲养,由专人管理。动物的饲养与使用遵照相关的实验动物伦理要求。
1.1.2主要试剂及仪器 重组鼠MMP-8(rmMMP-8,美国R&D公司)、MMP-8检测试剂盒(美国AnaSpec公司)、羟脯氨酸试剂盒(南京建成生物工程研究所)、4-乙酸汞基苯胺(AMPA,美国Sigma公司)、酶标仪(美国Perkin Elmer公司)、裂隙灯显微镜(日本Topcon公司)、手术显微镜(苏州六六视觉科技股份有限公司)、体视显微镜(德国Zeiss公司)、双光子激光扫描显微镜(德国Zeiss公司)。
1.2方法
1.2.1MMP-8活性鉴定 用Assay Buffer配制50 μL 1 ng/μL MMP-8(含1 mmol/L AMPA),37 ℃孵育1 h活化后加入酶板,同时加入50 μL MMP-8 底物;另设50 μL Assay缓冲液加入50 μL MMP-8底物作为单纯底物孔,各重复3个复孔,室温孵育30 min。设置激发光波长340 nm,发射光波长490 nm,酶标仪测吸光度(A)值。
1.2.2角膜基质注射动物模型建立及分组 右眼作为实验组,用Assay缓冲液配置20 ng/μL MMP-8,37 ℃孵育1 h活化,角膜基质注射方法参照文献[5]。实验小鼠按0.017 mL/g腹腔注射1%戊巴比妥钠麻醉。手术显微镜下,术者左手轻按小鼠结膜囊以暴露眼球,右手持微量注射器,角膜缘内1 mm处进针,进入角膜中基质层后缓慢注射约10 μL MMP-8。左眼作为对照组按上述方法注射等量生理盐水。
1.2.3角膜混浊度临床评分 基质注射前(0 h)及注射后4、8 h在裂隙灯显微镜下观察小鼠角膜混浊度,评分系统如下[6]:角膜完全透明,虹膜纹理清晰可见,计0分;角膜轻度混浊,可见75%及以上虹膜纹理,计1分;角膜基质中度混浊,可见50%~<75%虹膜,计2分;角膜基质重度混浊,仅可见50%以下虹膜,计3分;角膜基质完全混浊,不可透见前房、虹膜及瞳孔,计4分。
1.2.4SHG观察角膜基质信号强度 将小鼠麻醉平稳后放在特殊制作的固定头位的平台上,暴露待测角膜,根据参考文献[6]设置发射波长780 nm,20倍水浸物镜观察,使用Z-stack(Z=5 μm)逐层扫描,于0、4、8 h采集图像,获得的图像用Imaris软件进行三维重建,计算图像的平均信号强度。图像信号强度越强即说明角膜基质胶原纤维排布越规则,角膜基质结构完整,图像信号越弱即说明角膜基质胶原纤维结构紊乱或被降解[7]。
1.2.5羟脯氨酸试剂盒检测角膜羟脯氨酸水平 羟脯氨酸为胶原水解产物,测定羟脯氨酸可反映角膜中胶原的水平,操作参照文献[8]及试剂盒说明书进行,方法如下:8 h后经腹腔麻醉小鼠,脱颈椎法处死,体视显微镜下进行角膜取材,测质量(mg)。将角膜放入EP管中剪碎,加入100 μL水解液,95 ℃水浴加热20 min,调节pH在6.0~6.8,加入1 mL蒸馏水及少量活性碳,混匀离心,取100 μL上清液。配置100 μL 5 μg/mL羟脯氨酸标准品。取100 μL蒸馏水作为空白对照。向空白管、标准品及各样品中分别加入100 μL 56 mmol/L Chlormine T试剂,室温孵育25 min,取100 μL上清液,加入100 μL 1 mol/L Ehrlich′s 液,60 ℃水浴15 min,冷却后,3 500 r/min离心10 min,取上清液200 μL加入96孔板,各设2个复孔,于波长550 nm测定A值。按照公式:(测定A值-空白A值)/(标准A值-空白A值)×标准品浓度×水解液总体积(0.1 mL)/角膜湿重(mg),计算样品中的羟脯氨酸水平(μg/mg)。
1.3统计学处理 采用SPSS 20.0软件进行统计学分析。角膜混浊度比较采用两独立样本资料比较的Wilcoxon秩和检验。SHG检测基质信号强度组间比较采用重复测量方差分析。角膜羟脯氨酸浓度检测组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1MMP-8活性鉴定 MMP-8平均A值(A490)为206.3±13.9,单纯底物孔为34.0±6.6。
2.2角膜混浊度临床评分的比较 于0、4、8 h使用体视显微镜对角膜拍照(图1)。4 h浑浊度为0分的角膜在实验组为0只,对照组为11只,浑浊度为1分在实验组为12只,对照组为4只,浑浊度为2分在实验组为3只,对照组为0只;8 h浑浊度为0分的角膜在实验组为0只,对照组为13只,浑浊度为1分在实验组为4只,对照组为2只,浑浊度为2分在实验组为11只,对照组为0只。使用Wilcoxon秩和检验统计结果,4 h及8 h实验组与对照组角膜混浊度比较,差异有统计学意义(均P=0.000)。
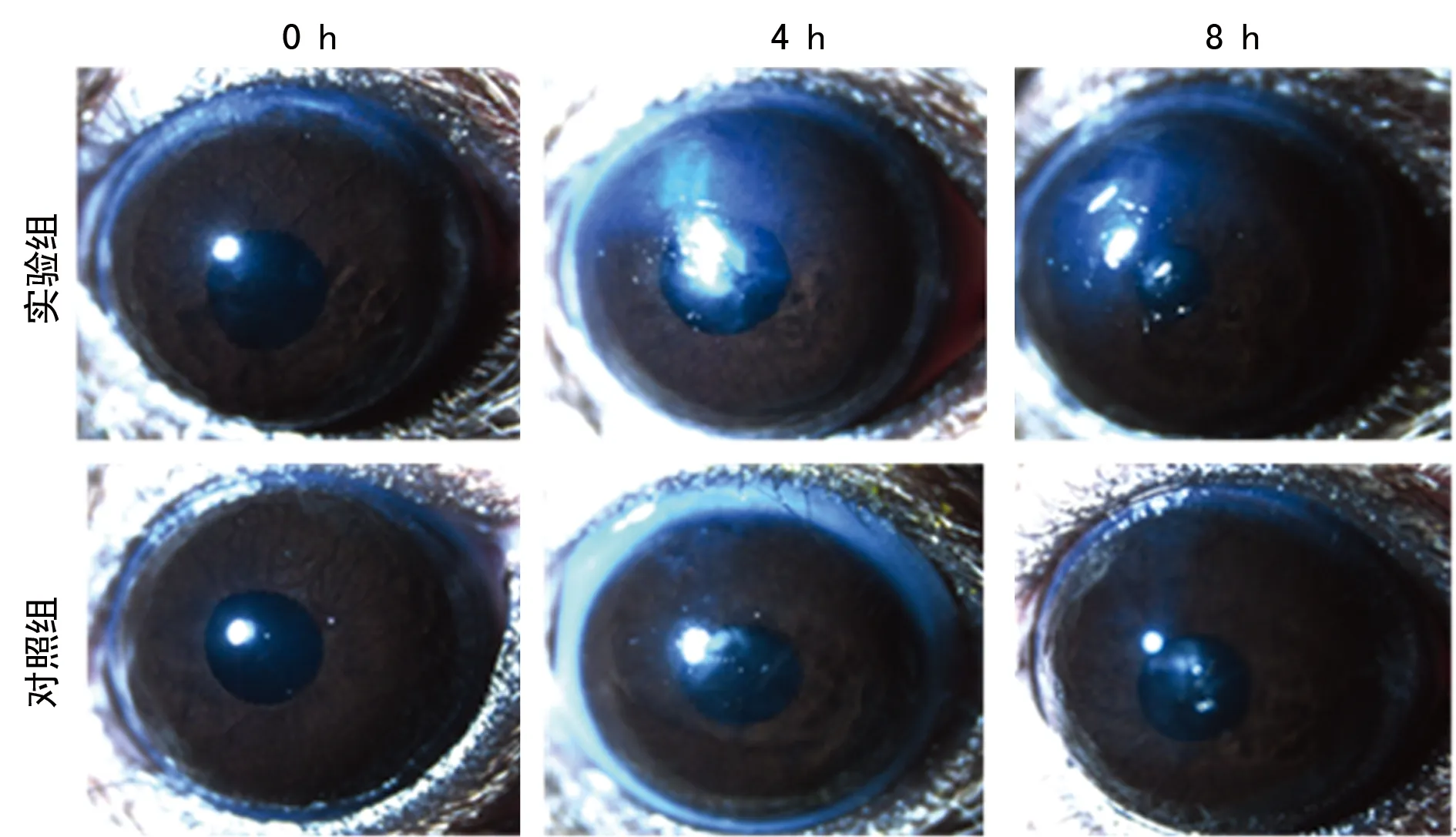
图1 体视显微镜下小鼠角膜(×16)
2.3SHG观察基质信号强度 0 h实验组与对照组角膜基质信号强度分别为89.7±11.2、85.3±7.0;4 h实验组与对照组分别为14.5±3.4、46.6±14.0;8 h实验组与对照组分别为11.0±4.6、34.6±12.5。重复测量方差分析统计结果,根据Mauchly球形检验,所得数据不符合球形假设(P<0.05),故对数据进行多变量方差分析,各个时间点的数据差异有统计学意义(P<0.01)。各组内不同时间点角膜基质信号强度比较,差异有统计学意义(P<0.05);实验组和对照组0 h间比较,差异无统计学意义(P=0.75);实验组和对照组间4 h及8 h比较,差异有统计学意义(P=0.000),实验组角膜基质纤维信号强度较对照组明显降低。
2.4角膜羟脯氨酸水平测定 8 h角膜取材,实验组与对照组角膜羟脯氨酸水平分别为(0.433±0.090)、(0.590±0.133)μg/mg,使用单因素方差分析统计数据,经Shapiro-Wilk检验证实呈正态分布(P>0.05),组间方差经 Levene 检验证实方差齐,实验组角膜羟脯氨酸水平明显低于对照组(F=7.193,P=0.014)。
3 讨 论
FK是全球范围内一种严重的致盲性眼病,由于共聚焦显微镜等早期诊断技术及抗真菌滴眼剂的早期应用,已部分降低真菌性眼内炎的发生率,从而避免眼内容剜除。然而临床上FK患者由于基质破坏在晚期往往形成瘢痕愈合,若瘢痕位于瞳孔区,甚至致盲[1]。由于角膜供体紧缺,虽然人工角膜及各种角膜替代材料正在研究中,目前仍有相当一部分患者不能够进行角膜移植,且术后为预防角膜排异反应需长期应用抗排斥滴眼剂,影响患者的生活质量,所以如何防止瘢痕形成已成为近年来FK研究的重要方向。
FK大致发病过程如下,角膜受外伤后,上皮细胞屏障受损,导致基底膜暴露,致病真菌黏附于受损的角膜上皮,引起机体天然免疫和适应性免疫反应。一方面,真菌的病原相关分子结构与宿主角膜上皮细胞的Toll样受体(TLRs)相互作用,引起角膜上皮细胞分泌白细胞介素(IL)-8等诱导中性粒细胞浸润;另一方面,真菌表面的β-葡聚糖与角膜居留巨噬细胞表面的Dectin-1结合,导致酪氨酸激酶(Syk)磷酸化、核因子(NF)-κB转移至核内,NF-κB进入核内进一步引起肿瘤坏死因子(TNF)-α、IL-1β、IL-8表达,扩大炎性反应,免疫细胞(主要是中性粒细胞[9])释放水解酶,在杀灭真菌的同时对角膜造成破坏[10]。
MMPs分5个亚组,胶原酶、明胶酶、基质水解酶、膜型金属蛋白酶及广泛底物酶。其中,MMP-8属于胶原酶的一种,又名中性粒细胞胶原酶。正常状态下,MMP-8以酶原的形式存在,然而病理状态下,如角膜溃疡[11]、人工角膜移植术后[10],MMP-8表达迅速升高,当MMPs与基质金属蛋白酶组织抑制剂(TIMPs)失衡,可导致角膜基质降解。
本研究通过建立MMP-8高表达模型,以SHG成像技术活体实时观察角膜基质胶原纤维及混浊度变化,并通过角膜羟脯氨酸的测定,定量观察角膜胶原水平,阐明了MMP-8可直接降解角膜Ⅰ型胶原,从而造成基质破坏,导致角膜混浊。随着MMPs/TIMPs在角膜疾病研究的不断深入,现已研制多种天然及人工合成TIMPs,在角膜炎症早期使用TIMPs滴眼剂可为角膜瘢痕的治疗提供新策略。本研究为TIMPs滴眼剂应用于MMP-8高表达的角膜病以减轻角膜瘢痕提供新思路。
[1]Kredics L,Narendran V,Shobana CS,et al.Filamentous fungal infections of the cornea:a global overview of epidemiology and drug sensitivity[J].Mycoses,2015,58(4):243-260.
[2]Leal SM,Pearlman E.The role of cytokines and pathogen recognition molecules in fungal keratitis-Insights from human disease and animal models[J].Cytokine,2012,58(1):107-111.
[3]Ollivier FJ,Gilger BC,Barrie KP,et al.Proteinases of the cornea and preocular tear film[J].Vet Ophthalmol,2007,10(4):199-206.
[4]王艳艳,韩蒙,孙辉,等.用二次谐波成像技术研究经飞秒激光切削后角膜变化[J].激光生物学报,2005,14(5):321-326.
[5]Sonoda Y,Streilein JW.Orthotopic corneal transplantation in mice--evidence that the immunogenetic rules of rejection do not apply[J].Transplantation,1992,54(4):694-704.
[6]Ghazaryan A,Tsai HF,Hayrapetyan G,et al.Analysis of collagen fiber domain organization by Fourier second harmonic generation microscopy[J].J Biomed Opt,2013,18(3):31105.
[7]Siddiqi NJ,Alhomida AS.Hydroxyproline concentrations in ocular tissues of Arabian camel (Camelus dromedarius Linn.)[J].Indian J Biochem Biophys,2003,40(6):451-454.
[8]张红敏,刘素素,许中中,等.小鼠真菌性角膜炎中主要免疫细胞的作用[J].中华实验眼科杂志,2012,30(9):779-784.
[9]Lee H,Overall CM,McCulloch CA,et al.A critical role for the membrane-type 1 matrix metalloproteinase in collagen phagocytosis[J].Mol Biol Cell,2006,17(11):4812-4826.
[10]Robert MC,Arafat SN,Spurr-Michaud S,et al.Tear Matrix Metalloproteinases and Myeloperoxidase Levels in Patients With Boston Keratoprosthesis Type I[J].Cornea,2016,35(7):1008-1014.
[11]Sakimoto T,Ohnishi T,Ishimori A.Simultaneous study of matrix metalloproteinases,proinflammatory cytokines,and soluble cytokine receptors in the tears of noninfectious corneal ulcer patients[J].Graefes Arch Clin Exp Ophthalmol,2014,252(9):1451-1456.
EffectofMMP-8oncorneacollagen*
JinXin1,LiuSusu1,HeSiyu1,WangLiya1,ZhangFenfen2,DaiYanfang1,YangKe1,ZhangZhirui3,ZhangHongmin1△
(1.DepartmentofOphthalmology,People′sHospitalofZhengzhouUniversity/HenanProvinvcialEyeInstitute/HenanProvinvcialEyeHospital,Zhengzhou,Henan,450000,China;2.DepartmentofOphthalmology,JinzhouMedicalUniversity,Jinzhou,Liaoning121000,China;3.MasterDegreeCandidateofOphthalmology,XinxiangMedicalUniversity,Xinxiang,Henan453000,China)
ObjectiveTo investigate the effect of MMP-8 on cornea.MethodsFifteen C57BL/6J healthy mice were selected.The right eyes corneal stroma was injected by 10μL MMP-8 as the experimental group and the left eyes were injected by same amount of normal saline as the control group.At 0,4,8 h,the two-photon microscope second harmonic generation imaging technology was used to scan mice corneal stroma layer by layer in vivo.The obtained images were performed the 3D reconstruction by Imaris software and the signal intensity of the images were calculated.At 4,8 h,the corneal opacity degree was evaluated under slit lamp.At 8 h,mice were killed and corneas were collected to determine the hydroxyproline concentration.ResultsThe cornea stromal fiber signal strengthes at 0 h in the experimental group and control group were (89.7±11.2) and (85.3±7.0),which at 4 h were (14.5±3.4) and (46.6±14.0) respectively,which at 8 h were (11.0±4.6) and (34.6±12.5) respectively.The cornea stromal signal strength at 4,8 h in the experiemental group was significantly decreased compared with that in the control group (P<0.05);the cornea at 4,8 h in the experimental group was significantly turbid than that in the control group (P<0.05);the cornea hydroxyproline concentrations detected at 8h in the experiemental group and control group were (0.433±0.090) μg/mg and (0.590±0.133) μg/mg respectively,the experimental group was significantly lower than the control group (F=7.193,P=0.014).ConclusionMMP-8 has obvious degradation and destroy effect on mice corneal stroma collagen,which leads to the decrease of corneal opacity.
corneal matrix;matrix metalloproteinases-8;second harmonic generation
河南省自然科学基金资助项目(162300410163);河南省创新人才计划项目(144100510015);河南省国际合作项目(152102410085)。
金鑫(1991-),住院医师,硕士,主要从事角膜病的研究。△
,E-mail:zhm0906@163.com。
R392.9
A
1671-8348(2017)30-4187-03
2017-01-18
2017-04-06)

