人巨细胞病毒miR-UL22A的重组载体构建以及表达分析
王鸿雁, 王 博, 齐 莹, 马艳萍, 黄郁晶, 柳中洋, 阮 强
(中国医科大学附属盛京医院 病毒研究室,辽宁 沈阳 110004)
人巨细胞病毒miR-UL22A的重组载体构建以及表达分析
王鸿雁, 王 博, 齐 莹, 马艳萍, 黄郁晶, 柳中洋, 阮 强*
(中国医科大学附属盛京医院 病毒研究室,辽宁 沈阳 110004)
优化构建人巨细胞病毒(human cytomegalovirus, HCMV)miR-UL22A的真核表达载体;明确HCMV临床株及实验室株感染过程中miR-UL22A-5p及miR-UL22A-3p的表达情况。扩增HCMV UL22A编码区不同长度(975、494、209及140 bp)的序列,构建表达miR-UL22A的重组pSilencer(pS)载体,转染人胚肾293细胞后提取总RNA;收集HCMV临床株Han株以及实验室株Towne株感染人胚肺成纤维细胞后6、12、24、48和72 h以及不同感染时相(即刻早期、早期、晚期)的总RNA标本;应用TaqMan颈环-实时荧光定量PCR技术检测上述标本miR-UL22A-5p及miR-UL22A-3p的表达量。成功构建了包含上述不同长度miR-UL22A编码序列的重组载体; 侧翼序列长度各为40 bp左右的pre-miRNA(即插入140 bp的编码序列)表达成熟miRNA的效果最佳;在病毒的一个复制周期内,HCMV临床株和实验室株miR-UL22A的表达趋势无明显差异,均在感染后6 h即检测到表达,72 h达到峰值,且在即刻早期即有miRNA的明确表达;无论是在重组载体表达状态下还是自然感染状态下,miR-UL22A-5p始终为miR-UL22A前体优势表达的miRNA。结果表明,有140 bp片段miR-UL22A编码序列的重组载体能够高效地异源表达miR-UL22A-5p及miR-UL22A-3p; miR-UL22A-5p始终为miR-UL22A前体优势表达的miRNA。为进一步研究miRNA转录后调控作用提供了参考。
人巨细胞病毒;miR-UL22A-5p;miR-UL22A-3p
microRNA (miRNA) 是一类含20~24个核糖核苷酸的小分子RNA家族,广泛存在于病毒、植物以及高等哺乳动物中。近年的研究发现,miRNA通过与其靶mRNA分子的3′末端非编码区域(3′untranslated region, 3′UTR) 结合,在病毒感染、生物个体发育以及肿瘤发生等生命活动过程中发挥重要的转录后调控作用[1]。人巨细胞病毒(human cytomegalovirus, HCMV) 在人群中感染广泛,健康人群感染HCMV后多呈无症状或亚临床感染,但胎儿等免疫功能低下人群感染HCMV会导致严重损害。目前,活产新生儿先天性HCMV感染率约为0.7%,常累及多个器官及系统;无症状HCMV先天感染儿有5%~15%在生后2 a内发生胆汁淤积性肝炎、胆道闭锁、神经性耳聋或不同程度神经精神运动障碍[2]。迄今为止,HCMV的致病机制尚不清楚;其复杂的生活周期需要大量的基因产物以及调控机制参与,而HCMV编码的miRNA通过调控病毒和/或宿主的基因表达,在HCMV和宿主复杂的相互作用中发挥重要作用[3-4]。目前的研究表明,HCMV至少编码24种miRNA。尽管miR-UL22A-5p和miR-UL22A-3p是最早被鉴定出的HCMV编码的两种miRNA,但它们的表达特性以及生物学功能尚不十分明确。在miRNA生物学功能的研究过程中,经常需要外源性补充或提供miRNA;除采用合成miRNA前体的方法外,可以用载体表达所研究的miRNA。本研究以miR-UL22A为研究对象,构建了含有miR-UL22A前体不同长度编码序列的重组载体,检测由同一miR-UL22A前体同时表达miR-UL22A-5p和miR-UL22A-3p的表达量,明确构建miRNA重组表达载体所需最合适的前体miRNA (pre-miRNA)侧翼序列长度。同时,为了明确miR-UL22A-5p及miR-UL22A-3p表达的时相特点,检测了HCMV临床株Han株以及实验室株Towne株在感染后6、12、24、48和72 h以及不同感染时相(即刻早期IE、早期E、晚期L)这一miRNA的表达情况。
1 材料与方法
1.1材料
人胚肾293细胞(HEK 293)及人胚肺成纤维细胞(HELF)购自中国科学院细胞库。pSilencerTM4.1-CMV neo载体及TURBO DNA-free kit购自Ambion公司。质粒提取试剂盒Wizard® Plus SV Minipreps DNA Purification System购自promega公司。脂质体2000以及Trizol reagent购自Invitrogen公司。FQ-PCR产品购自ABI公司,包括:CustomTaqMan®Small RNA Assays,TaqMan®MicroRNA Reverse Transcription Kit,TaqMan®Universal PCR Master Mix Kit。 HCMV miR-UL22A-5p及miR-UL22A-3p标准品购自锐博生物公司。构建载体的引物合成及测序分析由Invitrogen公司完成。
1.2方法
1.2.1 pSilencer-miR-UL22A重组载体的构建 由于miR-UL22A-5p及miR-UL22A-3p是由同一个前体的2个侧臂加工成熟而形成,因此扩增HCMV miR-UL22A前体编码序列,将其克隆到真核表达载体pSilencer中,可以同时表达miR-UL22A-5p及miR-UL22A-3p。根据HCMV AD169株(EMBL:X17403.1)的相应序列,设计了可扩增包含miR-UL22A前体编码序列的4对PCR引物(见表1),产物长度依次为975、494、209及140 bp。从HCMV临床株Han株感染的人胚肺成纤维细胞中提取DNA,并以此为模板分别以上述4对引物进行PCR扩增。反应体系为50 μL,PCR条件:95 ℃预变性4 min;经95 ℃变性45 s,50 ℃退火1 min,72 ℃延伸1 min,30个循环后72 ℃延伸10 min。用BamHⅠ及Hind Ⅲ双酶切纯化后的扩增产物和载体pSilencer。酶切产物进行纯化后,采用T4 DNA连接酶进行目的片段与载体的连接。将连接产物转化入感受态大肠埃希菌DH5ɑ中,转化后的DH5ɑ接种于含有氨苄青霉素的LB固体培养基,37 ℃温箱过夜。提取单克隆菌落的DNA,应用pSilencer载体上的测序引物进行PCR扩增,筛选出产物大小与预期相一致的阳性克隆;筛选的克隆经含氨苄青霉素的LB液体培养基培养过夜后,收集菌液并抽提质粒,进一步采用DNA测序方法验证克隆结果。获得的4种含有不同长度miR-UL22A前体编码序列的重组质粒分别命名为pS-miR-UL22A-975、pS-miR-UL22A-494、pS-miR-UL22A-209及pS-miR-UL22A-140。
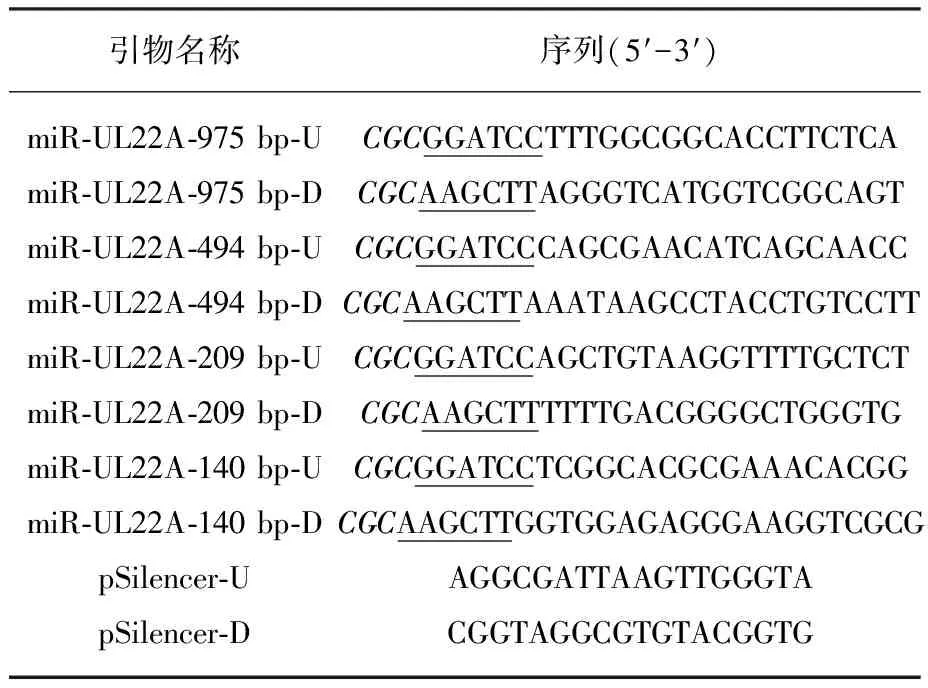
表1 PCR 引物序列
注:划线部分是限制性内切酶的酶切位点,保护性碱基在5′末端
1.2.2 转染HEK 293细胞并提取总RNA 按照Lipo2000说明书操作,转染24孔板培养的HEK 293细胞。每孔细胞均加入800 ng重组质粒或pSilencer质粒及2 μL Lipo2000。 转染后48 h,提取总RNA,并使用Ambion公司的TURBO DNA-free kit去除可能残留的DNA。分别用1%琼脂凝胶电泳及Nanodrop1000分光光度计检测RNA的质量和纯度。
1.2.3 提取不同感染时间点及感染时相的总RNA 以感染复数(Multiplicity of Infection,MOI)为2.0的临床株Han株以及实验室株Towne株分别感染6 cm平皿上已经长成单层的人胚肺成纤维细胞。在感染细胞中加入终浓度为100 μg/mL的放线菌酮(cycloheximide,CHX),在感染后24 h收集细胞中提取的RNA为即刻早期(immediately early,IE)RNA样本;加入终浓度为100 μg/mL的磷乙酸(phosphonoacetic acid,PAA),并在感染后48 h收集细胞提取的RNA为早期(early,E)样本;感染后96 h(约90%~100%出现细胞病变效应)收集并提取的RNA样本为晚期(late,L)RNA样本。另外,分别于HCMV感染后6、12、24、48及72 h用Trizol收获感染细胞。按照Invitrogen公司的Trizol reagent操作说明书,提取总RNA,去除可能残留的DNA,检测RNA的纯度和浓度。
1.2.4 检测miR-UL22A的表达 根据miRBase数据库提供成熟miR-UL22A-5p (MIMAT0001574)及miR-UL22A-3p (MIMAT0-001575)的序列进行相应FQ-PCR引物和探针(P/N: 4433914、4398987) 的设计与合成(ABI公司)。将miR-UL22A-5p及miR-UL22A-3p的标准品稀释成40.0 nmol/L、4.0 nmol/L、 400.0 pmol/L、40.0 pmol/L、 4.0 pmol/L、 400.0 fmol/L 和40.0 fmol/L的浓度。逆转录的反应体系:1 μL总RNA样品(100 ng)或miR-UL22A-5p/miR-UL22A-3p不同稀释浓度的标准品,3.0 μL颈环状逆转录引物,1×RT缓冲液,1.0 mmol/L dNTPs,50 U逆转录酶及3.8 U RNase抑制剂,补去离子水至15 μL;逆转录条件:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min。PCR反应体系包括:1×TaqMan Universal PCR Master Mix,1×TaqMan Small RNA assay,上述反转录后的cDNA各1.33 μL,补去离子水至20 μL;反应条件:95 ℃预变性10 min,95 ℃ 15 s、60 ℃ 60 s(读取荧光)扩增40个循环。每份样品重复3次PCR检测;采用ABI公司的SDS软件分析PCR结果。
2 结果与分析
2.1pSilencer-miR-UL22A重组质粒构建
通过针对pS载体序列设计的特异性引物pSilencer-U和pSilencer-D, PCR筛选4种pS-miR-UL22A重组克隆(空pS载体扩增长度为242 bp);得到的产物大小与预期(依次为382、451、736和1 217 bp)相一致的克隆(图1)。测序分析结果证实获得的重组克隆中插入的外源序列与预期的miR-UL22A编码序列完全一致。
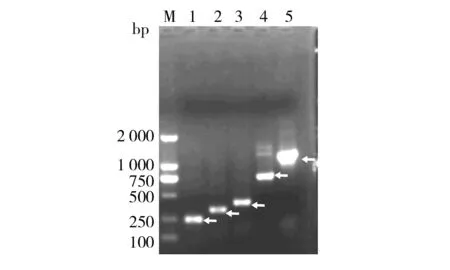
图1 pS-miR-UL22A克隆的PCR筛选结果
箭头所指为目的条带。M:DL2000;1:空pSilencer载体;2:pS-miR-UL22A-140;3:pS-miR-UL22A-209;4:pS-miR-UL22A-494;5: pS-miR-UL22A-975
The target bands were indicated by white arrows.M:Marker DL2000; Lane 1 is the PCR result of pSilencer vector. Lanes 2, 3, 4 and 5 are the PCR results of pS-miR-UL22A-140, pS-miR-UL22A-209, pS-miR-UL22A-494 and pS-miR-UL22A-975
2.2重组质粒miR-UL22A-5p及miR-UL22A-3p的表达量4种重组质粒pS-miR-UL22A-140、pS-miR-UL22A-209、pS-miR-UL22A-494和pS-miR-UL22A-975在转染HEK293细胞中表达miR-UL22A-5p及miR-UL22A-3p的情况见图2。在所有重组质粒中,miR-UL22A-5p的表达量均高于miR-UL22A-3p;而且以pS-miR-UL22A-140重组质
粒的miR-UL22A表达量最高;即含有长度为140 bp左右miR-UL22A编码序列的重组质粒能够获得miR-UL22A的最佳表达效果。

图2 不同miR-UL22A重组质粒miR-UL22A-5p及miR-UL22A-3p的表达量Fig.2 The expression levels of miR-UL22A-5p and miR-UL22A-3p from the miR-UL22A recombinant clones
2.3不同感染时期miR-UL22A-5p及miR-UL22A-3p的表达
HCMV临床株Han株及实验室株Towne株在感染后6、12、24、48、72 hpi时间点miR-UL22A-5p及miR-UL22A-3p的表达见图3A,在感染后IE期、E期以及L期的表达见图3B。结果显示,在HCMV感染后病毒的一个复制周期内,HCMV临床株Han株及实验室株Towne株miR-UL22A-5p及miR-UL22A-3p的表达趋势无明显差异,均在感染后6 h即检测到表达,72h达到峰值;且在即刻早期即有上述miRNA的明确表达。同时,无论在任何特定时间点,HCMV实验室株Towne株的miR-UL22A表达量均比临床株Han株高;而其miR-UL22A-5p的表达量也均高于miR-UL22A-3p的表达量。
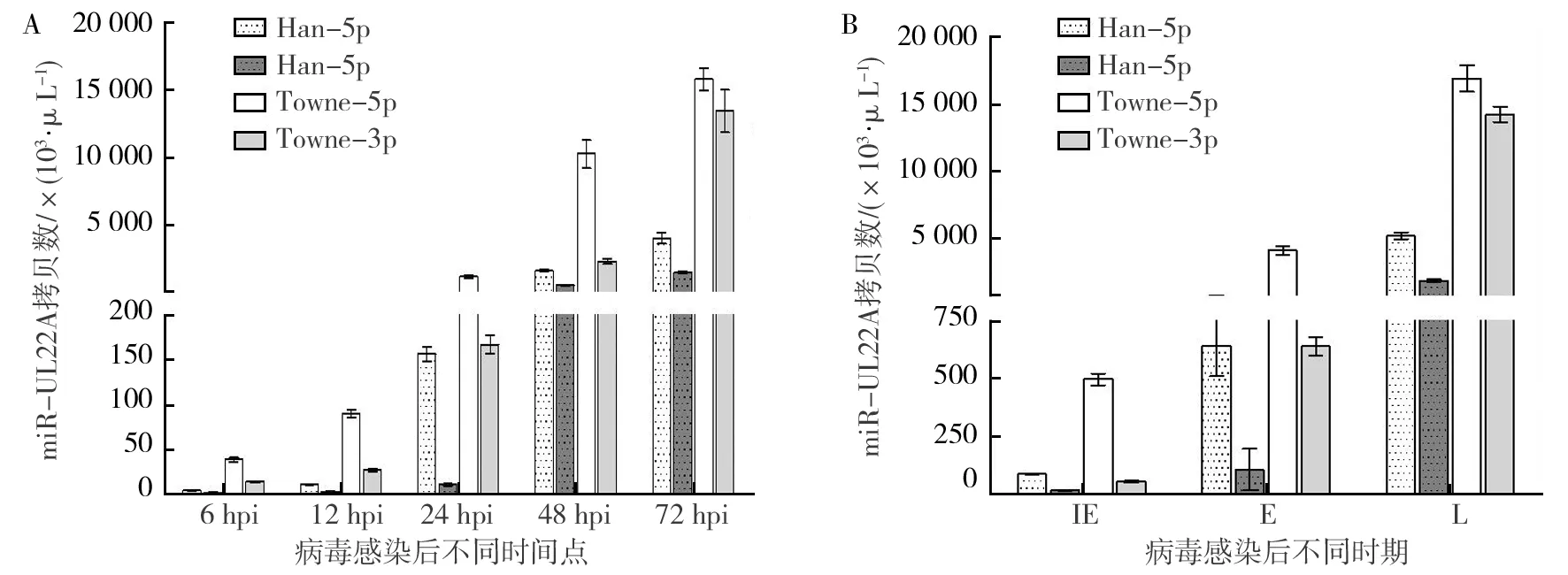
图3 HCMV临床株Han株及实验室株Towne株感染后不同时期miR-UL22A-5p及miR-UL22A-3p的表达量Fig.3 The expression levels of miR-UL22A-5p and miR-UL22A-3p at different time points post infection of HCMV clinical strain Han and laboratory strain Towne
3 讨 论
HCMV miRNA的编码基因分散于整个病毒的基因组中。目前研究较多的HCMV miRNA包括miR-US25-1、miR-US25-2、miR-UL148D-1、miR-US4-1和miR-UL112-1等;其功能主要涉及免疫逃避、抑制病毒复制、调控感染细胞凋亡、为病毒潜伏创造有利条件等方面[5-7]。2005年,Dunn等[8]预测miR-UL22A-5p及miR-UL22A-3p的靶基因包括神经干细胞分化相关蛋白AHANK,干扰素18受体前体,组蛋白3等,推测其可能在细胞分化、免疫、基因表达等方面发挥重要作用;但是到目前为止尚没有关于miR-UL22A生物学功能的实验研究报道。目前,一般是通过“过表达”或“抑制表达”这两种手段进行miRNA的生物学功能研究。本研究构建了HCMV miR-UL22A的表达载体并转染真核细胞,通过细胞内的miRNA加工成熟机制,获得“过表达”的miR-UL22A-5p及miR-UL22A-3p。这种方法所表达的miRNA更接近感染细胞内表达的miRNA,比合成miRNA前体更经济、方便,且时效性长。
本研究需要同时检测同一前体表达的两个miRNA。为了提高检测的特异性和灵敏性,应用了ABI公司的TaqMan®MicroRNA Assays颈环RT-PCR方法检测miRNA的表达情况。这一方法可精确区分同一家族中序列高度同源的miRNA,能检测只有一个碱基差别不同miRNA的表达水平,是目前检测miRNA表达的金标准[9-10]。结果显示,miR-UL22A-5p及miR-UL22A-3p在含有140 bp片段miR-UL22A编码序列的重组载体中,表达量最高;结合我们其他miRNA的研究结果,提示构建miRNA表达载体,插入pre-miRNA两侧的侧翼序列长度各控制在40 bp左右,通常能够获得miRNA的最佳表达效果[11-13]。
2005年,Grey等[14]通过Northern blot技术检测发现HCMV感染状态下(MOI为5.0),miR-UL22A-5p及miR-UL22A-3p随感染时间延长其表达量逐渐增加,即在72 hpi表达量最高。尽管有其他研究显示,同样以MOI为5.0接种成纤维细胞时,miR-UL22A的最高表达量出现在感染后48 h[15],我们的研究结果与Grey的结果一致。当以MOI为2.0接种细胞时,miR-UL22A-5p及miR-UL22A-3p的表达量在72 hpi达到峰值。人巨细胞病毒转录本表达具有时相性,应用蛋白合成抑制剂放线菌酮和DNA复制抑制剂磷乙酸处理感染细胞后,获得了HCMV临床株Han株以及实验室株Towne株感染的即刻早期和早期miR-UL22A-5p及miR-UL22A-3p的表达情况。研究结果显示miR-UL22A-5p及miR-UL22A-3p在即刻早期即有明确的表达,在早期和晚期表达量显著增加。上述结果提示miR-UL22A可能在病毒感染早期即可发挥生物学功能,且相关功能贯穿病毒复制的整个周期。同时,发现由同一miRNA前体编码表达的miR-UL22A-5p及miR-UL22A-3p无论在重组载体或自然感染的情况下,均可以在特定时间同时表达;而且miR-UL22A-5p的表达量始终高于miR-UL22A-3p的表达量。这一结果预示在病毒感染过程中,miR-UL22A-5p可能发挥更为重要的调控作用。
综上所述,本研究明确了异源性表达miRNA所需最佳编码序列长度;HCMV实验室株及临床株自然感染过程的不同时间点和不同感染时相miR-UL22A-5p及miR-UL22A-3p的表达情况。为进一步研究HCMV miR-UL22A参与对宿主细胞的转录后调控功能以及在HCMV感过程中发挥的作用提供参考。
[1] Yang M,Li Y,Padgett RW. MicroRNAs: Small regulators with a big impact[J]. Cytokine Growth Factor Rev, 2005, 16(4-5):387-393.
[2] Kadambari S1, Williams EJ, Luck S, et al. Evidence based management guidelines for the detection and treatment of congenital CMV[J]. Early Hum Dev, 2011,87(11):723-728.
[3] Hook L, Hancock M, Landais I, et al. Cytomegalovirus microRNAs[J]. Curr Opin Virol,2014,7:40-46.
[4] Misra MK, Mishra A, Pandey SK, et al. Genetic variation in Micro-RNA genes of host genome affects clinical manifestation of symptomatic Human Cytomegalovirus infection[J]. Hum Immunol,2015,76(10):765-769.
[5] Qi M, Qi Y, Ma Y, et al. Over-expression of human cytomegalovirus miR-US25-2-3p downregulates eIF4A1 and inhibits HCMV replication[J]. FEBS Lett,2013,587(14): 2266-2271.
[6] Hook LM, Grey F, Grabski R, et al. Cytomegalovirus miRNAs target secretory pathway genes to facilitate formation of the virion assembly compartment and reduce cytokine secretion[J]. Cell Host Microbe,2014,15(3):363-373.
[7] Kim S, Lee S, Shin J, et al. Human cytomegalovirus microRNA miR-US4-1 inhibits CD8(+) T cell responses by targeting the aminopeptidase ERAP1[J]. Nat Immunol,2011,12(10):984-991.
[8] Dunn W, Trang P, Zhong Q, et al. Human cytomegalovirus expresses novel microRNAs during productive viral infection[J]. Cell Microbiol,2005, 7(11): 1684-1695.
[9] Chen C, Ridzon DA, Broomer AJ, et al. Real-time quantification of microRNAs by stem-loop RT-PCR[J]. Nucleic Acids Res,2005,33(20):e179.
[10] Schmittgen TD, Lee EJ, Jiang J, et al. Real-time PCR quantification of precursor and mature microRNA[J].Methods, 2008, 44(1):31-38.
[11] Huang Y, Qi Y, Ma Y, et al. Down-regulation of human cytomegalovirus UL138, a novel latency-associated determinant, by hcmv-miR-UL36[J].J Biosci,2013,38(3):479-485.
[12] Huang Y, Qi Y, Ma Y, et al. The expression of interleukin-32 is activated by human cytomegalovirus infection and down regulated by hcmv-miR-UL112-1[J].Virol J,2013,10:51.
[13] Wang YP, Qi Y, Huang YJ, et al. Identification of immediate early gene X-1 as a cellular target gene of hcmv-mir-UL148D[J].Int J Mol Med,2013,31(4): 959-966.
[14] Grey F, Antoniewicz A, Allen E, et al. Identification and characterization of human cytomegalovirus-encoded microRNAs[J]. J Virol,2005,79(18):12095-12099.
[15] Shen ZZ, Pan X, Miao LF, et al. Comprehensive analysis of human cytomegalovirus microRNA expression during lytic andquiescent infection[J]. PLoS One,2014,9(2):e88531.
ConstructionofRecombinantVectorsandExpressionsofHumanCytomegalovirusmiR-UL22A
WANG Hong-yan, WANG Bo, QI Ying, MA Yan-ping, HUANG Yu-jing, LIU Zhong-yang, RUAN Qiang
(VirusLab.,ShengjingHosp.Affil.ChinaMed.Uni.,Shengyang110004)
Eukaryotic expression vectors of human cytomegalovirus (HCMV) miR-UL22A were optimized and constructed, to clarify the expression situation of the infection process of HCMV clinical strain and the lab strain. Sequences of different lengths of HCMV miR-UL22A encoding fragments (975 bp, 494 bp, 209 bp, and 140 bp) were amplified and constructed a recombinant the expression vector pSilencers (pS), and extracted total RNA after transfected into human embryo kidney 293 cell, and collected total RNA samples at 6, 12, 24, 48, and 72 hours after transfection of embryo lung fibroblast with HCMV clinical strain, Han strain and lab Towne strain, as well as different infection time phase (immediate-early stage, early stage, and late stage). The expressions of miR-UL22A-5p and miR-UL22A-3p were determined and tested by Taqman stem-loop RT-PCR. The results showed that the recombinant vectors containing different lengths of miRNA encoding sequences were constructed successfully. The flank sequences each about 40 bp of pre-miRNA (i.e. the inserted 140 bp coding sequence) achieved the best expression effect of the mature miRNA. No obvious difference of miR-UL22A expression trend was observed during one viral replication cycle of HCMV clinical strain and lab strain. All the expressions were determined and tested 6 hours after the infection, and reached the peak value at 72 hour, moreover, the definite expression of miRNA was immediately observed at immediate-early stage; and whatever expressed by recombinant vector or infected during natural condition, miR-UL22A-5p has always been prosomatically dominant expression of miR-UL22A. Therefore, recombinant vector containing 140 bp of miR-UL22A encoding sequence of miR-UL22A could high-efficiently heterogenetic express miR-UL22A-5p and miR-UL22A-3p; And miR-UL22A-5p has always been prosomatically dominant expression of miRNA; This study provides a foundation for further study on the regulations after transcription of miRNA.
human cytomegalovirus; miR-UL22A-5p; miR-UL22A-3p
辽宁省自然科学基金项目(2013021008)
王鸿雁 女,硕士研究生。主要从事人巨细胞病毒致病的分子机制研究。E-mail:935686941@qq.com
* 通讯作者。男,教授,博士生导师。从事人巨细胞病毒致病的分子机制研究。E-mail:ruanq@sj-hospital.org
2016-09-01;
2016-09-26
Q939.93;R37
A
1005-7021(2017)04-0034-06
10.3969/j.issn.1005-7021.2017.04.006
·写作常识·
署名
论文的作者应在发表的作品上署名。署名者可以是个人作者、合作作者或团体作者。
1 署名是拥有著作权的声明。《中华人民共和国著作权法》规定:著作权属于作者。著作权包括发表权、署名权、修改权、保护作品完整权等。署名权即表明作者在作品上署名的权利;署名表明作者的劳动成果及作者本人都得到了社会的承认和尊重,即作者向社会声明,作者对该作品拥有了著作权。
2 署名是表示文责自负的承诺。署名即表明作者愿意承担责任。
3 署名便于读者与作者联系。署名即表明作者有同读者联系的意愿。
4 论文的署名者应具备下列条件:①本人应是直接参加课题研究的全部或主要部分的工作,并做出主要贡献者;②本人应为作品创作者,即论文撰写者;③本人对作品具答辩能力,并为作品的直接责任者。
不够署名条件但确对研究成果有所贡献者可作为“致谢”段中的感谢对象。可以由学生和导师共同署名,一般是学生在前导师在后。个人署名一般应使用真实姓名。多位作者共同完成的作品联合署名时,署名顺序按对该文的贡献大小排列。第一作者是主要贡献者和直接创作者,除有特别声明外,第一作者就是第一权利、第一责任和第一义务者。翻译的作品,应同时注明原作者和编译者。

