多重耐药鲍曼不动杆菌氨基糖苷类修饰酶与16S rRNA甲基化酶基因的研究
杨 艳, 王厚照 , 张 玲
(厦门大学 附属成功医院/安徽医科大学 解放军174临床学院,福建 厦门 361003)
多重耐药鲍曼不动杆菌氨基糖苷类修饰酶与16SrRNA甲基化酶基因的研究
杨 艳, 王厚照*, 张 玲
(厦门大学 附属成功医院/安徽医科大学 解放军174临床学院,福建 厦门 361003)
了解氨基糖苷类修饰酶、16S rRNA甲基化酶基因在多重耐药鲍曼不动杆菌中的流行情况。收集2014年12月至2015年3月厦门大学附属成功医院住院患者临床分离的多重耐药鲍曼不动杆菌共28株,采用VIKET Compact 2 全自动细菌鉴定系统进行细菌鉴定,应用纸片扩散法(K-B法)检测鲍曼不动杆菌对抗菌药物的耐药性,采用聚合酶链反应(PCR)法检测氨基糖苷类修饰酶、16S rRNA甲基化酶基因。结果显示,多重耐药鲍曼不动杆菌除对头孢哌酮/舒巴坦耐药率为21.4%外,对其他所测药物耐药率均>50%,本组28株多重耐药鲍曼不动杆菌共检出5种氨基糖苷类修饰酶基因aac(3)-Ⅰ、aac(3)-Ⅱ、aac(6′)-Ⅰb、ant(3")-Ⅰ、aph(3′)-Ⅰ和1种16S rRNA甲基化酶基因armA,阳性率分别为85.7%(24株)、7.14%(2株)、67.8%(19株)、92.9%(26株)、53.6%(15株)和 82.1%(23株)。氨基糖苷类修饰酶、16S rRNA甲基化酶耐药基因是多重耐药鲍曼不动杆菌对氨基糖苷类耐药的重要原因。
鲍曼不动杆菌;多重耐药性;氨基糖苷类修饰酶;16S rRNA甲基化酶;耐药基因
鲍曼不动杆菌是引起院内感染重要的条件致病菌,临床检出率不断上升、严峻的耐药形势受到广大医疗工作者的广泛关注。氨基糖苷类常用来治疗鲍曼不动杆菌引起的感染,由于多重耐药菌株的不断增加,鲍曼不动杆菌对β-内酰胺类耐药率不断增加的同时,对氨基糖苷类耐药率也在不断上升。为探讨鲍曼不动杆菌对氨基糖苷类抗菌药物的耐药机制,本研究对厦门大学附属成功医院2014年12月至2015年3月收集的多重耐药鲍曼不动杆菌进行氨基糖苷类修饰酶与16S rRNA甲基化酶基因检测,现报道如下。
1 材料与方法
1.1材料
1.1.1 菌株来源 收集2014年12月至2015年3月厦门大学附属成功医院住院患者临床分离的多重耐药鲍曼不动杆菌28株,剔除同一患者相同部位重复分离的菌株。所有菌株均采用VIKET Compact 2 全自动细菌鉴定仪进行鉴定。标本来源为23株痰液、4株分泌物、1株尿液。多重耐药鲍曼不动杆菌的判定标准:对5类抗菌药物(头孢菌素类、氟喹诺酮类、氨基糖苷类、碳青霉烯类和β-内酰胺酶抑制剂)中3类及以上耐药的。质控菌株:大肠埃希菌ATCC25922 和铜绿假单胞菌ATCC27853。
1.1.2 药敏试验 采用纸片扩散法(K-B法)进行药物敏感性试验,根据2013年版美国临床实验室标准化研究所(CLSI)的标准判断药敏试验结果。
1.1.3 仪器和试剂 全自动细菌鉴定仪VIKET Compact 2、GN细菌鉴定卡(法国梅里埃公司);PCR扩增仪(eppendorf公司);超微量分光光度计(德国IMPLEN公司);电泳仪、凝胶成像系统(Bio-Rad公司);PCR试剂盒(TaKaRa,大连宝生物工程有限公司);M-H平板、药敏纸片(英国OXOID 公司);DNA Marker及PCR引物(上海生工生物工程有限公司)。
1.2方法
1.2.1 引物设计 引物序列参考文献[1],引物序列及产物长度见表1。

表1 靶基因PCR引物序列及终产物长度

续表1
1.2.2 DNA模板的制备 采用煮沸法提取细菌的DNA:挑取纯培养菌落置于1.5 mL EP 管中(装有200 μL无菌纯水),震荡混匀,制成均匀的菌悬液。金属浴100 ℃煮沸10 min, 14 000 r/min离心10 min,上清液即为DNA模板溶液, IMPLEN超微量分光光度计检测DNA 模板含量,将浓度调整一致。
1.2.3 耐药基因检测 各耐药基因均采用PCR法检测。PCR反应体系:P1引物1 μL、P2引物1 μL,dNTP 4 μL,10×PCR buffer 5 μL,25 mmol/L MgCl23 μL,Taq酶0.3 μL,DNA模板液2 μL,超纯水33.7 μL,总反应体系50 μL。PCR扩增循环参数为:93 ℃预变性2 min,93 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,循环35个周期,最后72 ℃延长5 min。PCR产物经2%琼脂糖凝胶电泳,EB染色,凝胶成像系统观察结果同时拍照保存。
1.2.4 DNA序列测序 PCR阳性产物纯化后由上海生工生物工程有限公司测序,并与NCBI GenBank数据库进行比对。
2 结果与分析
2.1药敏试验结果
本组多重耐药鲍曼不动杆菌耐药情况较严重,除头孢哌酮/舒巴坦耐药率最低,为21.4%外,其他药物耐药率均>50%。结果见表2。
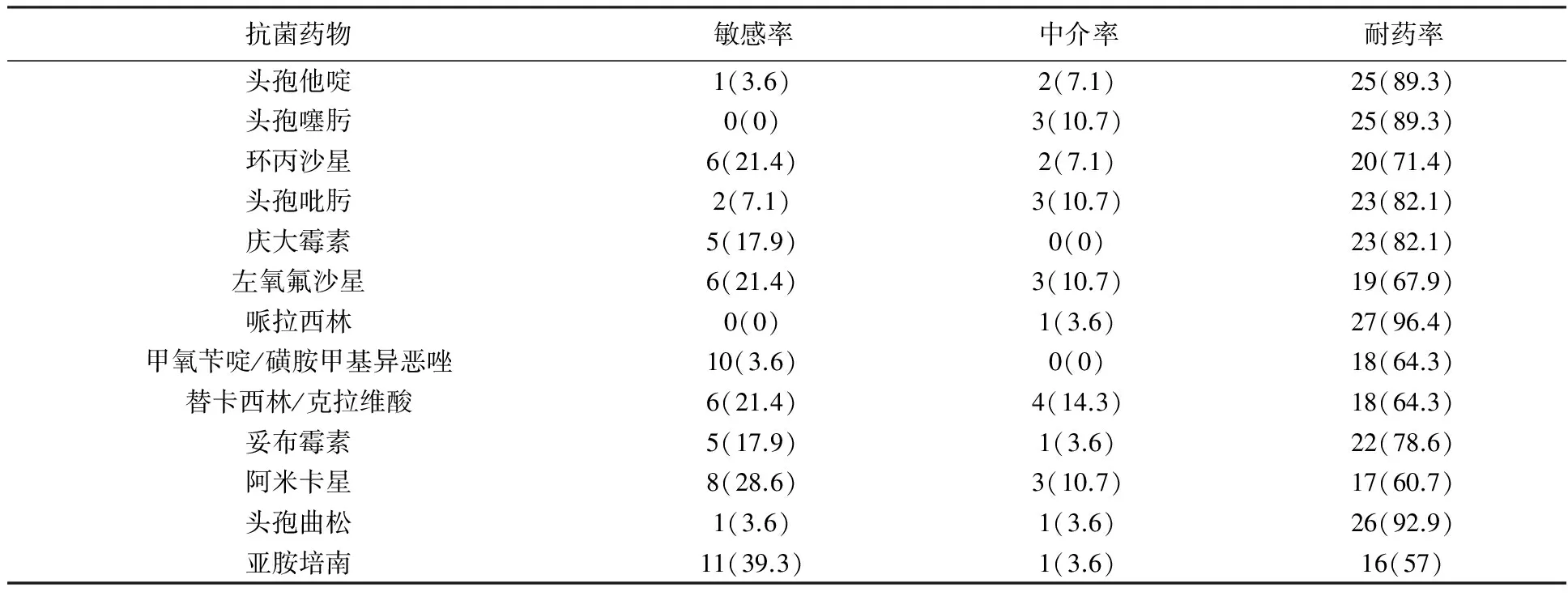
表2 28株多重耐药鲍曼不动杆菌药敏试验结果(n(%))

续表2
2.2氨基糖苷类修饰酶与16SrRNA甲基化酶基因的检出情况
对28株多重耐药鲍曼不动杆菌进行9种氨基糖苷类修饰酶基因、6种16S rRNA甲基化酶基因检测发现:氨基糖苷类修饰酶基因检出aac(3)-Ⅰ基因24株、aac(3)-Ⅱ基因2株、aac(6′)-Ⅰb基因19株、ant(3″)-Ⅰ基因26株、aph(3′)-Ⅰ基因15株; 16S rRNA甲基化酶基因检出armA 23株,各基因检出率见表3。阳性基因电泳图见图1~图6。分别抽取1株aac⑶-Ⅰ基因、aac(6′)-Ⅰb基因、ant(3″)-Ⅰ基因、armA基因进行基因测序,与GenBank上登录的标准序列比对同源性均>99.9%。
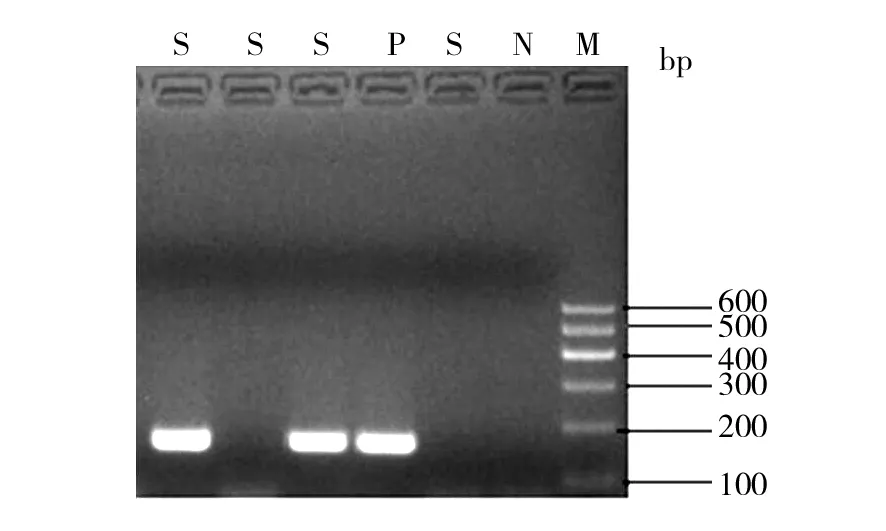
图1 aac(3)-Ⅰ基因PCR产物电泳图Fig.1 The aac(3)-Ⅰgene electrophoresis of PCR productsM: DNA marker;P: 阳性对照;N:阴性对照;S:样本M: DNA marker; P: Positive control; N: Negative control;S: Samples
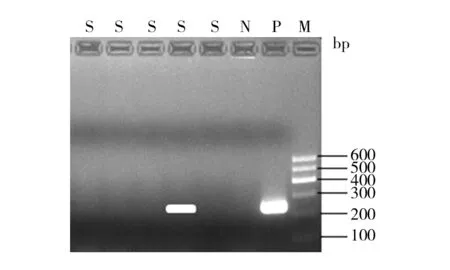
图2 aac(3)-Ⅱ基因PCR产物电泳图Fig.2 The aac(3)-Ⅱgene electrophoresis of PCR productsM: DNA marker;P: 阳性对照;N:阴性对照;S:样本M: DNA marker; P: Positive control; N: Negative control; S: Samples
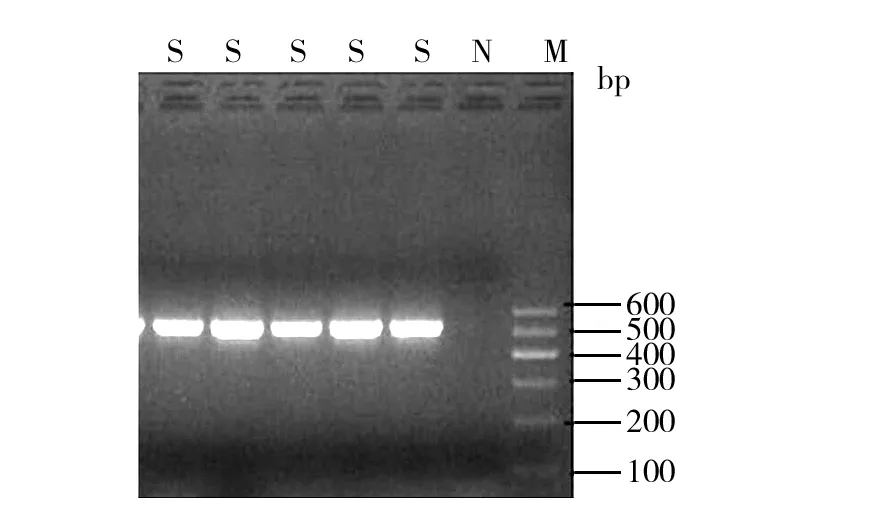
图3 aac(6′)-Ⅰb基因PCR产物电泳图Fig.3 The aac(6′)-Ⅰb gene electrophoresis of PCR productsM: DNA marker;P: 阳性对照;N:阴性对照;S:样本M: DNA marker; P: Positive control; N: Negative control; S: Samples
图4 ant(3″)-Ⅰ基因PCR产物电泳图Fig.4 The ant(3″)-Ⅰgene electrophoresis of PCR productsM: DNA marker;P: 阳性对照;N:阴性对照;S:样本M: DNA marker; P: Positive control; N: Negative control; S: Samples

图5 aph(3′)-Ⅰ基因PCR产物电泳图Fig.5 The aph(3′)-Ⅰgene electrophoresis of PCR productsM: DNA marker;P: 阳性对照;N:阴性对照;S:样本M: DNA marker; P: Positive control; N: Negative control; S: Samples
图6 armA基因PCR产物电泳图Fig.6 The armA gene electrophoresis of PCR productsM: DNA marker;P: 阳性对照;N:阴性对照;S:样本M: DNA marker; P: Positive control; N: Negative control; S: Samples
3 讨 论
鲍曼不动杆菌主要分布在重症监护病房(ICU)[2],已成为ICU 内患者感染的首位病原菌[3], 常造成感染的暴发流行,且ICU 内感染主要是由多重耐药菌株引起[4],多重耐药菌的检出率不断增多,给临床抗感染工作带来了巨大的压力。
氨基糖苷类药物作用机制是与细菌核糖体30S亚单位的16S rRNA解码区的A位点结合,抑制细菌蛋白质的合成,从而导致细菌死亡。氨基糖苷类因其抗菌谱广、抗菌效果好,在临床抗感染工作中广泛应用的同时耐药现象也越来越严重。氨基糖苷类耐药机制主要包括:外膜通透性降低、产生氨基糖苷类修饰酶(AMEs)、甲基化修饰、主动外排及靶位点的突变,其中最主要的是产生AMEs 和甲基化修饰产生16S rRNA甲基化酶[5],AMEs按功能分为三类:①乙酰转移酶(AAC),使游离羟基乙酰化;②核苷转移酶(ANT),使游离羟基核苷化;③磷酸转移酶(APH),使游离羟基磷酸化。三大类共50余种,AMEs修饰氨基糖苷类的特定基团的结果是引起共价键改变,导致药物不易进入菌体与靶位结合,从而产生耐药性。
鲍曼不动杆菌中已检出aac(3)-I、aac(3)-Ⅱ,aac(3)-Ⅲ、aac(3)-Ⅳ、aac(2′)-Ib、aac(6)-I、ant(2″)-I、ant(3″)-I、aphA1、aphA6等多种AMEs基因[6-7],本组28株多重耐药鲍曼不动杆菌检出:aac(3)-Ⅰ、aac(3)-Ⅱ、aac(6′)-Ⅰb、ant(3″)-Ⅰ、aph(3′)-Ⅰ共5种AMEs基因。除aac(3)-Ⅱ检出率(7.14%)最低外,其余4种基因检出率均>50%,其中ant(3″)-Ⅰ基因检出率高达92.9%,因此,可见氨基糖苷类耐药基因在本院多重耐药鲍曼不动杆菌中广泛存在。
氨基糖苷类抗菌药物作用的靶位点是16S rRNA,甲基化修饰的16S rRNA与氨基糖苷类的亲和力降低,因此导致对氨基糖苷类的高水平耐药[8-9],16S rRNA甲基化酶的编码基因包括rmtA、rmtB、rmtC、rmtD、rmtE、npm和armA等,其中armA和rmtB是主要基因[10]。rmtB基因主要见于肠杆菌科细菌[11],armA基因主要位于鲍曼不动杆菌的染色体上。本组28株多重耐药鲍曼不动杆菌检出23株携带armA基因,检出率达82.1%,显示armA基因在鲍曼不动杆菌中广泛存在,与研究报道相一致[12]。
本研究发现,同一细菌检出2种以上氨基糖苷类耐药基因较多,并且出现多种不同的基因组合形式,与耐药性结果综合分析发现:耐药表型与基因型并不是一一对应关系。值得注意的是,本组有两株菌未检出AMEs基因和16S rRNA甲基化酶基因,但表现为对妥布霉素和庆大霉素耐药,后续实验检测外排泵基因结果显示这两株菌adeB外排泵基因均阳性,证明氨基糖苷类耐药可能与主动外排系统有关,结果与报道一致[13]。
综上所述,厦门大学附属成功医院多重耐药鲍曼不动杆菌中检出5种AMEs基因和1种16S rRNA甲基化酶基因,以ant(3″)-Ⅰ、aac(3)-Ⅰ、armA阳性率最高,基因携带率高且多种基因常同时存在,是鲍曼不动杆菌对氨基糖苷类耐药的主要原因。因此,加强细菌耐药性监测和耐药基因的研究对于临床提高抗感染治疗的效率和探求细菌耐药机制及其传播方式具有重要意义。
[1] 王卫华,陈洁,毛雄英,等. 泛耐药鲍曼不动杆菌获得性耐药基因和可移动遗传元件检测与指标聚类分析[J].中华临床感染病杂志,2012,5(1):9-14.
[2] 方乐,胡江,陈敬银,等. 2013~2015年887株鲍曼不动杆菌的临床感染分布及耐药分析[J].现代预防医学,2016,43(12):2275-2279.
[3] 朱任媛,张小江,杨启文,等.卫生部全国细菌耐药监测网2011 年ICU 来源细菌耐药监测[J].中国临床药理学杂志,2012,28(12):905- 909.
[4] 胡鑫, 胡昭宇, 曹雁, 等. ICU鲍曼不动杆菌感染的流行状况及耐药性分析[J]. 中国微生态学杂志,2014,26(9):1081-1083.
[5] Shakil S, Khan R, Zarrilli R, et al. Aminoglycosides versus bacteria-a description of the action, resistance mechanism, and nosocomial battleground[J]. J Biomed Sci, 2008, 15(1):5-14.
[6] 唐朝贵,李前辉,林涛. 氨基糖苷类修饰酶基因aac(2′)-Ib型在耐药鲍曼不动杆菌中流行[J].中国抗生素学杂志,2014,39(11):844-848.
[7] 姜梅杰,刘晶,满思金. 某院多重耐药鲍曼不动杆菌氨基糖苷类耐药基因及qacE△1基因的检测[J].中华实验和临床感染病杂志,2015,9(3):374-377.
[8] 杨志伟,季萍,张坚.多重耐药鲍曼不动杆菌16S rRNA甲基化酶基因及qacEΔ1-sull 基因检测的研究[J].临床检验杂志,2010,28(5) : 389-390.
[9] 潘韵峰,俞云松, 周华, 等. 亚胺培南耐药鲍曼不动杆菌16S rRNA甲基化酶基因检测及流行菌株分析[J]. 中华微生物学和免疫学杂志, 2008, 28(1):34- 39.
[10] Wu Q, Zhang Y, Han L, et al. Plasmid-mediated 16S rRNA methylases in aminoglycoside-resistant Enterobacteriaceae isolates in Shanghai, China[J]. Antimicrob Agents Chemother,2009,53(1):271-272.
[11] Fritsche TR, Castanheira M, Miller GH,et al. Detectionof methyltransferases conferring high-level resistance to aminoglycosides in enterobacteriaceae from Europe, North America, and Latin America[J].Antimicrob Agents Chemother,2008,52(5):1843-1845.
[12] Yu YS,Zhou H,Yang Q,et al. Widespread occurence of aminoglycoside resistance due to ArmAmethylase in imipenem-resistant Acinetobacter baumannii isolates in China[J].JAntimicrobChemother,2007,60(2):454-455.
[13] 林丽,周岐新,凌保东. 鲍曼不动杆菌主动外排系统AdeABC、AdeIJK与多重耐药相关性[J].中国抗生素杂志,2009,34(2):100-103.
AminoglycosideModifyingEnzymesand16SrRNAMethylaseGenesinMulti-DrugResistantAcinetobacterbaumannii
YANG Yan, WANG Hou-zhao, ZHANG Ling
(Affil.ChengGongHosp.ofXiamenUni.,PLA174Clin.Coll.ofAnhuiMed.Uni.,Xiamen361003)
The prevalence of aminoglycoside modifying enzymes and 16S rRNA methylase genes in multi-drug resistantAcinetobacterbaumanniiwas studied. A total of 28 multi-drug resistantA.baumanniiisolates were collected from Dec. 2014 to Mar. 2015 from patients in the ChengGong Hospital Affiliated to Xiamen University. Bacterial identification was performed by VITEK 2 Compact automatic bacterial identification system. Kirby-Bauer Diffusion Method was used to detect the drug resistance of antimicrobial drugs. The aminoglycoside modifying enzymes and 16S rRNA methylase genes were amplified by polymerase chain reaction (PCR). The results showed that the resistance rate of all the other measured drugs were all above 50% except for cefoperazone-sulbactam (21.4%). 5 kinds of aminoglycoside modifying enzyme genes includingaac(3)-I,aac(3)-II,aac(6′)-Ib,ant(3")-I,aph(3′)-I and one kind of 16S rRNA methylase genearmA were found in 28 strains of multi-drug resistant A. baumannii with the positive rates at 85.7% (24 strains), 7.14% (2 strains), 67.8% (19 strains), 92.9% (26 strains), 53.6% (15 strains) and 82.1% (23 strains) respectively. Therefore the genes of aminoglycoside modifying enzymes and 16S rRNA methylase were the major reasons for the resistance to aminoglycosides in multi-drug resistantA.baumannii.
Acinetobacterbaumannii; multi-drug resistance; aminoglycoside modifying enzymes; 16S rRNA methylase; medicine-resistance gene
全军医学科技青年培育项目(13QNP047)
杨艳 女,硕士,主管检验师。 主要从事临床免疫学和微生物学检验。 E-mail:yangyan_1878@126.com
* 通讯作者。男,硕士,副主任技师。主要从事检验科管理工作。E-mail:wanghouzhao@126.com
2016-12-06;
2016-12-28
Q939.93
A
1005-7021(2017)04-0028-06
10.3969/j.issn.1005-7021.2017.04.005
欢迎订阅《微生物学杂志》

