单增李斯特菌vip基因缺失菌株的构建与筛选
李 森, 牟俊洁, 刘武康
(上海理工大学 医疗器械与食品学院,上海 200093)
单增李斯特菌vip基因缺失菌株的构建与筛选
李 森, 牟俊洁, 刘武康
(上海理工大学 医疗器械与食品学院,上海 200093)
单增李斯特菌(Listeriamonocytogenes)是广泛存在于自然界及食物中的食源性致病菌,作为胞内寄生菌,它可以引起强烈的细胞免疫,是潜在的优良疫苗载体。vip是单增李斯特菌的毒力基因,与其侵袭能力密切相关。因此构建vip基因敲除株可为单增李斯特菌疫苗载体的研发打下重要基础。从单增李斯特菌EGDe基因组中扩增出vip基因上、下游序列,连接到穿梭载体pKSV7中得到敲除载体pKSV7-Δvip,将其以电穿孔的方式转入单增李斯特菌后,通过同源重组利用氯霉素和温度双重压力筛选得到vip基因的敲除突变株,并对敲除菌株的生长曲线进行分析发现vip敲除对细菌的生长没有显著影响,为进一步研究vip基因功能、单增李斯特的致病机制和疫苗载体的研发提供参考。
单增李斯特菌;vip基因敲除;突变株;同源重组
LI Sen, MU Jun-jie, LIU Wu-kang
(Schl.ofMed.Instrum. &FoodEngin.,ShanghaiUni.ofSci. &Techonol.,Shanghai200093)
单核细胞增多性李斯特菌简称单增李斯特菌(Listeriamonocytogenes,LM),广泛存在于自然界中,是一种人畜共患病的病原菌[1],主要通过污染的食物引起人、畜的李斯特菌病,易感染者为新生儿、孕妇、40岁以上的成人和免疫功能缺陷者,死亡率高达30%以上[2]。单增李斯特菌对食品的污染与危害,已引起世界各国的普遍关注和高度重视,被世界卫生组织列为四大食源性致病菌之一[3]。单增李斯特菌主要随污染食物进入肠道,侵袭肠道上皮细胞穿透肠道屏障后进入血液循环引起其他器官的感染。研究发现内化素InlA和InlB是细菌进入肠道细胞的关键因子[4],ActA(actin-assembby inducing protein precursor)等对于单增李斯特菌在细胞与细胞间扩散是必不可少的[5]。vip基因是单增李斯特菌的重要毒力基因,其表达的Vip蛋白可以被锚定在细菌的细胞壁上,介导单增李斯特菌对宿主细胞的侵袭[6],但目前对于vip基因如何介导单增李斯特菌对宿主细胞侵袭的研究仍然十分有限。因此vip基因功能的研究有助于进一步阐述单增李斯特菌的致病机理。单增李斯特菌是一种细胞内寄生菌,进入人体后主要寄生在巨噬细胞和单核细胞内,可以引起有效的细胞免疫反应[7]。并且单增李斯特菌独特的生物学特点使其具备了作为疫苗载体的优秀潜质,如表面的肽聚糖、载脂蛋白等可以起到加强抗原提呈的作用[8-9]。如果将单增李斯特菌做减毒处理,将其作为载体转入肿瘤抗原等制成肿瘤疫苗,就可以起到激发细胞免疫特异杀伤肿瘤细胞的作用[10]。如何获得安全无害的减毒株是目前研究的重点之一。本研究拟通过同源重组的方法构建单增李斯特菌vip基因敲除突变株,为进一步研究vip基因的功能,阐述其在单增李斯特菌侵袭感染宿主细胞中的作用,及减毒疫苗载体的研发提供参考。
1 材料与方法
1.1材料
1.1.1 菌株与质粒 单增李斯特菌EGDe(血清型为1/2a);穿梭载体pKSV7;克隆载体pMD19-T(Takara 公司)。
1.1.2 主要试剂 rTaqDNA聚合酶、dNTP等(Takara公司);基因组DNA提取试剂盒,DNA琼脂糖凝胶电泳回收试剂盒,质粒抽提试剂盒(天根生化科技有限公司);限制性内切酶SalI、HindIII、BamHI,T4 DNA连接酶(天根生物科技有限公司);氨苄青霉素、氯霉素(上海励瑞生物科技有限公司);BHI培养基(北京陆桥技术股份有限公司)。
1.1.3 引物及测序 引物根据NCBI序列(ID:987538)设计(表1),由生工生物工程(上海)股份有限公司合成。本实验中的所有相关DNA测序工作均由华大基因完成。
1.1.4 主要仪器 PCR仪(Veriti,Applied Biosystem公司);水平电泳仪(Bio-Rad公司);全自动凝胶成像系统(G:Box,基因公司);离心机(Eppendorf公司);恒温摇床、恒温培养箱(上海世平实验设备有限公司);电穿孔仪(Micropulser,Bio-Rad公司)等。

表1 实验中使用的PCR引物序列
1.2方法
1.2.1 PCR扩增同源臂 将EGDe单克隆接种于BHI液体培养基中,37 ℃摇床振荡培养16 h。取5 mL左右菌体离心后利用基因组抽提试剂盒抽提EGDe全基因组。取2 μL基因组DNA为模板,分别利用VIP-5F、VIP-5R和VIP-3F、VIP-3R引物扩增vip基因上下游序列。利用SalI 将扩增得到的两个片段进行单酶切并连接转入克隆载体pMD-19T中得到pMD-19T-Δvip,送公司测序。
1.2.2 敲除载体pKSV7-Δvip的构建 将测序正确的pMD-19T-Δvip进行质粒抽提,并以质粒作为模板利用VIP-5F 和 VIP-3R扩增Δvip片段,DNA凝胶回收试剂盒回收后,分别将Δvip片段和pKSV7穿梭载体进行BamHI 和HindIII的双酶切,用T4连接酶将二者连接得到pKSV7-Δvip敲除载体,涂氨苄青霉素抗性平板,对单克隆进行PCR鉴定后将阳性克隆送公司测序。测序正确的克隆接种于液体LB培养基培养后抽提质粒备用。
1.2.3 单增李斯特菌的电穿孔 将1 μg 左右的重组穿梭质粒pKSV7-Δvip与200 μL单增李斯特菌感受态细胞混合均匀,转移至电转杯中冰浴10 min后用电转仪进行电转化(1 kV,5 ms)。电转后立即加入1 mL新鲜的BHI培养基,用移液枪转移到1.5 mL的EP管中,30 ℃摇床培养2 h后1 000 r/min离心5 min,涂含10 μg/mL氯霉素的BHI平板,置于30 ℃培养箱中培养至平板上长出单菌落。
1.2.4vip敲除菌株的筛选 挑取氯霉素平板上的克隆接种于BHI培养基中进行震荡培养,以菌液为模板,利用VIP-5F和VIP-3R做菌液PCR鉴定。得到阳性菌落后将其接种于含氯霉素(10 μg/mL)的BHI培养基中41 ℃振荡培养,每12 h传代1次。8~10代后将末次培养产物进行平板划线(含氯霉素10 μg/mL)。挑取平板上的克隆接种于无抗性BHI培养基,30 ℃培养,每12 h传代1次。待6~8代抗性质粒丢失后,将末次培养产物分别进行氯霉素抗性板划线和无抗性板划线培养,得到在抗性板上不生长、在无抗性板上生长的克隆,即为vip敲除克隆。
1.2.5vip敲除菌株的鉴定 将上述克隆培养后进行菌液PCR鉴定,以EGDe菌株作为阴性对照,以pksv7-Δvip载体作为阳性对照,为排除引物的污染将ddH2O作为引物的阴性对照。野生型扩增片段为2 200 bp左右,敲除vip后扩增片段为1 100 bp左右。
1.2.6 生长曲线测定 分别挑取EGDe和Δvip单个菌落接种于BHI液体培养基中,37 ℃摇床过夜培养16 h。取部分菌液按1∶100稀释于新鲜培养基,将OD调至0.1左右。37 ℃摇床振荡培养1 h后,取200 μL菌液于分光光度计中测定OD600值,每1 h测定1次,连续测量12 h,记录细菌生长情况。
1.2.7 细菌RNA的抽提和RT-PCR 将EGDe和Δvip单个菌落接种于BHI液体培养基中培养过夜后收集菌体于1.5 mL离心管中。加入1 mL预冷的苯酚乙醇(1∶9)重悬,冰浴30 min后5 000 r/min离心5 min,弃上清加入含50 U变溶菌素和1.25 mg溶菌酶的裂解液超声裂解30 min。再用RNA 提取试剂Trizol(Takara公司)继续抽提RNA。将抽提的RNA反转为cDNA 后利用VIP-KO-F和VIP-KO-R引物进行PCR检测。
2 结果与分析
2.1目的基因片段的克隆
vip基因位于单增李斯特菌基因组344850~346049区段,根据其序列信息设计基因敲除构建策略如图1 所示。
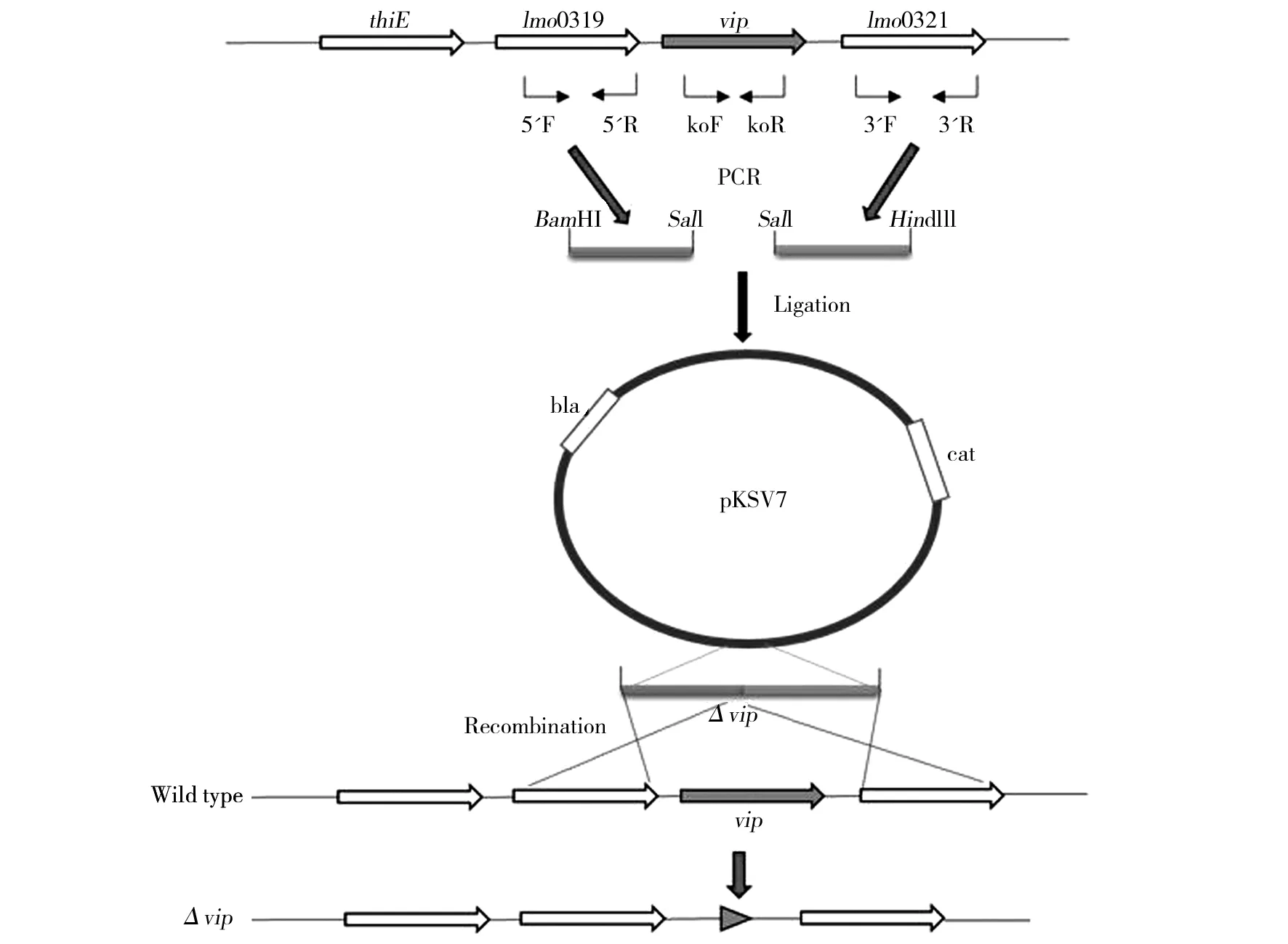
图1 单增李斯特菌vip基因敲除菌株构建策略Fig.1 The construction of vip knockout Listeria monocytogenes
用引物分别扩增上下游序列后得到与预期大小一致的条带,上游为616 bp,下游为515 bp(图2A)。将上下游片段经酶切连接转入pMD-19T载体后得到T-Δvip,菌液PCR鉴定结果如图2B所示,抽提2号菌中的质粒作为模板构建穿梭载体。
2.2基因敲除穿梭载体的构建
以T-Δvip质粒为模板,用VIP-5F 和VIP-3R扩增得到Δvip片段,连入穿梭载体pKSV7后得到pKSV7-Δvip,即重组穿梭载体。对该载体的酶切鉴定结果见图3,4个克隆均为阳性,取1号克隆送测序,结果显示序列同源性99%以上,为阳性克隆。

图2 vip上下游同源臂片段的克隆与连接Fig.2 The construction of vip upstream and downstream fragmentsM:DNA分子量标准品;A:vip上下游片段的PCR扩增结果,1~8:不同PCR反应管编号;B:vip上下游片段连接到pMD-19T载体后的菌液PCR鉴定结果,1~5:菌落编号M:DNA marker;A:the PCR results of vip upstream and downstream fragments,1-8:the number of PCR reaction tubes;B:the PCR results of bacterial clones after the ligation of vip upstream and downstream fragments with pMD-19T,1-5:the number of clones

图3 pKSV7-Δvip敲除穿梭载体的酶切鉴定Fig.3 The verification of the shuttle vector pKSV7-Δvip by enzyme digestionM1、M2:不同的DNA分子量标准品;1~4:不同克隆菌落编号M1,M2:different DNA marker;1-4:the number of clones
2.3基因敲除菌株的筛选
将pKSV7-Δvip质粒通过电穿孔转入单增李斯特菌后,将含有重组载体的菌落进行氯霉素和温度筛选。菌落PCR鉴定结果如图4 所示,只有2 200 bp左右片段为阴性克隆,只扩增得到1 100 bp左右片段的为阳性克隆,显示鉴定的9个克隆中除5号外均为阳性克隆。同时氯霉素抗性板培养结果显示,8个克隆均不能在抗性板生长,为vip基因敲除 阳性克隆。

图4 vip基因敲除菌株的PCR鉴定Fig.4 The verificati Identification of Δvip strains by PCRM:DNA分子量标准品;1~9:菌落编号;Vector:pKSV7-Δvip质粒M:DNA marker;1-9:the number of clones;Vector:the pKSV7-Δvip plasmid
2.4vip基因敲除菌株的RT-PCR验证
为进一步验证vip敲除菌株中vip基因的表达情况是否有改变,进一步利用RT-PCR检测了敲除菌株中vip的转录水平,结果如图5所示。在EGDe中可以检测到vip基因的表达,而在敲除菌株1号和2号则检测不到目的条带(1号中条带偏小为杂带)。

图5 vip敲除菌株的RT-PCR鉴定Fig.5 RT-PCR results of vip knockout strainsM:DNA分子量标准品;1~2:敲除菌株编号M:DNA marker;1-2:the number of mutant strains
2.5单增李斯特菌EGDe和Δvip的生长曲线测定
为进一步研究vip基因的敲除是否对单增李斯特菌的生长活性产生影响,分别测定了野生型菌株和vip敲除菌株的生长曲线。结果显示两者的生长曲线无明显区别(图6),提示vip基因的敲除不影响单增李斯特菌的生长活性。这一结果与Cabanes等[6]的发现并不一致,他们通过对EGDe (ATCC BAA-679)菌株中的vip敲除后发现敲除菌株在2~8 h内的生长速率低于野生型菌株,但最后达到相同密度。这一结果的差异可能因为不同的敲除策略造成,Cabanes等完全敲除了vip基因的读码框,而我们的敲除策略中保留了C末端的30个氨基酸,这段氨基酸序列包含Vip蛋白的分选信号和膜定位信号。

图6 vip敲除菌株的生长曲线Fig.6 The growth curve of vip knockout strains横轴的0代表菌液稀释后未培养前,1~12依次为培养1~12 h后0 point on axis represents the time point before culture, 1-12 represent the time point after culturing for 1-12 h
3 讨 论
基因敲除不仅是研究基因功能的重要分子生物学手段,也是制备减毒疫苗的重要策略之一,对毒力基因的敲除可以大大加快减毒疫苗的研发速度。本研究构建了既能在大肠埃希菌表达又能在单增李斯特菌表达的基因敲除穿梭载体,利用生物体内的同源重组,在抗性和温度的作用下筛选得到了单增李斯特菌的vip基因敲除菌株,并且发现vip基因的敲除对细菌的生长活性没有明显影响,为基因功能的研究和减毒疫苗的研发奠定基础。
几十年来,单增李斯特菌一直被作为一种研究病原菌-宿主免疫相互作用关系的重要的模式菌株。通过多年的研究,科学家对其基因组和基因的功能有了更为深入的了解,大量的毒力基因被发现。由于单增李斯特菌在激发天然免疫和T细胞免疫方面的优势,近年来科学家致力于将其作为肿瘤免疫治疗的疫苗载体,通过基因重组等手段获得减毒疫苗治疗肿瘤。目前已有许多单增李斯特菌的肿瘤疫苗应用于临床I/II期研究。比如溶血毒素LLO是单增李斯特菌侵袭宿主、逃逸吞噬小体造成细胞间传播的重要毒力因子[11]。目前已开发出多种LLO敲除的重组疫苗,如含有乳头瘤病毒DNA的预防乳头瘤的减毒疫苗,可以治疗黑色素瘤的减毒疫苗。Advaxis公司开发的减毒活疫苗已进入临床实践阶段,他们将截断的无溶血活性的LLO与乳头瘤病毒E7蛋白融合制成疫苗,可以有效治疗乳头瘤病毒引起的宫颈癌等[12-13]。2015年,Lucia等研制的LLO相关的疫苗可以将黑色素瘤细胞转化为树突状细胞,起到抗原提呈的作用,激发有效的细胞免疫,清除肿瘤细胞,同时一并清除细胞内的细菌,无需额外使用抗生素[14]。目前,如何平衡毒力和有效激发免疫能力是疫苗研发的关键。除了LLO,其他毒力基因的敲除菌株如actA[15-16]、plcB[17]等也被作为潜在的疫苗载体得到研究。
表面蛋白是单增李斯特菌侵袭感染宿主细胞的重要毒力因子。在单增李斯特菌中存在40多种表面蛋白,其中有20多种只存在于具有侵袭感染能力的毒力株中,表明表面蛋白和细菌的侵袭密切相关[18]。vip基因编码的Vip蛋白只在有毒力的单增李斯特菌株中表达,具有LPTGX序列,可以被Sortase酶锚定在细胞膜上[6]。研究发现Vip蛋白可以通过与细胞上的受体GP96作用,介导细菌对细胞的侵袭和感染,并在此过程中通过信号转导干扰机体的免疫系统,使得细菌在细胞内得以存活[19],但是目前对其中具体的分子机制并不清楚。本研究构建的vip敲除菌株虽未进行毒力检测,但可推测当Vip蛋白缺失后细菌的侵袭能力会受到破坏,造成细菌毒力降低。另外,敲除vip基因会破坏Vip与GP96之间的相互作用,可能减弱细菌对宿主细胞免疫系统的干扰,诱发免疫激活。基于以上推测,vip敲除菌株将会是一种优良的减毒疫苗载体。因此,本研究为单增李斯特菌减毒疫苗的研发提供了新的思路,对vip敲除菌株的侵袭能力及是否能有效激发细胞免疫的评价将是今后研究的重点。
[1]Hernandez A, Payeras-cifre A. What is new in listeriosis?[J]. BioMed research international, 2014, 2014(4):358051.
[2]Drevets D A, Bronze M S.Listeriamonocytogenes: epidemiology, human disease, and mechanisms of brain invasion[J]. FEMS immunology and medical microbiology, 2008, 53(2): 151-165.
[3]Centers For Disease Prevention. Vital signs: Listeria illnesses, deaths, and outbreaks--United States, 2009-2011[J]. MMWR Morbidity and mortality weekly report, 2013, 62(22): 448-452.
[4]Werbrouk H, Grijspeerdt K, Btteldoorn N, et al. Differential inlA and inlB expression and interaction with human intestinal and liver cells byListeriamonocytogenesstrains of different origins[J]. Applied and environmental microbiology, 2006, 72(6): 3862-3871.
[5]Carvalho F, Sousa S, Cabanes D. HowListeriamonocytogenesorganizes its surface for virulence[J]. Frontiers in cellular and infection microbiology, 2014, 4(48):1-22.
[6]Cabanes, Sousa S, Cebria A, et al. Gp96 is a receptor for a novelListeriamonocytogenesvirulence factor, Vip, a surface protein[J]. The EMBO journal, 2005, 24(15): 2827-2838.
[7]Skoberne M, Yewdall A, Bahjat K S, et al. KBMAListeriamonocytogenesis an effective vector for DC-mediated induction of antitumor immunity[J]. The Journal of clinical investigation, 2008, 118(12): 3990-4001.
[8]Rothman J, Paterson Y. Live-attenuated Listeria-based immunotherapy[J]. Expert review of vaccines, 2013, 12(5): 493-504.
[9]周云,潘蕾,郝春秋,等. 单增李斯特菌作为疫苗载体的研究进展[J]. 中国免疫学杂志, 2011, 27(12):1132-1134.
[10]Wood L M, Paterson Y. AttenuatedListeriamonocytogenes: a powerful and versatile vector for the future of tumor immunotherapy[J]. Frontiers in cellular and infection microbiology, 2014, 4:51.
[11]Lam G Y, Fattouh R, Muise A M, et al. Listeriolysin O suppresses phospholipase C-mediated activation of the microbicidal NADPH oxidase to promoteListeriamonocytogenesinfection[J]. Cell host & microbe, 2011, 10(6): 627-634.
[12]Maciag P C, Radylovic S, Rothman J. The first clinical use of a live-attenuatedListeriamonocytogenesvaccine: a Phase I safety study of Lm-LLO-E7 in patients with advanced carcinoma of the cervix[J]. Vaccine, 2009, 27(30): 3975-3983.
[13]Wallecha A, French C, Petit R, et al. Lm-LLO-Based Immunotherapies and HPV-Associated Disease[J]. Journal of oncology, 2012, 2012(5):42851.
[14]Bronchalo-vicente L, Rodriguez-del Rio E, Freire J, et al. A novel therapy for melanoma developed in mice: transformation of melanoma into dendritic cells withListeriamonocytogenes[J]. PloS one, 2015, 10(3): e0117923.
[15]Manohar M, Baumann D O, Bos N A, et al. Gut colonization of mice with actA-negative mutant ofListeriamonocytogenescan stimulate a humoral mucosal immune response[J]. Infection and immunity, 2001, 69(6): 3542-3549.
[16]Wolf B J, Princiotta M F. Processing of recombinantListeriamonocytogenesproteins for MHC class I presentation follows a dedicated, high-efficiency pathway[J]. Journal of immunology, 2013, 190(6): 2501-2509.
[17]Angelakopoilos H, Loock K, Sisul D M, et al. Safety and shedding of an attenuated strain ofListeriamonocytogeneswith a deletion of actA/plcB in adult volunteers: a dose escalation study of oral inoculation[J]. Infection and immunity, 2002, 70(7): 3592-3601.
[18]Cabanes D, Dussurget O, Dehous P, et al. Auto, a surface associated autolysin ofListeriamonocytogenesrequired for entry into eukaryotic cells and virulence[J]. Molecular microbiology, 2004, 51(6): 1601-1614.
[19]Martins M, Custodio R, Camejo A, et al.Listeriamonocytogenestriggers the cell surface expression of Gp96 protein and interacts with its N terminus to support cellular infection[J]. The Journal of biological chemistry, 2012, 287(51): 43083-43093.
ConstructionandScreeningofvipGeneKnockoutListeriamonocytogenesStrains
Listeriamonocytogenes(LM) is a foodborne pathogen that widely exists in nature and foods. As an intracellular parasitic bacterium, it can cause striking cell immunity, and could be regarded as a potential vaccine vector. Genevipis an important virulence gene and closely related to the invasiveness of LM. Therefore, construction ofvipknockout LM strain will contribute to the R & D of LM vaccine. In this study, the upstream and downstream sequences of vip gene were amplified from LM-EGDe genome, and ligated into shuttle vector pKSV7 to get the knockout vector pKSV7-Δvip. Then the vector was electroperforated into LM. Under the double stresses of chloramphenicol and temperature, the knockout mutant strains by allelic recombination were obtained. Further study revealed no obvious changes on bacterial growth activity withoutvip. This study will contribute foundation for further study on the function ofvipgene as well as pathogenic mechanism and vaccine vector R & D of LM.
Listeriamonocytogenes(LM);vipgene knockout; mutant strain; homogenous recombination
上海理工大学博士启动基金项目(1000308001);上海理工大学大学生创新创业训练计划项目(10-15-308-201)
李森 女,博士,讲师。研究方向为食品安全检测,食源性致病菌致病机理研究等。E-mail:lisen1027@gmail.com
2016-09-02;
2016-10-27
Q933
A
1005-7021(2017)04-0016-07
10.3969/j.issn.1005-7021.2017.04.003
诚征广告
《微生物学杂志》由中国微生物学会、辽宁省微生物学会、辽宁省微生物科学研究院主办,为中国科技论文核心期刊、中国生物学核心期刊,被美国《化学文摘(CA)》、《英联邦农业文摘(CAB)》、《中国生物学文摘》、中国科学引文数据库、CNKI中国期刊全文数据库、中国核心期刊(遴选)数据库等国内外重要检索刊物及数据库摘引和收录,是包括工业微生物学、农业微生物学、医学微生物学、兽医微生物学、生物质资源、食用菌学、生物工程学、加工技术及各相关领域的综合性刊物,是国内外科研人员、大中专院校师生、企业人士、医生及生物学爱好者必读的刊物。
《微生物学杂志》创刊于1978年,国内外发行,双月刊。发行面覆盖国内各地的图书馆、科研院所、高校、企业、医院及港、澳、台、北美、澳州、西欧、日本、东南亚等地。
本刊于2013年全面改版升级。目前诚征广告业务,真诚欢迎国内外厂商和读者来此发布产品、技术和服务信息,刊登试验及生产设备、仪器、试剂等各方面的广告。
地址:辽宁省朝阳市双塔区龙山街四段820号《微生物学杂志》编辑部
邮编:122000 信箱:lnwswxh@126.com
帐户:工行朝阳市燕都支行 户名:辽宁省微生物学会
帐号:0713020209249067528
电话:0421-2976841 0421-2914613 联系人:孙翠焕

