环氧乙烷非均相催化水合动力学及均温反应器热稳定性分析
何文军,费泰康,王嘉华,杨为民
中国石油化工股份有限公司上海石油化工研究院 绿色化工与工业催化国家重点实验室,上海 201208
环氧乙烷非均相催化水合动力学及均温反应器热稳定性分析
何文军,费泰康,王嘉华,杨为民
中国石油化工股份有限公司上海石油化工研究院 绿色化工与工业催化国家重点实验室,上海 201208
采用碳纳米管增强复合材料催化剂,在等温积分反应器中获得环氧乙烷非均相催化水合宏观反应动力学实验数据,建立了幂函数型宏观反应动力学方程,采用Levenberg-Marquardt法对动力学模型参数进行估算,并以该动力学模型为基础,分析了均温反应器的热稳定性。结果表明,生成乙二醇主反应的表观活化能为71.7 kJ/mol,与两个典型的串联副反应的活化能接近。模型参数统计检验结果表明,该宏观动力学方程参数是适定的,可用于工业反应器的设计。给出的反应器关键参数的计算方法,可为乙二醇合成反应器的模拟计算和设计开发提供必要的依据。
环氧乙烷 水合 宏观动力学 热稳定性
乙二醇是一种重要的有机化工原料及中间体,主要用于生产聚酯、防冻剂、增塑剂和润滑剂等多种化工产品[1,2]。目前,主要通过环氧乙烷非催化水合生产乙二醇[3,4]。非催化水合反应活化能79.13 kJ/mol,生成副产物的速率常数高于目标产物的速率常数[5]。为了获得高乙二醇选择性(88%~91%),需在190~200 ℃、压力高于1.9 MPa,水和环氧乙烷进料物质的量之比(简称进料水比)为(22~25)∶1的条件下进行反应[6,7],这大大超过化学计量比中水的需求量,导致目标产物乙二醇与水的分离能耗大大提高。尽管采用多效蒸发系统可以提高能量利用率,但增加了流程的复杂性,且能耗仍较大。采用催化剂可以降低反应活化能,提高反应速率[8-10],催化水合技术[11-13]从根本上解决了水比高和选择性低的问题,尤其是非均相催化剂,无需从产品中分离回用催化剂,可以降低成本,是一种流程简单、节能降耗的新技术[14]。
离子交换树脂类催化剂是环氧乙烷水合制乙二醇中较好的催化剂[15-17]。以离子交换树脂为基础,开发了碳纳米管增强复合技术制备的催化剂[18,19],并在千吨级中试运行1 000 h以上,乙二醇选择性95%,环氧乙烷转化率99.5%以上[20]。为实现该催化剂的工业应用,对工业反应器的选型、设计与计算提供必要的依据,提出最适宜的操作条件,需要进行宏观反应动力学的研究。宏观反应动力学方程的形式及动力学参数,与催化剂的制备(活性组分分布、组成和结构)及测试的条件(反应温度、压力和反应物料的组成)密切相关。同一反应体系,采用不同体系的催化剂,不同反应相态,其动力学方程的形式及参数必定不相同,不能外推使用。本工作采用工业催化剂(碳纳米管增强复合材料),在和实际工业生产条件相仿的实验下进行宏观反应动力学研究,从实验中获得催化剂原颗粒宏观反应动力学数据,建模并进行反应器的热稳定性分析。
1 宏观反应动力学研究
环氧乙烷水合主反应生成目标产物乙二醇(MEG),副反应生成二乙二醇(DEG)和三乙二醇(TEG)等[21]。
主反应属于二级不可逆反应,有串联和平行反应的两重性质。酸性或碱性催化剂均可催化环氧乙烷开环与亲核试剂水进行加成反应生成乙二醇。对于副反应,生成的MEG同样是很好的亲核试剂,与环氧乙烷继续进行亲核加成反应生成DEG,直至生成多元醇。反应式如式(1)~(3)。
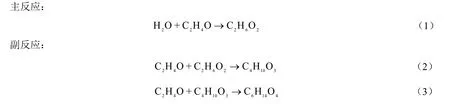
1.1 实验装置及流程
图1为测定环氧乙烷催化水合宏观反应动力学数据的实验装置。由原料定量输运系统、预热及反应系统、温度及压力控制系统、产物采集及分析系统组成。采用等温积分反应器,反应器高600 mm,内径10 mm,分3段控温,恒温段350 mm。
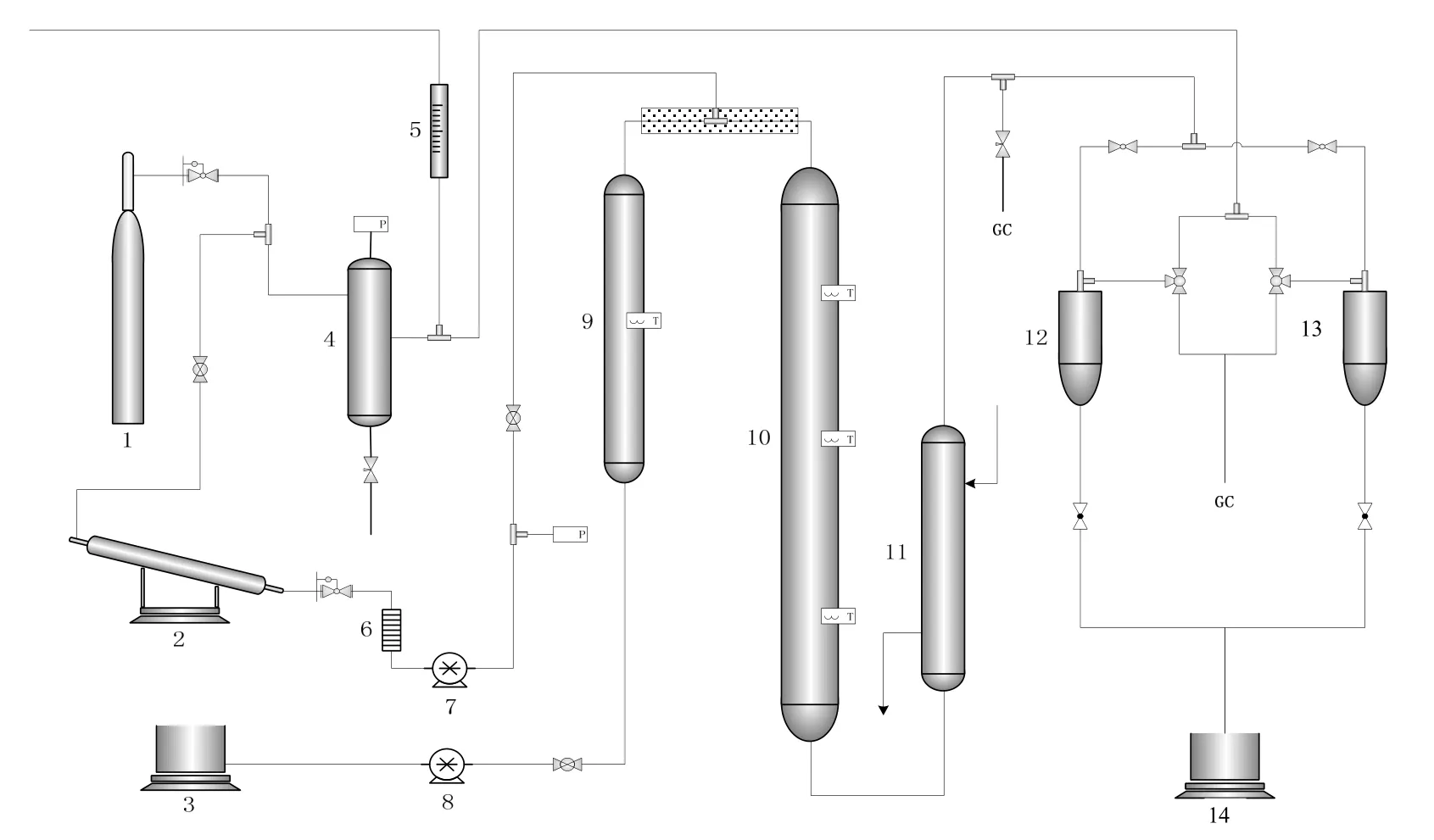
图1 宏观反应动力学测试流程Fig.1 Macrokinetic testing flow
计量钢瓶中的EO经过氮气放空,计量后与进入预热器升温的水混合,调节预热器温度使环氧乙烷与水混合原料的温度达到反应入口温度。反应原料经水合反应器中催化剂床层生成产物乙二醇,反应产物再经过冷却器用循环冷却水快速冷却到室温,两个取样罐切换操作(取样、放料和平衡压力),反应产物及未反应的原料经产物计量罐计量,残余气相经过滤器中碱液浸润的填料过滤后放空,色谱取样分析产物组成。环氧乙烷常压沸点10.7 ℃,冷凝器的温度在10 ℃以下可保证EO等有机物全部被收集。
催化剂为SCM06型球形颗粒,粒径0.3~0.5 mm,装填量2~10 g。环氧乙烷进料0.04~0.33 mL/min,水进料0.10~0.80 mL/min,恒定反应压力为1.2 MPa(可确保反应在液相条件下反应),实验温度为80~100 ℃。
1.2 分析方法及数据处理
反应液相产物中主要成分有MEG,DEG,TEG,H2O和EO等。采用带有FID检测器的HP 7890A气相色谱工作站进行分析,HP-FFAP 50 m×0.32 mm×0.50 μm毛细管色谱柱,7963自动进样器,相对校正因子外标法进行定量。程序升温,初始柱温70 ℃,以30 ℃/min升到220 ℃,保持2 min,以20 ℃/min升温至230 ℃,保持5.5 min。N2作载气,检测器温度300 ℃,汽化室温度280 ℃。采用碳平衡的方法核算有机相的组成。
以下计算按单位质量(1 g)进料量进行计算。

2 结果与讨论
2.1 宏观反应动力学模型及参数
反应物系中包括下列反应组分:EO,H2O,MEG,DEG和TEG。采用原子矩阵法确定独立反应数,原子矩阵经初等变换,计算得矩阵的秩为2,反应组分数为5,因此独立反应数为3。取式(1)~(3)作为独立反应。
反应压力已被证明对液相反应的影响可以忽略,因此恒定反应压力1.2 MPa。为了便于应用,建立幂函数型动力学方程,xi(i分别为H2O,EO,MEG和DEG)为反应混合物中组分i的摩尔分率。
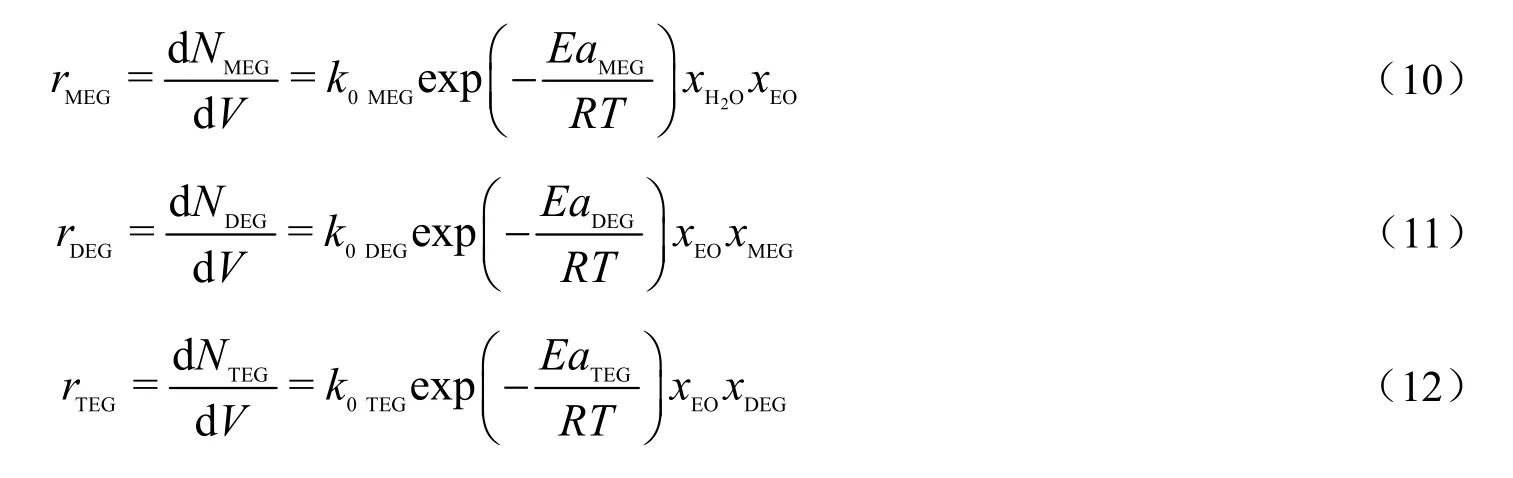
其中,R 为 8.314 J/(mol·K)。
以NMEG,NDEG和NTEG为独立变量,参数估值时以式(13)作为最优化的目标函数。
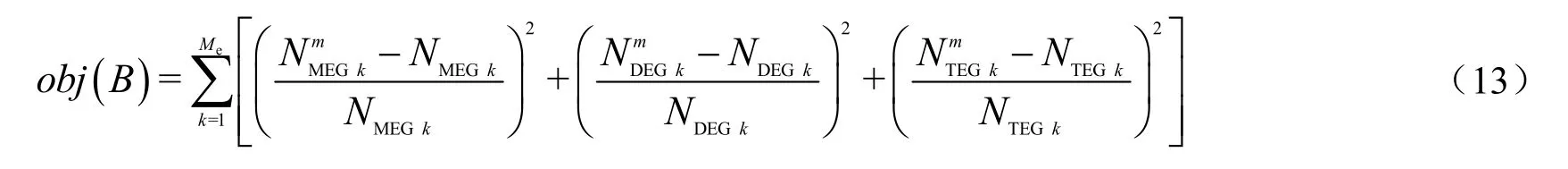
设定初值向量B0,采用四阶Runge-Kutta-Fehlberg法沿反应器体积(V)由入口积分到反应器出口,即求解式(10)~(12)组成的微分方程组,进而按实验中测得的出口组成(见表1)计算目标函数值,采用最优化方法(Levenberg - Marquardt法)求出使目标函数值最小的一组待定参数。
宏观动力学参数实验条件为进料水比4~12,总体积空速1.99~4.98 h-1,反应温度80~100 ℃,反应压力1.2 MPa。
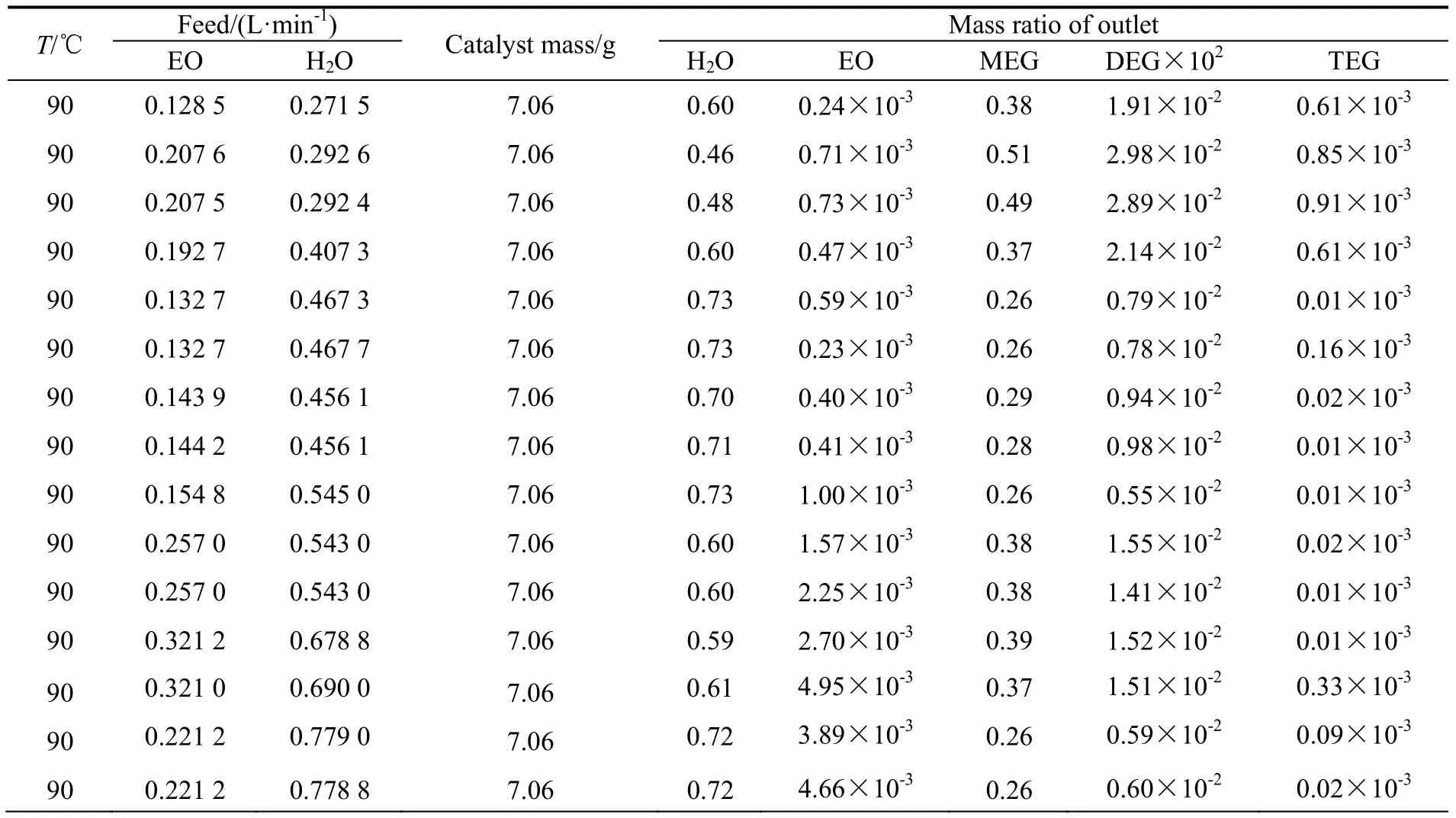
表1 宏观动力学实验结果Table 1 Macrokinetics experiment results
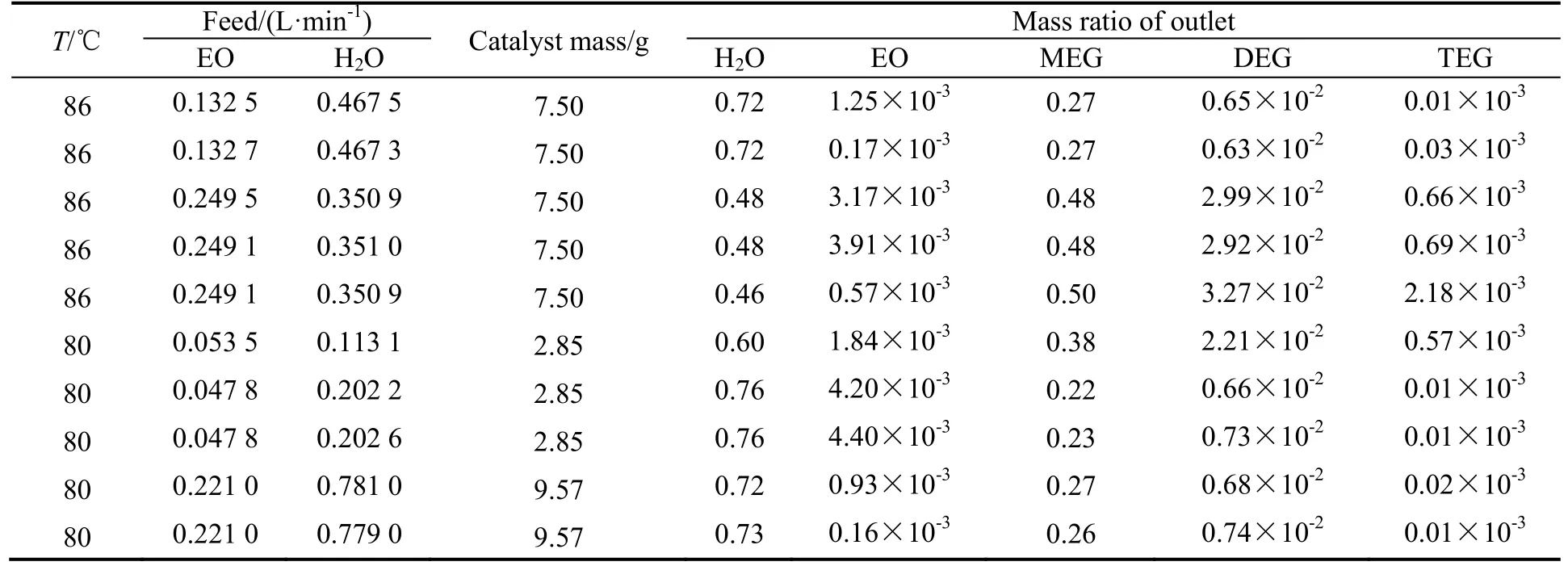
续表1
表2为宏观动力学模型参数统计检验结果,其中Me为实验次数,MP为参数个数,F为回归均方与模型残差均方和之比,ρ2为决定性指标,F0.05为相对水平5%相应自由度下的F值。一般认为当F大于F0.05×10,ρ2大于0.9时,模型是适宜的。由表2可知,该宏观动力学方程参数是适定的。

表2 宏观动力学模型参数统计检验结果Table 2 Statistical results of macrokinetics model parameters
将适定的参数代入式(10),(11)和(12),得到宏观反应动力学方程:
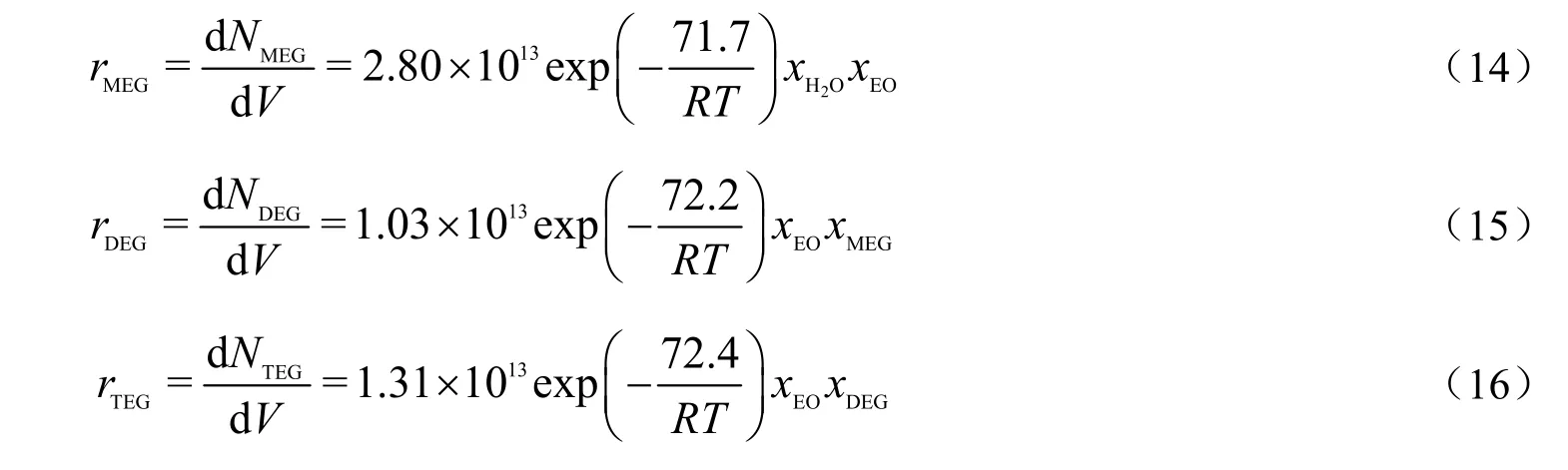
由主反应表观活化能的数值可看到,主副反应的活化能接近,因此,改变反应温度对乙二醇的选择性影响不大。
2.2 环氧乙烷水合反应器热稳定性
对于强放热反应,移出反应热是必要的。取反应器微元作热量衡算,由上述动力学参数结合反应器的热稳定性约束即可确定反应器的关键结构参数。
微元内反应放热速率:

微元通过器壁移热速率:

假设微元中反应物浓度不变,分别将QL和Qr对T作图,可知放热曲线是指数曲线,移热曲线是直线,两线交点为定态操作点,QL=Qr。定态能否稳定操作需满足条件为:

将式(14)和(15)分别对温度求导,结合式(16)可得临界反应区比表面积:

设计时必须保证反应区域比表面积大于此极小值(At)min,对圆管形反应区来说,反应区比表面积的大小取决于管径(Dt)的大小。最大能承受的放热强度为:

对于非圆管形反应区,可以引入当量直径(De)的方法核算相邻管壁的间距-传热间距。催化剂装在管间,相邻两管间距为d,冷却水管直径di,根据等体积原则确定De。

管径越小,比表面积越大。所以当管径大到一定程度就会使比表面积小于式(20)规定的临界值,从而破坏了定态的稳定条件。因此,最大允许的管径为:

(Dt)max即是由热稳定性判据确定反应器的结构参数。
结合式(14),(15)和(16)可导出最大允许温差:

相应的最小允许的冷却介质温度为:

对于绝热固定床反应器,反应放热强弱的重要标志不只是反应热效应的高低,还有反应物系的绝热温升大小。而对于有换热结构的均温反应器,反应热效应的大小不是识别强弱放热反应的唯一标识。决定反应热强弱的因素除了反应本身的特性外,单位反应器体积的放热速率(QL/VR)也是重要的决定因素,它不仅与反应本身的热效应大小有关,还受反应速率高低的影响,更确切地说,均温反应器中强放热反应的重要标志是单位反应器体积的放热速率。
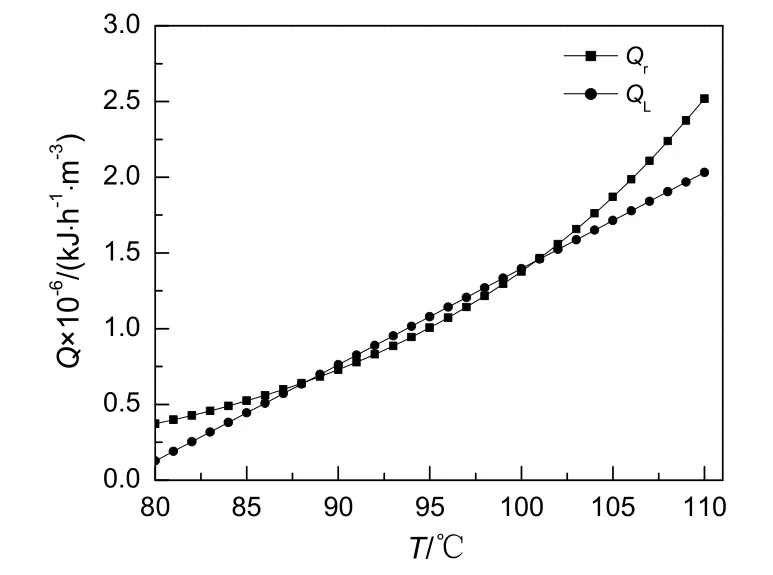
图2 热曲线与温度关系Fig.2 Relationship between thermal curve and temperature
反应器管壁总传热系数为56.8 W/(m2·℃),在进料水比10,冷却水温度80 ℃的条件下,移热速率、放热速率与操作温度的关系见图 2。由图可知,移热速率线与放热速率线有两个交点,低温交点和高温交点,满足定态条件(QL=Qr)。但只有低温交点满足式(19),为稳定的定态操作点,对外界的扰动具有自衡能力。高温交点不满足式(19),是不稳定的操作点,外界扰动容易造成温度的快速上升,控制不当将引起飞温。反应器的实际操作温度应选择低温交点规定的温度,约为88 ℃。
反应器内的化学反应与传热过程耦联,定态稳定条件对传热措施存在限制作用,即传热条件不能任意选择,必须采用很大的总传热系数与传热比表面积和很小的温差,否则就不能满足热稳定条件。超越了热稳定条件就使反应器无法实现稳定操作,这是反应器能否正常运行的关键所在。
不同进料水比下,根据式(20)~(25)计算得到反应器的关键参数见表3。这些数据作为反应器设计的约束性条件。

表3 反应器参数与进料水比的关系Table 3 Relationship between reactor parameters and feed water ratio
上述结果表明,必须采用热水作为冷却介质,这使得反应器传热问题的解决变得更为困难。飞温和熄火都是难以控制的,采用一般的控制措施达到闭环稳定是不现实的。
采用换热式固定床反应方式将不能任意指定参数进行工艺条件实验,不符合热稳定性判据的定态都无法取得稳定数据。优化工艺条件只能在实验室中进行,在中试中验证和修正。
3 结 论
采用碳纳米管增强复合材料催化剂,通过等温积分反应器中得到的催化剂原颗粒宏观反应动力学实验数据,获得了幂函数型宏观反应动力学参数。模型参数统计检验结果表明,宏观动力学方程参数是适定的,可用于工业反应器的设计。生成乙二醇主反应的表观活化能为71.7 kJ/mol,与两个典型的串联副反应的活化能接近,均低于相应非催化反应的活化能。
以实验获得的动力学参数为基础,研究了均温反应器的热稳定性,给出此类反应器的关键参数的计算方法,为乙二醇合成反应器的模拟计算和设计开发提供了必要的依据。
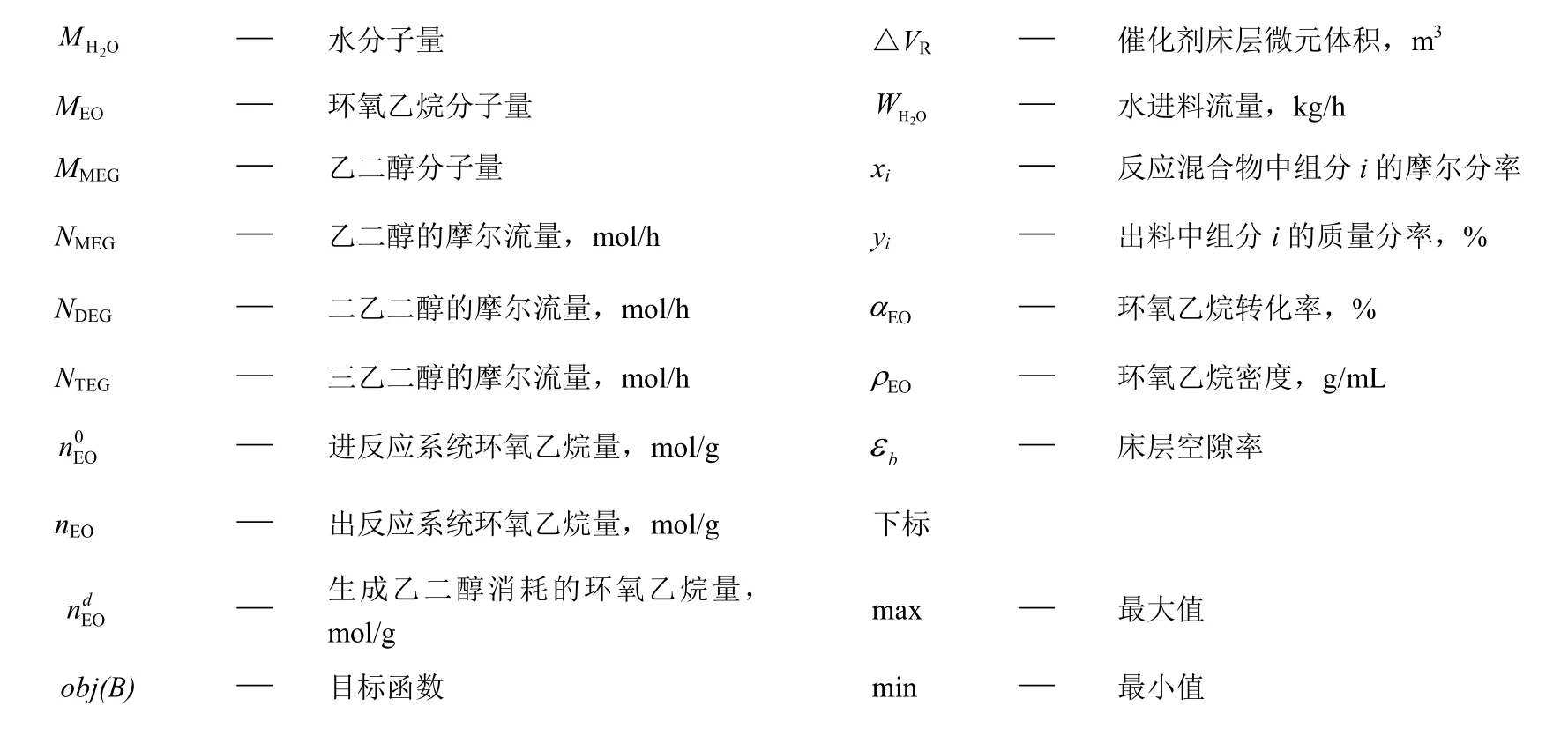
符号说明

[1]赵 岚, 李维真, 谷彦丽.环氧乙烷水合制乙二醇的现状、技术进展及建议[J].化工进展, 2009, 28(S1): 27-30.Zhao Lan, Li Weizhen, Gu Yanli.Technical status, research progress and suggestions for hydration process of ethylene oxide to ethylene glycol[J].Chemical Industry and Engineering Progress, 2009, 28(S1): 27-30.
[2]Yue Hairong, Zhao Yujun, Ma Xinbin, et al.Ethylene glycol: properties, synthesis and applications[J].Chemical Society Reviews, 2012,41(11): 4218-4244.
[3]朱培玉, 李 扬, 王永宏.乙二醇生产新技术研究进展[J].化工进展, 2002, 21(10): 713-717.Zhu Peiyu, Li Yang, Wang Yonghong.Development of new technology on production of ethylene glycol[J].Chemical Industry and Engineering Progress, 2002, 21(10): 713-717.
[4]杨志剑, 任 楠, 唐 颐.环氧乙烷催化水合制备乙二醇的研究进展[J].石油化工, 2010, 39(5): 562-569.Yang Zhijian, Ren Nan, Tang Yi.Advances in preparation of ethylene glycol via catalytic hydration of ethylene oxide[J].Petrochemical Technology, 2010, 39(5): 562-569.
[5]Melhem G A, Gianeffo A.Kinetics of the reactions of ethylene oxide with water and ethylene glycols[J].Process Safety Progress, 2001,20(4): 23l-245.
[6]李应成, 何文军, 陈永福.环氧乙烷催化水合制乙二醇研究进展[J].工业催化, 2002, 10(2): 38-45.Li Yingcheng, He Wenjun, Chen Yongfu.Advances in the researches in preparation of ethylene glycol via ethylene oxide catalytic hydration[J].Industrial Catalysis, 2002, 10(2): 38-45.
[7]贺俊海, 黄集钺, 石鸣彦, 等.乙二醇合成技术研究[J].化工中间体, 2009, (1): 59-62.He Junhai, Huang Jiyue, Shi Mingyan, et al.Advances of ethylene glycol synthesizing process[J].Chemical Intermediate, 2009, (1):59-62.
[8]Shvets V F, Makarov M G, Kozlovskiy R A, et al.The model of catalytic reactor of ethylene glycol production[J].Organic Process Research Development, 2005, 9(6): 768-773.
[9]黄彦科, 周焕文, 刘伟成.环氧乙烷催化水合生成乙二醇动力学研究[J].化工科技, 2007, 15(6): 24-27.Huang Yanke, Zhou Huanwen, Liu Weicheng.Study on kinetics of ethylene glycol produced by catalytic hydrolysis of ethylene oxide[J].Science & Technology in Chemical Industry, 2007, 15(6): 24-27.
[10]尹芳华, 孙 奇, 何明阳, 等.非均相催化水合法合成乙二醇反应动力学研究[J].江苏工业学院学报, 2008, 20(4): 40-43.Yin Fanghua, Sun Qi, He Mingyang, et al.Study of kinetics of heterogeneous catalytic hydration to ethylene glycol[J].Journal of Jiangsu Polytechnic University, 2008, 20(4): 40-43.
[11]Shvets V F, Makarov M G, Kustov A V, et al.Method for producing alkylene glycols: RU, WO9912876[P].1999-03-18.
[12]Yang Z J, Ren N, Zhang Y H, et al.Studies on mechanism for homogeneous catalytic hydration of ethylene oxide: effects of pH window and esterification[J].Catalysis Communications, 2010, 11(5): 447-450.
[13]Dai W L, Wang C M, Tang B, et al.Lewis acid catalysis confined in zeolite cages as a strategy for sustainable heterogeneous hydration of epoxides[J].ACS Catalysis, 2016, 6(5): 2955-2964.
[14]章洪良.环氧乙烷直接催化水合制乙二醇的研究[J].石油化工技术与经济, 2009, 25(5): 53-56.Zhang Hongliang.Study on production of ethylene glycol via direct catalytic hydrolysis of ethylene oxide[J].Technology & Economics in Petrochemicals, 2009, 25(5): 53-56.
[15]Van K E.Process for the preparation of alkylene glycols: NL, WO9719043[P].1997-05-29.
[16]Strickler G R, LandonV G, Lee G S J, et al.Process and equipment for the production of ethylene glycols: US, 6137015[P].2000-10-24.
[17]许 茜, 王保伟, 许根慧.乙二醇合成工艺的研究进展[J].石油化工, 2007, 36(2): 194-199.Xu Qian, Wang Baowei, Xu Genhui.Technological development of ethylene glycol production[J].Petrochemical Technology, 2007,36(2): 194-199.
[18]Yu F P, Cai H, He W J.Synthesis and characterization of a polymer/multiwalled carbon nanotube composite and its application in the hydration of ethylene oxide[J].Journal of Applied Polymer Science, 2010, 115(5): 2946-2954.
[19]李亚男, 何文军, 杨为民.复合离子交换树脂催化环氧乙烷水合制乙二醇的性能研究[J].化学反应工程与工艺, 2015, 31(1): 8-14.Li Yanan, He Wenjun, Yang Weimin.Catalytic performance of composite resins for the hydration of ethylene oxide to ethylene glycol[J].Chemical Reaction Engineering and Technology, 2015, 31(1): 8-14.
[20]何文军, 费泰康, 王嘉华, 等.环氧乙烷直接催化水合制乙二醇技术经济性探讨[J].化工进展, 2016, 35(7): 2268-2273.He Wenjun, Fei Taikang, Wang Jiahua, et al.Economic investigation of direct catalytic hydration of ethylene oxide to ethylene glycol[J].Chemical Industry and Engineering Progress, 2016, 35(7): 2268-2273.
[21]Samoilova N A, Mnushkin I A, Mnushkina O A.Calculation of ethylene glycol production in a reaction rectification column[J].Petroleum Chemistry, 2007, 47(3): 209-218.
Heterogeneous Catalytic Hydration Kinetics of Ethylene Oxide and Thermal-Stability of Homogeneous Temperature Reactor
He Wenjun, Fei Taikang, Wang Jiahua, Yang Weimin
State Key Laboratory of Green Chemical Engineering and Industrial Catalysis, Shanghai Research Institute of Petrochemical Technology, SINOPEC, Shanghai 201208, China
The experimental data of macrokinetics on heterogeneous catalytic hydration of ethylene oxide were obtained in an isothermal integral reactor by using carbon nanotube reinforced composite catalyst.The macrokinetic equation of power function model was established, and the kinetic parameters were estimated by Levenberg-Marquardt method.Based on the kinetic model, the thermal stability of the homogenous temperature reactor was analyzed.The results showed that the apparent activation energy of the main reaction of ethylene glycol was 71.7 kJ/mol, which was close to those of the two typical tandem side reactions.Statistical results of the model parameters indicated that these parameters of the macrokinetic equation were suitable and could be used in the design of industrial reactors.
ethylene oxide, hydration, macrokinetics, thermal stability
TQ013.1; TQ015.3
A
1001—7631 ( 2017 ) 04—0326—09
10.11730/j.issn.1001-7631.2017.04.0326.09
2017-06-13;
2017-07-24。
何文军(1968—),男,博士。E-mail: hewj.sshy@sinopec.com。

