二氧化氯抑制黄曲霉菌生长和产毒能力及其在高水分玉米中的应用
史健阳, 宁 华, 徐 冉, 高珍璇, 余 洋, 刘 保, 柯永培, 孙 群,
(1.四川大学轻纺与食品学院,四川 成都 610064;2.四川省自然资源科学研究院,四川 成都 610065;3.四川大学生命科学学院,四川 成都 610064;4.四川农业大学农学院,四川 成都 611130)
二氧化氯抑制黄曲霉菌生长和产毒能力及其在高水分玉米中的应用
史健阳1, 宁 华2, 徐 冉3, 高珍璇3, 余 洋3, 刘 保3, 柯永培4, 孙 群1,3
(1.四川大学轻纺与食品学院,四川 成都 610064;2.四川省自然资源科学研究院,四川 成都 610065;3.四川大学生命科学学院,四川 成都 610064;4.四川农业大学农学院,四川 成都 611130)
该文系统研究平板条件下二氧化氯(ClO2)对黄曲霉菌丝生长、孢子萌发,以及黄曲霉菌产毒能力的抑制作用,考察ClO2对高水分玉米中黄曲霉菌孢子萌发的影响。结果表明:0.60mg/L ClO2作用40min对黄曲霉菌丝生长抑制率为9.78%,但对黄曲霉毒素B1(AFB1)生成的抑制率达78.22%;0.75mg/L ClO2作用20min即可完全抑制黄曲霉菌丝生长和AFB1产生,因此为最低有效浓度;而1.00mg/L和1.50mg/L ClO2作用5min对黄曲霉菌孢子萌发抑制率分别达到53.38%和100%;以aw0.92的玉米为载体,9.0mg/L的ClO2作用60min对黄曲霉菌孢子萌发抑菌率可达86.63%。因此,ClO2对黄曲霉菌丝生长、产毒能力、孢子萌发都有强烈抑制作用,对抑制高水分玉米中黄曲霉菌孢子萌发也有显著效果,有潜力防控仓储前玉米中黄曲霉菌生长和AFB1污染。
气体ClO2;黄曲霉菌;黄曲霉毒素B1;玉米

0 引 言
黄曲霉菌(Aspergillus flavus)是一种能通过次级代谢产生一级致癌物AFB1的腐生真菌,普遍存在于发霉的粮食、粮制品及其他霉腐的有机物上[1-2],联合国粮农组织估计每年至少有2%的农产品因黄曲霉毒素污染而浪费[3-4]。热带和亚热带地区温度和湿度等条件适宜各类产毒素真菌生长,在我国,西南地区的高温高湿气候极易导致黄曲霉菌的污染[5]。玉米杂交种正红311具有高产、优质、抗多种玉米病害及适应性广等特点,自2006年至今已在西南地区推广1500万亩(1亩=666.67m2)以上,为西南山区玉米主推品种之一;但由于潜在的黄曲霉毒素污染限制了其作为大规模饲料生产原料的范围,而采摘期常见的高温多雨和玉米中的高水分是黄曲霉菌生长和产生毒素的有利条件,因此有必要控制仓储前玉米中黄曲霉菌的生长和毒素生成。
二氧化氯(ClO2)分子具有极强的氧化作用,对微生物的细胞壁有较好的吸附和透过性,可与蛋白质中的部分氨基酸发生氧化还原反应,使氨基酸分解破坏,进而控制微生物蛋白质的合成,最终导致微生物的死亡[6]。由于气体具有良好的渗透性、高效性以及无残留的特点,世界卫生组织(WHO)将ClO2定为A1级高效安全消毒剂,可用在果蔬加工领域,美国环境保护署(EPA)和美国食品与药物管理局(FDA)也于2006年批准ClO2应用于果蔬的采后措施[7-8]。目前,国内外已有许多研究利用气体ClO2处理食品表面,以达到抑制食源性病原菌目的[9-10]。Trinetta等[7]发现ClO2气体可以完全抑制Alternaria alternata和Stemphylium vesicarium菌丝生长,有效控制西红柿采后污染。Sun等[9]在蓝莓包装中充入一定量ClO2气体后,蓝莓在10℃的保藏时间可延长至9d。钟梅等[11]使用500μL/L的ClO2每3 d处理新疆甜瓜一次,有效降低了甜瓜呼吸率,抑制黄曲霉菌等真菌生长。近几年,研究者将其应用于谷物储存中以控制黄曲霉毒素对谷物的污染。马骏等[12-13]通过研究发现ClO2对甜荞和苦荞表面的黄曲霉孢子也有显著杀灭效果。杨莎等[14-15]以4种不同谷物为载体研究了ClO2对黄曲霉菌的抑菌效果,得出8.5mg/L的ClO2作用于晾干后的玉米30min抑菌率可达99.99%。研究表明接种载体是ClO2影响黄曲霉抑菌效率的主要因素[14],而初始接种量和湿度等因素也会影响ClO2的抑菌效果[16]。目前,关于ClO2对以谷物为载体的黄曲霉菌孢子萌发影响的研究较多,但所获得的处理条件差异较大,同时缺乏系统研究ClO2在平板上对黄曲霉菌丝生长和产毒能力的影响,以及对采摘后高水分玉米中黄曲霉菌孢子萌发影响的研究。
一般情况下,霉菌生长包括两种形式,一是菌丝的无性繁殖,最后产生子实体生成孢子;二是孢子萌发形成菌丝。对于粮油食品中的黄曲霉来说,其毒素生成是另一个重点关注的内容。本文研究二氧化氯抑制微生物生长,主要从孢子和菌丝,以及对AFB1的生成3个方面全面评估。同时,选取了西南山区最具代表性的玉米杂交种正红311为载体,研究了ClO2对高水分玉米中接种黄曲霉菌孢子萌发的抑制效果,以期为后续的仓储应用提供理论依据。
1 材料与方法
1.1 实验材料
黄曲霉菌筛选于发霉玉米,16SrRNA测序鉴定为黄曲霉菌(Aspergillus flavus)。在365nm紫外灯下有黄绿荧光,鉴定为产毒黄曲霉菌;玉米杂交种正红311,平均水分<14%(由四川农大正红生物技术公司提供)。
1.2 培养基
马铃薯葡萄糖琼脂培养基(PDA):马铃薯200g、葡萄糖 20 g、琼脂 20 g、蒸馏水 1 L,自然 pH,121 ℃高压灭菌20min。
1.3 主要试剂
黄曲霉毒素B1酶联免疫定量测试盒(北京中检维康生物技术有限公司);粉末状二氧化氯制剂(湖南湘怡源生公司,转化率>95%,纯度≥98%);其余试剂均为市售分析纯。
1.4 实验仪器与设备
HR40-IIA2生物安全柜,青岛海尔特种电器有限公司;HH-BII420BS隔水式电热恒温培养箱,上海跃进医疗器械有限公司;LDZX-50KBS立式压力蒸汽灭菌锅,上海申安医疗器械厂;BH-2光学显微镜,日本Olympus。
1.5 实验方法
1.5.1 ClO2制备
水与二氧化氯药剂按5mL∶1g的比例混合获得纯度≥98%的ClO2气体。收集制备好的ClO2气体,每次使用时用分光光度法测定浓度[17]。
1.5.2 ClO2对黄曲霉菌丝生长的影响
取已制备的黄曲霉孢子悬液(107CFU/mL)5 μL点涂接种于PDA培养基中央,28℃培养36h后移入无菌操作室。培养皿去盖,每3皿置于一个3L的已灭菌PVC盒中,密封。按所需ClO2气体浓度计算出需要ClO2气体的量X mL,先用注射剂抽取盒中空气X mL,再注入同等体积的ClO2气体,即相同体积的ClO2气体置换出等量的空气以保持盒中压力平衡。在标准大气压下避光处理。作用一段时间后打开盒子,散尽ClO2气体,将处理后的带菌培养基于28℃培养,每隔1d测量菌落直径。以未被ClO2处理的接种平板为对照。
黄曲霉菌丝生长抑制率(%)=(对照组菌落直径-处理组菌落直径)/对照组菌落直径×100%
1.5.3 ClO2对黄曲霉菌孢子萌发的影响
取已制备的黄曲霉孢子悬液 (107CFU/mL)100μL均匀涂布于PDA培养基中央,与1.5.2中操作相同。在标准大气压下避光处理。作用一段时间后打开盒子,散尽ClO2气体,将处理后的带菌培养基于28℃培养2d,统计孢子萌发情况[18]。
黄曲霉孢子萌发抑制率(%)=(培养皿面积-带菌面积)/培养皿面积×100%
1.5.4 ClO2对黄曲霉菌产毒能力的影响
1.5.2中PDA平板培养5 d的黄曲霉菌测量生长直径并拍照后,用10mm打孔器在每个培养基沿中心向外依次打孔,取3块带有菌丝的培养基于50 mL离心管,加入25 mL 70%甲醇水,200 r/min摇床振荡40min。将提取液用滤纸过滤,用0.22μm有机系滤膜过滤后收集滤液,待用;ELISA试剂盒检测黄曲霉毒素B1含量,具体方法参见试剂盒说明书。以未用ClO2处理的菌块作为对照[19]。
抑毒率(%)=(对照组AFB1产量-处理组AFB1产量)/对照组AFB1产量×100%

图1 ClO2作用浓度对黄曲霉菌落形成的影响
1.5.5 ClO2对玉米中黄曲霉菌孢子萌发的影响
挑选颗粒饱满的新鲜玉米,用10%的NaClO浸泡60s后用无菌水洗涤两次,调节水分活度至0.92(正红311玉米收获初期水活度平均值),按10g/瓶分装在100 mL无菌三角瓶中,每瓶接入106CFU/mL的黄曲霉菌孢子悬液1 mL,胶塞封口。放置1 h后与1.5.2相同ClO2处理方式。处理后每个三角瓶中加入1g/L蛋白胨水90mL,摇床150r/min振荡2min,然后采用10倍递增稀释法稀释菌悬液,分别进行平板涂布。以未用ClO2处理组为对照。28℃培养48 h后计数,参照GB 4789.15——2010《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》。
孢子萌发抑制率(%)=(对照组孢子数-处理组孢子数)/对照组孢子数×100%
2 结果与分析
2.1 ClO2对黄曲霉菌落形成的影响
实验发现,ClO2处理前后黄曲霉菌落颜色发生变化。如图1(a)所示,ClO2处理前黄曲霉呈现黄绿色菌落,0.5 mg/L处理30 min后形成的菌落颜色变浅,大部分菌苔呈白色;0.75mg/L处理后的菌丝呈现枯死倒伏状,贴在培养基表面。在光学显微镜下可以观察到,ClO2处理前黄曲霉菌丝粗壮饱满(见图1(b)),分生孢子头完整;经0.5mg/L ClO2处理30min后仍然有较多菌丝,但孢子变少;而0.75mg/L处理后的菌丝断裂,孢子散乱在孢子头周围。由此可见,低浓度ClO2对黄曲霉菌菌落形成有抑制作用,高浓度时导致黄曲霉菌菌丝严重受损,其生长完全受到抑制。
2.2 ClO2对黄曲霉菌丝生长的影响
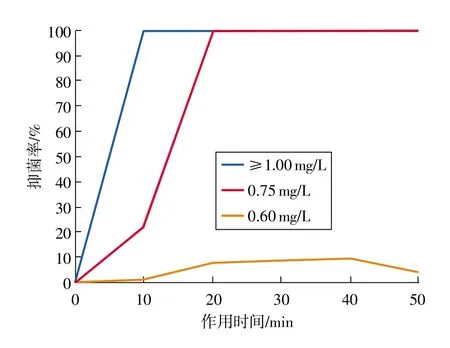
图2 ClO2作用时间、浓度对黄曲霉菌丝生长的影响
分别考查了不同浓度和处理时间条件下ClO2对黄曲霉菌菌丝生长的抑制效果。如图2所示,在较低浓度(0.60 mg/L)处理30 min时,最高抑菌率仅有9.78%,随时间延长抑菌率并无持续增长。而ClO2浓度为0.75 mg/L和1.00 mg/L时,随时间增加抑菌率迅速上升,分别作用20min、10min便可完全杀灭黄曲霉菌(培养15 d仍无任何生长迹象)。因此,ClO2对黄曲霉菌丝生长有明显的抑制作用,且0.75mg/L为平板条件下ClO2的最低有效浓度。在最低有效浓度以上时,ClO2短时间(20 min)处理即可达到良好的抑菌效果,而低于0.75 mg/L时,延长作用时间并不能有效提高抑菌效果。
2.3 ClO2对黄曲霉菌孢子萌发的影响
通常情况下,抑制孢子萌发的抑菌剂有效浓度高于抑制菌丝生长的浓度。因此,用低(1.00mg/L)、高(1.50mg/L)两个浓度的ClO2处理黄曲霉菌孢子,考察其对孢子萌发的抑制作用见图3。随着处理时间增加,两个浓度的ClO2对黄曲霉菌孢子萌发的抑制率都在逐渐上升;低浓度处理15 min才可达到的100%抑制率,对于高浓度处理只需要5min。因此,ClO2对黄曲霉菌孢子萌发有强烈抑制效果,浓度的提升可以大大降低处理时间,这对仓储条件下高效、简便应用ClO2抑制黄曲霉孢子萌发具有指导意义。
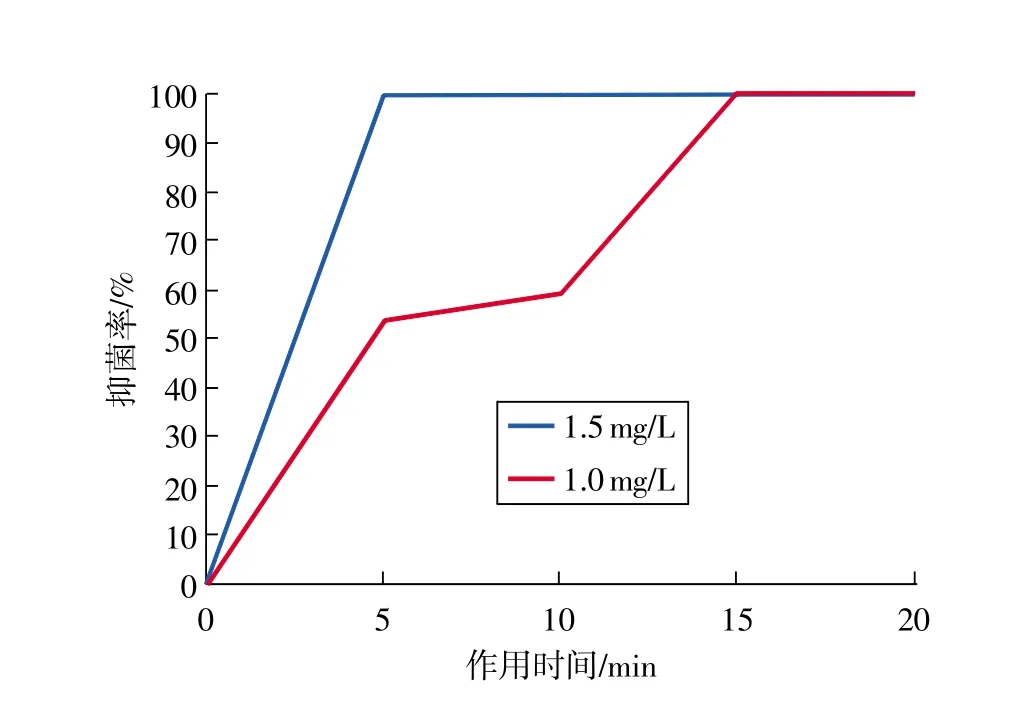
图3 ClO2作用时间、浓度对黄曲霉菌孢子萌发的影响
2.4 ClO2对黄曲霉菌产毒能力的影响
为了评估ClO2对黄曲霉菌产毒能力的影响,采用ELISA法对ClO2处理前后的AFB1含量进行检测。如表1所示,当处理时间为30min时,随着ClO2浓度的增加,对AFB1的抑制效率逐渐提升;分别用浓度为0.25mg/L和0.50mg/L的ClO2处理后,较对照组AFB1的产量分别减少43.65%和56.69%;继续升高作用浓度至0.75mg/L时,AFB1完全被抑制。

表1 ClO2处理浓度对黄曲霉毒素B1生成的抑制作用1)
如表2所示,当ClO2处理浓度为0.60mg/L时,随着处理时间增加,AFB1的抑制效率逐渐提升,当作用时间升至40min时,虽然对菌丝生长的抑制率仅有9.78%,但AFB1产量降低了78.22%。可见低浓度ClO2对黄曲霉生长抑制较弱,但对AFB1的生成却有强的抑制效果。

表2 ClO2处理时间对黄曲霉毒素B1生成的抑制作用
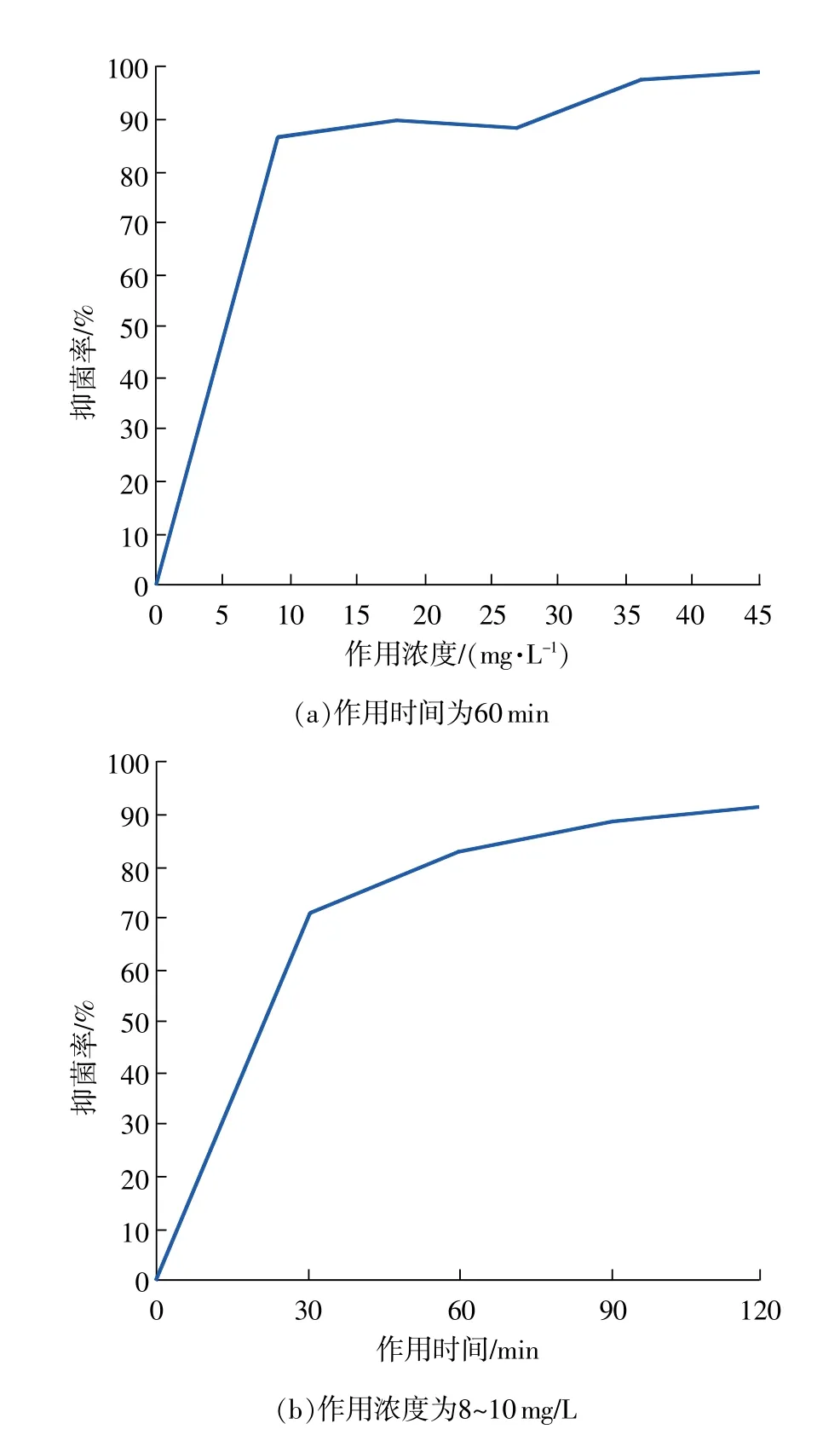
图4 ClO2作用浓度、时间对玉米(aw0.92)中黄曲霉菌孢子萌发的影响
2.5 ClO2对玉米中黄曲霉菌孢子萌发的影响
ClO2对黄曲霉菌的抑制效果与作用时的载体种类、水分含量等因素有关[16]。以水分活度为0.92的正红311玉米为载体,用不同浓度、时间ClO2处理。如图4(a)所示,当ClO2浓度为9.00mg/L时,处理60min对黄曲霉孢子的抑菌率可达到86.63%;升高浓度至27.00mg/L抑菌率缓慢增加,继续升高浓度至45.00 mg/L时,其抑菌率达到99.36%。用浓度为8~10 mg/L的ClO2处理不同时间时如图4(b)所示,作用30 min后样品中黄曲霉孢子萌发抑制率可达70.87%,随着时间延长,抑菌率逐渐增高,作用120min时抑菌率为91.34%。
3 结束语
ClO2对黄曲霉菌菌丝生长和孢子萌发以及黄曲霉菌的产毒能力都有明显的抑制效果。在PDA培养基中考察ClO2对黄曲霉菌丝生长的抑制作用时,结果表明0.75mg/L ClO2为最低有效浓度。当处理浓度高于0.75mg/L时,短时间处理可完全抑制黄曲霉菌丝生长和AFB1产生,而低于此有效浓度时,随着时间延伸抑菌效果并未持续增长,但AFB1产量下降78.22%,其产毒能力下降,极大降低了AFB1积累带来的危害。数据进一步表明,在低浓度处理条件下,仅用菌丝生长和孢子萌发情况来评估其抑制效果是比较片面的,还需要结合产毒能力来综合分析。
ClO2处理前后黄曲霉菌苔颜色明显变化,由于ClO2的强氧化能力,破坏了黄曲霉蒽铜类色素,这些色素不但表征了黄曲霉菌苔颜色,还直接参与了黄曲霉毒素的合成[20],该现象在臭氧处理黄曲霉、黑曲霉时也被观察到[2]。显微观察发现,ClO2使黄曲霉菌丝扭曲变形,孢子量减少,可能是ClO2破坏了其细胞壁结构,阻止了黄曲霉正常生长。已有研究表明,曲霉菌产孢量与毒素产量呈正比关系[21],当然,ClO2对黄曲霉生长代谢抑制的作用机理,需要进一步研究。
以高水分玉米为载体时,ClO2作用时间、浓度都是影响黄曲霉菌孢子萌发的主要因素。低浓度延长杀菌时间或较高浓度短时间内都可以有效抑制黄曲霉菌孢子的萌发,这与马骏[12]以苦荞为载体时ClO2处理黄曲霉菌的研究结果类似。考虑作用时间太短或浓度过低时,ClO2对高水分玉米中黄曲霉孢子萌发的抑菌率都较低,故选取9.00mg/L ClO2处理60min可达到较高抑菌率(86.63%)。而杨莎等[14]用8.5mg/L ClO2处理玉米中黄曲霉菌30 min即可达到99.98%的抑菌率,造成差异的主要原因可能是杨莎实验中以晾干后玉米为载体,而本文中以高水分玉米为载体,水分越高越有利于微生物存活,导致抑菌率下降。此外,接种载体、初始接种量、以及湿度等因素在一定程度上也会影响ClO2的抑菌效果[22]。
本研究发现ClO2气体对黄曲霉菌的生长和产毒能力均有良好的抑制作用,对含高水分的玉米也有着显著抑菌效果。因此,ClO2在食品、饲料中控制黄曲霉菌生长和毒素积累将具有应用价值。本研究小组将进一步探讨其抑菌和抑制产毒的机理,为其在食品工业中的实际应用提供理论依据。
[1]HELL K, MUTEGI C, FANDOHAN P, et al.Aflatoxin control and prevention strategies in maize for sub-Saharan Africa[J].Afr J Microbiol Res,2011,5(5):459-466.
[2]ALENCAR E R, FARONI L R, SOARES N F, et al.Efficacy of ozone as a fungicidal and detoxifying agent of aflatoxins in peanuts[J].Journal of the Science of Food&Agriculture,2012,92(4):899-905.
[3]李培武,张道宏,杨扬,等.粮油制品中黄曲霉毒素脱毒研究进展[J].中国油料作物学报,2010,32(2):315-319.
[4]PIZZOLITTO R P, SALVANO M A, DALCERO A M.Analysis of fumonisin B1removal by microorganisms in co-occurrence with aflatoxin B1and the nature of the binding process[J].International Journal of Food Microbiology,2012,156(3):214-221.
[5] 陈志娟.玉米中黄曲霉毒素降解与去除的研究[D].北京:中国农业科学院,2010.
[6]梅广.二氧化氯保鲜动物性食品及对其品质影响的研究[D].重庆:西南大学,2008.
[7]TRINETTA V,LINTON R H,MORGAN M T.Use of chlorine dioxide gas for the postharvest control of Alternaria alternata and Stemphylium vesicarium on Roma tomatoes[J].Journal of the Science of Food&Agriculture,2013,93(13):3330-3333.
[8]KIM H, YUM B, YOON S S, et al.Inactivation of salmonella on eggshells by chlorine dioxide gas[J].Korean Journal for Food Science of Animal Resources,2016,36(1):100-108.
[9]SUN X, BAI J, FERENCE C, et al.Antimicrobial activity of controlled-release chlorine dioxide gas on fresh blueberries[J].Journal of Food Protection,2014,77(7):1127-1132.
[10]CHOI S, PARK S, KIM Y, et al.Reduction of salmonella enterica on the surface of eggshells by sequential treatment with aqueous chlorine dioxide and drying[J].International Journal of Food Microbiology,2015(210):84-87.
[11]钟梅,吴斌,王吉德.ClO2气体抑菌性能及对新疆甜瓜品质的影响[J].食品科技,2009(4):63-66.
[12]马骏,晋日亚,郑璐,等.气体二氧化氯对谷物表面黄曲霉杀灭效果研究[J].粮食与油脂,2015(6):63-65.
[13]郭凯旋,晋日亚,白小龙,等.气体二氧化氯对染菌甜荞麦杀菌效果研究[J].粮食与油脂,2014(5):55-57.
[14]杨莎,白小龙,晋日亚,等.气体二氧化氯对黄曲霉的抑菌效果研究[J].食品工业科技,2013,34(15):213-215.
[15]杨莎,晋日亚,陕方,等.气体二氧化氯对燕麦易染菌的杀菌效果研究[J].食品工业,2013(6):60-62.
[16]PARK S H,KANG D H.Antimicrobial effect of chlorine dioxide gas against foodborne pathogens under differing conditions of relative humidity[J].LWT-Food Science and Technology,2015,60(1):186-191.
[17]池致超.气体ClO2对葡萄致腐菌的杀菌及保鲜效果研究[D].太原:中北大学,2010.
[18]SCHWENDICKE F, KORTE F, DÖRFER C E, et al.Inhibition of streptococcus mutans growth and biofilm formation by probiotics in vitro[J].Caries Research,2017,51(2):87.
[19]刘菲,王龑,王刘庆,等.不同培养基对赭曲霉生长及产毒能力的影响[J].核农学报,2017,31(4):702-710.
[20]SHIER W T, LAO Y, STEELE T W, et al.Yellow pigments used in rapid identification of aflatoxin-producing aspergillus strains are anthraquinones associated with the aflatoxin biosynthetic pathway[J].Bioorganic Chemistry,2005,33(6):426-438.
[21]CALVO A M,WILSON R A,BOK J W,et al.Relationship between secondary metabolism and fungal development[J].Microbiol Mol Biol Rev,2002,66(3):447-459.
[22]GÓMEZ-LÓPEZ V M, RAJKOVIC A, RAGAERT P, et al.Chlorine dioxide for minimally processed produce preservation:areview[J].Trends in Food Science&Technology,2009,20(1):17-26.
Inhibitory effect on the growth and aflatoxin-production of Aspergillus flavus by ClO2and its application in corn of high water content
SHI Jianyang1, NING Hua2, XU Ran3, GAO Zhenxuan3, YU Yang3, LIU Bao3, KE Yongpei4, SUN Qun1,3
(1.College of Textiles and Food Science,Sichuan University,Chengdu 610064,China;2.Sichuan Provincial Institute of Nature Resource Science,Chengdu 610065,China;3.College of Life Science,Sichuan University,Chengdu 610064,China;4.Agronomy College,Sichuan Agricultural University,Chengdu 611130,China)
The efficacy of gaseous chlorine dioxide(ClO2)on the inhibition of mycelial growth and spore germination of Aspergillus flavus,as well as aflatoxin-producing ability were evaluated.The effect of ClO2on the germination of A.flavus in maize of aw0.92 was also evaluated.Results demonstrated that ClO2noticeably suppressed A.flavus growth, sporulation, and AFB1producing.After the treatment of 0.75 mg/L ClO2for 20 min, the growth of A.flavus was completely inhibited,while the inhibition rates of ClO2at 0.60 mg/L for 40 min was 9.78%and 78.22%for mycelium formation and AFB1development, respectively.On spore germination, after treatment of1.00 and 1.50mg/L ClO2for 5min, the inhibition rates reached 53.38%and 100%,respectively.In addition, the treatment of 9.0 mg/L ClO2for 60 min on corn (aw0.92)resulted in the inhibition rate of 86.63%for spore germination.Accordingly,chlorine dioxide has the potential to be applied for controlling the growth of A.flavus and the pollution of AFB1in corn.
gaseous ClO2; Aspergillus flavus; aflatoxin B1; corn
A
1674-5124(2017)10-0047-06
10.11857/j.issn.1674-5124.2017.10.010
2017-06-10;
2017-07-25
四川省科技支撑计划项目(2016SZ0068)
史健阳(1992-),女,甘肃平凉市人,硕士研究生,专业方向为粮食、油脂及植物蛋白工程。
孙 群(1967-),女,四川成都市人,教授,博士,研究方向为微生物技术与食品安全。
(编辑:莫婕)

