花旗泽仁对胰岛素抵抗大鼠肌肉组织中CaSR基因、蛋白表达及AKT活性的影响
黄启晶,李璐,赵聪,郑义,阚玉娜,刘笑男,刘萍,韩东卫,葛鹏玲*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.牡丹江医学院,黑龙江 牡丹江 157000;3.牡丹江医学院附属红旗医院,黑龙江 牡丹江 157011;4.中国人民解放军军事经济学院门诊部,湖北 武汉 430035)
实验研究
花旗泽仁对胰岛素抵抗大鼠肌肉组织中CaSR基因、蛋白表达及AKT活性的影响
黄启晶1,李璐2,赵聪3,郑义4,阚玉娜1,刘笑男1,刘萍1,韩东卫1,葛鹏玲1*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.牡丹江医学院,黑龙江 牡丹江 157000;3.牡丹江医学院附属红旗医院,黑龙江 牡丹江 157011;4.中国人民解放军军事经济学院门诊部,湖北 武汉 430035)
目的:通过观察花旗泽仁对2型糖尿病胰岛素抵抗大鼠肌肉组织中钙敏感受体(CaSR)基因、蛋白表达及AKT活性的影响,探究花旗泽仁治疗胰岛素抵抗的作用机制。方法:取雄性Wistar大鼠持续灌胃脂肪乳、腹腔注射链脲佐菌素的方式复制2型糖尿病胰岛素抵抗模型。将造模成功的胰岛素抵抗大鼠随机分为模型对照组、阳性对照组、花旗泽仁组。花旗泽仁组给予花旗泽仁水煎液,阳性对照组给予罗格列酮药液。给药结束后,分别检测各组大鼠空腹血糖(FBG)及空腹血清胰岛素(FINS),计算胰岛素敏感指数(ISI),并且取大鼠肌肉组织,采用qRT-PCR和Western blot技术检测钙敏感受体CaSR mRNA、CaSR蛋白和磷酸化AKT(Ser473和Thr308)蛋白表达水平。结果:胰岛素抵抗大鼠模型被成功建立。CaSR mRNA、CaSR蛋白表达水平明显降低(P<0.001),磷酸化AKT(Ser473和Thr308)蛋白含量明显下降(P<0.001,P<0.01);花旗泽仁组与模型组比较,FBG及FINS水平明显降低(P<0.01),ISI显著升高(P<0.01),CaSR mRNA、CaSR蛋白和磷酸化AKT(Ser473和Thr308)蛋白表达水平均明显增加(P<0.01,P<0.05)。结论:花旗泽仁可能通过上调CaSR表达水平,上调与胰岛素抵抗关系密切的PI3K/AKT信号通路中的AKT蛋白(Ser473、Thr308位点)磷酸化水平,从而改善胰岛素抵抗。
花旗泽仁;胰岛素抵抗;钙敏感受体;AKT
全球患病率中,超过9%的人口为2型糖尿病,2型糖尿病(T2DM)已被认为是全球性流行病之一(世界卫生组织出版,2014)[1]。胰岛素抵抗是2型糖尿病的主要发病机制,同时也是冠心病、高血压和动脉粥样硬化等多种疾病的共同病理基础[2-3]。骨骼肌是机体葡萄糖摄取及利用的器官,体内大多数碳水化合物、脂肪都在骨骼肌进行能量代谢,因此骨骼肌是产生胰岛素抵抗的重要靶位[4-5]。
PI3K-AKT通路是介导细胞摄取利用葡萄糖与糖原合成的主要途径。研究表明,PI3K/Akt信号通路,特别是Akt的活化,可能在胰岛素抵抗发生、发展过程中发挥重要作用[6],通路相关蛋白在IR发病中的确切作用仍需进一步明确。钙敏感受体(CaSR)是一种整合膜蛋白,属于G蛋白偶联受体C家族[7],CaSR主要在肝、肌肉中表达,同时也在脑中表达,CaSR在心血管和骨骼肌肉系统中与PI3K-AKT通路密切相关[8-9]。有研究报道,CaSR激动剂使AKT活性显著增强,其抑制剂则能够抑制AKT活性[10]。
本研究通过检测实验大鼠肌肉组织中CaSR mRNA、CaSR蛋白及磷酸化AKT蛋白表达水平的变化,结合PI3K/AKT信号通路活性变化,探究花旗泽仁治疗2型糖尿病胰岛素抵抗的作用机制。
1 材料与方法
1.1 实验动物
体质量200~220 gWistar雄性大鼠50只,由黑龙江中医药大学动物实验中心提供,合格证号编号:SCXK(鲁-2009-0007)。
1.2 试剂与仪器
链脲佐菌素STZ(纯度≥98%)购于BIOSHARP公司;丙硫氧嘧啶购于Sigma公司;马来酸罗格列酮,国药准字H20020475,购于葛兰素史克有限公司;诺和灵R生物合成人胰岛素,国药准字J20070043,购于丹麦诺和诺德公司;胆固醇购于上海惠世生化试剂有限公司;ELISA试剂盒购于南京生物试剂公司;TRIzol Reagen购于Invitroge公司;ECL化学发光试剂盒购于Solarbio公司;DEPC焦炭酸二乙酯购于上海钰博公司;AccuPower GreenStar qPCR PreMixTris-HCl购于Bioneer公司;pH6.8购于Amresco公司;Tris-HCl, pH8.8购于Amresco公司;10%十二烷基硫酸钠购于Solarbio公司;N,N,N',N'-四甲基二乙胺(TEMED)购于Sigma公司;10%过硫酸铵(Aps)购于济宁佰一化工有限公司;蛋白裂解液、4×蛋白上样缓冲液均购于碧云天公司;蛋白预染Marker购于Thermo公司;AKT,T308,S473一抗(兔)购于CST公司;CaSR抗体(小鼠)、β-actin(兔)均购于abcam公司;二抗(辣根酶标记山羊抗兔lgG, 辣根酶标记山羊抗小鼠lgG,购于北京中杉金桥公司;吐温20购于天津市致远化学试剂有限公司;氯仿、无水乙醇、异丙醇购于天津市致远化学试剂有限公司;梯度单头PCR仪 Bio-RadS1000、Real-time PCR仪 Bio-Rad CFX96、电泳仪、Universal Hood II型Bio-RAD凝胶成像系统均购于美国伯乐公司;酶标仪购于MD公司;血糖仪购于德国罗氏诊断有限公司;紫外分光光度计购于上海奥析科学仪器有限公司。
1.3 胰岛素抵抗大鼠模型的建立
取雄性Wistar大鼠按照随机化原则分为模型对照组(40只)和正常对照组(10只)。模型对照组按10 mL/(kg·d)剂量灌胃脂肪乳,连续灌胃20天后,禁食不禁水12 h,连续2天腹腔注射剂量为20 mg/(kg·d)的链脲佐菌素(Streptozocin,STZ),腹腔注射STZ 15 min后,给予大鼠胰岛素0.4 U,并于2.5 h和5h后分别灌胃剂量为10 mL/kg的葡萄糖。末次注射STZ后,测其空腹血糖值、空腹胰岛素及胰岛素敏感指数[11]。
1.4 分组及给药
建立模型成功后,将30只大鼠按照随机化原则分为模型对照组(10只)、花旗泽仁组(10只)和阳性对照组(10只)。花旗泽仁组给予花旗泽仁水煎液;阳性对照组给予罗格列酮药液;空白对照组和模型对照组给予等体积生理盐水,共灌胃28天[11]。
1.5 样本采集
给药结束后,将动物麻醉,用采血管于腹主动脉取血4 mL,静止30 min,低温离心机3 500 rpm,4℃离心15 min,吸取上层血清1 mL,-20℃保存。取适量肌肉组织剪碎后置于液氮中迅速冷冻,2 h后置于-80℃超低温冰箱备用。
1.6 检测方法
1.6.1 空腹血糖(FBG)、空腹胰岛素(FINS)及胰岛素敏感指数(ISI)检测

1.6.2 实时荧光定量PCR(qRT-PCR)检测肌肉组织钙敏感受体(CaSR)mRNA的表达量
RNA的提取实验步骤:①取50 mg肌肉组织在研钵中加入液氮研磨成为小粉末颗粒,并将研磨好的组织转移入冰浴中的l.5 mL离心管;②滴加1 mL Trizol溶液反复吹打3~5次,颠倒混匀10次,室温放置5 min;③4℃,12 000 g离心5 min,取上层清液转移至1.5 mL离心管,加入0.3 mL氯仿溶液,涡旋振荡15 s,常温放置5 min;④12 000 g离心15 min。将上层透明水相取出加入到1.5 mL离心管,滴加0.5 mL异丙醇混匀,室温静置10 min;⑤12 000 g,4℃ 离心15 min;去上清液,加入70%乙醇1 mL,涡旋混匀,4℃,7 500 g离心5 min;弃上清,室温下干燥10 min;⑥滴入20 μL DEPC配置的Rnase失活水溶解,55℃溶解RNA 10 min,-80℃低温存放。
qRT-PCR实验步骤:将从肌肉中提取的RNA反转录为cDNA,然后采用AccuPower GreenStar qPCR master mix进行定量重复。根据试剂盒说明书,CaSR引物序列(正向引物序列:5′- ttctttgaacctggacgacgagt-3′反向引物序列:3′- gcgaggaaggatttgtac-5′)用于扩增片段。按照Bio-Rad定量装置说明进行操作:将溶液混合并按95℃ 10 min,95℃ 15s和47℃ 1min条件进行PCR反应,40个循环周期。利用公式2-■■C(t)计算所有相关表达量。聚合酶链反应产物通过琼脂糖凝胶电泳(AGE)进行识别,以确定非特异性片段。
1.6.3 蛋白印迹法(Western blot)检测肌肉组织钙敏感受体(CaSR)蛋白表达水平及Akt活性
在10%SDS凝胶上分离蛋白质样品(50 μg)并转移到聚偏二氟乙烯(PVDF)膜上。用5%脱脂奶粉在37℃下封闭非特异性蛋白1 h。 随后,将每个PVDF膜与以下初级抗体在4℃下温育12 h:大鼠抗CaSR(1∶1 000; Abcam,MA); 蛋白激酶B(1∶1 000; Abcam),磷酸化Ser473(1∶1 000; Abcam)和磷酸化T308(1∶1 000; CST,MA),与相应的第二抗体孵育2 h后,将膜与过氧化物酶缀合的affiniPure抗体(1∶1 000; Abcam)一起温育,然后通过化学发光(Solarbio,China)显现。
1.7 统计学分析
2 结果
2.1 胰岛素抵抗大鼠模型鉴定结果
与正常组对比,模型组空腹血糖(FBG)和空腹胰岛素(FINS)水平显著升高,ISI明显降低;与模型组比较,花旗泽仁组及阳性对照组的FBG和FINS水平显著下降,ISI明显升高,说明胰岛素抵抗大鼠模型被成功建立。
2.2 花旗泽仁对IR大鼠肌肉组织钙敏感受体(CaSR)mRNA表达水平的影响

表1 花旗泽仁对大鼠肌肉组织中CaSR mRNA的影响
注:与空白对照组比较,△△P<0.01;与模型对照组比较,**P<0.01

图1 花旗泽仁对IR大鼠肌肉组织中CaSR mRNA表达水平的影响
如表1、图1所示,在肌肉组织中,与空白对照组比较,模型组CaSR mRNA表达水平明显降低(P<0.001);与模型组对比,花旗泽仁组CaSR mRNA表达水平显著升高(P<0.01),而阳性对照组差异不具有统计学意义。
2.3 花旗泽仁对IR大鼠肌肉组织钙敏感受体(CaSR)蛋白表达水平的影响

表2 花旗泽仁对大鼠肌肉组织中CaSR蛋白的影响
注:与空白对照组比较,△△P<0.01;与模型对照组比较,**P<0.01,*P<0.05
如表2、图2所示,与空白组比较,模型对照组IR大鼠肌肉组织中CaSR蛋白表达明显下降(P<0.001);花旗泽仁组、阳性对照组与模型组对比,IR大鼠中CaSR蛋白表达水平显著升高(P<0.01,P<0.05)。
2.4 花旗泽仁对IR大鼠肌肉组织中蛋白激酶B(AKT)活性的影响
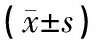
表3 花旗泽仁对大鼠肌肉组织中Thr308和Ser473蛋白表达量的影响
注:与空白对照组比较,△△P<0.01;与模型对照组比较,**P<0.01,*P<0.05
如表3、图3所示,与空白组比较,模型对照组大鼠肌肉组织中磷酸化AKT(Ser473和Thr308)蛋白含量明显下降(P<0.05,P<0.01);与模型对照组比较,花旗泽仁组、阳性对照组大鼠肌肉组织中磷酸化AKT(Ser473 和Thr308)蛋白表达水平显著升高(P<0.05,P<0.01)。

图2 大鼠肌肉组织中CaSR 蛋白表达水平注:A.Western blot检测结果;B.蛋白灰度值

图3 大鼠肌肉组织中磷酸化Akt蛋白表达水平注:A. Western blot检测结果;B.蛋白灰度值
3 讨论
胰岛素抵抗贯穿2型糖尿病的发病过程[12-16],同时也是诱发高血压、冠心病、动脉硬化等多种疾病的共同联系基础。长期高脂饮食容易导致身体肥胖,而肥胖正是引起胰岛素抵抗产生的重要危险因素之一。高脂饮食诱导的动物模型,与人类不良饮食习惯形成的胰岛素抵抗状态相似,具较高的研究价值。本实验采用灌胃脂肪乳的方法复制胰岛素抵抗大鼠模型,主要目的是在此模型的基础上更好的探讨花旗泽仁治疗2型糖尿病的作用机制。
肌肉组织在葡萄糖摄取与利用的过程中发挥重要作用,也是胰岛素作用的重要靶器官。骨骼肌胰岛素抵抗是与2型糖尿病相关的主要缺陷,胰岛素的代谢过程在糖尿病患者的肌肉组织中发生紊乱,可能会导致葡萄糖转运、糖原合成、葡萄糖氧化和基因表达调控的异常[17-20]。
Ohkubo等[21]通过研究发现,纯合子基因和线粒体基因突变的钙敏感受体(CaSR),诱导2型糖尿病的发生。大量实验的研究结果表明,钙敏感受体(CaSR)可能参与到胰岛素抵抗(IR)以及胰岛素抵抗引起的2型糖尿病发病过程中。因此钙敏感受体(CaSR)可能会作为治疗胰岛素抵抗的新的药物靶点,然而钙敏感受体(CaSR)在这些疾病过程中的作用机制尚不明确,仍有待研究。
在本实验中,与空白对照组比较,模型对照组CaSR的mRNA和蛋白表达量降低,磷酸化AKT蛋白含量明显下降,AKT活性被抑制,提示CaSR表达和PI3K/AKT信号通路之间具有相关性。
大量的文献研究证实PI3K/Akt通路是IR病理变化过程中的一个关键因素,尤其是PI3K/AKT下游蛋白激酶B(AKT)的活性变化,如PKB和RAC。有研究证实生长因子和胰岛素可以增加蛋白激酶B(AKT)的活性,而蛋白激酶B(AKT)活性变化涉及两个关键位点(Thr308与Ser473位点)的磷酸化水平,这两个位点的磷酸化是Akt完全活化和糖原形成的关键步骤[22-24]。Akt还参与细胞周期调节,并且还可在胰岛素调节葡萄糖转运过程中发挥重要作用[25-26]。而且在肌肉组织中,胰岛素可通过激活PDK1来诱导Akt在Thr308和Ser473上的磷酸化[27]。
本实验中,与模型对照组比较,花旗泽仁组大鼠肌肉组织中钙敏感受体(CaSR)的基因与蛋白以及Thr308、Ser473的蛋白表达量显著上调。本实验结果提示,胰岛素抵抗大鼠给予花旗泽仁后,钙敏感受体可能通过激活蛋白激酶B的活性,进而调节PI3K/AKT信号通路的传导,缓解胰岛素抵抗。
[1] Alfa R W,Kim S K.UsingDrosophilato discover mechanisms underlying type 2 diabetes[J].Disease Models & Mechanisms,2016,9(4):365-376.
[2] Kasuga M.Insulin resistance and pancreatic beta cell failure[J].Journal of Clinical Investigation,2006,116(7):1756.
[3] Kahn S E,Cooper M E,Prato S D. Pathophysiology and treatment of type 2 diabetes: perspectives on the past,present,and future[J].Lancet,2014,383(9922):1068-1083.
[4] 马慧娟.高脂饮食诱导的胰岛素抵抗大鼠骨骼肌线粒体相关蛋白PGC-1α的表达及调控[D].石家庄:河北医科大学,2010.
[5] 蒙碧辉,舒昌达.骨骼肌胰岛素抵抗的分子机制[J].国际内分泌代谢杂志,2002,22(6):398-400.
[6] Shepherd P R, Withers D J, Siddle K. Phosphoinositide 3-kinase: the key switch mechanism in insulin signalling[J].Biochemical Journal,1998,333(3):471.
[7] Justinich C J, Mak N, Pacheco I, et al. The extracellular calcium-sensing receptor (CaSR) on human esophagus and evidence of expression of the CaSR on the esophageal epithelial cell line (HET-1A)[J].Am J Physiol Gastrointest Liver Physiol,2008,294(1):G120-129.
[8] Li G W, Xing W J, Bai S Z, et al. The Calcium-Sensing Receptor Mediates Hypoxia-Induced Proliferation of Rat Pulmonary Artery Smooth Muscle Cells Through MEK1/ERK1,2 and PI3K Pathways[J].Basic & Clinical Pharmacology & Toxicology,2011,108(3):185-193.
[9] Dvorak M M, Burg M B. Physiological changes in extracellular calcium concentration directly control osteoblast function in the absence of calciotropic hormones[J]. Proceedings of the National Academy of Sciences of the United States of America,2004,101(14):5140-5145.
[10] Li H X, Kong F J, Bai S Z, et al. Involvement of calcium-sensing receptor in oxLDL-induced MMP-2 production in vascular smooth muscle cells via PI3K/Akt pathway[J]. Molecular & Cellular Biochemistry, 2012, 362(1-2):115-122.
[11] 葛鹏玲,张宇驰,韩东卫,等.花旗泽仁对胰岛素抵抗大鼠胸主动脉血管张力、血清一氧化氮含量以及骨骼肌胰岛素受体mRNA基因表达的影响[J].中医药信息,2016,33(6):23-27.
[12] Himsworth H P. Diabetes mellitus: Its differentiation into insulin-sensitive and insulin-insensitive types[J]. International Journal of Epidemiology,2013,42(6):1594-1598.
[13] Yalow R S, Berson S A. Immunoassay of endogenous plasma insulin in man[J].Obes Res,1996,39(6):583-600.
[14] 葛鹏玲,赵静,阚玉娜,等.花旗泽仁对2型糖尿病胰岛素抵抗大鼠氧化应激的影响[J].中医药信息,2014,31(5):1-4.
[15] 鲁彩霞,苑程鲲,侯丽辉.补肾化痰方治疗胰岛素抵抗PCOS的临床研究[J].中医药学报,2015,43(6):58-61.
[16] 邓晓威,谢宁.黄连素通过抑制MicroRNA-29a的表达改善胰岛素抵抗[J].中医药学报,2016,44(1):45-48.
[17] DeFronzo RA. Pathogenesis of type 2 (non-insulin dependent) diabetes mellitus: a balanced overview[J].Diabetologia,1992,35(4):389-397.
[18] Kahn CR.Banting Lecture. Insulin action, diabetogenes, and the cause of type II diabetes[J].Diabetes,1994,43(8):1066-1084.
[19] Zierath JR, Krook A, Wallberg-Henriksson H.Insulin action and insulin resistance in human skeletal muscle[J].Diabetologia,2000,3(7):821-835.
[20] Bouzakri K, Roques M, Gual P, et al.Reduced activation of phosphatidylinositol-3 kinase and increased serine 636 phosphorylation of insulinreceptor substrate-1 in primary culture skeletal muscle cells from patients with type 2 diabetes[J].Diabetes,2003,52(6):1319-1325.
[21] Ohkubo E, Aida K, Chen J, et al. A Patient with Type 2 Diabetes Mellitus Associated with Mutations in Calcium Sensing Receptor Gene and Mitochondrial DNA[J]. Biochemical & Biophysical Research Communications, 2000, 278(3):808-813.
[22] Franke T F, Kaplan D R, Cantley L C. PI3K: downstream AKTion blocks apoptosis[J].Cell,1997,88(4):435-437.
[23] Burgering, B.M.,P.J. Coffer, Protein kinase B (c-Akt) in phosphatidylinositol-3-OH kinase signal transduction[J].Nature,1995,376(6541):599-602.
[24] Franke T.F.The protein kinase encoded by the Akt proto-oncogene is a target of the PDGF-activated phosphatidylinositol 3-kinase[J].Cell,1995,81(5):727-736.
[25] Hajduch E., G.J. Litherland, H.S. Hundal, Protein kinase B (PKB/Akt)——a key regulator of glucose transport[J].FEBS Lett,2001,492(3):199-203.
[26] Diehl J A, Cheng M, Roussel M F, et al. Glycogen synthase kinase-3beta regulates cyclin D1 proteolysis and subcellular localization[J]. Genes & Development,1998,12(22):3499.
[27] Alessi D R, Andjelkovic M, Caudwell B, et al. Mechanism of activation of protein kinase B by insulin and IGF-1[J].Embo Journal,1996,15(23):6541-6551.
InfluenceofHuaqizerenontheLevelsofCaSRExpressionandAKTActivityinMuscleTissuesofT2DMRatswithIR
HUANGQi-jing1,LILu2,ZHAOCong3,ZHENGYi4,KANYu-Na1,LIUXiao-nan1,LIUPing1,HANDong-Wei1,GEPeng-Ling1
(1.HeilongjiangUniversityofChineseMedicine,Harbin150040,China; 2.MudanjiangMedicalCollege,Mudanjiang157000,China; 3.HongqiHospitalAffiliatedtoMudanjiangMedicalCollege,Mudanjiang157011,China;4.ChinesePeople'sLiberationArmyMilitaryEconomicsInstitute,Wuhan430035,China)
Objective: To explore the mechanism of Huaqizeren(HQZR) in the treatment of insulin resistance(IR) by investigating the effect of HQZR on calcium receptor(CaSR)gene, its protein expression and AKT activity in the muscle tissues of T2DM Rats with IR. Methods: The IR model was established with compound fat emulsion diet for 4 weeks and small-dose STZ injection in male Wistar rats. The successful model rats were randomly divided into the model group, the HQZR group, and the positive control group, which was given Rosiglitazone. FBG(fasting blood glucose) and FINS(fasting insulin) were tested, and ISI (insulin sensitivity index) was calculated. The expressions of CaSR mRNA, CaSR protein and phosphorylated AKT(Ser473 and Thr308) in the muscles were detected with qRT-PCR and Western blot techniques. Results: IR models were successfully established. After HQZR treatment, the levels of FBG and FINS were significantly increased with decreased ISI compared to the model group(P<0.01). The expressions of CaSR mRNA, CaSR protein and phosphorylated AKT were remarkably increased(P<0.01,P<0.05). Conclusion: HQZR may improve IR by regulating CaSR mRNA, protein CaSR and phosphorylated AKT.
HQZR; IR; CaSR; AKT
R285.5
A
1002-2392(2017)05-0031-05
2017-06-01
2017-06-26
国家科技重大专项(2012ZX09103201-018);国家自然科学基金项目(81273650);黑龙江省自然科学基金项目(LC2011C03);黑龙江中医药大学"优秀创新人才支持计划" (No. 2012RCD19);黑龙江省博士后科研启动基金项目(No.LBH-Q15136);哈尔滨市科技创新人才研究专项资金项目(No.2016RAXXJ100);黑龙江中医药大学科研基金项目(No.201515);黑龙江省中医药科研项目(No.ZHY16-093)
黄启晶(1992-),女,硕士研究生,专业:药理学。
*通讯作者:葛鹏玲(1974-),女,博士,教授,博士研究生导师,研究方向:中医药治疗2型糖尿病的现代药理学研究。

