基于植物采矿的“绿色冶镍”研究进展
张鑫,吕香英,刘文深,刘畅,袁鸣 ,仇荣亮
(1. 河南师范大学环境学院∥黄淮水环境与污染防治教育部重点实验室∥河南省环境污染控制重点实验室,河南 新乡 453007;2. 环境污染治理与生态修复河南省协同创新中心,河南 郑州 450000;3. 中山大学环境科学与工程学院,广东 广州 510275)
基于植物采矿的“绿色冶镍”研究进展
张鑫1,2,3,吕香英1,刘文深3,刘畅3,袁鸣3,仇荣亮3
(1. 河南师范大学环境学院∥黄淮水环境与污染防治教育部重点实验室∥河南省环境污染控制重点实验室,河南 新乡 453007;2. 环境污染治理与生态修复河南省协同创新中心,河南 郑州 450000;3. 中山大学环境科学与工程学院,广东 广州 510275)
基于植物采矿的理念,利用镍超富集植物将低品位红土镍矿或镍污染土壤中的镍吸收并转运到植物的地上部分,而后将收获的镍超富集植物视为镍资源的二次来源,经由焚烧镍超富集植物获得w(镍)约20%的“高镍生物矿砂”。通过综述镍超富集植物吸收转运镍的机理、种植镍超富集植物的农艺调控研究,以及现有的从镍超富集植物或“高镍生物矿砂”中制备纯镍、易斯酸催化剂、六水硫酸镍铵以及镍纳米材料工艺技术等,展望今后可能的“绿色冶镍”研究方向。期望在使用镍超富集植物修复环境镍污染,降低环境中镍对人类和其它生物的潜在危害的同时,开发新型的“绿色冶镍”技术,缓解我国镍资源紧缺的重要问题。
镍;超富集植物;植物采矿;生物矿砂;绿色冶金
我国镍资源相对缺乏,其储量占世界镍总储量的比例较小,2014年中国镍储量仅占世界镍总储量的3.7%。目前国内矿山生产的镍只能满足总消费需求的一半,供需缺口日渐增大,存在每年需从国外大量进口镍矿石的困境[1]。
国际采矿及金属协会(ICMM)发布数据显示[2],随着高品位矿床的逐渐枯竭,采矿业将从少量高品位矿床转移到大量的低品位矿床。针对镍资源,随着高品位硫化镍矿资源的逐步减少,镍矿的开采已经转向低品位的红土镍矿。
目前,充分利用具有高镍、低肥力、高镁低钙等特征的蛇纹岩土壤或生态环境风险较高的高镍污染农业土壤,通过种植和收割镍超富集植物进而提炼镍金属或镍产品,实现低品位红土镍矿的开采以及镍污染土壤修复过程中的镍金属资源化已逐渐受到一些专家学者的重视[3-5]。因此,基于植物采矿的“绿色冶镍”技术具有重要的战略意义。
1 植物采矿(镍)
植物采矿[6]是指在低品位的金属矿区或金属严重污染的土壤上种植金属超富集植物,利用植物将金属从地下吸收并转运到植物的地上部分,待收割后将金属从植物生物质中回收利用的一种绿色清洁的采矿技术。因此植物采矿包含两个过程:①旨在获得更多富含金属的植物生物质的农业过程[7];②湿法冶金法等方法从植物生物质中制取金属或金属产品[3,5]。

图1 植物采矿示意图Fig.1 Phytomining scheme
在一定意义上,植物采矿不仅可以绿色有效地开采低品位矿产资源以及治理土壤金属污染,同时其经济效益与金属的价格直接相关,当金属的价格足够高时植物采矿具有更广阔的应用前景。日前,世界范围内植物采矿主要应用于植物采镍[8-9]和极小范围的植物采金[10-11]。
1.1 土壤中的镍:植物采镍的潜在资源
1.1.1 含镍的蛇纹土壤 超镁铁质土壤广泛存在全球的许多地区,例如古巴、新喀里多尼亚、澳大利亚、土耳其、巴西、中国等。蛇纹岩土壤是一种特殊的超镁铁质土壤,由蛇纹岩衍生,土层浅、粗,具有特殊的物理化学性质[12],例如低营养状态、阳离子不平衡、表面温度高的影响和金属含量高等。铁(Fe)、镁(Mg)、硅(Si)、镍(Ni)、铬(Cr)和钴(Co)含量通常很高,但氮(N)、磷(P)、钾(K)和硼(B)元素匮乏[13]。在蛇纹岩土壤中,w(Ni)范围通常是1 000~7 000 mg/kg[14-15]。在中国,蛇纹岩土壤主要分布在云南哀牢山等西南地区,其中w(Ni)和w(Co)分别为565~4 844和69~481 mg/kg[16]。这类土壤无法达到传统冶炼的品位要求(w(Ni)通常为1.5%以上),但却足以为超富集植物提供良好的采镍基质。
1.1.2 镍污染的土壤 土壤中除天然含有的一些镍,其它的镍是由镍污染造成的。根据我国环保部、国土资源部发布的《全国土壤污染状况调查公报》[17],我国土壤污染金属中,Ni的点位超标率为4.8%,仅次于镉(7%),污染状况十分严重。例如,在中国著名的“镍城”金昌采集的10个污染土壤样品中,w(Ni)为139~1 099 mg/kg,平均为300 mg/kg。此结果远远超过了中国土壤环境质量Ⅱ级土壤标准中Ni含量(GB15168-1995)[18]。还有通过对东莞市118处农业表层土壤取样结果显示,东莞市农业土壤w(Ni)为2~58 mg/kg,平均值为21 mg/kg,远高于广东省土壤中Ni的背景值[19]。
此外,由于镍在不锈钢合金生产、化工、电池生产以及电镀表面处理等方面的广泛应用,国内相当一部分土壤已被镍污染。其中镍及镍产品生产过程中和后处理不当产生的废水和废弃物的排放是镍污染的主要来源[20]。
1.1.3 镍在土壤中的存在形态 镍在土壤中的存在形态主要有无机结合态、沉淀态、络合或吸附在有机阳离子表面、交换态、水溶态、自由离子或螯合态[21]。
超镁铁质土壤经过特殊的成土作用,在适度的气候条件下,大量富含镍金属氧化物和拥有大量可利用镍的二次粘土一起形成了雏形土。高交换粘土(例如蒙脱石)是可利用镍的另一种来源[22]。在热带气候下,铁氧化物集中在具有较高结晶度的土壤中,在它们的晶格里包含不可利用的镍形态。镍在每个脱水步骤都会减少,镍在针铁矿变成赤铁矿过程中减少的含量均是其不可用的形态。在温带和热带气候的排水不便利的条件下,含镁丰富的粘土可能积累在土壤中,并成为主要与可利用镍形态结合的相[22]。
1.1.4 土壤镍污染对人类健康的危害 镍是我们生物圈生活中不可缺少的元素。但当人们接触和摄取过多镍和镍盐,尤其通过呼吸道进入人体过多的镍吸收会伤害肺,引起肺水肿、急性肺部炎症、和各种癌症,如喉癌、肺癌、前列腺癌和鼻癌等[23]。也有一些研究显示,从我们每天使用的手机中和从一些低廉的装饰品(头饰、耳环、项链等)中释放的过量镍会导致皮肤镍过敏、过敏性皮炎和湿疹等[24-25]。
1.1.5 土壤中镍污染的治理方法 传统的镍污染土壤修复方法主要包括工程措施、物理和化学方法。然而,自1983年Chaney提出通过种植和收割重金属超富集植物来减少并移除土壤中重金属含量的想法后,植物修复技术便被视为是具有应用前景的重金属污染修复技术[26-27]。
植物修复是利用一些对重金属有超富集能力的植物将重金属转运到植物的地上部分从而达到减少土壤中重金属的目的。该技术主要包括植物提取、植物挥发和植物稳定。植物稳定仅暂时降低了重金属在土壤中的生物有效性,植物挥发只能针对一些可挥发性的污染物并且必须保证向大气中挥发的速度和浓度不构成生态危险。
相比而言,植物吸收[28]是一种广泛和永久性的植物修复途径,特别是当利用植物修复污染土壤与从超富集植物中回收重金属结合起来后,可使污染土壤中的重金属通过转移到植物生物质中增值进而创造经济效益,这种思路促进了植物采矿的发展。
1.2 镍超富集植物对镍的吸收转运机理研究
研究发现,超富集植物对镍的吸收符合米氏吸收动力学方程,其米氏常数Km值可达36.1 μmol/L[29],说明镍可能主要通过低亲和力转运通道进入植物体内。一些间接的证据则显示,镍超富集植物Thlaspigoesingense主要吸收离子态镍(Ni2+)而非有机镍螯合物,同时超富集植物根部镍的吸收受到低温、代谢抑制剂及缺氧环境的抑制,说明其吸收是一个消耗能量的过程[29]。
超富集植物对镍的吸收会与其它矿质营养元素发生强烈的竞争作用。在锌/镍超富集植物Thlaspipindicum和Noccaeacaerulescens中,锌强烈抑制镍在植物体内的吸收和转运,但镍对锌的吸收则几乎没有影响[30-31],Halimaa等[32]通过分子生物学技术,推测超富集植物Noccaeacaerulescens体内锌转运子ZIP10可能参与了镍的吸收。除了锌/铜之外,镍和铁、钴在吸收过程中也存在相互作用。铁的缺乏导致Arabidopsisthaliana对镍吸收增加[33-34],其原因可能是镍通过非特异性的Fe2+转运载体AtIRT2吸收进入植物体内[35]。此外,铁的螯合物转运蛋白YSL3也可能参与了镍的运输[36]。类似地,超富集植物Alyssumtroodii和Berkheyacoddii对镍的吸收会受到钴的显著抑制[37],表明镍和钴在吸收过程中也存在着较强的竞争作用。
近年来关于超富集植物转运镍机理方面的探索已取得了很多进展。研究发现[38-40],超富集植物Alyssumlesbiacum根部中富含组氨酸(His),His与镍具有很强的螯合能力,能够显著抑制镍在根细胞液泡中的区室化作用,增加其横向移动性。外源施加His不仅增强了超富集植物对镍的耐性,而且提高了镍从根部向地上部的转运。除His之外,烟草胺(nicotianamine)也参与了镍向木质部的装载和转运过程[41]。当到达木质部导管时,镍则主要以离子形态随蒸腾流向地上部运输[42]。Alves等[43]的研究显示,生长在蛇纹岩地区的超富集植物Alyssumserpyllifolium木质部汁液中70%的镍为水合离子态,其它则被柠檬酸(18%)等结合。到达地上部后,叶片中累积的镍与有机酸(柠檬酸,苹果酸等)螯合后,主要储存在表皮液泡及毛状体基部等活性部位较低的生理组织进行解毒。
Van等[44]在野外调查时发现热带蛇纹岩地区生长的木本超富集植物的韧皮部汁液中w(Ni)可达到16.9%。Deng等[45]近期的研究发现镍能够在源汇之间快速转移,老叶中的镍大部分通过韧皮部从运输到新叶中,少量则向下运输至根部。
当然镍超富集植物对镍的吸收转运机理研究也大大推动了其它重金属超富集植物的筛选及一些机理的研究[46-47]。
1.3 植物采矿(镍)的农艺管理研究
农艺调控管理措施在植物提取技术中有着重要的作用,目前已有较多利用农艺实践提高重金属超富集植物生物质产量的研究[7,48,49]。植物采镍的主要农艺过程包括选择最佳的超富集植物、庭荠属超富集植物Alyssummurale种子的选育和提高该植物生长的土壤条件以收获尽可能高含镍的生物质。
关于选择最佳的镍超积累植物,首先,金属超富集植物是从相关的非超积累植物中筛选出来的,其具备3个主要特点:较强吸收重金属的能力;将重金属从根部快速向植物地上部分转运的能力;较强的重金属解毒能力并将重金属保持在植物体内。此外,这些特殊的植物应具有在特定环境中适应能力强,生长良好且生物量大的特征。
其次,镍超富集植物是从特殊的重金属超富集植物中选出的。大约400种植物已被确定为镍超富集植物[6,41-42],如Streptanthuspolygaloides(在美国加利福尼亚州Red Hills的镍肥沃的土壤);Sebertia(=Pycnandra)acuminata(在新喀里多尼亚的蛇纹石土);Berkheyacoddii(菊科,在南部非洲的蛇纹石土壤);Alyssumbertolonii(在托斯卡纳和阿尔巴尼亚的蛇纹石土壤);AlyssumargenteumBurtt(在意大利西北的超镁铁质土壤上);Alyssumserpyllifoliumssp.lusitanicum(在葡萄牙东北的达拉斯奥斯蒙达斯区和西班牙加利西亚的蛇纹石土壤);Centaureathracica和Violavourinensis(希腊的蛇形土壤上的植物);Eichhorniacrassipes(水葫芦,原产南美洲,在南亚地区大量存在);Hybanthusfloribundus(在西澳大利亚东部金矿区);Stackhousiatryonii(在澳大利亚的昆士兰中部,超镁铁质土壤);A.murale(原产于地中海地区土壤蛇纹石土壤)等。2014年,又有Rubiaceae科Timonius属中的9种新发现的镍超富集植物作为植物采镍的目标植物[50]。
A.murale被选为植物采镍所用的实验室和中试实验的镍超富集植物,因为与报道出的其它镍超富集植物相比,其更容易生长并具有更多的生物量。从植物个体生长状况来看,A.murale的平均高度是83~85 cm,最高高度为98~99 cm,部分低枝叶为70~73 cm。一棵单一植物的干质量可达1.1 kg。它很容易从种子进行繁殖,并在干燥和充足太阳光下生长良好[51]。
此外,不同气候(温度和降水)和土壤条件(pH值,有机质含量,钙镁含量比,可利用的N、P、K等)下种植植物,种植密度、收割时间及收获方法等均被作为研究以提高镍的积累[51]。
当然,关于植物采镍农艺学的研究还有很多工作需要进一步开展。例如进一步提高超富集植物的繁殖能力,提高生物量,提高镍富集量,合理的管理规范等等。
1.4 从镍超富集植物中回收镍
1.4.1 从镍超富集植物中生产纯镍 生物质焚烧后,通过冶炼可从富含镍的生物矿砂中生产纯镍。2007年,当镍的价格为MYM 40 /kg时,Chaney等[52]计算得出每年每公顷种植镍超富集植物获得的利润可达MYM 16 000。Barbaroux等[53]利用0.5 mol/L H2SO4溶液直接从A.murale的花和种子中化学酸浸获得w(Ni)=76.2%的硫酸镍溶液,而后通过电化学沉积从硫酸镍溶液中获得纯镍的过程如图2。

图2 电沉积镍的示意图Fig.2 The scheme of electroplating of Ni
但是,这种生产纯镍的方法未被继续使用,究其原因是镍的回收率较低。同时,由于镍在植物灰分中的质量分数是在植物体内的10~20倍,因此很多学者支持从镍超富集植物灰分中回收镍[54]。此外,市场上大多数镍产品是通过纯镍与硫酸反应获得硫酸镍溶液后生产的,这意味着让镍超富集植物的灰分与硫酸直接反应获得硫酸镍溶液的研究变得更有意义。
1.4.2 从镍超富集植物中制备路易斯酸催化剂 从新喀里多尼亚收获的镍超富集植物(P.douarrei和G.pruinosa)中通过酸浸获得Ni2+后,研究表明该Ni2+可制作为路易斯酸催化剂应用在有机化学合成中[3,55]。反应如图3,但该催化剂的纯度、热稳定性、活性、反应机理、应用范围及可回收性等性质仍需深入研究。
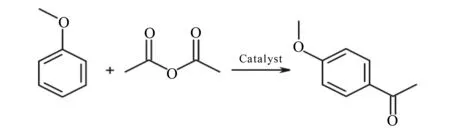
图3 从镍富集植物中制得的催化剂应用的有机反应Fig.3 Organic reaction studied with the catalyst derived from Ni-Hyperaccumulating plants
1.4.3 从镍超富集植物中生产镍盐 湿法冶金从A.murale灰分中制备六水硫酸镍铵(Ammonium Nickel Sulfate Hexahydrate, ANSH)的工艺已获专利[56]。该工艺步骤主要包括:① 生物质的燃烧、洗涤和酸浸;② ANSH结晶;③ANSH的纯化。但此工艺制备的ANSH纯度仅有88.8%。为节约能源及降低生产成本,减少工艺流程中废水、固废的产生和提高ANSH的纯度,Zhang等[5]对该生产工艺进行了优化(图4),ANSH纯度可高达99.1%,目前优化后的工艺已经完成中试实验。
1.4.4 水热法从镍超富集植物中提取镍 2001年,Le Clercq等[57]研究了利用水热法从镍超富集植物中直接提取镍。该方法工艺简单,使用去离子水在200~375 ℃,25 MPa下处理镍超富集植物B.coddii,有效的回收了镍并获取了生物质燃料。随后,实验证明Yang等[58-59]也成功利用此方法从超富集植物东南景天和伴矿景天中去除了重金属Zn、Pb和Cu,并获得了生物原油。但此方法对设备和控制条件要求高,其技术尚未成熟。本文作者所在课题组目前正在研究于常压下直接水热处理、或微波、超声水热法处理镍超富集植物以获得不同的镍产品。
1.4.5 从镍超富集植物中制备镍纳米材料 文献调研发现Qu等[60-61]从Zn富集植物灯笼草中成功制取出高纯度氧化锌纳米颗粒及从Cu富集植物印度芥菜中制备出Cu0.05Zn0.95O纳米颗粒和碳纳米管。此方法为从镍超富集植物中制备镍纳米材料提供了新思路。但该方法其制备纳米材料过程需从植物中提取叶绿酸C32H30ON4H2(CO2H)2,后续又经过7个不同温度不同反应时间的步骤制备出纳米材料,流程繁杂且反应时间较长,因此从镍超富集植物中绿色合成镍纳米材料过程中可进一步简约其制备流程,从而减少产品生产成本,提高经济效益。
2 植物采镍的可行性
截止日前,国外对镍富集植物的种植技术已相当成熟。例如,在加利福尼亚农业种植条件下,镍富集植物Streptanthuspolygaloides的产量已达w(Ni) 100 kg·hm-2,意大利的A.bertolonii产量为w(Ni) 72 kg·hm-2,南非的B.coddii产量w(Ni)为100 kg·hm-2,以及阿尔巴利亚农业种植条件下,镍超富集植物A.murale的产量可达w(Ni)105 kg·hm-2,其w(Ni)在植物干质量中可达3.4%,在焚烧后的植物灰分中可达20%。依据以上镍超富集植物的产量和2015年镍的价格为 USMYM 15 kg-1,得出利用植物采矿获取镍的经济效益大于USMYM 1 000 hm-2[7]。

图4 从A. Murale灰分中制备ANSH的新工艺[5]Fig.4 The new flow sheet of the process to produce ANSH salt from ashes of A. Murale[5]
当然,已有一些研究表明植物采镍正处于商业化的进展中[7,9,52]。美国农业部的Chaney教授是国际上最早开始研究超富集植物并将其投入商业利用的科学家之一。他领导的研究组在美国Oregon进行了大量的植物采矿实验,选择了来自同纬度欧洲地区的Alyssum、Leptoplax、Bornmuellera等镍超富集植物进行优选优育,最后选择了具有高效提取效率的A.murale和A.corsicum,并申请了植物采镍的国际专利。20世纪90年代中期在美国开展的镍污染土壤植物采矿实践,估算出植物采矿带来的经济效益可达MYM 513 hm-2[62]。
近年来,植物修复领域另外一位奠基人Alan Baker教授等将研究工作拓展到印尼、马来西亚、新喀里多尼亚等地。同时,法国洛林大学的Jean-Louis Morel团队也在阿尔巴尼亚、法国等地中海气候区开展植物采矿的实验。通过长达5年的田间大规模实验,发现A.murale的富集能力最强,其叶片能够富集w=2%的镍,并探讨了农艺管理措施优化以及最佳收获时期等,其镍的植物提取量可达到105 kg·hm-2(MYM 1 000 hm-2)[48-49,51]。由于蛇纹岩土壤相对贫瘠,种植普通农作物的收获量很低,因此植物采矿具有较高的经济可行性。
2012年起,中山大学仇荣亮教授课题组与法国Jean-Louis Morel教授团队合作,在云南和广东成功地开展了镍污染土壤的植物修复和植物采矿野外实践,发现A.murale品系在中国有良好的适应性,同时可通过植物-微生物联合修复明显提高生物量和提取效率。
当然,植物采镍的经济效益也取决于从镍富集植物中制备何种镍产品、其生产工艺成本和镍的价格。特别要注意镍的价格变化幅度很大(如图5),但如果条件允许的情况下,镍产品也可经过储存到镍价格较高时再出售。
综上所述,利用镍超富集植物进行植物采镍是可行的。不仅如此,2015年从植物采矿引申而提出的农业采矿[7](Agromining:farming for metals in the future)也已被超富集植物研究领域的专家认可,因此利用植物采镍的绿色冶镍研究具有广泛的工业化应用前景。

图5 2007-2016年伦敦金属交易所的镍市场价格Fig.5 Nickel market price value at the London Metal Exchange from 2007 to 2016
3 待解决问题
虽然利用镍超富集植物进行植物采矿是可行的,但整体而言,目前世界范围在镍污染土壤上进行植物采矿尚待解决3个关键过程:
1)深入的镍超富集植物对镍的吸收转运机理研究
当前学术界对镍超富集植物的根部吸收与转运机理尚缺乏系统深入的了解。中山大学仇荣亮教授课题组近期采用地球化学研究领域中的稳定同位素分馏技术,发现介质-植物体系中镍/锌同位素组成的微小变化,能够指示介质中镍/锌的生物可利用性以及植物对镍/锌的吸收途径,而镍很有可能通过锌的低亲和力转运通道进入超富集植物体内[63-64],但超富集植物体内是否确实不存在镍的专性吸收通道与转运载体尚需进一步证实。
2)进一步对镍超富集植物种植的农艺实践探索
创造植物采镍经济价值并且高效修复镍污染土壤的关键因素是提高镍超富集植物的生物量。一旦提高镍超富集植物的生物质产量,每季度从土壤中吸收及转运到植物地上部分的镍将大大提升。目前,植物基因型、土壤类型、气候带等因子研究超富集植物和富镍土壤中微生物之间的相互选择机制,考察不同因子(如植物基因型、土壤类型、气候带等)对镍超富集植物根际及内生微生物群落结构及功能的影响,重点关注能够促进超富集植物生长、提高镍富集量及提高植物抗性微生物功能群的定殖机制及其影响因子都将是以后研究的重点,这方面的研究将为植物采镍实践过程中如何提高植物活性、生物量及镍富集量提供重要的理论指导。
3)高附加值的镍超富集植物生物质的资源化过程
目前的超富集植物湿法冶金工艺产品制备流程复杂,分离步骤过多的问题。探讨利用镍富集植物制备镍化合物的不同合成方法,同时研究生物质共存金属和有机组分对合成镍材料结构和性能的影响,有助于实现高附加值的镍超富集植物金属资源化。
4 结论与展望
基于我国镍污染土壤面积不断扩大,利用植物修复技术产生的大量镍超富集植物急需资源化处理问题,本文提出植物采矿绿色冶镍可将植物中的镍提纯为有用的工业原料,既可产生良好的经济效益,也符合我国的国情,有很强的可操作性。
在利用镍超富集植物绿色治理国内土壤镍污染的同时,安全无害化和资源化地处理镍超富集植物生物质需要进一步深入研究。这些研究将大力推动植物修复技术的工程化应用,为国内如何处理大批重金属超富集植物生物质提供理论依据,同时也将缓解我国镍等金属资源紧缺的重要问题。
[1] 曾祥婷,许虹,田尤,等.中国镍资源产业现状及可持续发展策略[J].资源与产业,2015,17(4):94-99.
ZENG Xiangting, XU Hong, TIAN You, et al. Situation and sustainable development strategy of China’s nickel resources industry[J]. Resources Industries, 2015,17(4):94-99.
[2] Trends in the Mining and Metals Industry. Mining’s contribution to sustainable development[C]. International Council on Mining and Metals (ICMM), London, United Kingdom, 2012:16.
[3] LOSFELD G, ESCANDE V, JAFFRÉ T, et al. The chemical exploitation of nickel phytoextraction: An environmental, ecologic and economic opportunity for New Caledonia[J]. Chemosphere, 2012, 89(7):907-910.
[4] ENT A V D, BAKER A J M, BALGOOY M M J V. et al.Ultramafic Ni laterites in Indonesia (Sulawesi, Halmahera): Mining, nickel hyperaccumulators and opportunities for phytomining[J]. Journal of Geochemical Exploration, 2013, 128:72-79.
[5] ZHANG X, LAUBIE B, HOUZELOT V, et al. Increasing purity of ammonium nickel sulfate hexahydrate and production sustainability in a nickel phytomining process[J]. Chemical Engineering Research Design, 2016, 106:26-32.
[6] BROOKS R R, CHAMBERS M F, NICKS L J, et al. Phytomining[J]. Trends Plant Science, 1998, 3: 359-362.
[7] ENT A V D, BAKER A J M, REEVES R, et al. Agromining: farming for metals in the future? [J]. Environment Science and technology, 2015, 49 (8):4773-4780.
[8] ROBINSON B H, BROOKS R R, HOWES A W,et al. The potential of the high-biomass nickel hyperaccumulatorBerkheyacoddiifor phytoremediation and phytomining[J]. Journal of Geochemical Exploration, 1997, 60: 115-126.
[9] HARRIS A T, NAIDOO K, NOKES J, et al. Indicative assessment of the feasibility of Ni and Au phytomining in Australia[J]. Journal of Cleaner Production, 2009, 17: 194-200.
[10] ANDERSON C W N, BROOKS R R, CHIARUCCI A, et al. Phytomining for nickel, thallium and gold[J]. Journal of Geochemical Exploration, 1999, 67: 407-415.
[11] SHEORAN V, SHEORAN A, POONIA P. Phytomining of gold: A review[J]. Journal of Geochemical Exploration, 2013, 128: 42-50.
[12] RAJAKARUNA N, BOHM B A. Serpentine and its vegetation: A preliminary study from Sri Lanka[J]. Journal of Applied Botany and Food Quality-Angewandte Botanik, 2002, 76: 20-28.
[13] SHALLARI S, SCHWARTZ C, HASKO A, et al. Heavy metals in soils and plants of serpentine and industrial sites of Albania[J]. Science total environment, 1998,209: 133-142.
[14] ALVES S, TRANCOSO M A, GONCALVES M D S, et al. A nickel availability study in serpentinised areas of Portugal[J]. Geoderma, 2011,164: 155-163.
[15] CHENG C H, JIEN S H, IIZUKA Y, et al. Pedogenic chromium and nickel partitioning in serpentine soils along a toposequence[J]. Soil Science Society of America Journal, 2011,75: 659-668.
[16] 方晓航, 仇荣亮, 汤叶涛, 等. 云南蛇纹岩发育土壤与植被中重金属含量的分析[J]. 应用与环境生物学报, 2005,11 (4): 431-434.
FANG Xiaohang, QIU Rongliang, TANG Yetao,et al. Analysis of heavy metals contents in Yunnan serpentine soil and plants growing on it[J]. Chinese Journal of Applied and Environmental Biology, 2005,11 (4): 431-434.
[17] 环境保护部和国土资源部.全国土壤污染状况调查公报[EB/OL].中国环境网,2014-04-17.
The Ministry of Environmental Protection and the Ministry of Land and Resources. National soil pollution survey bulletin[EB/OL]. China Environmental Network, 2014-04-17.
[18] QUINIOU T, LAPERCHE V. An assessment of field-portable X-ray fluorescence analysis for nickel and iron in laterite ore (New Caledonia)[J]. Journal of Geochemical Exploration, 2014,14: 245-255.
[19] 蔡立梅,马瑾,周永章,等.珠江三角洲典型区农业土壤镍的空间结构及分布特征[J]. 中山大学学报(自然科学版), 2008, 47(4): 100-104.
CAI Limei, MA Jin, ZHOU Yongzhang, et al. Spatial structure and distribution of Ni contents in agricultural soils in a typical area of the Pearl River Delta[J].Acta Scientiarum Naturalium Universitatis Sunyatseni, 2008, 47(4): 100-104.
[20] WUANA R A, OKIEIMEN F E. Heavy metals in contaminated soils: A Review of sources, chemistry, risks and best available strategies for remediation[J]. ISRN Ecology, 2011, 2011: 2090-4614.
[21] CEMPEL M, NIKEL G. Nickel: A review of its sources and environmental toxicology[J]. Polish Journal of Environmental Studies, 2006, 15: 375-382.
[22] BANI A, ECHEVARRIA G, MONTARGES-PELLETIER E, et al. Pedogenesis and nickel biogeochemistry in a typical Albanian ultramafic toposequence[J]. Environmental Monitoring and Assessment, 2014 ,186 (7): 4431 - 4442
[23] MARWA E M M, MEHARG A A, RICE C M. Risk assessment of potentially toxic elements in agricultural soils and maize tissues from selected districts in Tanzania[J]. Science Total Environment 2012, 416: 180-6.
[24] JENSEN P, JOHANSEN J D, ZACHARIAE C, et al. Excessive nickel release from mobile phonesua persistent cause of nickel allergy and dermatitis[J]. Contact Dermatitis, 2011, 65: 354-358.
[25] THYSSEN J P, MENNE T, LIDEN C, et al. Excessive nickel release from earrings purchased from independent shops and street markets-a field study from Warsaw and London[J]. Journal of the European Academy of Dermatology and Venereology, 2011, 25: 1021-1026.
[26] QIU R L, LUI F J, WAN Y B, et al. Phytoremediation on nickel-contaminated soils by hyperaccumulatorsAlyssumcorsicumandAlyssummurale[J]. China Environ Sci,2008,28 (11):1026- 1031.
[27] SARMA H. Metal hyperaccumulation in plants: A review focusing on phytoremediation technology[J]. Journal Environment Science Technology, 2011, 4: 118-138.
[28] SHEORAN V, SHEORAN A S, POONIA P. Role of hyperaccumulators in phytoextraction of metals from contaminated mining sites: A review[J]. Critical Review Environment Science Technology, 2011, 41: 168-214.
[29] PUSCHENREITER M, SCHNEPF A, MILLN I M, et al. Changes of Ni biogeochemistry in the rhizosphere of the hyperaccumulatorThlaspigoesingense. Plant and Soil, 2005, 271 (1): 205-218.
[30] TAYLOR S I, MACNAIR M R. Within and between population variation for zinc and nickel accumulation in two species ofThlaspi(Brassicaceae)[J]. New Phytologist, 2006, 169 (3): 505-514.
[32] HALIMAA P, LIN Y F, AHONEN V H, et al. Gene expression differences betweenNoccaeacaerulescensecotypes help to identify candidate genes for metal phytoremediation[J]. Environment Science and Technology, 2014, 48 (6): 3344-3353.
[33] NISHIDA S, TSUZUKI C, KATO A, et al, the primary iron uptake transporter in the root, mediates excess nickel accumulation inArabidopsisthaliana[J]. Plant and Cell Physiology, 2011, 52 (8): 1433-1442.
[34] NISHIDA S, AISU A, MIZUNO T. Induction of IRT1 by the nickel-induced iron-deficient response inArabidopsis[J]. Plant Signaling and Behavior, 2012, 7 (3): 329-331.
[35] SCHAAF G, HONSBEIN A, MEDA A R, et al. AtIREG2 encodes a tonoplast transport protein involved in iron-dependent nickel detoxification inArabidopsisthalianaroots[J]. Journal of Biological Chemistry, 2006, 281 (35): 25532-25540.
[36] GENDRE D, CZERNIC P, CONEJERO G, et al. A member of the YSL gene family from the hyper-accumulatorThlaspicaerulescens, encodes a nicotianamine-Ni/Fe transporter[J]. Plant Journal, 2007, 49 (1): 1-15.
[37] KEELING S M, STEWART R B, ANDERSON C W, et al. Nickel and cobalt phytoextraction by the hyperaccumulatorBerkheyacoddii: implications for polymetallic phytomining and phytoremediation[J]. Internation journal of Phytoremediation, 2003, 5 (3): 235-244.
[38] RICHAU K H, KOZHEVNIKOVA A D, SEREGIN I V, et al. Chelation by histidine inhibits the vacuolar sequestration of nickel in roots of the hyperaccumulatorThlaspicaerulescens[J]. New Phytologist, 2009, 183 (1): 106-116.
[39] KOZHEVNIKOVA A D, SEREGIN I V, VERWEIJ R, et al. Histidine promotes the loading of nickel and zinc, but not of cadmium, into the xylem inNoccaeacaerulescens[J]. Plant Signaling and Behavior, 2014, 9 (9):e29580-29584.
[40] KRAMER U, COTTER-HOWELLS J D, CHARNOCK J M, et al. Free histidine as a metal chelator in plants that accumulate nickel[J]. Nature, 1996, 379(6566): 635-638.
[41] CORNU J Y, DEINLEIN U, H?RETH S, et al. Contrasting effects of nicotianamine synthase knockdown on zinc and nickel tolerance and accumulation in the zinc/cadmium hyperaccumulatorArabidopsishalleri[J]. New Phytologist, 2014, 206: 738-750.
[42] CENTOFANTI T, SIEBECKER M, CHANEY R L, et al. Hyperaccumulation of nickel byAlyssumcorsicumis related to solubility of Ni mineral species[J]. Plant and Soil, 2012, 359: 1-13.
[43] ALVES S, NABAIS C, SIMES GONÇALVES M D L, et al. Nickel speciation in the xylem sap of the hyperaccumulatorAlyssumserpyllifoliumssp. lusitanicum growing on serpentine soils of northeast Portugal[J]. Journal of Plant Physiology, 2011,168 (15): 1715-1722.
[44] VAN D E A, MULLIGAN D. Multi-element concentrations in plant parts and fluids of Malaysian nickel hyperaccumulator plants and some economic and ecological considerations. Journal of Chemical Ecology, 2015, 41 (5): 396-408.
[45] DENG T H B,TANG Y T, VAN D E A,et al. 2016. Nickel translocation via the phloem in the hyperaccumulatorNoccaeacaerulescens(Brassicaceae) [J]. Plant and Soil, 2016, 404(1):1-11.
[46] 徐在超, 史亚楠, 张仁铎, 等,三株具重金属抗性油菜内生真菌对镉铅锌富集特性研究[J]. 中山大学学报(自然科学版), 2016, 55(6): 153-160.
XU Zaichao, SHI Yanan, ZHANG Renduo,et al. Bioaccumulation of Cd, Zn and Pb by three heavy metal-resistant endophytic fungi isolated from rapes[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2016, 55(6): 153-160.
[47] 王凤珠, 陈琴芳, 俞陆军, 等. 利用植物来源铅结合蛋白进行植物修复的研究进展[J]. 中山大学学报(自然科学版), 2015, 54(3): 102-106.
WANG Fengzhu, CHEN Qinfang, YU Lujun, et al. Potential of plant-derived lead-binding proteins in phytoremediation[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2015, 54(3): 102-106.
[48] BANI A, ECHEVARRIA G, SULCEA S, et al. Improving the agronomy ofAlyssummuralefor extensive phytomining: A five-year field study[J]. International Journal of Phytoremediationtion, 2015,15(2):117-127.
[49] ZHANG X, HOUZELOT V, BANI A, et al. Selection and combustion of Ni-hyperaccumulators for the phytomining process[J]. International Journal of Phytoremediation, 2014, 16: 1058-1072.
[50] CHEN J, WONG K M, VAN D E A, et al. Nine new species ofTimonius(Rubiaceae) from Kinabalu Park[J]. Borneo Phytotaxa, 2014, 181(3):138-150.
[51] BANI A, ECHEVARRIA G, ZHANG X, et al. The effect of plant density in nickel-phytomining field experiments withAlyssummuralein Albania[J]. Australian Journal of Botany, 2015, 63(1/2):72-77.
[52] CHANEY R L, ANGLE J S, BROADHURST C L, et al. Improved understanding of hyperaccumulation yields commercial phytoextraction and phytomining technologies[J]. Journal of Environmental Quality, 2007 , 36 (5): 1429 -1443
[53] BARBAROUX R, MERCIER G, BLAIS J F, et al. A new method for obtaining nickel metal from the hyperaccumulator plantAlyssummurale[J]. Separation and Purification Technology, 2011:83: 57-65.
[54] BARBAROUX R, PLASARI E, MERCIER G, et al. A new process for nickel ammonium disulfate production from ash of the hyperaccumulating plantAlyssummurale[J]. Science Total Environment, 2012, 423:111-119.
[55] LOSFELD G, ESCANDE V, BLACHE P V D L, et al. Design and performance of supported Lewis acid catalysts derived from metal contaminated biomass for Friedel-Crafts alkylation and acylation[J]. Catalysis Today, 2012, 189: 111-116.
[56] MERCIER G, BARBAROUX R, PLASARI E, et al. Production of a crystallized nickel salt from hyperaccumultor plants[P]. Canada, 2012.
[57] le CLERCQ M, ADSCHIRI T, ARAI K. Hydrothermal processing of nickel containing biomining or bioremediation biomass[J]. Biomass Bioenergy, 2001,21: 73-80.
[58] YANG Jianguang. Heavy metal removal and crude bio-oil upgrading from Sedum plumbizincicola harvest using hydrothermal upgrading process[J]. Bioresource Technology, 2010, 101: 7653-7657.
[59] YANG Jianguang, YANG Jianying, PENG Changhong, et al. Recovery of zinc from hyperaccumulator plants: Sedum plumbizincicola[J]. Environment Technology, 2009, 30: 693-700.
[60] QU Jiao, LUO Chunqiu, CONG Qiao, et al. Carbon nanotubes and Cu-Zn nanoparticles synthesis using hyperaccumulator plant[J]. Environment chemical letter, 2012, 10(2):153-158.
[61] QU Jiao, LUO Chunqiu, CONG Qiao, et al. A new insight into the recycling of hyperaccumulator: Synthesis of the mixed Cu and Zn oxide nanoparticles usingBrassicajunceaL[J]. International Journal Phytoremediation, 2012, 14(9):854-860.
[62] NICKS L J, CHAMBERS M F. A pioneering study of the potential of phytomining for Ni[C]// BROOKS R R, ed. Plants that hyperaccumulate heavy metals. Wallingford, Oxon, UK:CAB International, 1998:313-325.
[63] DENG T H B, COQUET C, TANG Y T,et al. Nickel and zinc isotope fractionation in hyperaccumulating and nonaccumulating plants[J]. Environmental Science and Technology, 2014, 48 (20): 11926-11933.
[64] TANG Y T, CLOQUET C, STERCKEMAN T,et al. Fractionation of stable zinc isotopes in the field-grown zinc hyperaccumulatorNoccaeacaerulescensand the zinc-tolerant plantSilenevulgaris[J]. Environmental Science and Technology, 2012, 46 (18): 9972-9979.
Researchprogressofgreenmetallurgicalnickelbasedonphytomining
ZHANGXin1,2,3,LVXiangying1,LIUWenshen3,LIUChang3,YUANMing3,QIURongliang3
(1.School of Environment, Henan Key Laboratory for Environmental Pollution Control, Key Laboratory for Yellow River and Huai River Water Environment and Pollution Control, Ministry of Education, Henan Normal University, Xinxiang 453007, China;2. Collaborative Innovation Center of Environmental Pollution Control and Ecological Restoration, Zhengzhou 450000, China;3.School of Environmental Science and Engineering, Sun Yat-sen University, Guangzhou 510275, China)
Based on the concept of phytomining, the nickel hyperaccumulator could be employed to absorb nickel from the low grade laterite nickel ore or nickel-polluted soil and transport nickel to the aerial parts of the plant, and the harvested nickel hyperaccumulators are considered as secondary nickel-rich resources. Then nickel-rich bio-ore with nickel concentration roughly 20% can be obtained via incineration. By reviewing the mechanism of nickel-rich hyperaccumulators to transport nickel transport, the agronomic control of planting nickel-rich hyperaccumulators, and the existing methods of producing pure nickel, lewis acid catalyst , nickel sulfate hexahydrate and nickel nano-materials from harvested nickel hyperaccumulators or nickel-rich bio-ore, this paper proposes the prospects of the possible “Green Metallurgical Nickel” research trend. It is expected to use nickel hyperaccumulator to repair nickel environmental pollution, to reduce nickel hazards to humans and other organisms and develop a new type of “green nickel-smelting” technologies to alleviate the shortage of Chinese nickel resources.
nickel; hyperaccumulator; phytomining; bio-ore; green metallurgy
X756
A
0529-6579(2017)05-0020-10
10.13471/j.cnki.acta.snus.2017.05.003
2016-11-14
国家自然科学基金(51604099);河南省高等学校重点科研项目(17A610007);环境污染治理与生态修复河南省协同创新中心开放性基金(XTCX-023);河南师范大学博士后启动项目(5101219170109)
张鑫(1984年生),女;研究方向环境重金属污染治理、植物修复、植物冶金;E-mail:xinzhang2015@126.com
仇荣亮(1967年生),男;研究方向:重金属污染土壤植物-化学-微生物联合修复等;E-mail:eesqrl@mail.sysu.edu.cn

