地西他滨治疗骨髓增生异常综合征的临床疗效和不良反应观察
吕茹迪,杨艳丽,李佳佳,朱俊锋,张凤
(蚌埠医学院第一附属医院血液内科,安徽 蚌埠 233000)
地西他滨治疗骨髓增生异常综合征的临床疗效和不良反应观察
吕茹迪,杨艳丽,李佳佳,朱俊锋,张凤
(蚌埠医学院第一附属医院血液内科,安徽 蚌埠 233000)
目的 探讨地西他滨(DAC)治疗骨髓增生异常综合征(myelodysplastic syndrome,MDS)的临床疗效及安全性。方法 回顾性分析蚌埠医学院第一附属医院血液科近3年收治的48例中高危MDS患者的临床资料,根据治疗方案的不同,32例用地西他滨单药方案(DAC 25 mg/m2×5 d,28 d为1个疗程),16例用地西他滨联合半量CAG方案(其中DAC 25 mg/m2×3 d),观察其治疗中高危MDS的疗效及安全性。结果总48例中高危MDS患者中,CR 10例,PR 22例,ORR 66.67%,其中地西他滨单药及地西他滨+半量CAG治疗的CR率分别为12.50%和37.50%,差异有统计学意义;ORR分别为62.50%和75.00%,差异无统计学意义。两组治疗后血细胞数目均较前增加,且两组治疗后血细胞数目以血红蛋白增加为著。主要不良反应为骨髓抑制及感染,总48例患者均发生了3~4级骨髓抑制,感染发生率约8.33%。结论 地西他滨单药或联合半量CAG方案治疗中高危MDS患者初步疗效显著,能有效延长患者生存期,较少向白血病转化时间,主要不良反应为骨髓抑制及感染,不良反应可耐受,安全性高,值得在临床进一步推广。
地西他滨;骨髓增生异常综合征;临床疗效;不良反应
1 资料与方法
1.1 临床资料 回顾性分析2014年1月~2017年1月蚌埠医学院第一附属医院血液科收治的经地西他滨治疗的中高危MDS患者48例,所有患者治疗前均经血常规、骨髓细胞学、遗传学、免疫学方法确诊,诊断标准符合参考文献《血液病诊断及疗效标准》[1]。其中男30例,女18例,年龄19~79岁,平均年龄(46.71±8.67)岁,病程0.2~3.6个月,平均(0.9±0.4)个月,按IPSS危险度分层,均为中高危患者,其中中危-1 36例,中危-2 10例,高危2例。据WHO 2008年修订分型[1],MDS-ERAEB-I 24例,MDS-RAEB-II 12例,MDS-RCUD(均为MDSRA)8例,MDS-RCMD 4例,所有48例患者均为初治患者,染色体核型正常者12例,染色体核型异常者36例(其中包括复杂核型18例)。依据IPSS染色体核型分型,48例MDS患者中,分为预后良好MDS 12例,中间型MDS 6例,预后不良型MDS 30例。所有患者均无严重感染及肝肾功能障碍,心电图显示无异常,排除化疗禁忌。
1.2 方法 所有患者治疗前均签署化疗知情同意书。采用随机数字表法将总48例患者分为两种治疗方案组,其中32例用地西他滨单药方案,DAC[齐鲁制药(海南)有限公司,50 mg/支,国药准字H20140051]25 mg/m2,qd,静脉滴注,连用5 d,每次静滴时间>1 h,28 d为1个疗程;16例用地西他滨联合半量CAG方案[DAC(齐鲁制药(海南)有限公司,50 mg/支,国药准字H20140051)25 mg/m2×(d1-d3),静脉滴注,每次静滴时间>1 h;阿糖胞苷(Ara-C)(Actavis Italy S.p.A,100 mg/支,H20100594)10 mg/m2,皮下注射,q 12 h,d4-d10;阿克拉霉素(Acla)(扬州奥赛康药业有限公司,20 mg/瓶,H20060196)10 mg/次,静滴,qd,d4-d7;粒细胞刺激因子(G-CSF)(齐鲁制药有限公司,200 μg/支,S20063065)200μg/(m2·d),静滴,qd,d4-d10,28天为1个疗程],WBC>20×109/L时停用GCSF。治疗的中位疗程数为4(1~19个疗程)。WBC>20×109/L时停用G-CSF。患者均住普通病房,粒缺时住无菌层流病房,每天监测患者体温,定期监测血常规、肝肾功能,并给予保肝、护胃、止吐、营养心肌等常规支持治疗,定期行胸、腹部CT了解有无胸腹感染情况。治疗过程中骨髓抑制期,给予成分血输注,应用G-CSF、IL-11、EPO及TPO刺激造血等支持治疗。中性粒细胞<1.5×109/L时应用G-CSF,Hb<60 g/L或有贫血、乏力等症状时予输注浓缩红细胞,血小板<20×109/L或有明显出血时予血小板输注。治疗过程中出现发热(体温>39.5℃),则经验性给予足量广谱抗生素抗感染及对症支持治疗,并同时行病原体检查,如治疗3~5天体温控制不理想,有真菌感染证据则可联合抗真菌药物,并根据细菌培养及药敏结果及G试验、GM试验、胸部CT结果及时调整敏感抗生素。
1.3 观察指标
1.3.1 治疗疗效 治疗前后血常规、骨髓象,化疗后待血象恢复正常复查骨髓细胞学检查,评估疗效。
1.3.2 不良反应发生情况 治疗期间间隔1日检查血常规,每1周复查肝肾功能、心功能,记录不良反应发生情况,如骨髓抑制、感染、出血等以及胃肠道反应、过敏反应、黏膜炎等。
1.4 疗效及不良反应评价标准 疗效评定标准依据《血液病诊断及疗效标准》[1],MDS疗效分为:完全缓解(CR),临床症状完全消失,血象正常,骨髓增生程度恢复正常或接近正常,原幼细胞<5%。部分缓解(PR),临床症状减轻,血常规部分恢复正常,原幼细胞5%~20%。未缓解(NR),临床症状未减轻或加重,血常规阴性,原幼细胞>20%。总有效率=(CR+PR)/总例数×100%。
不良反应依据WHO化疗药物不良反应分级标准判断。
1.5 生存评价 PFS(无进展生存期)以首次用药至第一次出现疾病进展或死亡的时间,计算治疗后无疾病进展生存时间。OS(总生存期)以首次用药至任何原因死亡的时间。
1.6 随访情况 应用医院登记系统、电话等方式进行随访,随访时间截止至2017年01月,中位随访时间16个月(3~40个月)。
1.7 统计学方法 应用SPSS 21.0进行统计学处理,计量资料采用“±s”表示,组间比较采用t检验,计数资料以率(%)表示,采用χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效总48例患者中,CR10例,PR 22例,NR 16例,CR 21.27%,ORR 65.95%,其中地西他滨单药治疗的32例患者中,CR 4例,PR 16例,NR 12例,完全缓解率12.50%,ORR 62.50%。地西他滨+半量CAG治疗的16例患者中,CR 6例,PR 6例,NR 4例,完全缓解率37.50%,ORR 75.00%。联合治疗组完全缓解率高于地西他滨单药组,且两组治疗后较治疗前血细胞数均升高,差异有统计学意义。两组治疗疗效及治疗前后血细胞情况见表1、表2。
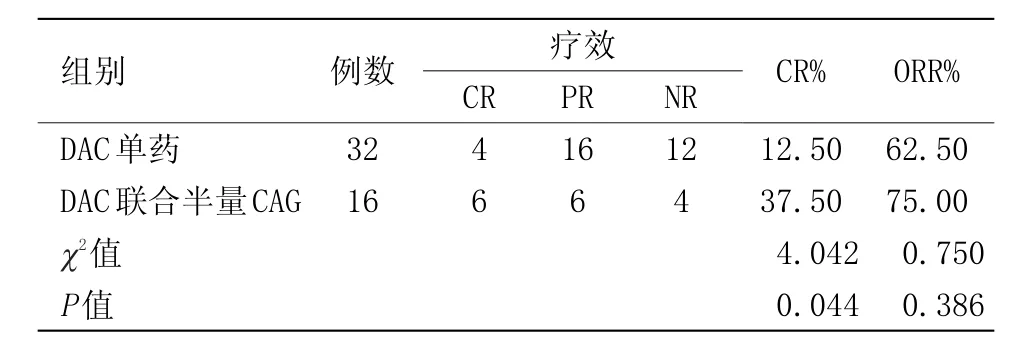
表1 48例MDS患者的疗效观察Table 1 Observation of curative effect on 48 cases of MDS
2.2 毒副反应发生情况
2.2.1 骨髓抑制 总48例患者均发生了3~4级骨髓抑制,其中DAC组IV度骨髓抑制24例,III度骨髓抑制8例,DAC+半量CAG组中16例均为IV度骨髓抑制。粒缺平均持续时间(16.79±1.67)d,血小板小于20×109/L平均持续时间为(14.27±1.38)d,差异具有统计学意义(P<0.05)。
2.2.2 感染及出血 总48例患者中,4例(每种治疗方案组各2例)患者出现感染并发热,其中2例为肺部感染,2例为上呼吸道感染。经抗感染及皮下注射G-CSF治疗后好转。地西他滨组2例出现出血并感染,分别为鼻出血及皮肤黏膜出血,经应用止血药物及输注血小板、造血细胞生长因子应用后出血症状均可控制,地西他滨+半量CAG组无出血患者,两组相比,差异无统计学意义。
2.2.3 其他不良反应 地西他滨组中,患者出现肝脏、肾脏、心肌损害者各2例,地西他滨+半量CAG组中有2例出现肾功能损害,1例患者出现轻度胃肠道反应,给予对症处理后好转。所有患者均未出现药物过敏反应及黏膜炎,无治疗相关死亡患者。两种治疗方案患者毒副反应发生情况及支持治疗见表3。
表2 两种不同治疗方案前后血细胞情况比较(±s)Table 2 Comparison of blood cell status before and after two different treatment regimens(±s)

表2 两种不同治疗方案前后血细胞情况比较(±s)Table 2 Comparison of blood cell status before and after two different treatment regimens(±s)
组别治疗前治疗后t值P值DAC单药(n=32)白细胞(×109/L)2.94±0.22 3.11±0.26 2.824 0.006血红蛋白(g/L)74.86±0.16 85.65±0.57 103.099 0.000血小板(×109/L)69.21±1.13 80.47±3.56 17.054 0.000 DAC联合半量CAG(n=16)白细胞(×109/L)3.34±0.21 4.68±0.13 30.691 0.000血红蛋白(g/L)57.71±0.22 69.85±0.36 162.773 0.000血小板(×109/L)44.85±1.15 46.57±2.18 3.948 0.000
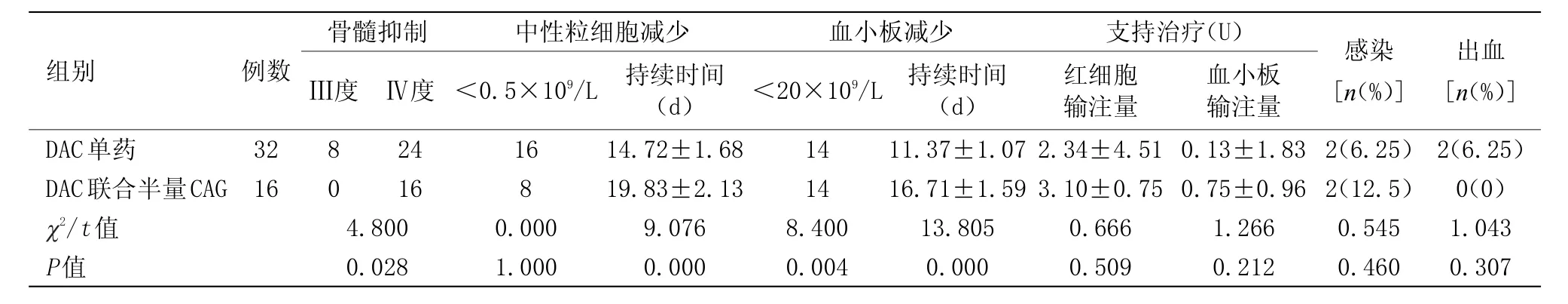
表3 两组治疗过程中毒副作用发生情况(x±s)Table 3 The incidence of side effects of two groups with treatment(x±s)
2.3 生存分析 随访至2017年1月,中位随访时间16个月(3~40个月)。地西他滨单药组平均总生存时间(17.3±9.6)个月,联合治疗组(11.2±6.8)个月。两组平均无进展生存期分别为(9.5±6.7)个月及(5.3±4.2)个月,两组比较,差异均有统计学意义,见表4。
表4 两组治疗后生存相关指标分析(s,个月)Table 4 Analysis of survival-related indicators after treatment in both groups(±s,month)

表4 两组治疗后生存相关指标分析(s,个月)Table 4 Analysis of survival-related indicators after treatment in both groups(±s,month)
无进展生存时间9.5±6.7 5.3±4.2 2.286 0.027组别DAC单药DAC联合半量CAG t值P值例数32 16总体生存时间17.3±9.6 11.2±6.8 2.268 0.028
3 讨论
相关调查显示,约有55%~70%的MDS患者为50岁以上的老年人,很多患者因骨髓衰竭并发症如感染、出血导致死亡,总体预后欠佳[4]。MDS临床表现多样,自然病程和预后差异很大,约20%的MDS患者最终可转为急性髓系白血病(AML),中位生存期仅3个月[5]。目前国内外一致主张对MDS确诊患者进行危险度分层(IPSS/WPSS),并结合年龄、体能状况及MDS分型进行分层治疗。相对低危MDS患者,进展到AML机率较小,主要采用以支持治疗、促造血和免疫抑制剂为主的治疗方案,从而改善生活质量。相对高危MDS患者,尤其是骨髓原始细胞接近白血病的患者,预后较差,易进展为AML,应积极进行化疗或造血干细胞移植,但标准化疗副反应大,骨髓抑制作用严重,老年人难以耐受,而小剂量化疗对中高危MDS患者而言,疗效低,复发率高,唯一能治愈的方法是异基因造血干细胞移植,但对大多数人而言,基于年龄、配型及体能状态、经济条件限制,进行异基因造血干细胞移植亦较困难[6]。
通常,细胞恶性转化早期以DNA甲基化异常为特征,表现为特殊基因的高甲基化以及总体基因组的低甲基化,此异常修饰往往造成抑癌基因失活或其他关键基因突变,进而导致肿瘤的发生[7]。表观遗传学研究发现,与MDS/AML发生、发展密切相关的基因启动子区CpG岛甲基化会抑制部分抑癌基因及DNA修复基因,导致正常细胞生长、分化失去正常调控,形成肿瘤。因此,逆转DNA异常甲基化可能成为血液性肿瘤疾病治疗的新选择。DAC作为特异性的DNA甲基化转移酶抑制剂,具有去甲基化作用,其可通过抑制DNA甲基化转移酶,使抑癌基因恢复正常的去甲基化状态,并诱导肿瘤细胞向正常细胞分化或诱导肿瘤细胞凋亡[8]。与阿糖胞苷一同被第53届美国血液病学会议推荐为中高危MDS患者的一线治疗用药。
中高危MDS患者预后极差,接受最佳支持治疗者中位生存期为8.5个月,中位PFS为3个月。Lubbert[9]等应用低剂量地西他滨和最佳支持治疗对比治疗不能耐受强化疗的高危老年MDS患者,2组总体生存期无显著差别(10.1个月VS 8.5个月,P=0.38),但是地西他滨明显延长了向白血病转变时间,减少了转白率,改善了患者生存质量。Steensma[10]研究表明,MDS患者99例(其中6例死亡),平均年龄72岁,使用DAC 20 mg/m2,连用5天,>1 h/d,4周为1个疗程,CR17%,ORR51.5%,中位生存期19.4个月。82%MDS患者最初出现改善的时间在第二个疗程后,中位时间1.7个月。临床试验表明,DAC治疗高危MDS,ORR为30%~73%,完全缓解率9%~31%。且大量研究证明,地西他滨20 mg/(m2×d)连用5天方案疗效最佳。Klepfish A[11]等研究显示,DAC单药20 mg×(d1~d5)治疗中高危MDS,28天为1个疗程,ORR 26%。谢伟成[12]用DAC治疗高危 MDS患者,发现DAC治疗组总有效率达72.7%,不良反应发生率27.3%,证实DAC治疗MDS的有效性和安全性。目前国内外对地西他滨25 mg/m2,连用5天方案及DAC 25 mg/m2×3 d联合半量CAG方案的研究很少,因此本研究患者应用上述两种方案治疗。接受DAC单药治疗的患者,CR 12.50%,ORR 62.50%,与Lee[13]等研究结果相似。平均无疾病进展生存时间(9.5±6.7)个月,平均总生存时间(17.3±9.6)个月,表明地西他滨可延长向AML转化及生存时间。
然而,DAC抗肿瘤活性具有剂量相差的双重机制,低浓度具有去甲基化作用,高浓度则具有细胞毒作用[14]。中高危MDS患者易转化为AML,故常应用预激方案[15]。目前使用最多的是CAG(阿克拉霉素、阿糖胞苷、G-CSF)预激方案,国内研究多采用DAC联合CAG方案治疗[16]。相关研究显示,CAG方案可提高白血病患者的有效率及缓解率,但对于减少疾病复发,延长患者生存时间上无明显效果[17]。且有关研究证实,DAC与 Ara-C可协同作用于髓系原始细胞,认为DAC联合CAG方案可能比单药治疗疗效确切[18]。标准剂量DAC被推荐与化疗合用于IPSS评分中的中高危、复发难治性MDS以及MDS转化的AML患者[10]。徐瑜[4]等用DAC联合小剂量CAG方案治疗中高危MDS及AML疗效相近,但比国内单用全量HAG或DAC单药在完全缓解率及总有效率方面均有所提高。本研究中,DAC联合半量CAG方案,ORR 75.0%,CR 37.5%,平均无疾病进展生存时间(5.3±4.2)个月,平均总生存时间(11.2±6.8)个月,与地西他滨单药相比,完全缓解率较高,差异有统计学意义。且两种治疗方案总有效率均较高,两组患者治疗后血细胞数目较治疗前均上升明显,且差异显著,说明地西他滨为主的治疗方案治疗中高危MDS疗效确切。其中地西他滨联合半量CAG方案生存时间较地西他滨单药组短,分析其原因,可能与该组中患者肿瘤负荷大,如合并高危染色体核型及白细胞数目较高等不良因素有关。
然而,地西他滨在发挥其临床疗效的同时,仍具有一定的毒副作用,主要表现为骨髓抑制及其引起的感染和出血。中高危MDS患者应用标准剂量DAC 20 mg/(m2×d)×5 d治疗后,III~IV度贫血、中性粒细胞减少、血小板减少发生率分别为51.5%,80.2%,53%。严重感染发生率19.8%,III度出血发生2.66%[11]。本研究中,所有患者均发生III~IV度骨髓抑制,其中IV度骨髓抑制发生率83.33%。地西他滨组96%患者发生IV度骨髓抑制,粒细胞缺乏、血小板下降例数所占比例DAC单药组与联合治疗组相同,粒缺、血小板下降持续时间分别为(14.72±1.58)d和(11.37±1.07)d,这与高苏[19]等应用地西他滨25 mg×5 d方案平均粒缺时间15 d相近,低于联合用药组,但治疗发现,两组红细胞、血小板输注量均较少,比较差异无统计学意义。III~IV度感染发生率8.33%,低于Steensma[10]等报道的11%感染率,严重出血发生率低,分析原因可能与及时地积极对症支持治疗有关。所有患者经积极对症治疗后,如抗感染、输血、刺激造血等治疗后可安全过骨髓抑制期,且心脏、肾脏、胃肠道及过敏等副反应发生率低,不良反应可耐受。说明地西他滨为主的治疗方案可减轻输血依赖及感染、出血风险,最终改善患者生存质量。
综上所述,DAC为主的治疗方案治疗中高危MDS疗效确切,可延长患者生存时间,改善自然病程,有利于提高患者生活质量。且血液学毒性等不良反应可耐受,经对症处理后患者反应良好。但目前关于地西他滨治疗MDS的最佳给药方案尚无统一标准。本研究例数较少,观察时间短,对DAC的合适剂量、给药间隔及用药疗程等尚需扩大样本量进行长时间随访研究,对于地西他滨最佳给药方案仍在进一步探索中,未来MDS治疗前景值得期待。
[1] Greenberg LP. Myelodysplastic syndromes:clinical practice duidelines in oncology[J].J Natl C ompr Canc Netw,2013,11(7):838-874.
[2] Issa JP.The Myelodysplastic syndrome as a prototypical epigenetic disease[J]. blood, 2013,121(19):3811-3817.
[3] Jing Y,Shen X,Mei Q,et al.Spotlight on decitabine for Myelodysplastic syndromes in Chinese patients[J].Onco Targets Ther,2015,8(3):2783-2790.
[4] 徐瑜,沙颖豪,谢彦晖,等.地西他滨联合小剂量化疗治疗老年中高危骨髓增生异常综合征及急性髓系白血病的临床观察[J].老年医学与保健,2013,19(1):31-33.
[5] 范蕊芳,刘相富,方志刚,等.地西他滨治疗骨髓增生异常综合征10例疗效观察[J].新医学,2011(12):786-788.
[6] Blum W.How Much?How Frequent?How Long?A clinical Guide to New Therapies in Myelodysplastic syndromes[J]. Homology Am Soc Hematol Educ Program,2010,2010:314-321.
[7] Mummaneni P,Shord SS.epigenetics and oncology[J].Pharmacotherapy,2014,34(5):495-505.
[8] Hackanson B,Daskalakis M.Recent results in cancer research Fortschritte der Krebsforschung Progres danslesrecherchessurlecancer[J].Decitabine,2014,201:269-297.
[9] Lubbert M, Suciu S, Baila L, et al. Low-dose Decitabineversusbestsupportivecareinerderly patientswithintermediateorhigh-riskmyelodysplastic syndrome(MDS)ineligible for intensive chemotherapy:final results of the randomized phase III study of the European Organisation for Research and Treatment of Cancer Leukemia Group and the German MDS Study Group[J].J Clin Oncol,2011,29(15):1987-1996.
[10]Steensma DP,Bear MR,Slack JL,et al.Multicenter study of decitabine Administered daily for 5 days every4weekstoadultswithmyelodysplastic syndromes:the alternative dosing for outpatient treatment(ADOPT)trial[J].J Clin Oncol,2009,27(23):3842-3848.
[11] K leapfish A, Silbershatz I, Lugassy G, et al.DecitabinetreatmentinMyelodysplasticsyndromesresults of a compassionate patient program in Israel[J].Harefuah,2013,152(10):591-594.
[12]谢伟成,程淑琴,林翠芳,等.地西他滨治疗骨髓增生异常综合征的临床疗效研究[J].临床和实验医学杂志,2014,13(11):877-880.
[13]Lee JH,Jang JH,Park J,et al.A prospective multicenter observational study of decitabine treatment in Korean patients with Myelodysplastic syndrome[J].Haematologica,2011,96(10):1441-1447.
[14]Borthakur G,Ahdab SE,Ravandi F,et al.Activity of decitabine in patients with myelodysplastic syndrome previously treated with azacitidine[J].Leuk Lymphoma,2008,49(4):690-695.
[15]Suzushima H,Wada N,Yamasaki H,et al.Low-dose cytarabine and aclarubicin in combination with granulocyte colony-stimulating factor for elderly patients with previously untreated acute myeloid leukemia[J].Leuk Res,2010,34(5):610-614.
[16]张秀群,邓银芳,张磊,等.地西他滨序贯半量CAG方案治疗高危骨髓增生异常综合征及白血病转化四例[J].白血病.淋巴瘤,2012,21(7):433-435.
[17]Abou Zahr A,Saad Aldin E,Barbarotta L,et al.The clinical use of DNA methyl transferase inhibitors in myslodysplastic syndromes[J].Expert Rev Anticancer Ther,2015,15(9):1019-1036.
[18]Wu DP,Du X,Jin J,et al.Decitabine for treatment of myelodysplastic syndromes in Chinese patients:an Open-label,Phase-3b study[J].Adv Ther,2015,32(11):1140-1159.
[19]高苏,仇惠英,金正明,等.地西他滨单药及联合半程和全程CAG方案治疗骨髓增生异常综合征和急性髓系白血病疗效观察[J].中华血液学杂志,2014,35(11):961-965.
Clinical efficacy and adverse reactions of decitabine in the treatment of myelodysplastic syndrome
Lv Ru-di,Yang Yan-li,Li Jia-jia,Zhu Jun-feng,Zhang Feng
(Department of Hematology,The FirstAffiliated Hospital of Bengbu Medical College,Bengbu,Anhui,233000,China)
Objective To investigate the clinical efficacy and safety of decitabine in the treatment of myelodysplastic syndromes(MDS).Methods The clinical date of 48 cases of medium and high-risk MDS during the past three years in the first affilicated hospital of Bengbu Medical College were analyzed Retrospectively.According to the different treatment options,32 cases with MDS were treated with decitabine monotherapy(25 mg/m2×3 d),during the first day to the fifth day,twenty-eight days a course and 16 patients with MDS were treated with decitabine combined with a half dose of CAG monotherapy.Among which 16 patients,the use of decitabine was 25mg/(m2×3 d),during the first day to the thirth day.To observe the treatment results of patients with medium and high-risk MDS,which including efficacy and safety.Results Of all the patients,ten patients achieved complete remission,twenty-two patients achieved partial remission and the total efficiency rate was 66.67%.The complete remission rate in the group treated with decitabine monoherapy was 12.50%and in the group treated with decitabine combined with half dose CAG regimen was 37.50%,which were statistically significant differences.The ORR in the group treated with decitabine monoherapy was 37.50%while the other group was 75.00%.There were no statistically significant differences between them.The hemogram indexes were all improved after the treatment of decitabine,and the hemoglobin were improved significantly.The major adverse events were myelosuppression and infection.Grade III to IV hematological toxicities were observed in overall 48 cases.Infection occured in 8.33%of treatment courses.Conclusion The treatment of moderate and high-risk MDS with single dose of decitabine or a combined dose of CAG is significant.The utility model can effectively prolong the survival time of the patients and reduce the time for the transformation to the Acute Myeloid Leukemia.The major adverse events were myelosuppression and infection.It is worthy of further promotion in clinic on account of tolerable adverse reactions and high security.
Decitabine;Myelodysplastic syndrome;Clinical effect;Adverse reaction
10.3969/j.issn.1009-4393.2017.31.015
骨髓增生异常综合征(myelodysplastic syndrome,MDS)是一组起源于造血干细胞的恶性克隆性疾病,表现为无效造血、难治性血细胞减少,以髓系细胞发育异常、病态造血、高风险向急性髓系白血病转化为特点,老年人多发,且随年龄增高,年发病率有逐年增加趋势[1]。MDS发病机制尚不完全明确,相关研究表明,DNA甲基化异常是MDS发病原因之一[2]。地西他滨是目前唯一批准用于临床的DNA甲基化转移酶抑制剂,可通过逆转DNA甲基化进程,诱导肿瘤细胞向正常细胞分化或诱导肿瘤细胞凋亡[3]。蚌埠医学院第一附属医院血液科近年来采用地西他滨单药及联合半量CAG方案治疗中高危MDS,并对其近期疗效以及毒性、安全性进行总结,现报道如下。
张凤,E-mail:13855281898@163.com

