人4型腺病毒拷贝数SYBR GreenⅠ实时定量PCR检测方法的建立
张文宁,王芃,周建光,王健,秦崇涛,李宗,李山虎
1.福建中医药大学 药学院,福建 福州 350122;2.军事医学科学院 生物工程研究所,北京100850;3.福建省食品药品认证审评中心,福建 福州 350003
人4型腺病毒拷贝数SYBR GreenⅠ实时定量PCR检测方法的建立
张文宁1,王芃2,周建光2,王健2,秦崇涛1,李宗3,李山虎2
1.福建中医药大学 药学院,福建 福州 350122;2.军事医学科学院 生物工程研究所,北京100850;3.福建省食品药品认证审评中心,福建 福州 350003
目的:建立检测人4型腺病毒拷贝数的荧光定量PCR方法。方法:提取本实验室构建的4型腺病毒全基因组质粒,以梯度稀释质粒为标准模板,选取人4型腺病毒六邻体区域基因设计一对特异性引物,进行SYBR GreenⅠ荧光定量PCR扩增并制作标准曲线。结果:标准曲线为y=-4.284x+53.468,由全基因组质粒所构建的标准曲线线性关系良好,扩增反应Ct值与拷贝数的对数呈线性关系(R2=0.999 609),检出敏感度可达1×102拷贝/μL,且与其他几种腺病毒无交叉反应。用该方法检测4型腺病毒感染细胞2、12和24h后的病毒拷贝数,其病毒拷贝数随时间增加,与细胞病变(CPE)变化保持一致,且荧光定量PCR的测量结果稳定(变异系数<6%)。结论:建立了检测人4型腺病毒基因拷贝数的荧光定量RT-PCR方法,该方法灵敏度高、特异性强。
人4型腺病毒拷贝数;实时荧光定量PCR;标准曲线
人腺病毒(human adenovirus,HAdV)是一种无包膜的DNA双链病毒,最早于1953年从小儿扁桃体中分离得到[1-2],主要在细胞核内繁殖,常引起人上呼吸道和眼部上皮细胞感染。根据其不同的免疫学、生物和生化特性,可分为A~G共7个亚群,国际病毒分类委员会(ICTV)已公布了57种血清型[3]。腺病毒近年来作为肿瘤基因治疗和疫苗载体,有较为广泛的应用[4]。
目前应用最多的腺病毒载体是人血清五型腺病毒(Ad5)载体,它是当前肿瘤和人类免疫缺陷病毒(HIV)疫苗临床研究的主要病毒载体,但人群中普遍存在的Ad5的预存免疫[5]极大地降低了其使用中的效价。4型腺病毒(Ad4)是美军基层官兵训练重症呼吸道疾病的重要病原体之一,鉴于此,1971~1996年,美国国防部联合国家卫生署和Wyeth公司开发了口服Ad4疫苗,经胃肠给药途径可以激发受试者血清抗体,多年接种结果证实该疫苗是安全的,没有观察到病毒间的交叉反应,而且该疫苗项目的接种实施在军队中显著降低了腺病毒的致病和死亡人数。对Ad4的疫苗株和原型株的基因组测序、生物信息学分析和比对已经完成[6-8]。因此,本实验室构建了人Ad4载体,期望发展为一种更有潜质的疫苗载体。
在腺病毒的研发、应用和批量生产过程中,一个十分重要的步骤是测定病毒的滴度。现有测定腺病毒滴度的方法有细胞病变TCID50法[9]、壳蛋白免疫法[10-11]、分光光度计检测法和荧光定量PCR[12]法。其中细胞病变TCID50和腺病毒壳蛋白免疫法均可较为直观地反映腺病毒的感染能力,但缺点是实验周期太长,尤其是细胞病变TCID50法所需时间最长,可达10~14d,且主要依靠观察镜下细胞形态来判定细胞病变,主观因素较大,使得在绝多数情况下实验重复性较差。壳蛋白免疫法虽然在时间上已大大缩短,但仍需要2~3d,虽可严格区分病变与非病变细胞,但对于一些尚无商品化抗体的病毒还须自行制备抗体,且其实验步骤较为繁琐,实验条件相对苛刻,如抗体孵育浓度及时间均需要一定的探索,对实验者本身的实验技巧也有一定要求。分光光度计检测法虽然使用便捷,单次测量耗时短,但由于大多数分光光度计在0.1以下时读数不准确,因此使用前须大批量制备腺病毒并用氯化铯纯化,对病毒浓度要求高,且包含缺陷性颗粒,其数量与病毒载体的结构、病毒扩增的操作过程等诸多因素有关,并无固定比例,导致分光光度计法测得的结果与病毒的实际感染力无明显相关性,不能真实反映腺病毒的实际感染力。荧光定量PCR法所需时间最短,步骤也较为简便,同时重复性也比较良好,适用范围最广。
在本研究中,我们以本课题组构建的包含人Ad4完整基因组的大质粒pMD-AD4为模板,构建了SYBR GreenⅠ荧光定量PCR标准曲线,以此为依据检测了Ad4感染细胞不同时间点的病毒拷贝数变化,为Ad4载体的进一步应用奠定了基础。
1 材料与方法
1.1 材料
人 Ad4(HAdV-4株)购自 ATCC;大肠杆菌DH5α由本实验室保存;pMD-Ad4全基因组序列质粒由本实验室构建并保存;A549细胞购自ATCC,由本实验室冻存;病毒核酸提取试剂盒、Easy dilution buffer由宝生物工程(大连)有限公司生产;Real-time PCR Master Mix由东洋纺(上海)生物科技有限公司生产;质粒小提试剂盒购自爱思进生物技术(杭州)有限公司;Taq酶产自上海申能博彩生物科技有限公司;胎牛血清(FBS)购自浙江天杭科技股份有限公司;DMEM产自Sigma公司;台式高速离心机为Eppendorf公司产品;荧光定量PCR仪为Bio-Rad公司产品;超微量分光光度计为Nano Drop公司产品。
1.2 引物设计与合成
采用Primer Premier 5.0设计PCR引物RTHEXONsense(5'CCACAAGTTGGAAATGACAG3')和RT-HEXONanti(5'GCGAATGAACCATAACAGG3'),由赛百盛公司合成,目的片段为150bp。
1.3 病毒培养与病毒DNA提取
复苏液氮中冻存的A549细胞,待融合度至70%~90%时传代至4个60mm培养皿中,细胞贴壁后弃去含10%FBS的DMEM培养基,用PBS冲洗,换含2%FBS的DMEM培养液继续培养,每皿接种人Ad4病毒原液500μL,感染吸附2h后弃去病毒液,用PBS冲洗未吸附的病毒,换含2%FBS的DMEM培养液继续培养,分别取感染2、12、24h的细胞,-80℃/37℃交替冻融3次收取培养液,将冻融病毒液通过Millipore 0.22μm微孔滤膜过滤器过滤除菌,得到病毒液。冻融前在光学显微镜下观察细胞病变效应(CPE)并拍照。取200μL病毒液,用病毒核酸提取试剂盒提取腺病毒DNA,用作荧光定量PCR反应的检测模板。
1.4 阳性标准品的制备
提取包含人Ad4全基因组的pMD-Ad4质粒作为标准品制备的模板,用微量分光光度计测得质粒浓度,参照下式计算质粒拷贝数[13]:

根据计算结果,将质粒用Easy dilution buffer分别稀释至 1×108、1×107、1×106、1×105、1×104拷贝/μL,作为标准品的扩增模板,-20℃保存备用。
1.5 建立SYBR GreenⅠ荧光定量PCR检测方法
1.5.1 扩增条件 采用Real-time PCR Master Mix试剂盒,用CFX Connect荧光定量PCR仪进行扩增,荧光染料的发光强度在反应过程中自动采集,反应结束后机器自动生成标准曲线。
以pMD-Ad4质粒为模板进行PCR扩增,对PCR反应体系(模板、混合体系、引物和水)、反应条件(变性、退火、延伸的温度及循环次数)进行优化,选取Ct最小值、荧光最高值、溶解曲线显示只有特异峰最佳的PCR反应条件。
1.5.2 标准曲线的建立 1/10梯度稀释pMD-Ad4质粒,获得浓度为 1×108~1×104拷贝/μL 的标准模板,采用优化的条件进行PCR扩增,扩增结果用SPSS22.0中的曲线拟合,以Ct值为纵坐标、起始模板浓度的对数为横坐标,制作标准曲线。
1.5.3 特异性试验 采用已建立的SYBR GreenⅠ方法,分别以 Ad3、Ad7、Ad14及无 RNase的ddH2O为模板进行检测,验证该方法是否具有特异性。
1.5.4 灵敏性试验 以 1×106~1×100拷贝/μL 的系列稀释标准品为模板,同时设置以等量无RNase的ddH2O代替模板的阴性对照进行SYBR GreenⅠ实时荧光定量PCR扩增,每个模板浓度做3个重复。
1.5.5 重复性试验 ①批内重复性试验:分别取等量的 3份不同拷贝(1×106、1×105和 1×104拷贝/μL)的质粒进行荧光定量PCR检测,每份样品做3个重复;②批间重复性试验:取以上3份样品,在同一反应条件下进行3次独立的荧光定量PCR检测。验证该荧光定量PCR方法的重复性及稳定性。
1.5.6 活病毒样本检测 应用本实验建立的人Ad4 SYBR GreenⅠ实时荧光定量PCR,对A549细胞感染后2、12、24h的病毒DNA拷贝数进行检测。
2 结果
2.1 SYBR GreenⅠ实时荧光定量PCR反应条件的确定及标准曲线的建立
通过对SYBR GreenⅠ实时荧光定量PCR反应条件进行优化,建立了最佳反应体系,获得了最佳循环参数:①反应体系:2×混合液10μL,上、下游引物各 500 nmol/L,样本 1μL,去离子水补至总体积为20μL;②反应条件:95℃ 3min预变性;95℃ 5s,55℃ 10s,72℃ 15s,40个循环;95℃ 5s,65℃ 5s,95℃ 15s;③ 熔 解 曲 线 :95℃ 5s,60℃ 1min,95℃,1个循环,退火延伸时检测荧光信号。
如图1,扩增产物的Tm值为81.5~82℃,标准样品均出现了单一波峰,阴性对照未见熔点峰,表明该实验中SYBR GreenⅠ实时荧光定量反应为特异性扩增。
1/10梯度稀释pMD-Ad4质粒标准品的荧光定量曲线见图2,由左至右分别为 1×108、1×107、1×106、1×105、1×104拷贝/μL,最下面一条线是 PCR级水做的阴性对照。1×108~1×104拷贝/μL pMD-Ad4质粒标准品的变化趋势与此相同,只是曲线抬头的位置(Ct值)依浓度降低而依次错后3~4个循环,显示为一组斜率相同、间距相等的平行曲线,说明各反应组的扩增效率相近,且Ct值在不同稀释率组间呈等差递减关系。
为了获得标准曲线,将以1/10梯度稀释的pMD-Ad4质粒为模板的荧光定量PCR反应重复3次,用统计学分析软件,以所得Ct平均值为纵坐标、对应模板拷贝数的对数为横坐标进行曲线拟合,求得回归方程(表1,图3),得出拷贝数的对数值与Ct值间的线性关系表达式为y=-4.284x+53.468,相关系数R2=0.999 609。这说明在标准质粒稀释质量浓度范围内具有非常好的线性关系。
2.2 特异性试验
用建立的SYBR GreenⅠ实时荧光定量PCR方法对 Ad4、Ad7、Ad14及无 RNase的 ddH2O 进行检测,结果均为阴性,而Ad4有良好的扩增(图4),说明其具有较好的特异性。

图1 SYBR GreenⅠ实时荧光定量的熔解曲线
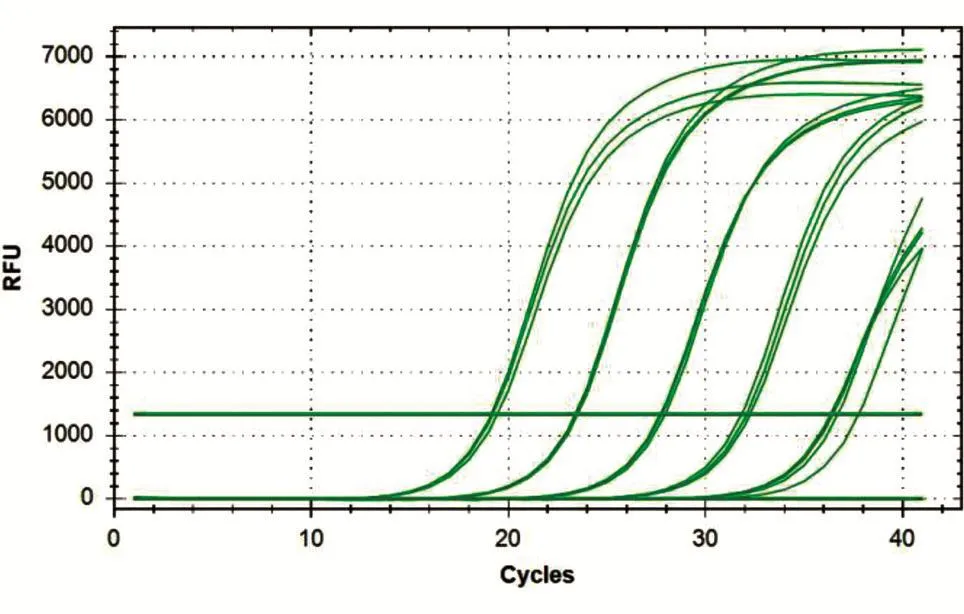
图2 SYBR GreenⅠ实时荧光定量曲线
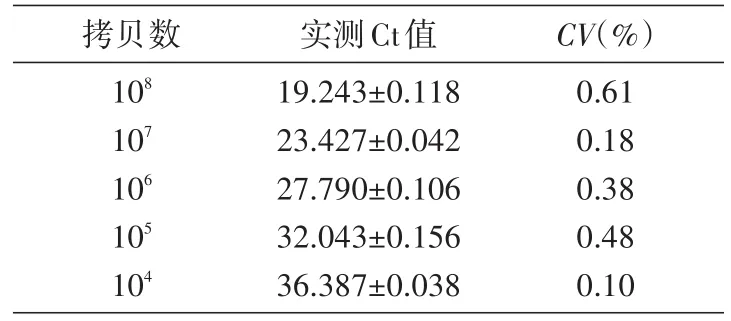
表1 标准样品扩增的Ct值
2.3 灵敏性和重复性检测
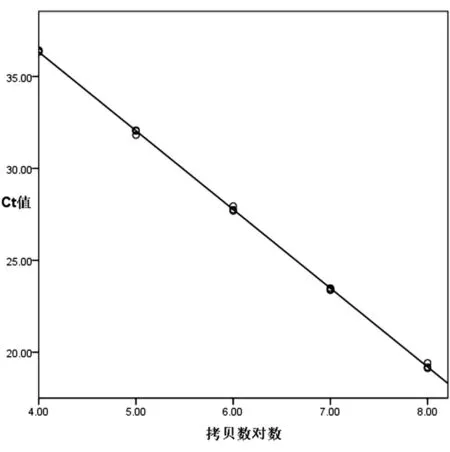
图3 Ct值与拷贝数的对数绘制的标准曲线
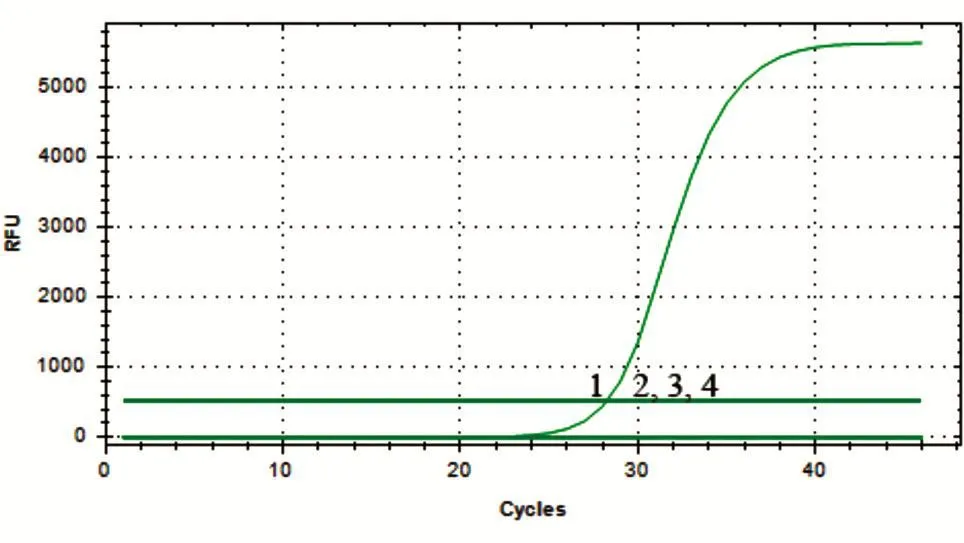
图4 SYBR GreenⅠ实时荧光定量特异性扩增曲线
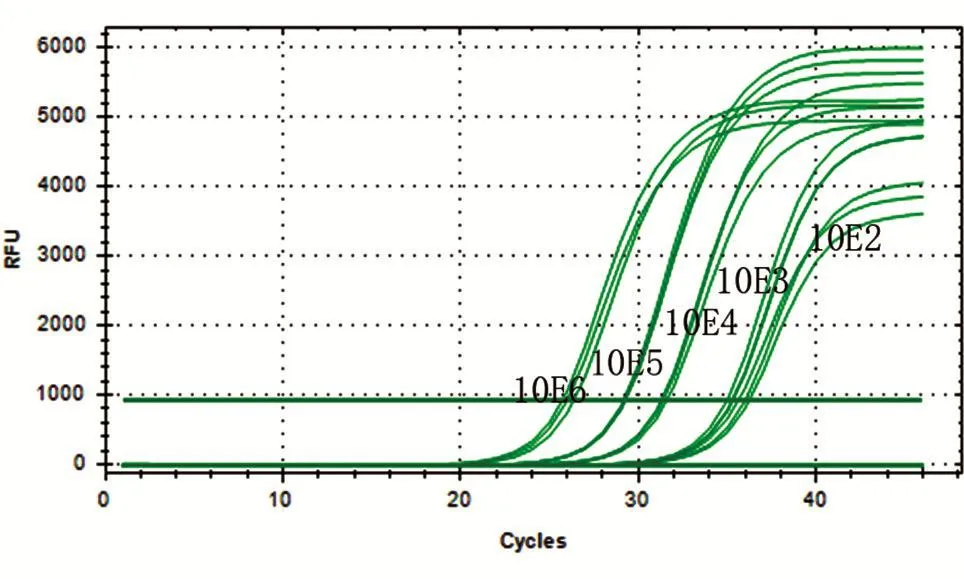
图5 荧光定量PCR的灵敏性测定
将标准阳性质粒做1/10梯度稀释,至无荧光信号出现,以此计算荧光定量PCR仪所能检出的最低模板拷贝数为 102拷贝/μL(图5)。同时,与常规PCR检测结果进行了比较。常规PCR最佳反应条件为95℃ 3min预变性,95℃ 5s,55℃10s,72℃ 15s。常规PCR所能检出的最低模板拷贝数为103拷贝/μL(图6),表明荧光定量PCR灵敏度比常规PCR高10倍左右。
批内和批间重复性试验结果见表2,批内变异系数(CV)为0.43%~0.69%,批间CV为1.21%~2.09%,批内、批间重复性均良好,扩增效率稳定。
2.4 应用Real-time PCR检测Ad4拷贝数
以提取的人Ad4基因组为模板,进行实时荧光定量PCR反应(每个时间点重复测量3次),并由得出的Ct值计算感染后2、12、24h的病毒DNA拷贝数,结果发现其病毒拷贝数随时间增加与CPE变化保持一致,且荧光定量PCR的测量结果稳定(CV<6%)(表3,图7)。
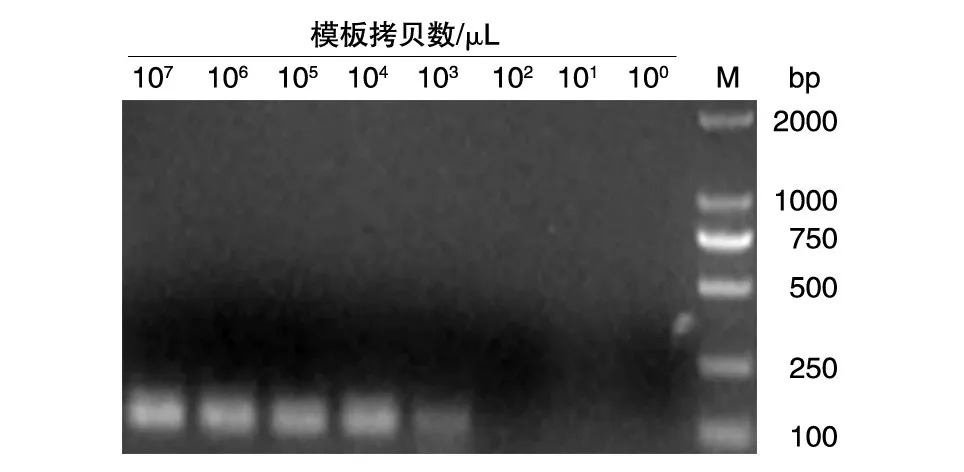
图6 普通PCR的灵敏性测定
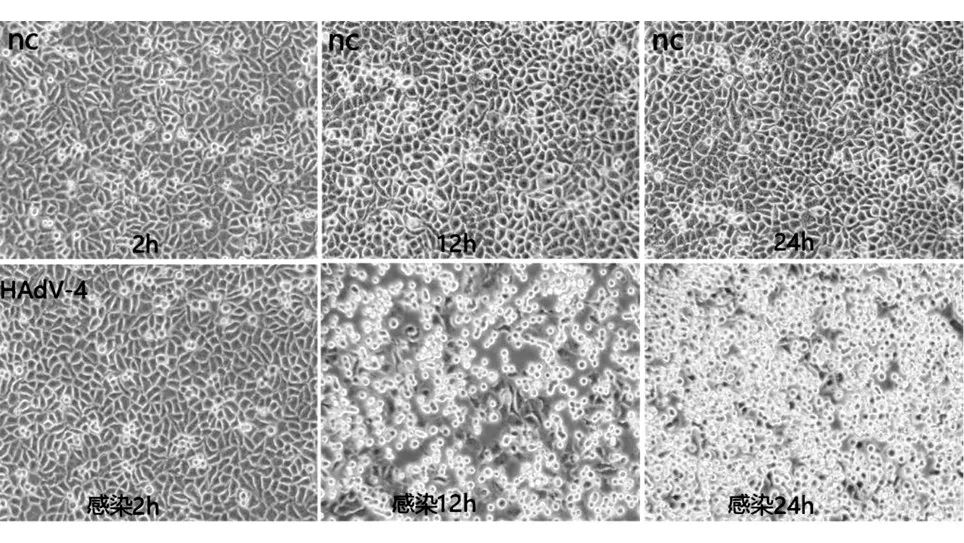
图7 不同时间点镜下细胞CPE状态
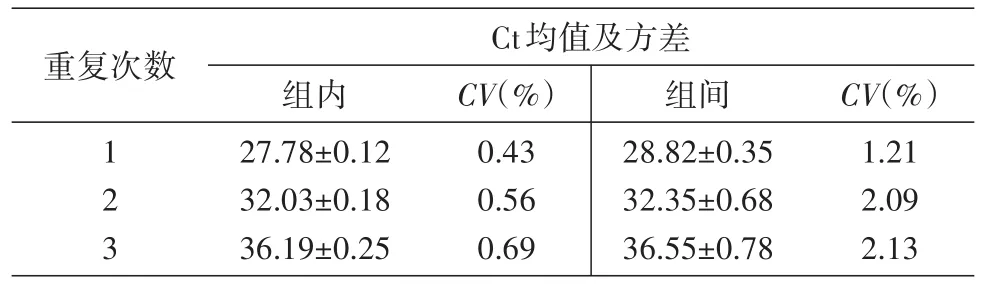
表2 SYBR GreenⅠ实时荧光定量PCR批内与批间重复性试验
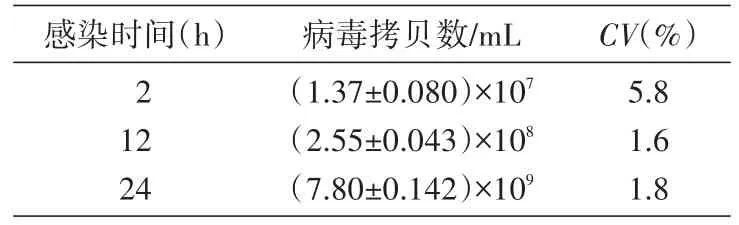
表3 不同时间点对应的细胞内人Ad4拷贝数
3 讨论
构建腺病毒DNA的实时荧光定量PCR标准曲线是建立一个腺病毒基因组拷贝数的对数与Ct值的线性方程关系,依据该标准曲线可以简便准确地获得腺病毒基因组的拷贝数。线性回归方程中的相关系数R2是标准曲线构建是否成功的重要参数,也是衡量质粒各梯度浓度之间扩增效率是否一致的指标,一般认为R2>0.995为相关性较好。本实验构建的标准曲线R2=0.999 609,且小组内变异小于1%(低于一般默认的6%),说明其稳定性好,可用于后续的样品测定。
实时荧光定量PCR对腺病毒基因组模板的制备纯度有一定的要求。在实验中我们尝试了2种提取腺病毒基因组的方法,即腺病毒基因组粗提法和病毒核酸试剂盒法分别提取基因组。粗体法即在病毒液中先直接加入蛋白酶K消化大部分病毒蛋白,再用乙醇沉淀方法获得腺病毒DNA。实验结果显示粗提法制备的病毒DNA用于荧光定量PCR反应的重复性较差,而病毒核酸试剂盒提取法重复性较好。分析原因可能在于粗提法中各类杂质没有去除完全,病毒DNA溶液中残留的杂质干扰了PCR的反应结果。
本实验构建的标准曲线,其引物选取的是人Ad4六邻体区域高变区的片段,所以目前建立的方法只适用于检测人Ad4的基因组拷贝数,不能用于其他型别的腺病毒。后续实验中,我们拟腺病毒六邻体的型别同源区DNA设计PCR引物,从而扩大应用范围,期望建立一种适用于多种型别腺病毒拷贝数测定的荧光定量PCR检测方法。
[1] Hilleman M R,Werner J H.Recovery of new agent from patientswith acute respiratory illness[J].Proc Soc Exp Biol Med,1954,85:183-188.
[2] Rowe W P,Huebner R J,Gilmore L K,et al.Isola⁃tion of a cytopathogenic agent from human adenoids undergoing spontaneous degeneration in tissue culture[J].Proc Soc Exp Biol Med,1953,84(3):570-573.
[3] Fauquet C M,Mayo M A,Maniloff J,et al.Virus tax⁃onomy:8th report of the international committee on taxonomy of viruses[M].Elsevier Academic Press,2005:213-218.
[4] 王芃,周建光.腺病毒疫苗研究进展[J].生物技术通讯,2014,25(2):263-267.
[5] Mast T C,Kierstead L,Gupta S B,et al.Internation⁃al epidemiology of human pre-existing adenovirus(Ad)type-5,type-6,type-26 and type-36 neutralizing anti⁃bodies:correlates of high Ad5 titers and implications for potential HIV vaccine trials[J].Vaccine,2010,28(4):950-957.
[6] Purkayastha A,Su J,Mc Graw J,et al.Genomic and bioinformatics analyses of HAdV-4vac and HAd V-7vac,two human adenovirus(HAdV)strains that consti⁃tuted original prophylaxis against HAd V-related acute respiratory disease,a reemerging epidemic dis⁃ease[J].J Clin Microbiol,2005,43(7):3083-3094.
[7] Purkayastha A,Su J,McGraw J,et al.Genomic and bioinformatics analysis of HAdV-4,a human adenovi⁃rus causing acute respiratory disease:implications for gene therapy and vaccine vector development[J].J Vi⁃rol,2005,79(4):2559-2572.
[8] Purkayastha A,Su J,Carlisle S,et al.Genomic and bioinformatics analysis of HAdV-7,a human denovi⁃rus of species B1 that causes acute respiratory disease:implicationsforvectordevelopmentin human gene therapy[J].Virology,2005,332(1):114-129.
[9] Torres S,Chodosh J,Seto D,et al.The revolution in viralgenomics as exemplified by the bioinformatic analysis of human adenoviruses[J].Viruses,2010,2(7):1367-1381.
[10]Mittereder N,March K L,Trapnell B C.Evaluation of the concentration and bioactivity of adenovirus vec⁃torsforgene therapy[J].JVirol,1996,70(11):7498-7509.
[11]Lybarger L,Dempsey D,Franek K J,et al.Rapid gen⁃eration and flowcytometric analysis of stable GFP-ex⁃pressing cells[J].Cytometry,1996,25(3):211-220.
[12]Ugai H,Yamasaki T,Hirose M,et al.Purification of infectious adenovirus in two hours by ultracentrifuga⁃tion and tangential flow filtration[J].Biochem Biophys Res Commun,2005,331(4):1053-1060.
[13]Roche Molecular Bilchemicals.Absolute quantification with externalstandards[E].TechnicalNote No.LC 112000.
Development of SYBR GreenⅠReal-Time PCR Assay for Human Adenovirus Type 4 Copy Number
ZHANG Wen-Ning1,WANG Peng2,ZHOU Jian-Guang2,WANG Jian2,QIN Chong-Tao1,LI Zong3*,LI Shan-Hu2*
1.College of Pharmacy,Fujian University of Traditional Chinese Medicine,Fuzhou 350122;2.Beijing Institute of Biotechnology,Beijing 100850;3.Fujian Food and Drug Certification Center,Fuzhou 350003;China
*Corresponding authors,LI Zong,E-mail:1730070412@qq.com;LI Shan-Hu,E-mail:lishanhu6@163.com
human adenovirus type 4(HAdV-4)copy number;real time quantitative PCR;standard curve
Q78
A
1009-0002(2017)04-0528-06
2017-04-07
国家科技重大专项(2014ZX09J14105-070)
张文宁(1990- ),男,硕士研究生,(E-mail)384179873@qq.com;王芃(1976- ),女,助理研究员,(E-mail)hellenhello@sina.com;二者为并列第一作者
李宗,(E-mail)1730070412@qq.com;李山虎,(E-mail)lishanhu6@163.com
10.3969/j.issn.1009-0002.2017.04.025
[Abatract]Objective:To develop a method for detecting human adenovirus type 4(HAdV-4) copy number using real time quantitative PCR(RT-PCR).Methods:The HAdV-4 whole genome plasmid was extracted and purified to 10 fold dilution series as the standard templates,primers were designed according to the hexon gene region.Then the standard curve for detecting HAdV-4 copy number was constructed.Results:The standard curve con⁃structed by HAdV-4 whole genome plasmid reflected amplification reaction Ct value in linear with the virus DNA copy number(linearity:R2=0.999 609).This method was used to detect the virus DNA copy number of the cells infected with HAdV-4 at 2,12 and 24 hours of infection,it can be seen that the copy number increased over time,which was in consistent with cytopathic effect(CPE),and finally the stable data were got.Conclusion:Thestandard curve for quantitative detection of HAdV-4 gene has been constructed by fluorescence quantitative RTPCR.It was sensitive and specific,accurate and reliable to detect HAdV-4 DNA copy number.

