绵枣儿大小孢子的发生和雌雄配子体发育研究
孙颖,王蕾,崔兰明,周蕴薇
绵枣儿大小孢子的发生和雌雄配子体发育研究
孙颖,王蕾,崔兰明,周蕴薇*
(东北林业大学园林学院,黑龙江哈尔滨150040)
用常规石蜡切片法和光学显微技术研究绵枣儿的花芽分化、大小孢子发生和雌雄配子体发育过程。结果表明:绵枣儿的花为两性花,每朵花具有雄蕊6枚,花药4室,花药壁由表皮、药室内壁、中层(2层)、绒毡层共5层细胞构成,其发育方式为双子叶型,绒毡层为腺质绒毡层类型;小孢子母细胞减数分裂的胞质分裂方式为连续型,产生的四分体包括左右对称型与四面体型2种,成熟的绵枣儿花粉为二细胞型花粉;子房为3心皮3室,中轴胎座,倒生胚珠,厚珠心,双珠被;胚囊的发育方式为英地百合型,成熟胚囊为7胞8核。
绵枣儿;大孢子;小孢子;雌配子体;雄配子体
绵枣儿()又名石枣儿、地兰、天蒜、鲜白头等,是风信子科绵枣儿属的多年生草本植物,中国除新疆、西藏、青海、宁夏、贵州和海南外的其他各地均有其分布;朝鲜、日本和俄罗斯也有其自然分布[1]。绵枣儿通常生长在海拔高度2 600 m以下的山坡、草地、路旁或林缘,鳞茎呈卵圆形,可药食两用[1–2],其总状花序为多花,淡紫色,花期较长,具有良好的观赏价值,且植株的耐寒、耐旱性强,病虫害少,生长季节不需要特殊管理,非常适合于城市园林绿化应用。
近年来,绵枣儿因为具有较高的观赏价值而受到了一定的关注,但关于绵枣儿的研究尚少,现主要针对其药物学[3–6]和基础细胞学[7–8]方面进行了研究,关于其生殖生物学研究,尤其是关于其胚胎学方面的研究尚少。Erika SVOMA等[8]研究绵枣儿属11个种的胚囊发育方式,发现只有1个种的胚囊发育方式为德鲁撒型,其余的均为葱型。绵枣儿属植物的胚囊发育方式为葱型,胚发育方式为柳叶菜型,胚乳发育方式为沼生目型[9]。目前,中国对绵枣儿的选育工作尚属空白,关于绵枣儿属的分类地位学术界尚未达成共识,大部分人认为绵枣儿属应该归于风信子科[10–11],但一部分人认为绵枣儿属应该归为百合科,所以,有必要对绵枣儿进行胚胎学方面的研究。笔者对绵枣儿大、小孢子发生及雌、雄配子体发育进行研究,旨在为绵枣儿繁殖和新品种培育等提供生殖生物学依据,也为该属植物的系统分类提供资料。
1 材料和方法
1.1 材料
试验材料为从长白山引种至东北林业大学园林学院苗圃的绵枣儿植株。
1.2 方法
在2015年4月初至7月末,每3~5 d挖取绵枣儿的球根,取其鳞茎中央的小芽(初期难以分辨时可直接切取鳞茎的中央部分,末期时切取地上部分未开的小花序,此时可将小花序上未发育完全的小花分离)。取回的材料置于FAA固定液(50%乙醇89 mL+冰醋酸5 mL+福尔马林6 mL)中固定和保存,并对其进行抽气处理,在4 ℃冰箱中保存。用爱氏苏木精整体染色10~15 d,蓝化后用常规石蜡切片法制片,切片厚度为8~12 μm,在LEICA DM2500显微镜下观察并照相。
2 结果与分析
2.1 小孢子的发生和雄配子体的发育结果
2.1.1花药壁的发育结果
绵枣儿花药壁发育情况见图1。
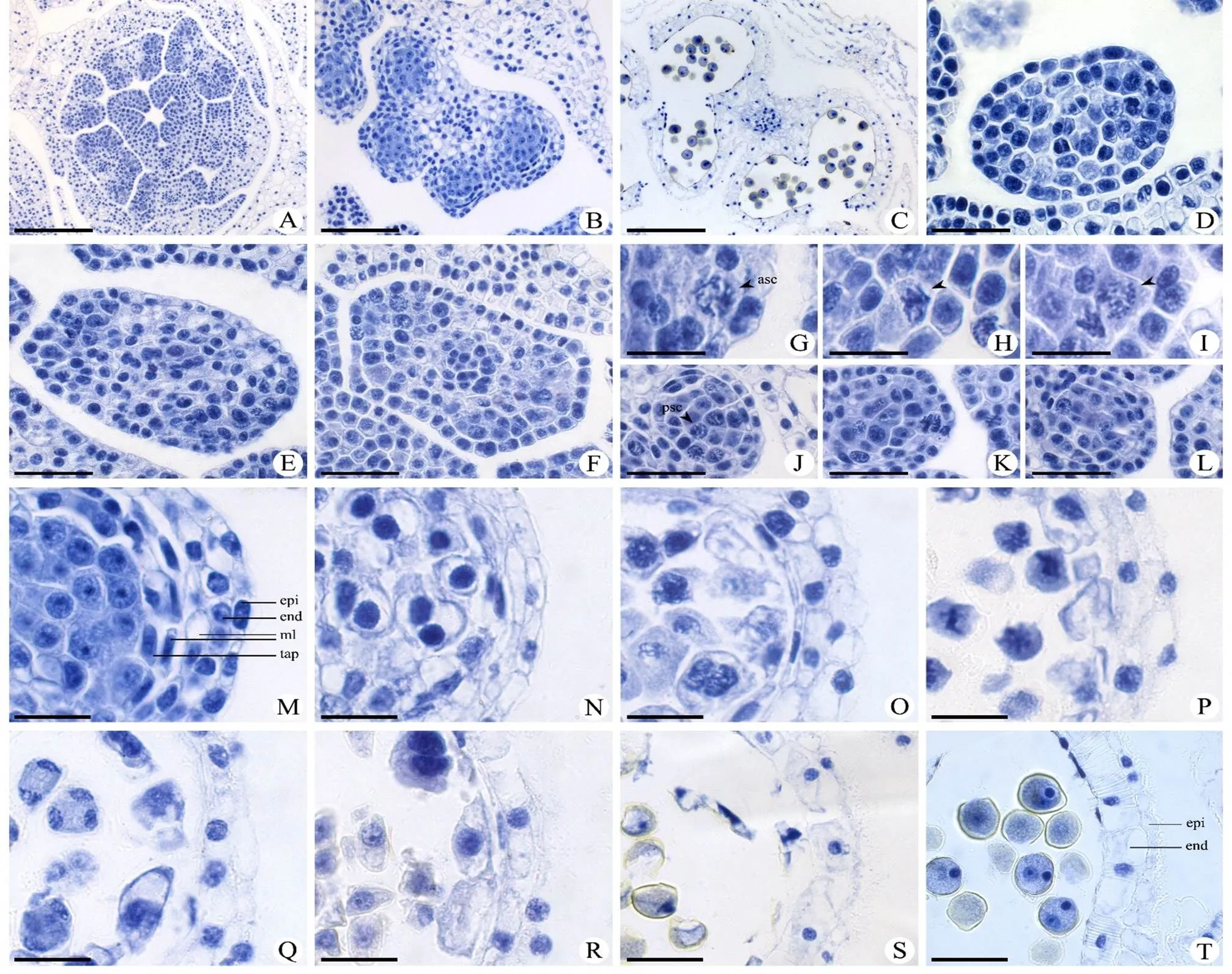
asc 孢原细胞;psc 初生造孢细胞;epi 表皮;end 药室内壁;ml 中层;tap 绒毡层;A 6枚花药横切;B 花药4室;C 成熟花药;D 幼小花药;E 四边形花药;F 蝴蝶形药;G,H,I 孢原细胞;J 初生壁细胞和初生造孢细胞;K 初生壁细胞;L 2层次生壁细胞;M 次生造孢细胞时期的花药壁;N 小孢子母细胞时期的花药壁;O,P,Q 小孢子母细胞减数分裂期的花药壁;R 单核小孢子时期的花药壁;S 单核靠边期的花药壁;T 二细胞花粉期的花药壁。
绵枣儿的花为两性花,每朵花具有6枚雄蕊(图1–A),花药4室(图1–B),呈左右对称型。发育初期的花药由外层的原表皮和内侧的分生组织构成(图1–D)。随后,花药四角隅处分裂加速,花药发育为四边形,中部为原形成层(图1–E,F)。孢原细胞在原表皮下的第一层细胞中形成,经1次平周分裂(图1–G)形成初生壁细胞和初生造孢细胞(图1–H,I)。初生壁细胞进行1次平周分裂和数次垂周分裂,形成内外2层细胞,外层为次生壁细胞,内层将来发育为绒毡层(图1–J,K,L)。次生壁细胞再次进行平周分裂和垂周分裂,形成中层和药室内壁。在初生造孢细胞有丝分裂形成次生造孢细胞过程中,花药壁已经基本分化出了完整的5层结构(图1–M),由外至内分别为表皮、药室内壁、中层(2层)、绒毡层。按照文献[12]中的划分标准,绵枣儿花药壁的发育属于双子叶类型。位于花药中部的原形成层细胞不断进行分裂,形成由维管束和薄壁细胞构成的药隔(图1– C)。
表皮细胞在小孢子母细胞时期开始变扁(图1–N),在小孢子母细胞减数分裂过程中开始解体(图1–O,P,Q)。在二胞花粉时期,大部分已解体消失(图1–T)。与表皮相邻的一层细胞为药室内壁(图1–M),小孢子母细胞减数分裂时期,药室内壁细胞径向延长(图1–O,P,Q),单核小孢子时期体积继续增大(图1–R),二细胞花粉时期体积达到最大,除外切向壁外,其他壁产生不均匀的条纹状加厚,此时的药室内壁又称作纤维层(图1–T)。绵枣儿的中层细胞为2层,位于药室内壁内侧。在小孢子母细胞进行减数第1次分裂时,药室内壁细胞挤压中层细胞,中层细胞开始解体(图1–O,P)。至小孢子单核靠边期时,中层细胞完全解体(图1–S)。绒毡层是花药壁最内层的1层细胞,在小孢子母细胞时期,绒毡层细胞为多边形,含双核或多核(图1–N)。从小孢子母细胞减数分裂开始,绒毡层开始解体(图1–O,P,Q),到二细胞花粉时期,绒毡层已经完全解体(图1–T)。在整个发育过程中,绒毡层的位置没有发生改变,所以绵枣儿的绒毡层为腺质绒毡层(或称分泌绒毡层)。绵枣儿成熟花药的中层和绒毡层已经完全退化,只具备纤维层和未退化完全的表皮(图1–C)。
由石蜡切片结果可以看出,绒毡层细胞发育早期,细胞染色较深(图1–M),说明其细胞质浓厚,细胞内贮存了大量的营养物质。之后绒毡层细胞程序性死亡,逐渐解体,绒毡层细胞的着色逐渐变浅,细胞液泡化,内含的营养物质被转移利用。据相关报道,花粉细胞可能利用了这一营养物质[13]。绵枣儿绒毡层的解体始于小孢子母细胞减数分裂,终于花药发育成熟。绒毡层活动状态与小孢子发生、雄配子发育对营养物质的需求相一致。
2.1.2小孢子发生结果
小孢子发生与花药壁的发育同步,初生造孢细胞进行数次有丝分裂,形成次生造孢细胞(图2–A,B),次生造孢细胞进一步发育为小孢子母细胞(图2–C),随后进入小孢子母细胞的减数分裂阶段。
减数分裂Ⅰ前期的时间比有丝分裂前期的时间长。减数分裂Ⅰ前期共分为5个时期:细线期(图2–D)、偶线期、粗线期、双线期和终变期(图2–E)。在减数分裂Ⅰ中期,核膜、核仁消失,二价体排列在赤道板两侧,纺锤体出现(图2–F)。在减数分裂Ⅰ后期,同源染色体在纺锤丝的牵引下移向两极(图2–G)。在减数分裂Ⅰ末期,染色体重新变为丝状,核膜和核仁重现,细胞中央赤道板处形成细胞板,二分体形成(图2–H)。随后,小孢子母细胞进入减数分裂二阶段。
在减数分裂Ⅱ前期,二分体内的染色质螺旋缩短变粗(图2–I)。在减数分裂Ⅱ中期,2个细胞内的染色体排列在各自的赤道板上,着丝点与纺锤丝相连,两极出现纺锤体(图2–J)。在减数分裂Ⅱ后期,受纺锤丝的牵引,染色体在着丝点处一分为二,染色单体分别向两极移动(图2–K)。在减数分裂Ⅱ末期,移向两极的染色体再次解螺旋,形成细胞核,细胞质同时分裂,四分体形成。四分体存在的时间较短暂。绵枣儿四分体的排列方式为左右对称型(图2–L),偶见四面体型(图2–M),胞质分裂为连续型,此时二倍体的小孢子母细胞已经形成4个单倍体的配子体细胞。

Mmc 小孢子母细胞;ms 小孢子;A 初生造孢细胞;B 次生造孢细胞;C 小孢子母细胞;D 减数第一次分裂前期细线期;E 减数第一次分裂前期终变期;F 减数第一次分裂中期;G 减数第一次分裂后期;H 减数第一次分裂末期;I 减数第二次分裂前期;J 减数第二次分裂中期;K 减数第二次分裂后期;L 左右对称型四分体;M 四面体型四分体;N,O 胼胝质;P 小孢子;Q,R 单核小孢子;S 单核靠边期小孢子;T,U 营养细胞(白色箭头)与生殖细胞(黑色箭头);V 新形成的二细胞花粉粒;W 生殖细胞进入营养细胞的细胞质中;X 成熟的二细胞花粉。
通过对绵枣儿小孢子母细胞减数分裂过程的观察,发现同一花药的不同药室或同一朵花的不同花药内小孢子母细胞的发育进程相差2~5个时期。出现这种不同步的原因尚不清楚。同一药室内小孢子母细胞的发育时期基本相同。胞间连丝的存在使同一药室内的小孢子母细胞减数分裂同步化[14]。
2.1.3雄配子体发育结果
小孢子母细胞进入减数分裂时,在小孢子母细胞壁上逐渐积累胼胝质,刚形成的四分体被包裹在胼胝质内。后绒毡层分泌的胼胝质酶将四分体的胼胝质壁水解,4个单核小孢子被释放(图2–N,O)。从四分体中刚分离出的小孢子形状不规则,细胞核明显(图2–P);随后,小孢子体积增大(图2–Q),细胞发生液泡化,细胞核大而明显,为单核居中期小孢子(图2–R);之后,小孢子液泡化的程度加强(图2–S),细胞核被挤向一侧(此时期称为单核靠边期)。单核靠边期小的孢子在贴近细胞壁的位置发生一次胞质分裂不均等的有丝分裂(图2–T,U),形成2个子核,分别为生殖细胞和营养细胞。靠近花粉壁的体积较小的细胞是生殖细胞,呈凸透镜状;体积大的是营养细胞,具有大液泡(图2–V)。随后,两细胞间的细胞壁溶解消失,生殖细胞渐渐移向营养细胞,沉浸在营养细胞的细胞质中(图2–W)。此时的生殖细胞渐渐由凸透镜状变为圆球形,核结构致密且染色较深,细胞质少,仅被质膜包被,而营养细胞的细胞核大,染色浅,核内结构松散,核仁明显,大液泡消失(图2–X)。直至绵枣儿花粉发育成熟时,花粉粒内只含有营养细胞和生殖细胞,生殖细胞没有进行有丝分裂而产生精细胞,因此,绵枣儿的花粉类型为二细胞型。
切片结果显示,在雄配子体发育过程中,营养细胞在形成时接受了来自小孢子的大量细胞质,其细胞质的染色程度浅(图2–U),内含营养物质少,之后随着营养细胞的发育,染色程度逐渐加深(图2–X),说明营养物质逐渐积累。这一过程能为其将来的花粉萌发提供足够的营养物质。
在绵枣儿花药发育过程中,花药壁发育的同时,小孢子及雄配子也在发育,二者在发育时间上有一定的对应关系(表1),待成熟二细胞花粉形成时,花药壁的发育过程已基本完成。

表1 花药壁发育与小孢子发生及雄配子发育时期的对应关系
2.2 大孢子发生和雌配子体发育结果
2.2.1胚珠
绵枣儿为子房上位,具有3心皮3室(图3–A),中轴胎座,每室具有1枚倒生型胚珠,并且为双珠被,厚珠心。发育初期,胚珠原基在子房内壁的胎座处开始分化(图3–B),产生一团凸起,体积增大成为胚珠原基(图3–C)。胚珠原基进一步发育,其前端成为珠心,基部分化为珠柄。靠近珠孔一端的珠心表皮下分化出一个孢原细胞(图3–E)。孢原细胞进行1次平周分裂(图3–F),靠近内侧的为造孢细胞,靠近珠孔的为周缘细胞(图3–G)。造孢细胞进一步发育为大孢子母细胞,周原细胞再进行0–1次平周分裂和数次垂周分裂,使大孢子母细胞位于珠孔顶端2~3层细胞之下,所以,绵枣儿的珠心为厚珠心。在胚珠的发育过程中,由于珠柄比其他部分生长快,加上珠柄较长,所以珠心出现180°倒转,成为倒生胚珠(图3–D)。
2.2.2大孢子的发生情况
大孢子母细胞减数分裂时期,珠被还未发育完全,包裹住珠心的中下部,两层珠被不易区分,而珠心组织基本成型。大孢子母细胞体积大,细胞质浓厚,能明显与周围细胞区分(图3–H)。大孢子母细胞通过第一次减数分裂形成二分体,两核之间形成细胞板(图3–I)。二分体中靠近合点端的一个退化(图3–J),珠孔端的细胞作为有功能细胞继续发育(图3–K),之后,其通过有丝分裂产生2个大孢子核,成为二核大孢子(图3–L),胚囊继续发育。

Ovp 胚珠原基;fu 珠柄;ii 内珠被;nu 珠心;oi 外珠被;vb 维管束;asc 孢原细胞;mec 大孢子母细胞;ant 反足细胞;cc 中央细胞;ea 卵器;ec 卵细胞;pn 极核;sy 助细胞;A 子房三室;B 横切,胚珠原基形成;C 纵切,胚珠原基;D 胚珠结构;E 孢原细胞; F 平周分裂的孢原细胞;G 造孢细胞;H 大孢子母细胞;I 二分体;J 二分体中靠近合点端的细胞退化;K 珠孔端留下的功能细胞;L 二核大孢子;M 二核胚囊;N 四核胚囊;O 八核胚囊中位于合点端的4个核;P 八核胚囊中位于珠孔端的4个核;Q 八核胚囊;R 助细胞;S 卵器;T 初期的卵细胞;U 位于合点端的卵细胞;V 位于珠孔端的卵细胞;W 卵细胞和极核;X 中央细胞;Y 3个反足细胞和极核。
在大孢子母细胞减数分裂期间,其细胞质染色状态由深变浅,附近珠心细胞的细胞质染色也逐渐变浅,并呈现出退化状态。由此可推测,供应大孢子母细胞减数分裂的营养一部分来自大孢子母细胞自身贮存的营养物质,另一部分来自珠心细胞。
2.2.3雌配子体发育情况
二核大孢子中的2个核分别向合点端和珠孔端移动,两核之间渐渐形成液泡,最终发育为二核胚囊(图3–M)。之后,2个核各进行1次有丝分裂,成为4核胚囊(图3–N)。4核胚囊中的每个核再进行1次有丝分裂,形成8核胚囊(图3–O,P,Q)。8核胚囊停留的时间较短,随即开始分化。核与核之间形成细胞壁,两端各有1个细胞分化为极核并向中央移动,形成中央核,构成中央细胞,珠孔端剩下的3个子核分化为1个卵细胞和2个助细胞,构成卵器,合点端的3个核分化成3个反足细胞,逐渐发育成为7个细胞8个核的成熟胚囊,所以,绵枣儿的胚囊发育类型为英地百合型。
胚囊中各细胞的发育各具特点,助细胞分布于珠孔端,是并列的2个细胞(图3–R),与卵细胞呈三角形排列,构成卵器(图3–S)。卵细胞细胞质在初期相对浓厚(图3–T)。成熟的卵细胞有时位于合点端(图3–U),有时位于珠孔端(图3–V),细胞液泡化明显,核较小,其体积比助细胞的小。中央细胞位于胚囊中心,是体积最大的细胞,液泡化程度高,包含2个极核(图3–W)。2个极核在受精作用发生之前没有融合(图3–X)。反足细胞是位于合点端的3个细胞,呈“品”字型排列,珠孔端较钝,合点端较尖,靠近合点端的反足细胞体积较大,细胞质浓,代谢较旺盛,另外2个体积较小(图3–Y)。
胚囊发育期间体积逐渐增大,周围的珠心细胞逐渐消亡,细胞质染色变浅,珠心细胞在消亡过程中通过胚囊的表面向其提供了营养。此外,靠近合点端反足细胞的细胞质浓厚,代谢旺盛。这是因为其参与了珠心摄入代谢物转移至中央细胞的过程。合点端被认为是营养物质移至胚囊的主要通道[13]。
2.3 雌雄配子体发育的对应关系
绵枣儿的雄蕊分化与发育都早于雌蕊,直到雄蕊发育到小孢子母细胞时期,雌蕊才开始形成孢原细胞。当花粉囊内已经形成成熟的二细胞花粉时,胚囊内还在进行核分裂,因此,绵枣儿雄蕊成熟早于雌蕊(表1),但在花朵开放前,雌、雄蕊均已成熟。

表2 雌蕊与雄蕊发育时期的对应关系
3 结论与讨论
绵枣儿的胚胎学特征。绵枣儿的每朵花有6枚雄蕊,花药4室。花药壁由表皮、药室内壁、中层(2层)、绒毡层共5层细胞构成,为双子叶型发育方式,为腺质绒毡层类型。小孢子母细胞减数分裂的胞质分裂方式为连续型,产生的四分体包括左右对称型与四面体型2种。成熟的绵枣儿花粉为二细胞型花粉。子房为3心皮3室,中轴胎座,倒生胚珠,厚珠心,双珠被。胚囊为英地百合型发育方式,成熟胚囊为7胞8核。
绵枣儿属胚胎学特征的系统学意义。绵枣儿被归为风信子科绵枣儿属。风信子科是于1998年根据基因亲缘关系分类的APG分类法而设置的独立科,属天门冬目。在此之前,根据克朗奎斯特的分类法,风信子科下的属都归于百合目百合科。绵枣儿的胚胎学特征与百合科的胚胎学特征接近,但也有不同,如百合科花药壁为单子叶型发育方式,中层为1层,具有薄珠心[12,15–16],所以,绵枣儿属与百合科并不能完全纳入百合科。
绵枣儿具有一些较为原始的胚胎学特征,如二细胞型花粉、厚珠心、倒生胚珠[13,17],同时,绵枣儿也具有较为进化的胚胎学特征,如绵枣儿花药绒毡层类型就是较为进化的腺质绒毡层;此外,绵枣儿也具备过渡阶段的胚胎学特征。JOHRI[17]认为胚囊发育进化过程中单孢子胚囊是最原始的类型,而四孢子胚囊是最进化的类型。绵枣儿胚囊发育方式为英地百合型,属双孢子胚囊的一种,为过渡类型。由以上几点推测,绵枣儿在系统进化中较为原始,是一种过渡植物类群。
绵枣儿雄蕊的分化和发育均早于雌蕊,但雄蕊分化和发育持续的时间较长,雌、雄蕊在开花前的发育同步。这可能与遗传因素和环境因素相关[18],也可能与花芽分化的进程相关[19]。本试验中,绵枣儿雄蕊原基的出现早于雌蕊原基,这可能是绵枣儿雄蕊分化、发育早于雌蕊的原因。
雌、雄蕊的发育关系与植物的授粉方式具有相关性,如雌雄异熟能有效保证异花授粉,避免自花授粉[20]。绵枣儿的授粉方式为异花授粉,部分自交亲和(待发表),这可能与其雌雄蕊同时发育成熟有关。
[1] 中国科学院中国植物志编辑委员会.中国植物志:第39卷[M].北京:科学出版社,1988.
[2] 邵建章,张定成,聂刘旺,等.绵枣儿2个不同居群的核型研究[J].安徽师范大学学报(哲学社会科学版),1995(4):40–44.
[3] 任福才,王丽霞,王飞,等.绵枣儿化学成分研究[J].中草药,2014,45(14):1984–1988.DOI:10.7501/j.issn. 0253–2670.2014.14.004.
[4] KATO A,KATO N,ADACHI I,et al.Isolation of glycosidase–inhibiting hyacinthacines and related alkaloids from[J].J Nat Prod,2007,70(6):993–997.DOI:10.1021/np0700826.
[5] ASANO N,IKEDA K,KASAHARA M,et al. Glycosidase–inhibiting pyrrolidines and pyrrolizidines with a long side chain in[J].J Nat Prod,2004,67(5):846–850.DOI:10.1021/np0499721.
[6] ARAKI H.The distribution of diploids and polyploids of thecomplex in Korea[J].Genetica,1985,66(1):3–10.DOI:10.1007/bf00123600.
[7] YÜ Z,ARAKI H.The distribution of diploids and polyploids of the Scomplex in the northeastern district of China[J].The Botanical Magazine Tokyo,1991,104(3):183–190.DOI:10.1007/bf02489 451.
[8] SVOMA E,GREILHUBER J.Systematic embryology of thealliance (Hyacinthaceae)[J].Nordic Journal of Botany,1989,8(6):585–600.DOI:10.1111/j. 1756–1051.1989.tb01733.x.
[9] CoşKun Z M,Ünal M.Embryological and cytochemical features ofL.[J].Turkish Journal of Botany,2010,34(4):291–301.
[10] TOBE H.The embryology of angiosperms:its broad application to the systematic and evolutionary study[J]. The Botanical Magazine Tokyo,1989,102(2):351–367.DOI:10.1007/bf02488572.
[11] PFOSSER M,SPETA F.Phylogenetics of hyacinthaceae based on plastid DNA sequences[J].Annals of the Missouri Botanical Garden,1999,86(4):852.DOI:10. 2307/2666172.
[12] FOGG G G.Book Review:Systematic embryology of theL.Davis[J].The Quarterly Review of Biology,1969(2):228.DOI:10.1086/406098.
[13] 胡适宜.被子植物生殖生物学[M].北京:高等教育出版社,2005.
[14] HESLOP'HARRISON J.Cytoplasmic connexions between[J].Annals of Botany,1966,30(2):221–222.DOI:10.1093/oxfordjournals.aob.a084 069.
[15] 王璐赟,卢梅,陈春燕,等.葱兰大小孢子发生和雌雄配子体发育及其系统学意义[J].西北植物学报,2015,35(5):942–947.DOI:10.7606/j.issn.1000–4025. 2015.05.0942.
[16] 张娜,赵桦,李永玲.黄花油点草大小孢子发生及雌雄配子体发育[J].西北植物学报,2013,33(8):1589–1594.
[17] JOHRI B M,AMBEGAOKAR K B,SRIVASTAVA P S. Comparative embryology of angiosperms [M].Dordrecht: Springer Science & Business Media,2013.
[18] 桂明珠,谭余,王慧生.黑穗醋栗雌雄配子体的发育[J].东北农学院学报,1986(2):130–138.
[19] 王庆亚,李扬汉.绞股蓝大小孢子发生和雌雄配子体的发育[J].南京农业大学学报,2002,25(3):17–21.DOI:10.3321/j.issn:1000–2030.2002.03.005.
[20] 张大勇.植物生活史进化与繁殖生态学[M].北京:科学出版社,2004.
责任编辑:王赛群
英文编辑:王库
Research on the genesis of megaspore and microspore inand the development of its gametophytes
SUN Ying, WANG Lei, CUI Lanming, ZHOU Yunwei*
(College of Landscape Architecture, Northeast Forestry University, Harbin 150040, China)
In order to enrich the contents of embryology researchon, the megasporogenesis, microsporogenesis and development of female and male gametophytes were studied by means of paraffin–embedded sectioning technique. The results show that each floret of inflorescence usually has six stamens, and each anther has four chambers.The development of the anther wall, which is formed by epidermis, endothecium, tapetum and two middle layers, belongs to a dicotyledonous type, and the tapetum is glandular type. Microspore cytokinesis of mother cell is continuously split twice and resulted in medianly zygomorphic tetrad and tetrahedral tetrad. Mature pollen grain is 2-cell type. The pistil ofconsisted of three carpels, and the ovary has three locules. Ovules are anatropous on axile placenta, bitegminous and crassinucellate. The development of embryo sac isclassified as endymiontype, and the mature embryo sac has seven cells and eight nuclei.
; megaspore; microspore; female gametophyte; male gametophyte
Q944.4
A
1007-1032(2017)05-0496-08
2017–03–17
2017–09–03
中央高校基本科研业务费专项基金项目(2572017CA13)
孙颖(1979—),女,吉林长春人,博士,副教授,主要从事园林植物种质资源开发与利用研究,littlesuning@126.com;*通信作者,周蕴薇,博士,教授,主要从事园林植物种质资源及繁殖栽培研究,yunwei_zhou@yahoo.com.cn
投稿网址:http://xb.hunau.edu.cn

