桑黄子实体与桑黄菌丝多糖抗氧化活性研究
应瑞峰,黄梅桂,王耀松,李婷婷,范龚健,吴彩娥
(南京林业大学轻工科学与工程学院,江苏南京210037)
桑黄子实体与桑黄菌丝多糖抗氧化活性研究
应瑞峰,黄梅桂,王耀松*,李婷婷,范龚健,吴彩娥
(南京林业大学轻工科学与工程学院,江苏南京210037)
桑黄是我国一种非常珍贵的功能性真菌,多糖是其的主要生物活性成分,试验提取桑黄子实体多糖和二种不同生长期的菌丝多糖,对其进行抗氧化试验,以总抗氧化能力、清除DPPH自由基能力、清除羟基自由基能力、对Fe2+螯合能力、超氧阴离子自由基清除能力测定5种方法评价其抗氧化活性,试验结果表明桑黄子实体多糖表现出较强的抗氧化活性,对比桑黄子实体多糖与桑黄菌丝多糖,子实体多糖抗氧化效果显著高于菌丝体多糖,不同生长期的菌丝多糖也呈现出不同的抗氧化性,生长期短的菌丝多糖表现出更强的抗氧化性。试验结果为今后桑黄产业提供重要的理论基础。
桑黄;多糖;菌丝;抗氧化
自古以来桑黄都是一种非常珍贵的功能性真菌,属于担子菌亚门层菌纲多孔菌目多孔菌科针层菌属,有些地方也叫做桑臣、桑耳。桑黄具有多种活性功能,尤其现代科学研究表明其具有非常突出的抗氧化和抗癌效果,因这一特性桑黄引起了世界各国的关注,尤其日本、韩国、中国和东南亚等国的科学家[1-4]。桑黄功能性成分很多,化学组成和结构都十分复杂,不同种属的桑黄品种、不同的地域和不同的提取方法都会造成其化学成分和结构的差异。桑黄的主要化学成分很多,主要有多糖、萜类、黄酮、甾体的香豆素等[3-4]。研究表明多糖是桑黄的主要生物活性成分,其作用主要为抗氧化和抗癌[5-8]。桑黄多糖可存在于桑黄子实体中、发酵液和菌丝体中。野生桑黄生长周期长,要长成适合药用的大小,需要很长的时间,由于野生桑黄稀少,加上近年来市场需求量巨大、价格昂贵,野生桑黄自然分布已经急剧减少,特别是东北地区该资源已经破坏性开发,几乎已无法恢复。市场对桑黄巨大的需求与桑黄培育的困难有着较大的冲突,培育高活性桑黄菌丝是一很重要的解决途径[7-9]。因此,本试验对桑黄子实体和桑黄菌丝的多糖分离纯化及活性成分的抗氧化能力进行研究,期望研究结果能为桑黄的研究、开发和综合利用提供重要的理论参考。
1 材料与方法
1.1 材料与试剂
桑黄子实体与桑黄菌丝,由淳安千岛湖桑都食用菌专业合作社提供;试验用水为超纯水;DPPH:Sigma公司;芦丁对照品:中国药品生物制品检定所;乙醇、NaNO2、Al(NO3)3、NaOH、硫酸亚铁、水杨酸和双氧水等皆为分析纯;96孔细胞培养板:Costar公司;RPMI 1640培养基、DMEM培养基、胎牛血清:Gibco公司;DMSO:Sigma 公 司 ;EnoGeneCellTMCounting Kit-8(CCK-8)细胞活力检测试剂盒:京恩晶生物科技有限公司。
1.2 仪器与设备
XO-SM200超声波微波复合反应系统:南京先欧仪器制造有限公司;QT-58A智能紫外检测仪:上海琪特分析仪器有限公司;TU-1800PC紫外可见分光光度计:北京普析通用仪器有限责任公司;ChemBase CBSCJ-1FD超净工作台;MCO-15AC二氧化碳培养箱:日本三洋SANYO;XD-202荧光倒置生物显微镜:南京江南永新光学有限公司;Thermo MK3酶标仪:美国热电公司。
1.3 提取方法与试验条件
桑黄多糖的提取工艺为:桑黄子实体或菌丝→粉碎→超声波热水浸提→过滤→80%乙醇醇沉→离心→沉淀复溶→50%乙醇醇沉→干燥→多糖。
1.4 试验条件
1.4.1 桑黄多糖及蛋白含量测定
1.4.1.1 多糖含量的测定
本试验应用苯酚-硫酸法测桑黄多糖的含量,经过试验得到苯酚-硫酸法标准曲线方程为:Y=0.010 9X+0.005 2,R2=0.978 9,式中:X 为葡萄糖的浓度,μg/mL;Y为该浓度下对应的488 nm处吸光值。样品溶液稀释后用同样的方法测定,根据计算所得的标准曲线方程求桑黄多糖的浓度。
1.4.1.2 蛋白含量的测定
本试验应用考马斯亮蓝G-250法测蛋白含量,得到考马斯亮蓝G-250法标准曲线方程为Y=0.005 3X+0.018 8,R2=0.994 5,式中:X 为蛋白浓度,μg/mL;Y 为该浓度下对应595 nm处吸光值。样品溶液稀释后用同样的方法测定,并根据标准曲线方程求得其浓度。
1.4.2 抗氧化能力的测定
以总抗氧化能力、清除DPPH自由基能力、清除羟基自由基能力、对Fe2+螯合能力、超氧阴离子自由基清除能力测定5种方法评价其抗氧化活性。
1.4.2.1 总抗氧化能力
在10 mL试管中加入0.1 mL不同浓度的样品溶液和3.9mL工作液,充分混匀,于23℃暗处孵育6min,测定混合溶液在734 nm处的吸光值。无水乙醇作空白对照。以无水乙醇调零。总抗氧化能力按以下公式计算:

1.4.2.2 清除DPPH自由基能力
取2 mL不同浓度的样品溶液,依次加入2 mL、0.1 mmol/L的DPPH溶液,充分混匀,静止30 min后于517nm处测定吸光度值A样品。以2mL无水乙醇+2mL不同浓度的样品溶液为对照测定A对照,2 mL DPPH+2 mL蒸馏水为空白测定A空白。样品清除DPPH自由基的能力计算公式:
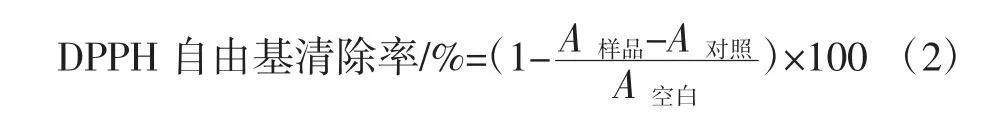
1.4.2.3 清除羟基自由基能力
取1 mL、0.75 mmol/L邻二氮菲的无水乙醇溶液,加入2 mL磷酸盐缓冲液(pH值为7.4),再加入1 mL、0.75 mmol/L硫酸亚铁,最后再加入不同浓度的样品,充分混匀后,加入1 mL、0.1%H2O2,于37℃温水浴中反应60 min,测定样品组在536 nm处的吸光度值A样品。以蒸馏水代替不同浓度的样品测定值为A损伤,以蒸馏水代替样品溶液及H2O2测定值为A未损伤。样品对羟基自由基的清除率计算公式为:

1.4.2.4 Fe2+螯合能力
在试管中加入1 mL不同浓度的样品溶液和1 mL、1 mmol/L FeCl2溶液,充分混匀,静置15 min,再加入0.2 mL、2.5 mmol/L Ferrozine,加入蒸馏水将试管补足至5 mL,于室温下静置20 min后于562 nm处测定吸光度值A样品。以蒸馏水代替FeCl2测定值为A空白。对Fe2+螯合能力测定的计算公式为:
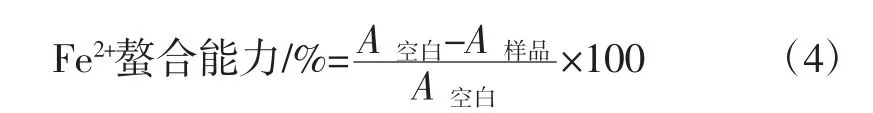
1.4.2.5 超氧阴离子自由基清除能力测定
称取样品分别配制成不同浓度的溶液,配制0.1 mol/L Tris溶液和0.1 mol/L HCl溶液,混匀制得0.05 mol/L Tris-HCl缓冲液。用10 mmol/L HCl配制配制25 mmol/L的邻苯三酚溶液测定邻苯三酚自氧化速率:移取各个浓度的样品待测液1 mL加入到10 mL透明刻度试管中,再移取4.5 mL 0.05 mol/L Tris-HCl缓冲液,振荡混匀。水浴锅设置25℃水浴20 min。加入20 μL,25 mmol/L的邻苯三酚溶液,同样预温。立即计时。振荡摇匀后倒入少量待测夜比色皿内润洗,用紫外分光光度计测定于325 nm吸光度,每隔1 min测定一次。以10 mmol/L HCl溶液代替邻苯三酚作为参比溶液。自氧化速率的计算公式:
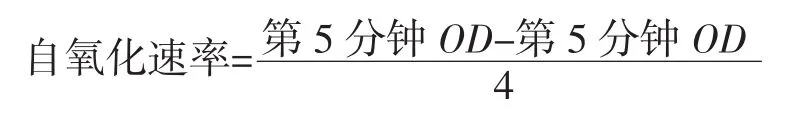
测定样品对邻苯三酚自氧化的抑制率:在10 mL透明刻度试管中加入4.5 mL 0.05 mol/L Tris-HCl缓冲液。加入各个浓度的样品待测液1 mL,水浴锅设置25℃水浴20 min。加入20 μL 25 mmol/L的邻苯三酚溶液。立即计时。振荡摇匀后倒入少量待测夜比色皿内润洗,测定在325 nm处每隔1min其吸光度。以10 mmol/L HCl溶液代替邻苯三酚作为参比溶液。按公式计算超氧阴离子自由基抑制率:
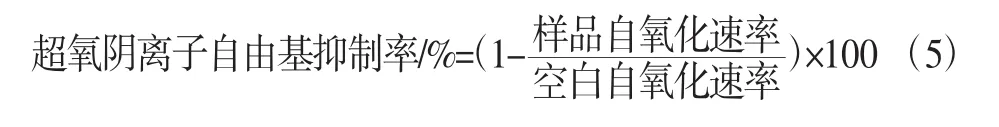
2 结果与分析
2.1 桑黄多糖各组分得率及多糖和蛋白含量
多糖各组分得率及多糖和蛋白含量见表1。
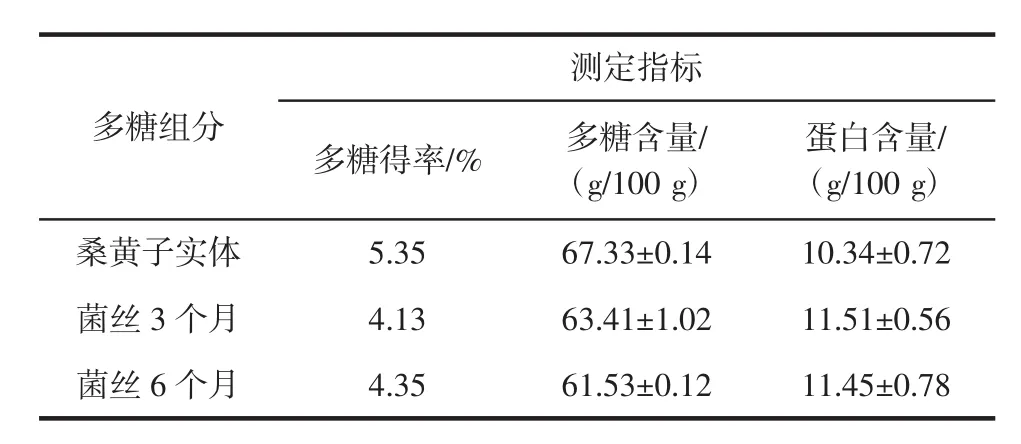
表1 多糖各组分得率及多糖和蛋白含量Table 1 The yield of polysaccharide and the content of polysaccharide and proteins
从表1可见,各组分中,桑黄子实体多糖得率最高达到了5.35%,极显著高于菌丝体,并且其多糖含量也最高达到了67.33 g/100 g,显著高于桑黄菌丝。桑黄子实体与菌丝多糖含有的蛋白质无显著差异。
2.2 桑黄多糖抗氧化能力测定
2.2.1 总抗氧化能力
桑黄多糖各组分的总抗氧化能力见图1。

图1 桑黄多糖各组分的总抗氧化能力Fig.1 Total antioxidant capacity of the polysaccharides from Phellinus igniarius
由图1得出,桑黄多糖、菌丝3个月、菌丝6个月多糖对ABTS自由基清除率都随浓度的增加而升高。桑黄子实体多糖的影响变化最明显,浓度在0~4 mg/mL时,ABTS自由基清除率上升较快,4 mg/mL之后ABTS自由基清除率放缓,在8 mg/mL时,ABTS自由基清除率达到92.19%,接近VC。菌丝3个月多糖、菌丝6个月多糖对ABTS自由基清除效果都弱于桑黄子实体多糖,菌丝3个月多糖清除效果略强于菌丝6个月多糖。量效关系得出桑黄子实体多糖清除ABTS自由基的IC50为 1.897 2 mg/mL。
2.2.2 桑黄多糖对DPPH自由基的清除率
桑黄多糖对DPPH的清除率曲线见图2。
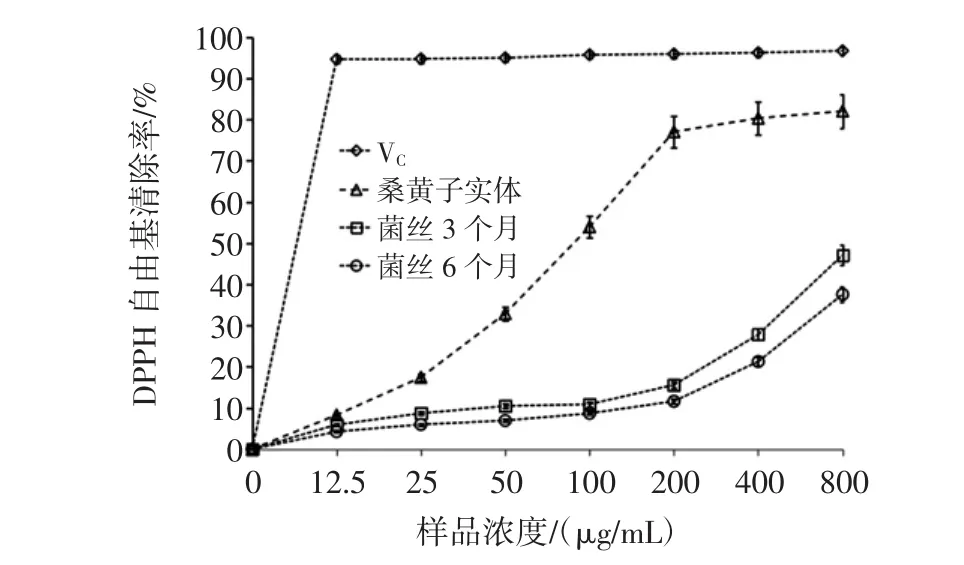
图2 桑黄多糖对DPPH自由基的清除率曲线Fig.2 Scavenging curves of the polysaccharides from Phellinus igniarius DPPH radicals
图2得出,桑黄子实体多糖、菌丝3个月多糖、菌丝6个月多糖对DPPH自由基清除率都随浓度的增加而升高。子实体多糖的影响变化最明显,浓度在0~200 μg/mL时,DPPH自由基清除率上升较快,200μg/mL之后DPPH自由基清除率放缓,在800 μg/mL时,DPPH自由基清除率达到82.05%。菌丝3个月多糖、菌丝6个月多糖对DPPH自由基清除效果弱于桑黄子实体多糖,菌丝3个月多糖对DPPH自由基清除效果效果略强于菌丝6个月多糖。
2.2.3 桑黄多糖对羟基自由基的清除率
桑黄多糖对羟基自由基的清除作用见图3。

图3 桑黄多糖对羟基自由基的清除作用Fig.3 Scavenging effects of the polysaccharides from Phellinus igniarius on hydroxyl radicals
由图3得出,桑黄子实体多糖、菌丝3个月多糖、菌丝6个月多糖对羟基自由基清除率都随浓度的增加而升高。桑黄子实体多糖的影响变化最明显,一直呈现上升趋势,在2 mg/mL时,羟基自由基清除率达到54%,但相比VC的对照试验,桑黄子实体多糖对羟基自由基清除效果并不是很明显。菌丝3个月多糖、菌丝6个月多糖对羟基自由基清除效果弱于桑黄子实体多糖,菌丝3个月多糖清除效果略强于菌丝6个月多糖,可以达到18.62%。桑黄子实体多糖的羟基自由基清除能力随浓度的增加而提高,此结果验证了红外光谱分析中3种桑黄多糖含有不饱和键。
2.2.4 桑黄多糖对Fe2+螯合能力
桑黄多糖对Fe2+螯合能力见图4。
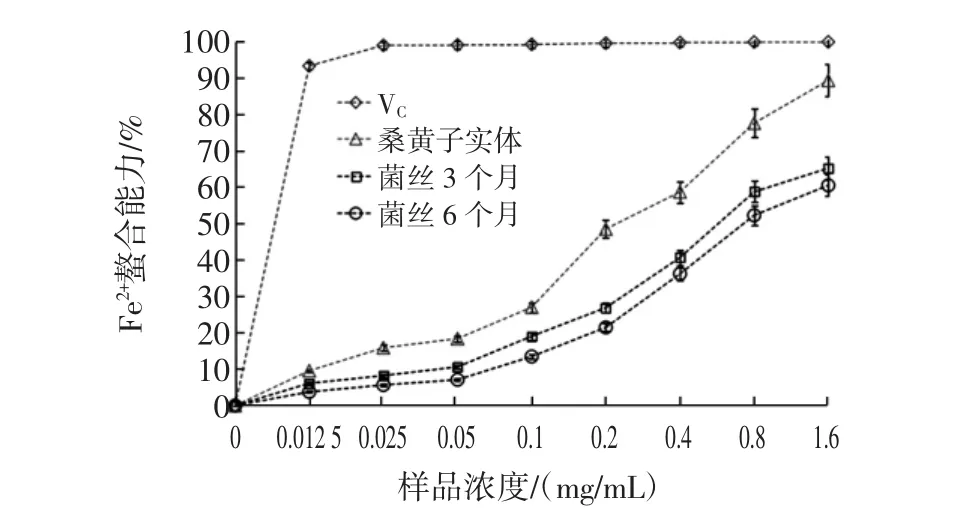
图4 桑黄多糖对Fe2+离子螯合能力Fig.4 The chelating ability of the polysaccharides from Phellinus igniarius to Fe2+
由图4得出,桑黄子实体多糖、菌丝3个月多糖、菌丝6个月多糖对Fe2+螯合能力都随浓度的增加而升高,桑黄子实体多糖的影响变化最明显,一直都呈现出上升的状态,在1.6 mg/mL时,Fe2+螯合能力达到89.39%,与EDTA的对照试验相比,桑黄子实体多糖的Fe2+螯合能力虽然不及EDTA,但也展现出很强的能力。菌丝3个月多糖、菌丝6个月多糖对Fe2+螯合能力效果均较高,菌丝3个月多糖Fe2+螯合能力略强,可以达到65.25%。量效关系得出桑黄子实体多糖Fe2+螯合能力的IC50为0.235 4 mg/mL。
2.2.5 桑黄多糖对超氧阴离子自由基的清除率
桑黄多糖对超氧阴离子自由基的清除率见图5。
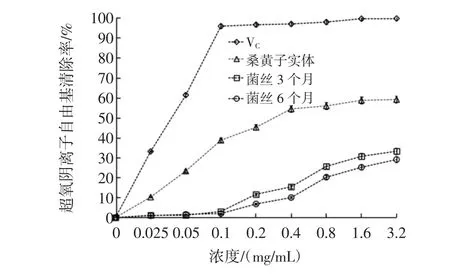
图5 桑黄多糖对超氧阴离子自由基的清除率Fig.5 Superoxide radical scavenging activities of the polysaccharides from Phellinus igniarius
由图5得出,桑黄子实体多糖、菌丝3个月多糖、菌丝6个月多糖对超氧阴离子清除率都随浓度的增加而升高,桑黄子实体多糖的影响变化最明显,浓度在0~0.4 mg/mL时,超氧阴离子清除率上升较快,0.4 mg/mL之后超氧阴离子清除率放缓,在3.2 mg/mL时,超氧阴离子清除率达到59.21%。菌丝3个月多糖、菌丝6个月多糖对超氧阴离子清除效果都弱于桑黄子实体多糖,菌丝3个月多糖效果略强于菌丝6个月多糖,可以达到33.27%。量效关系得出桑黄子实体多糖抑制超氧阴离子的IC50为0.897 2 mg/mL。
由上述抗氧化试验得出,桑黄子实体多糖具有较好的抗氧化性,菌丝3个月多糖、菌丝6个月多糖也具有抗氧化活性,但效果远低于桑黄子实体多糖。之前的研究发现桑黄子实体中多糖、黄酮和三萜的含量会因生长的树种不同,在活性成分含量上也会存在差异,比如一年生桑黄子实体,其多糖、黄酮类和三萜的含量要高于二年生的桑黄,抗氧化活性也优于二年生桑黄[10-11]。本研究对比了菌丝体和子实体中多糖,不仅多糖提取率有所差异,而且其多糖活性也存在很大差异,另外不同生长期的桑黄菌丝体多糖活性也存在显著差异。虽然桑黄菌丝比较容易培育,但其活性还是远低于子实体中的多糖,在今后的研究中不但要培育更经济的桑黄菌丝跟重要的是能培育出活性更强的桑黄菌丝。
3 结论
试验结果表明桑黄子实体多糖抗氧化效果显著高于桑黄菌丝体多糖,不同生长期的菌丝多糖也呈现出不同的抗氧化性,生长期短的菌丝多糖表现出更强的抗氧化性。要解决桑黄供需的矛盾,生产廉价量大的桑黄菌丝体是很好的一个解决问题的方法,但目前菌丝体多糖活性不如子实体多糖,今后需培育更高活性的菌丝,此试验结果能为今后桑黄产业提供重要的理论基础。
[1]胡启明.桑黄菌丝体多糖的分离纯化,结构鉴定及生物活性研究[D].武汉:华中农业大学,2013
[2]HSIEH P W,WU J B,WU Y C.Chemistry and biology of Phellinus linteus[J].BioMedicine,2013,3(3):106-113
[3]张林芳,邹莉.桑黄多糖的研究进展[J].中国食用菌,2012,31(4):1-4
[4]HWANG H J,KIM S W,CHOI J W,et al.Production and characterization of exopolysaccharides from submerged culture of Phellinus linteus KCTC 6190[J].Enzyme and Microbial Technology,2003,33:309-319
[5]WANG Zhanyong,WANG Chenyu,QUAN Yue.Extraction of polysaccharides from Phellinus nigricans mycelia and their antioxidant activities in vitro[J].Carbohydrate Polymers,2014,99:110-115
[6]LI Shi-Chao,YANG Xiao-Ming,MA Hai-Le,et al.Purification characterization and antitumor activity of polysaccharides extracted from Phellinus igniarius mycelia[J].Carbohydrate Polymers,2015,133:24-30
[7]LEE S,KIM J.I,HEO J,et al.The anti-influence virus effect of Phellinus igniarius extract[J].Journal of Microbiology,2013,51:676-681
[8]CHEN L,PAN J,LI X,et al.Endo-polysaccharide of Phellinus igniarius exhibited antitumor effect through enhancement of cell mediated immunity[J].International Immunopharmacology,2011,11:255-259
[9]DONG W,NING L,LU W D,et al.Tumor-inhibitory and liver-protective effects of Phellinus igniarius extracellular polysaccharides[J].World Journal of Microbiology and Biotechnology,2009,25:633-638
[10]GUO X,ZOU X,SUN M.Optimization of extraction process by response surface methodology and preliminary characterization of polysaccharides from Phellinus igniarius[J].Carbohydrate Polymers,2010,80:344-349
[11]LUNG M Y,TSAI J C.Antioxidant properties of polysaccharides from the Willow Bracket medicinal mushroom,Phellinus igniarius(L.)Quél.(Aphyllophoromycetideae)in submerged culture[J].International Journal of Medicinal Mushrooms,2009,11:383-394
Antioxidant Activity of Polysaccharides from Phellinus Igniarius Fruiting Body and Mycelium
YING Rui-feng,HUANG Mei-gui,WANG Yao-song*,LI Ting-ting,FAN Gong-jian,WU Cai-e
(College of Light Industry of Science and Engineering,Nanjing Forest University,Nanjing 210037,Jiangsu,China)
Phellinus igniarius was a very valuable function fungi in China,polysaccharides were the main bioactive components of Phellinus igniarius.In this experiment,the extractions of polysaccharide from fruiting body and two growth phase of mycelium were studied.The antioxidant activity was evaluated by 5 methods:total antioxidant capacity,scavenging ability of DPPH radical,scavenging effects on hydroxyl radicals,chelating ability to Fe2+,and scavenging ability of superoxide radical,the antioxidant experiments showed that the antioxidant effect of Phellinus igniarius polysaccharide was significantly higher than that of mycelium polysaccharide,different growth period mycelia polysaccharide had different antioxidant activity,polysaccharides within short growing period mycelium exhibited stronger antioxidant activity.The experimental results provided an important theoretical basis for industrial of Phellinus igniarius in the future.
Phellinus igniarius;polysaccharides;mycelium;antioxidant
10.3969/j.issn.1005-6521.2017.21.001
国家自然青年科学基金资助项目(31600153);南京林业大学引进高层次人才和高层次留学回国人员科研基金(GXL2013026);大学生实践创新训练计划项目
应瑞峰(1982—),男(汉),副教授,博士,研究方向:天然产物。
*通信作者
2017-07-18

