桂花黄色素微波预处理提取及抑菌作用研究
陈光,史娟
(1.汉中市中心医院,陕西汉中723000;2.陕西理工大学化学与环境科学学院,陕西汉中723000)
桂花黄色素微波预处理提取及抑菌作用研究
陈光1,史娟2
(1.汉中市中心医院,陕西汉中723000;2.陕西理工大学化学与环境科学学院,陕西汉中723000)
以汉中桂花为原料,通过微波辅助提取法,以乙醇浓度、回流时间、回流温度及料液比等因素为变量,黄色素提取率为响应值,设计正交试验得到黄色素提取最佳工艺条件。试验结果表明,最佳提取工艺为乙醇浓度80%、回流时间80 min、回流温度80℃、料液比1∶20(g/mL)。在此条件下,桂花黄色素提取率可达18.42%。同时,抑菌试验证实,桂花黄色素对大肠杆菌、金黄色葡萄球菌、枯草杆菌、沙门氏菌均有较好的抑菌效果。对金黄色葡萄球菌的抑菌活性最为显著,其最低抑菌浓度(MIC)为1.0 mg/mL;对大肠杆菌、枯草杆菌、沙门杆菌的MIC均为1.5 mg/mL。此外,桂花黄色素对食品还具有一定的防腐功能。
桂花黄色素;微波预处理;提取;抑菌活性
桂花(Osmanthus fragrans)是中国木犀属众多树木的习称,是我国特产的珍贵芳香花卉,产于云南西北部,陕西南部等地[1]。陕西汉中的汉桂,是桂花中的佼佼者,汉桂花具有花瓣多,花茎大,花期长等特点,年开花两次,以秋季为盛。汉桂是珍贵的观赏花卉,桂花精油是名贵香料,桂花色素则是很好的天然色素资源[2-3]。目前对桂花的研究主要集中在化学成分,如黄酮提取[4-5]、多糖提取[6]和精油提取[7]等方面。此外,还有一些桂花色素清除亚硝酸盐作用及其种皮色素抑菌活性的报道[8-9]。而关于桂花黄色素抑菌的研究少有报道。已有文献证实相当数量的天然色素,除可用于食品着色外,亦具备防腐,抗氧化及抑菌等生理活性[10-15]。
本文采用微波预处理,联合乙醇回流提取桂花中的黄色素,探究乙醇浓度、回流时间、回流温度及料液比对提取率的影响,正交试验对提取工艺进行优化。抑菌试验探究桂花黄色素对金黄色葡萄球菌、大肠杆菌、枯草杆菌、沙门氏菌的抑菌活性,为桂花黄色素作为天然食品防腐剂在工业中的应用提供参考。
1 材料与方法
1.1 材料与仪器
汉桂花:2015年10月份采自陕西理工大学南校区,洗净干燥后,研碎过60目筛,密封备用;无水乙醇、二甲基亚砜(DMSO)、氯化钠、氢氧化钠、盐酸(均为分析纯):成都市科龙化工试剂厂;胰蛋白胨、酵母浸粉、琼脂粉(生化试剂):国药集团化学试剂有限公司;供试菌种为大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、枯草杆菌(Bacillus subtilis)、沙门氏菌(Salmonella typhi):陕西理工学院生物工程学院微生物实验室提供;牛肉膏蛋白胨培养基:牛肉膏3 g、蛋白胨10 g、氯化钠5 g、去离子水1 000 mL、pH7.0~7.2,高压蒸汽灭菌备用;实验用水为自制去离子水。
DGG-9140B型电热恒温鼓风干燥箱:上海森信实验仪器有限公司;FW100型高速万能粉碎机:天津泰斯特仪器有限公司;AL204-IC电子天平:梅特勒-托利多仪器(上海)有限公司;WF-2000型微波快速反应系统:上海屹尧分析仪器有限公司;HH系列型恒温水浴锅:黄骅市渤海电器;SHB-Ⅲ型循环水式多用真空泵:郑州长城科工贸有限公司;Cary50型紫外可见分光光度计:美国瓦里安中国有限公司;LDZX-30KBS立式压力蒸汽灭菌器:上海申安医疗器械厂。
1.2 试验方法
1.2.1 色素的提取及纯化
桂花粉末微波预处理→乙醇回流提取→4℃下静置12 h→真空抽滤→滤液旋转蒸发浓缩得浸膏→柱层析洗脱→收集黄色部分溶液→旋干得到桂花黄色素
1.2.2 单因素试验设计
以桂花黄色素提取率为指标,固定桂花粉末称样量为5 g,微波功率600 W,微波预处理时间6 min,依次改变乙醇浓度(50%、60%、70%、80%、90%),回流时间(40、60、80、100、120 min),回流温度(50、60、70、80、90 ℃),料液比 [1 ∶5、1 ∶10、1 ∶15、1 ∶20、1 ∶25(g/mL)],分别考察乙醇浓度、回流时间、回流温度及料液比对色素提取率的影响。各单因素试验重复3次,并取平均值。
1.2.3 正交试验设计
在单因素试验基础上,以乙醇浓度、回流时间、回流温度和料液比为因素进行四因素三水平正交试验,进一步确定最佳提取工艺条件。
1.2.4 抑菌活性试验
准确称取不同质量的桂花黄色素提取物,用DMSO 精确配成 25、20、15、10、5、2.5 mg/mL 系列浓度的溶液,高温灭菌后备用。分别吸取已制备好的菌悬液(大肠杆菌、金黄色葡萄球菌、枯草杆菌、沙门氏菌)0.5 mL,滴入培养基平板上,用灭菌后的涂布器均匀涂抹[12-15],多余菌液吸走。

表1 L9(34)正交试验因素水平表Table1 Four factors and three levels orthogonal table
将灭菌牛津杯用镊子夹取平放在含菌平板上,每个菌种取两个含菌平板等距离逆时针放置4个牛津杯,并依次标记为 A(25 mg/mL)、B(20 mg/mL)、C(15 mg/mL)、O(DMSO);D(10 mg/mL)、E(5 mg/mL)、F(2.5 mg/mL)、O(DMSO)。精确吸取0.2 mL各质量浓度的桂花黄色素提取液按标记依次加入牛津杯中,DMSO作对照。将平板置于37℃下恒温培养24 h,观察细菌生长情况,游标卡尺测量抑菌圈直径[16-18]。
1.2.5 最低抑菌浓度(MIC)测定
参考微量肉汤稀释法[19-20],将供试的4种菌种分别取20 μL接种到装有不同体积的LB液体培养基(溶菌肉汤培养基)和不同质量浓度和体积的桂花色素的试管内,每组5只试管从左到右依次标记为1(DMSO,为空白对照)、2(0.5 mg/mL)、3(1.0 mg/mL)、4(1.5 mg/mL)、5(2.0 mg/mL);每种菌做 3 次重复,放置摇床中于37℃下培养充分振荡16 h~18 h,取出,观察试管中液体的浑浊情况。以培养皿中完全无菌生长的最低浓度作为相应的样品对相应菌的最小抑菌浓度。
1.2.6 色素在食物防腐中的应用
将土豆、牛肉煮熟切成约1 cm3见方的小块,用桂花黄色素溶液浸泡30 min;鲜榨苹果汁中加入适量桂花黄色素水溶液。平行试验中以蒸馏水为对照,进行相同条件的操作。并将两组处理好的样品盛装于灭菌培养皿中,37℃恒温培养72 h,观察结果。
2 结果与分析
2.1 单因素试验结果
2.1.1 最佳乙醇浓度的确定
乙醇浓度对提取效果的影响结果如图1所示。
乙醇浓度对桂花黄色素的提取率影响较大。乙醇浓度在50%~70%范围内,黄色素的提取率随乙醇浓度的增加,缓慢上升;由70%增至80%时黄色素提取率快速上升,至80%达到最大值,之后提取率开始下降。乙醇作为有机溶剂可以破坏膜蛋白,增加细胞膜的通透性,溶剂进出细胞不受影响,溶解的色素易被溶剂带出细胞外,桂花黄色素中所含的脂溶性色素较多,乙醇浓度大,有利于这类色素的溶出;但过大的乙醇浓度会在色素溶解的同时带入其他脂溶性杂质,对测试造成较大干扰。因此,最佳乙醇浓度为80%。

图1 乙醇浓度对提取效果的影响Fig.1 Results of different ethanol concentration
2.1.2 最佳回流时间的确定
不同回流时间的提取效果见图2。

图2 不同回流时间的提取效果Fig.2 Effects of different extraction time
在图2中可以看出,回流时间40 min时,提取率为10.6%;回流时间增至60 min,提取率增幅较大,达到了14.2%,这说明延长回流时间可以提高色素的提取率。在60 min以后,随着时间的延长,提取率逐渐降低。综合提取率、耗能低、成本等各项因素,确定最佳回流时间为60 min。
2.1.3 最佳回流温度的确定
不同回流温度的提取效果见图3。
由图3可知,50℃~70℃范围内,桂花黄色素提取率随温度升高而增大,在70℃时提取率最大;温度大于70℃时,桂花色素提取率反而下降。温度过高,易引起溶剂回流率降低;还可引起色素变质或者分解。故确定70℃为最佳提取温度。

图3 不同回流温度的提取效果Fig.3 Results of different extraction temperature
2.1.4 最佳料液比的确定
料液比对提取效果的影响见图4。

图4 料液比对提取效果的影响Fig.4 Results of different material/liquid ratio
由图4可以看出,在其他条件相同的情况下,料液比的增加对桂花色素的提取率影响较大,桂花色素的提取率随乙醇体积的增加而上升,当料液比为1∶25(g/mL)时达到最高;继续增加料液比,黄色素的提取率增幅趋于平缓,说明绝大多数色素已经被完全提取。所以从色素提取效果和节约成本两方面考虑,确定最佳料液比为 1 ∶20(g/mL)。
2.2 正交试验结果
2.2.1 正交试验的极差和方差的分析
正交试验及极差分析见表2,方差分析见表3。

表2 正交试验及极差分析Table 2 Orthogonal test design and results

续表2 正交试验及极差分析Continue table 2 Orthogonal test design and results
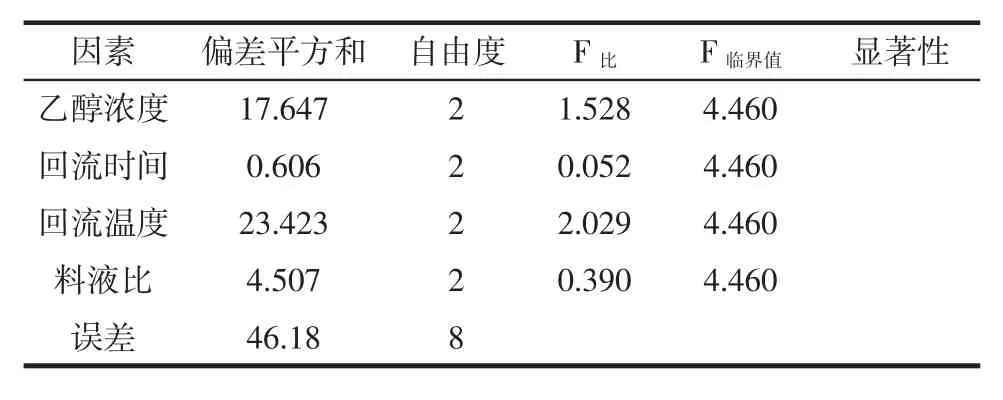
表3 方差分析Table 3 Analysis of variance
由表2极差分析结果可知,微波预处理的前提下,各因素对桂花黄色素提取率的影响程度依次为C(回流温度)>A(乙醇浓度)>D(料液比)>B(回流时间)。根据正交结果进行直观分析和考虑综合因素,最佳的提取工艺为A2B3C3D2,乙醇浓度80%,回流时间80 min,回流温度80℃,料液比1∶20(g/mL)。由表4方差分析可知,F比<F临界值,即各因素对桂花黄色素的提取率的影响均不显著。
2.2.2 验证性试验
为进一步考察正交试验优选工艺的稳定性,按照正交试验最佳条件,进行3次平行试验,得到平均提取率为18.42%。
2.3 桂花黄色素的抑菌效果
在测试条件下,以牛津杯法测定的桂花黄色素对枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌及沙门氏菌的抑菌效果如表4所示。
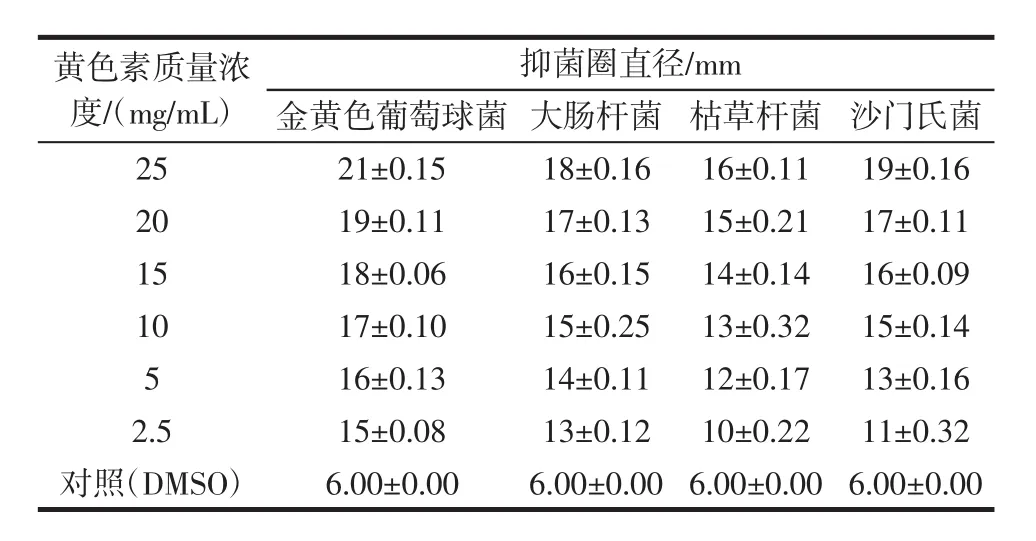
表4 不同浓度桂花黄色素提取液的抑菌效果Table 4 Antibacterial effect of different concentration on yellow pigment of Osmanthus fragrans
表4结果表明桂花黄色素对4种供试菌种具有较好的抑菌效果,对金黄色葡萄球菌的抑菌效果最为明显,枯草杆菌的抑菌活性相对较弱,且抑菌效果与黄色素的质量浓度成正相关。
2.4 最低抑菌浓度(MIC)测定
桂花黄色素对供试菌种的最低抑菌浓度见表5。
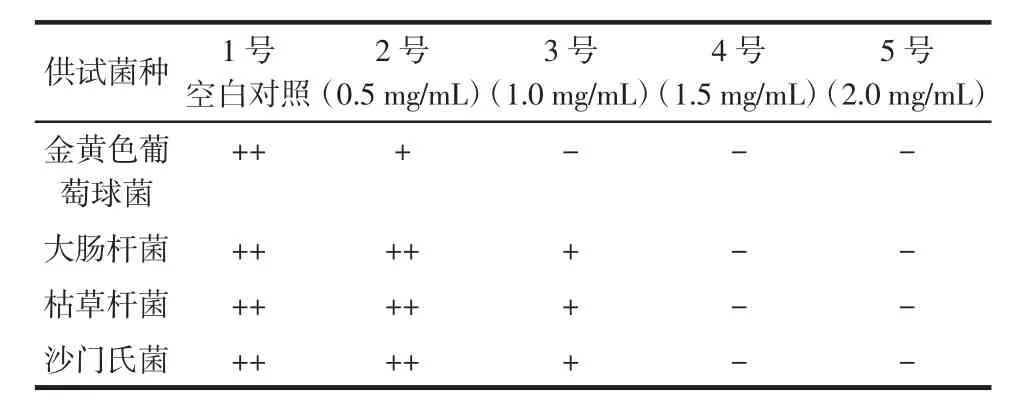
表5 桂花黄色素对供试菌种的最低抑菌浓度(MIC)Table 5 Minimal inhibitory concentration(MIC)of yellow pigment from Osmanthus fragrans
表5为桂花黄色素对金黄色葡萄球菌MIC的测试结果,1号试管为空白对照,试管内细菌生长旺盛,溶液浑浊度高;2号试管中黄色素色素浓度为0.5 mg/mL,该试管内液略有浑浊,表明此浓度下细菌的生长未能被完全抑制;而3号色素试管(浓度为1.0 mg/mL),试管液为澄清,表明此浓度下培养基内细菌生长被完全抑制。故桂花黄色素对金黄色葡萄球菌的最低抑菌浓度(MIC)为1.0 mg/mL。同理知,桂花黄色素对大肠杆菌、枯草杆菌、沙门杆菌的最低抑菌浓度均为1.5 mg/mL。
2.5 桂花黄色素在食品防腐中的应用
桂花黄色素的防腐效果见表6。

表6 桂花黄色素的防腐效果Table 6 The antiseptic effect of yellow pigment from Osmanthus fragrans
由表6可知,桂花色素处理后的苹果汁、土豆及牛肉样品,色泽,气味及质地变化较小,只有牛肉表面出现少许菌斑。而空白样品变色、腐烂,出现刺鼻异味,样品表面微生物生长明显。由此可见,桂花黄色素对淀粉类、肉类及水果类食品具有一定的防腐作用。
3 结论
桂花色素色泽鲜艳,易溶于乙醇等极性溶剂,微波辅助提取的最佳工艺条件为:乙醇浓度80%,回流时间 80 min,回流温度 80℃,料液比 1∶20(g/mL)。桂花黄色素具有较好的抑菌及防腐性能。桂花黄色素在食品和医药领域具有广阔开发前景,因其不仅可作为天然色素用于食品着色,还可同时实现防腐、抑菌活的双重功效,大大提高了色素的经济价值,具有良好的应用前景。
[1]王桃云,陈海华,张珍珍,等.桂花色素提取工艺的优化研究[J].苏州科技学院学报,2009,26(1):672-687
[2]李永祥,詹少华,蔡永萍,等.板栗壳色素的提取、纯化及稳定性[J].农业工程学报,2008,24(9):298-302
[3]李志洲,杨海涛.桂花色素的提取及其稳定性的研究[J].氨基酸与生物资源,2005,27(3):4-6
[4]王丽梅,余龙江,崔永明,等.桂花黄酮的提取纯化及抑菌活性研究[J].天然产物研究与开发,2008,20(4):717-720
[5]陶阿丽,冯学花,曹殿洁,等.响应面优化桂花果实总黄酮超声辅助提取工艺研究[J].食品工业科技,2014,35(22):264-268
[6]蒋德旗,黄利敏,王艳,等.响应面优化纤维素酶法提取桂花多糖工艺及其抗氧活性研究[J].食品工业科技,2015,36(2):271-277
[7]陈培珍,马春华,刘俊劭,等.桂花精油提取工艺优化及其成分分析[J].粮食与油脂,2016,29(10):54-57
[8]马森,陈培.桂花色素清除亚硝酸盐作用的研究[J].安徽农业科学,2012,40(36):17754-17755,17757
[9]王恒山,潘英明,李海云,等.桂花种子皮黑色素的提取及其抗氧化活性研究[J].云南大学学报(自然科学版),2004,26(S2):55-57
[10]蒋利华.野生火棘果中色素的提取、纯化与理化性质研究[D].长沙:湖南农业大学,2008:2-31
[11]邓祥元,王淑军,李富超,等.天然色素的资源和利用[J].中国调味品,2006,20(10):49-53
[12]田龙,庞振波,王云,等.油菜花黄色素的超声波提取及对苹果原汁的防腐特性[J].食品与发酵工业,2006,32(7):119-121
[13]罗璇,何景.超声辅助提取花生红衣色素工艺的优化[J].食品与机械,2016,32(9):172-177
[14]高昌勇.一串红色素清除自由基能力的研究[J].中国酿造,2008(20):79-80
[15]魏亚冉.油菜花黄色素稳定性和抑菌活性研究[J].中国食品添加剂,2006(6):90-93
[16]Guo Z,Jin Q,Fan G,et al.Microwave-assisted extraction of effective constituents from a Chinese herbal medicine Radix puerariae[J].Analytica chimica acta,2001,436(1):41-47
[17]You F,Huang L X,Zhang C H,et al.Preliminary study on spectrums and structure properties of pigments from Ziziphus jujube peel[J].Science&Technology of Food Industry,2013,34(13):99-102
[18]Robin AY,Fromm KM.Coordination polymer networks with-O-and N-donors:What they are,why and how they are made[J].Coord Chem Rev,2006,250(2):2127-2157
[19]汪洪涛.桔皮色素的抑菌性及稳定性研究[J].食品与机械,2011,27(6):163-166
[20]王玲,张富宝.中药大黄提取色素的抑菌作用研究[J].食品工业科技,2000,21(6):27-28
Extraction of Yellow Pigment from Osmanthus fragrans by Microwave Pretreatment and Their Antibacterial Activity
CHEN Guang1,SHI Juan2
(1.Hanzhong Central Hospital,Hanzhong 723000,Shaanxi,China;2.School of Chemical and Environmental Sciences,Shaanxi Sci-tech University,Hanzhong 723000,Shaanxi,China)
The extraction process of yellow pigment from Osmanthus fragrans assisted by microwave pretreatment was studied by single factor experiment which controlled the ethanol concentration,extraction time,extraction temperature and solid-to-liquid ratio.And based on single experiment,the orthogonal experiment showed the optimum extraction conditions were ethanol concentration 80%,extraction time 80 min,extraction temperature 80℃ and material to liquid ratio 1 ∶20(g/mL).In addition,the results of antibacterial experiment showed that the yellow pigment had different inhibition effects on four kinds of bacteria,and inhibition ability on Staphylococcus aureus was the strongest.The MIC of Staphylococcus aureus was 1.0 mg/mL,and Escherichia coli,Bacillus subtilis and Salmonella was 1.5 mg/mL.
Osmanthus fragrans yellow pigment;microwave-assisted pretreatment;extraction;antibacterial activity
10.3969/j.issn.1005-6521.2017.21.004
国家自然科学基金(21373132);陕西省教育厅2015年科学研究项目(15JK1141)
陈光(1981—),女(汉),本科,研究方向:药物活性研究。
2017-03-15

