浅谈原电池电极反应方程式的书写方法
张路


摘要: 针对原电池电极反应方程式的书写这个知识难点,笔者总结出了书写的三步法,并以两道例题为例对方法进行了具体的阐述。
关键词 原电池 电极反应方程式 书写方法
《高中化学新课程标准》 中对原电池这一节的要求是“理解原电池的构成、工作原理及应用,能书写电极反应和总反应方程式”,说明原电池电极反应方程式的书写是高考必考的内容。原电池电极反应方程式的书写一直是学生学习的难点,而要求学生掌握的原电池数目较多,如果单靠记忆,掌握和实际应用的效果都非常差,如果学生能够掌握书写的方法,那么这个知识难点将会得到突破,学生学习化学的信心将会得到增强。
通过对近几年高考试题的分析,笔者认为对于书写原电池电极反应式的考查主要分为两种情况,一种是题干所给信息涉及到的是学过的氧化还原反应,学生能够根据信息判断出氧化剂还原剂及相应的氧化产物和还原产物,从而判断出正负极参与反应的主要物质;另一种情况是题干提供一个学生未学过的较复杂的化学电源反应;这两种情况的电极反应方程式的书写方法大同小异,接下来以两道例题为例进行阐述:
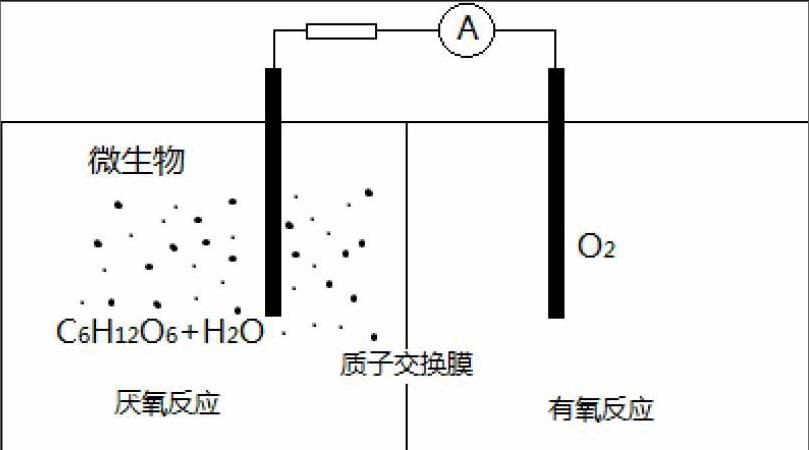
例题1、微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
A.负极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.正极反应为:O2 + 4e- +2H2O4OH?
由题干信息可以看出,该原电池总反应是学生通过已学知识能推出的反应,即C6H12O6在氧气中的燃烧反应,环境为酸(H+)环境,由此可以分析出还原剂为C6H12O6且对应的产物为CO2(碱环境下生成CO32-),氧化剂为O2,还原产物为H2O,就可以完成书写电极反应的第一步,确定出参与原电池正负极反应的主要物质,负极为、正极为,再分析化合价确定出电子转移数目,负极
正极;第二步调整电荷守恒,酸环境用H+,负极 、正极;第三步调整原子个数守恒,负极,正极已经守恒。
例題2、某碱性蓄电池在充电和放电时发生的反应为:
下列说法中正确的是
A.放电时,负极上发生反应的物质是Fe
B.放电时,正极反应是
C.充电时,阴极反应是
D.充电时,阳极附近PH增大
第一步分析化合价,找出得失电子物质,写出原电池正负极参加反应的主要物质,并分析化合价确定得失电子的数目,即负极、正极;
第二步,调整电荷守恒,用OH-来调整,即负极正极;第三步,调整原子个数守恒,负极已经守恒,不需要再添加,正极。
由此,笔者总结出书写原电池电极反应的三步:第一步,找出氧化剂、还原产物、还原剂、氧化产物,确定出参与正负极反应的主要物质,并分析化合价,确定出正负极得失电子的数目,即负极、正极;第二步,调整电荷守恒,使得电极反应式箭头两边电荷数相同+,用H+或OH-(取决于环境)调整;第三步,调整原子个数守恒。其中,第二步和第三步仅适用于水溶液中。对于大多数水溶液中的原电池电极反应式的书写,只要学生掌握了该书写方法,就能比较轻松应对,并大大减少了要记忆的内容、提高其解决实际问题的能力。尤其是例题2这类题,涉及到的反应都是学生在平常的学习中较少接触到,掌握了方法,就能减少学生的畏惧心理,提高解题的正确率。endprint

