SUMO-1在ApoE-/-小鼠PM2.5暴露中调控血管HIF-1α/VEGF信号通路的研究
甘向东, 李 飞, 蔡 欣, 付文亮, 徐东刚*, 龙民慧
(1. 军事医学科学院基础医学研究所, 北京 100850; 2. 天津科技大学生物工程学院, 天津 300457)
SUMO-1在ApoE-/-小鼠PM2.5暴露中调控血管HIF-1α/VEGF信号通路的研究
甘向东1,2, 李 飞1, 蔡 欣1, 付文亮1, 徐东刚1*, 龙民慧2*
(1. 军事医学科学院基础医学研究所, 北京 100850; 2. 天津科技大学生物工程学院, 天津 300457)
以气管滴注方法研究了ApoE-/-小鼠经PM2.5暴露后,其主动脉弓中SUMO-1、HIF-1α、血管内皮生长因子(VEGF)表达变化规律及HIF-1α的SUMO化修饰情况. 实验结果显示: PM2.5暴露后,小鼠主动脉SUMO-1、HIF-1α、VEGF的表达上调;PM2.5暴露诱导了SUMO-1对HIF-1α的SUMO化修饰; 低氧条件下SUMO-1敲低导致HIF-1α表达的下调. 结果提示PM2.5暴露通过上调细胞中SUMO-1的表达,稳定或者上调HIF-1α的表达,进而影响血管内皮生长因子(VEGF)的表达,造成动脉粥样硬化斑块的不稳定.
PM2.5暴露; SUMO-1; 缺氧诱导因子-1α; 血管内皮生长因子
Keywords: PM2.5exposure; SUMO-1; HIF-1 alpha; Vascular endothelial growth factor (VEGF)
细颗粒物(PM2.5)浓度急剧升高能够引起动脉粥样硬化(AS)斑块不稳定,并增加缺血性心血管疾病等冠脉综合症发病率[1]. 血管的修复和新生是导致斑块稳定性减弱的主要因素[2]. 血管内皮细胞生长因子(VEGF)能够与相应受体结合促进血管内皮细胞增殖、迁移和血管通透性增加来参与血管的修复和新生[3],提示VEGF可能对AS斑块稳定起了重要的作用. 但PM2.5暴露通过何种途径影响VEGF 表达并导致AS斑块稳定性变差的机制尚未明确. 有研究证实PM2.5进入人体到肺泡后,直接影响肺的通气功能,使机体处在缺氧状态[4]. 机体缺氧状态的应激反应之一就是低氧诱导因子HIF的应答反应和在细胞中积聚[5]. HIF-1是异二聚体的转录因子,由氧敏感的α亚基(HIF-1α)和在核内稳定表达的β亚基(HIF-1β)组成. HIF-1α是功能性亚基,调控VEGF等多种基因的表达,与血管的修复和动脉斑块的稳定性有重要的联系[6]. 因此,HIF-1的稳定性可能是影响斑块稳定性的重要因子. 影响HIF-1稳定性对血管重构和新生引发的AS斑块形成有着重要的意义. 最近几年发现的泛素样蛋白家族成员小泛素蛋白样修饰蛋白-1(SUMO-1)能与HIF-1α共价结合,并对其进行翻译后修饰作用,该过程称为小泛素相关修饰(Small Ubiquitin-related Modifier,SUMO)[7]. SUMO化是一个可逆的动态过程,可被特异性蛋白酶SENP-1将其从底物上去除,此过程称为去SUMO化[8]. 可逆的SUMO化修饰能在低氧下调节HIF-1α的稳定性及转录活性[9]. 本文旨在研究SUMO在PM2.5暴露引发低氧应激过程中对HIF-1α和VEGF表达的影响,探究PM2.5暴露引起AS斑块不稳定导致缺血性心血管疾病发生的可能机制.
1 材料与方法
1.1 材料
实验动物:ApoE-/-小鼠24只,体质量20~22 g,雄性,10周龄,由北京维通利华实验动物有限公司提供. 实验仪器:颗粒物采样器(Thermo Anderson G- 215,美国热电子公司);玻璃纤维滤膜(Whatman© 41 filters ,Whatman Inc, Maidstone,UK);mini-VIDAS-IDAS全自动免疫荧光酶标仪(法国生物梅里埃公司);DU640型分光光度计(美国Beckman公司);PAC200型电转印仪与电转印槽(美国BIO-RAD公司);600PJ型电泳仪与垂直电泳槽(天能公司);PE2400型PCR扩增仪(PerkinElmer公司);Mx3000P qPCR Systems(美国安捷伦公司). 实验试剂:Lowry法蛋白含量检测试剂盒(中国凯基生物技术公司);RIPA裂解缓冲液(Applygen Technologies Inc.China);PrimerScript Reverse Transcriptase(TaKaRa Biotechnology Co,Ltd.Jan);GAPDH(中国康为世纪生物公司);实验细胞系:Ecv304细胞. 胎牛血清(Gibco公司),DMEM高糖培养基(Gibco公司);所用抗体:SUMO-1(abcam,Y299),HIF-1α(abcam,ab16066),VEGF(abcam,ab46154);转染SUMO-1的siRNA(上海吉玛制药技术有限公司).
1.2 方法
1.2.1 PM2.5采样及处理 PM2.5采样于2013月12月1号起,采用ThermoAnderson G- 215采样器在北京三环某采样点连续2周采集PM2.5,将载有颗粒物的滤膜剪裁成2 cm2大小,浸入去离子蒸馏水中,超声清洗机中对PM2.5进行洗脱,功率700 W,震荡30 min,震荡液6层纱布过滤,滤液冷冻真空干燥,低温冰箱保存备用.
1.2.2 试验动物分组和染毒 ApoE-/-小鼠在恒温、恒湿二级动物房高脂(含质量分数2%胆固醇和10%脂肪)饲养18周后,将小鼠随机分成3组,PM2.5组、生理盐水组、空白对照组,每组8只. PM2.5染毒剂量为8 mg/kg, 染毒方法为气管滴注,每4 h一次,共3次. 染毒过程没有出现动物死亡情况,最后一次染毒24 h后,每组采集7只小鼠血液,并分离得血清;颈部脱臼处死小鼠,取小鼠主动脉,冻存于液氮罐中.
1.2.3 PM2.5暴露对心肌损伤指标肌酸激酶(Creatine Kinase,CK)、肌酸激酶同工酶(Creatine Kinase Isoenzyme,CK-MB)、肌钙蛋白(Troponin,CTn-I)的影响 血清中肌钙蛋白CTn-I、肌酸激酶CK及肌酸激酶同工酶CK-MB采用mini-VIDAS-IDAS全自动免疫荧光酶标仪进行检测.
1.2.4 qPCR检测PM2.5暴露对血管SUMO-1、HIF-1α、VEGF转录的影响 RNApure超纯总RNA快速提取试剂盒按说明书操作,小鼠主动脉标本每组取3只,分别提取总RNA,总RNA按1 μg 进行反转录. 转录后的cDNA 用于实时荧光定量PCR(Real-time Quantitative PCR,qPCR),使用带荧光的MaximaTMSYBR Green/ROX qPCR Master Mix(2×) 在Mx3000P QPCR Systems上进行反应,反应体系50 μL. 分别检测SUMO-1、HIF-1α、VEGF在不同处理组的小鼠血管中表达水平,所需引物序列见表1.
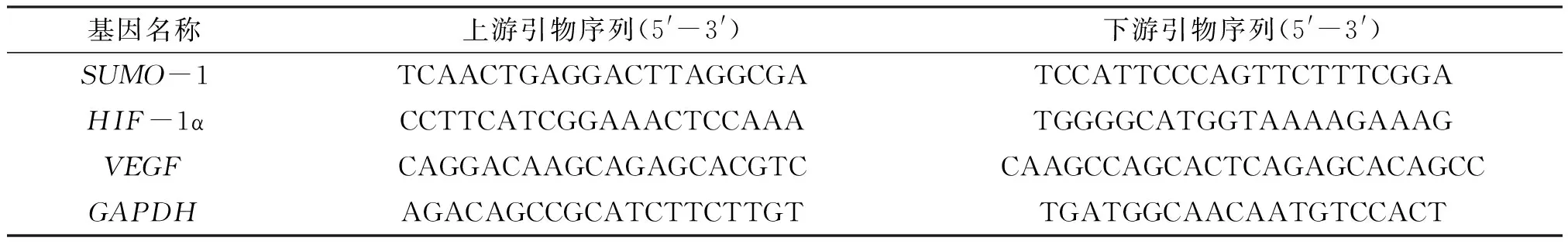
表1 小鼠主动脉qPCR所需引物序列Table 1 Primer sequenles for qPCR in aortic of mice
1.2.5 Western-blot检测PM2.5暴露对血管SUMO-1、HIF-1α、VEGF表达的影响 小鼠主动脉标本加RIPA裂解缓冲液在冰浴条件下匀浆,提取组织总蛋白,并用Lowry法蛋白含量检测试剂盒定量细胞总蛋白. 总蛋白经质量分数12% SDS-PAGE凝胶电泳分离,通过蛋白印迹法转移到孔径为0.2 μm的PVDF膜上. 将PVDF膜在质量分数5% 脱脂奶粉液(溶剂为含体积分数1‰ Tween20的Tris缓冲液,TBS-T)配制成的室温中封闭非特异结合位点1~2 h. 然后用质量分数5% 脱脂奶粉配制的特异性抗体(一抗)SUMO-1、HIF-1α、VEGF,稀释度均为(1∶1 000),4 ℃过夜孵育PVDF膜,过夜后用TBS-T洗去未结合的抗体,洗3次,每次10 min,再用带有辣根过氧化物酶(HRP)标签的羊抗鼠和羊抗兔的二抗继续室温孵育PVDF膜1 h,接着用TBS-T洗去未结合的二抗,洗3次,每次10 min. 最后用Super Signal West Femto Substrate 处理,暗室中显影. 以GAPDH作为内参.
1.2.6 免疫共沉淀(CO-IP) 取小鼠主动脉标本加入RIPA裂解液及蛋白酶抑制剂,冰上研磨后放置30 min,12 000 r/min、4 ℃离心10 min,收集上清;取1.5 mL离心管,每管加入30 μL ProteinA/G-agarose,加入200 μL RIPA裂解液洗珠子,3 000 r/min、4 ℃离心2 min,用RIPA裂解液洗2次后将上述组织上清液加入到ProteinA/G-agarose管中,4 ℃漩涡混合器上孵育1 h;将该混合物3 000 r/min、4 ℃离心2 min后取上清,各管加入HIF-1α抗体标签1 μg,4 ℃漩涡混合器上孵育4 h,各上清管加入ProteinA/G-agarose 50 μL,4 ℃漩涡混合器上孵育过夜,3 000 r/min、4 ℃离心5 min,小心弃去上清液,加入500 μL的RIPA裂解液重悬ProteinA/G-agarose沉淀,上述步骤重复5次后,彻底吸干裂解液后各样品加入30 μL 2×SDS上样缓冲液,混匀后100 ℃煮10 min,吸取上清,Western-blot检测SUMO-1的表达情况.
1.2.7 qPCR检测低氧对SUMO-1、HIF-1α转录的影响 ECV304细胞培养到对数生长期,细胞以每孔1×105个接种于6孔培养板,37 ℃、CO2体积分数5%培养箱中培养24 h,弃上清,每孔均加入2 mL含10%胎牛血清的DMEM培养基,根据实验设计加入CoCl2,使其终浓度为300 mmol/L. 培养24 h后,提取总RNA,qPCR检测所需引物序列见表2.
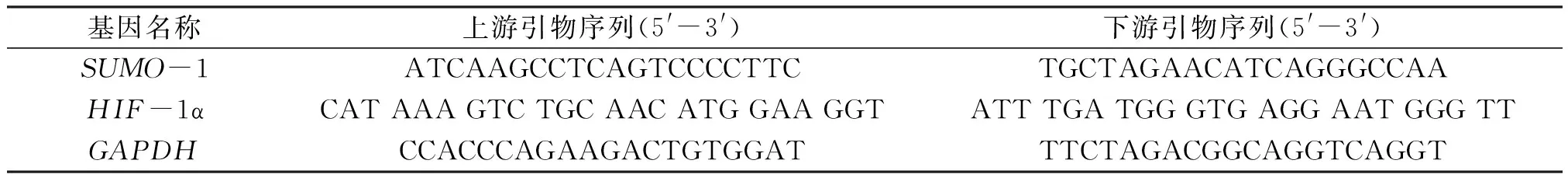
表2 ECV304细胞qPCR所需引物序列Table 2 Primer sequences for qPCR in ECV304 cell
1.2.8 低氧培养ECV304细胞,利用细胞转染siRNA敲低SUMO-1基因 将实验细胞分成对照组和敲低SUMO-1组,按照2.5×105个/孔、体积2 mL接种ECV304细胞于6孔板,并放置于低氧培养箱中12 h后转染,待细胞融合度达80%以上后,使用Lipofectamine2000 (Invitrogen, USA)转染细胞,继续培养24 h 后用于mRNA水平和蛋白水平检测. 用于转染的 siRNA序列分别为:
SUMO-1 siRNA:5′-AACTACATCTTCGTGTACCTC-3′;
NCsiRNA:5′-UUCUCCGAACGUGUCACGUTT-3′.
1.3 数据处理及统计学分析
所有数据用均值±方差表示,应用统计软件有SPSS13.0、MxPro3000-qPCR分析软件对数据进行统计分析. 有统计学显著性意义的用*P<0.05和**P<0.01表示. 计量资料进行正态性检验,服从正态分布的进行t检验;偏态分布数据采用Mann-Whitney U检验;检验水准为双侧检验.
2 结果与分析
2.1 PM2.5暴露对血清CK、CK-MB及CTn-I的影响
与空白对照组、生理盐水组相比,PM2.5暴露后的ApoE-/-小鼠血清中CK、CK-MB及CTn-I含量显著性提高(P<0.01),而生理盐水组小鼠血清中CK、CK-MB及CTn-I含量与空白对照组比较无显著性差异(P>0.05). 结果说明PM2.5暴露影响心肌酶谱的变化,缺血反应发生,心肌出现损伤(表3).

表3 PM2.5暴露对ApoE-/-小鼠血清CK、CK-MB及CTn-I的影响Table 3 Effects of PM2.5 on CK、CK-MB and CTn-I in serum after ApoE-/- mice exposed to PM2.5
注:**表示与空白组相比有显著性差异(P<0.01).
2.2 PM2.5暴露对SUMO-1、HIF-1、VEGF基因转录和蛋白质表达的影响
如图1A所示,ApoE-/-小鼠经PM2.5暴露后主动脉血管SUMO-1、HIF-1α、VEGF转录水平明显上调,生理盐水处理组小鼠与空白组相比无明显变化. 在蛋白水平上进一步研究证实:PM2.5暴露后小鼠血管中SUMO-1、HIF-1α、VEGF的表达水平与其基因转录水平有相似结果(图1B). 说明PM2.5能够上调主动脉SUMO-1、HIF-1α、VEGF等蛋白的表达.

图1 PM2.5暴露对SUMO-1、HIF-1α、VEGF基因转录和蛋白质表达的影响
Figure 1 Effects of PM2.5 exposure on transcription and protein expression ofSUMO-1,HIF-1α andVEGF注:**表示与对照组相比有显著性差异,下图同.
2.3 PM2.5暴露对HIF-1α的SUMO化修饰的影响
ApoE-/-小鼠经PM2.5暴露3次后,每组取2只小鼠主动脉进行研磨,免疫共沉淀结果显示,生理盐水组SUMO-1没有对HIF-1α发生SUMO化修饰,PM2.5暴露后SUMO-1对HIF-1α产生了明显的SUMO化修饰(图2). 本实验中以生理盐水组作为PM2.5组的对照,故没有设置空白对照组,每种处理2个重复.

图2 PM2.5暴露后HIF-1α的SUMO化修饰情况
Figure 2 SUMO modification of HIF-1 alpha after exposure to PM2.5
2.4 低氧处理ECV304细胞后对SUMO-1、HIF-1α转录的影响及敲低SUMO-1对HIF-1α表达的影响
对数生长期的ECV304细胞,经正常培养和低氧培养24 h后qPCR结果可见:低氧上调了ECV304细胞中SUMO-1、HIF-1α基因的表达(图3A);在低氧培养条件下,敲低SUMO-1蛋白表达后,HIF-1α的表达也受到了抑制(图3B),这些结果说明HIF-1α的表达受SUMO-1基因的调控.
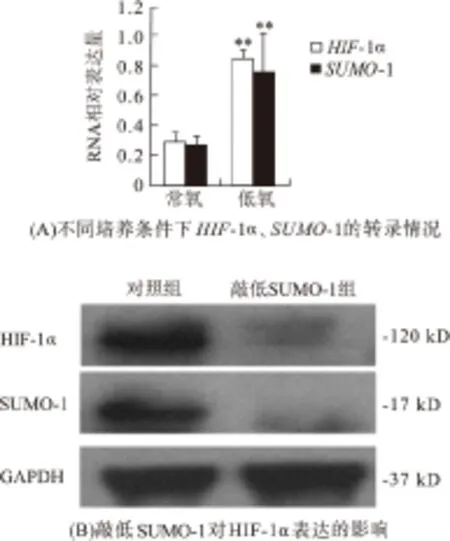
图3 低氧培养情况下SUMO-1敲低对ECV304细胞中HIF-1α表达的影响
Figure 3 Effects SUMO-1 knockdown on the expression of HIF-1αin ECV304 cells under hypoxia
3 讨论
由于PM2.5暴露直接作用于肺部,引起气道反应,造成呼吸功能减弱,导致机体缺氧发生. 缺氧与许多生理和病理过程密切相关[10]. 细胞对低氧应激的直接反应之一是在细胞内积聚转录因子HIF-1, 在细胞对环境条件的应答调节中发挥重要作用[11]. HIF-1参与细胞内的多种生物学过程, 包括血管生成、能量代谢以及细胞存活等. 而HIF-1需经历翻译后的修饰, 如羟基化修饰、泛素化修饰、乙酰化修饰来调节其稳定性[12]. 有研究表明SUMO-1介导了HIF-1α翻译后的修饰[13]. 另外的研究则认为 SUMO-1 对 HIF-1α的翻译后修饰起稳定作用并上调其表达,增加 HIF-1α的转录活性[14]. HIF-1 稳定性及转录活性增高,增强了 VEGF 的表达,影响血管新生和重构[15]. 因此,本文推测 PM2.5暴露引发肺部和呼吸道反应,造成肺部低氧,进而影响气血循环,并通过上调HIF-1α表达和抑制其降解来调控 VEGF 表达和血管新生,最后导致 VP 形成,这可能是 PM2.5暴露引发急性冠脉综合症的原因之一.
本文利用 ApoE-/- 小鼠证实: PM2.5暴露引起血清中 CK、CK-MB、CTnI 水平显著增高,确实引发了心肌损伤,并且损伤可能是由于心肌缺血所引起的. 不仅如此,文中还检测到 PM2.5暴露后,小鼠血管中 HIF-1α、SUMO-1 转录及表达水平升高,说明 PM2.5暴露引起了机体缺氧的发生,并且血管重构相关的重要因子VEGF表达上调,提示 PM2.5暴露可能引发血管重构.
细胞学实验进一步发现低氧条件下 SUMO-1表达水平升高,同时也证实了HIF-1α的转录水平升高. SUMO-1被敲低后,HIF-1α的表达降低. 这一结果表明SUMO-1可能增强了HIF-1α的表达. 综上所述,PM2.5暴露引起 SUMO-1 表达上调,增强了 HIF-1α/VEGF 通路信号传递,最终导致斑块的不稳定,可能是 PM2.5暴露导致急性冠脉综合症的一个机制.
[1] TONNE C,WILKINSON P. Long-term exposure to air pollution is associated with survival following acute coronary syndrome[J]. European Heart Journal,2013,34(17):1306-1311.
[2] GASPARI T,WELUNGODA I,WIDDOP R E,et al. The GLP-1 receptor agonist liraglutide inhibits progression of vascular disease via effects on atherogenesis,plaque stability and endothelial function in an ApoE(-/-) mouse model[J]. Diabetes and Vascular Disease Research,2013,10(4):353-360.
[3] ROCHA S F,SCHILLER M,JING D,et al. Esm1 modulates endothelial tip cell behavior and vascular permeability by enhancing VEGF bioavailability[J]. Circulation Research,2014,115(6):581-590.
[4] SCHWEL A D. Air pollution and health in urban areas[J]. Reviews Environ Health,2000,15(1/2):13-42.
[5] RABINOWITZ M H. Inhibition of hypoxia-inducible factor prolyl hydroxylase domain oxygen sensors:tricking the body into mounting orchestrated survival and repair responses[J]. Journal of Medicinal Chemistry,2013,56(23):9369-9402.
[6] WU Y,LUCIA K,LANGE M,et al. Hypoxia inducible factor-1 is involved in growth factor,glucocorticoid and hypoxia mediated regulation of vascular endothelial growth factor-A in human meningiomas[J]. Journal of Neuro-Oncology,2014,119(2):263-273.
[7] WANG Q,XIA N,LI T,et al. SUMO-specific protease 1 promotes prostate cancer progression and metastasis[J]. Oncogene,2013,32(19):2493-2498.
[8] BETTERMANN K,BENESCH M,WEIS S,et al. SUMOylation in carcinogenesis[J]. Cancer Letters,2012,316(2):113-125.
[9] MESSNER S,SCHUERMANN D,ALTMEYER M,et al. Sumoylation of poly(ADP-ribose) polymerase 1 inhibits its acetylation and restrains transcriptional coactivator function[J]. The FASEB Journal,2009,23(11):3978-3989.
[10] MANRESA M C,GODSON C,TAYLOR C T. Hypoxia-sensitive pathways in inflammation-driven fibrosis[J]. American Journal of Physiology Regulatory Integrative and Comparative Physiology,2014,307(12):1369-1380.
[11] SHIMODA L A,LAURIE S S. HIF and pulmonary vascular responses to hypoxia[J]. Journal of Applied Physiology,2014,116(7):867-874.
[12] AHN G O,SEITA J,HONG B J,et al. Transcriptional activation of hypoxia-inducible factor-1 (HIF-1) in myeloid cells promotes angiogenesis through VEGF and S100A8[J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(7):2698-2703.
[13] CHAN J Y,TSAI C Y,WU C H,et al. Sumoylation of hypoxia-inducible factor-1 α ameliorates failure of brain stem cardiovascular regulation in experimental brain death[J]. PLoS One,2011,6(3):e17375.
[14] SHAO R,ZHANG F P,TIAN F,et al. Increase of SUMO-1 expression in response to hypoxia:direct interaction with HIF-1alpha in adult mouse brain and heart in vivo[J]. FEBS Letters,2004,569(1/2/3):293-300.
[15] CURY V,MORETTI A I,ASSIS L,et al. Low level laser therapy increases angiogenesis in a model of ischemic skin flap in rats mediated by VEGF,HIF-1α and MMP-2[J]. Journal of Photochemistry and Photobiology B,2013,125:164-170.
HIF-1α/VEGF Signal Pathway Regulated by SUMO-1 in Vessel after ApoE-/- Mice Exposed to PM2.5
GAN Xiangdong1,2, LI Fei1, CAI Xin1, FU Wenliang1, XU Donggang1*, LONG Minhui2*
(1. Laboratory of Genomic Engineering, Beijing Institute of Basic Medical Sciences, Beijing 100850,China;2. College of Bioengineering, Tianjin University of Science and Technology, Tianjin 300457,China)
To evaluated the regulation of SUMO-1 to HIF-1αand vascular endothelial growth factor (VEGF) in ApoE-/- mice after PM2.5exposure by intratracheal instillation method, the SUMOylation of HIF-1αby SUMO-1, the expressions of SUMO-1, HIF-1α, and VEGF were investigated. After PM2.5exposure, the expressions of SUMO-1, HIF-1α, and VEGF in mouse aorta were up-regulated remarkably. PM2.5exposure induced SUMO-1 mediated SUMOlytion of HIF-1α. The expression of HIF-1αwas down-regulated bySUMO-1 knockdown under hypoxia. These results suggest that PM2.5exposure up-regulates the expression of SUMO-1 and stabilizes or up-regulates expression of HIF-1α, then upregulates the expression of VEGF, causing the unstablility of atherosclerotic plaques.
2015-12-31 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家重点基础研究计划(973)项目(2011CB503803);国家自然科学基金项目(81170255,31271476)
*通讯作者:徐东刚,研究员,Email:xudg@bmi.ac.cn;龙民慧,副研究员,Email:longminhui2006@126.com.
R318
A
1000-5463(2017)05-0054-05
【中文责编:成文 编辑助理:冷佳奕 英文审校:李海航】

